2. 646000 四川 泸州,西南医科大学附属医院耳鼻咽喉头颈外科;
3. 400016 重庆,重庆医科大学附属第一医院胸心外科
2. Department of Otolaryngology, Head and Neck Surgery, Affiliated Hospital of Southwest Medical University, Luzhou, Sichuan Province, 646000, China;
3. Department of Cardiothoracic Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016
鼻咽癌是具有地方流行性的头颈部恶性肿瘤,常见于我国南方地区[1]。现代影像、放疗技术的改进和化疗的应用,使鼻咽癌局控率得到明显提高,但复发和远处转移现已成为鼻咽癌治疗失败的主要原因[2]。研究鼻咽癌发病的分子机制,为复发和远处转移的治疗提供新思路具有重要性和必要性。人叉头盒M1(forkhead box M1,FoxM1)转录因子,属于Forkhead转录因子家族,共享该家族中长100个氨基酸序列的“翼状螺旋”DNA结合结构域[3]。FoxM1在胚胎组织、多种肿瘤组织中高表达,而在分化成熟的细胞中不表达或者低表达[4],对肿瘤分子诊断和靶向干预研究具有重要意义。FoxM1促进多种肿瘤细胞增殖、抑制凋亡、促进细胞衰老、侵袭转移、血管生成[4]。研究表明,在18 000例39种人类恶性肿瘤中,FoxM1已成为主要的不良预后指标[5]。β-catenin是Wnt信号转导通路中的关键信号分子,Wnt通路活化促进β-catenin在胞质中积聚并进入胞核,作用在TCF/LEF启动子上,在转录水平调控Wnt靶基因的表达[5]。经典的Wnt/β-catenin信号通路在肿瘤新陈代谢、胚胎发育、细胞结局、上皮间质转化中具有重要作用[6]。Wnt信号通路可诱导FoxM1去泛素化,稳定FoxM1的结构和表达,从而驱动β-catenin入核,促进肿瘤恶性生物学行为相关基因的转录[7]。
本课题组前期研究结果显示,FoxM1在鼻咽癌组织中高表达,其阳性率为68.8%,并与鼻咽癌临床分期与组织分型密切相关[8],下调FoxM1抑制鼻咽癌细胞株CNE-2、C666的增殖、侵袭、转移,诱导细胞凋亡[9],但对其机制缺乏进一步研究。因此,本研究采用siRNA技术下调FoxM1表达,探讨FoxM1是否通过促进Wnt通路关键蛋白β-catenin的核转位,促进其与下游启动子结合而提高下游基因的转录水平,由此影响鼻咽癌恶性生物学行为。
1 材料与方法 1.1 材料人鼻咽癌5-8F细胞株购自广州吉赛生物科技有限公司。胎牛血清(fetal bovine serum,FBS)购自德国PAN-biotech公司,RPMI1640培养基、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sfoxido,DMSO)、2.5 g/L胰蛋白酶购自Sigma公司。Transwell小室、基质胶购自BD公司。RNA提取试剂TRIzol、逆转录试剂盒、SYBR Green购自TaKaRa公司。RIPA蛋白裂解液、二辛可宁酸(bicinchoninc acid,BCA)法蛋白提取试剂盒购自上海碧云天公司。核蛋白提取试剂盒购自上海贝博公司。PVDF膜、ECL化学发光试剂盒购自Milipore公司。兔抗人FoxM1单克隆抗体(monoclonal antibody,mAb)、兔抗人β-catenin mAb、兔抗人MMP-2 mAb、兔抗人MMP-9 mAb、兔抗人C-MycmAb、兔抗人Cyclin D1 mAb、兔抗人GAPDH mAb均购自Abcam公司。辣根过氧化物酶标记的山羊抗兔IgG购自武汉博士德公司。PCR引物由TaKaRa公司合成。
1.2 方法 1.2.1 细胞培养人鼻咽癌5-8F细胞于含10%胎牛血清的RPMI1640培养基中,置37 ℃、50 mL/L CO2饱和湿度的孵箱中培养。每24小时观察细胞状态,PBS清洗换液。待细胞融合度约80%时行细胞传代。
1.2.2 FoxM1-siRNA最佳序列筛选选取本课题组前期筛选最佳FoxM1-siRNA序列,由上海吉玛公司合成。转染人5-8F细胞株,利用荧光定量PCR及Western blot检测下调效果。
1.2.3 细胞转染6孔板铺板,每孔20万细胞,待细胞贴壁后,将siRNA、转染试剂siRNA-mate、无血清1640混合物加入6孔板。设置FoxM1-siRNA组(细胞转染靶向FoxM1的siRNA)、阴性对照组(细胞转染NC-siRNA),以未经处理的细胞作为空白对照组,转染24~72 h进行后续实验。
1.2.4 荧光定量PCR检测人5-8F细胞株FoxM1 mRNA水平取处于对数生长期的人鼻咽癌5-8F细胞,转染48 h后,按PCR试剂说明书提取细胞总RNA,并反转录为cDNA,进行PCR扩增。FoxM1上游引物为5′-GAACTCCATCCGCCACAACC-3′,下游引物为5′-TTGGCACTGGGGTGAATGG-3′;β-actin上游引物为5′-CC-ACGAAACTACCTTCAACTCC-3′,下游引物为5′-GTG-ATCTCCTTCTGCATCCTGT-3′。反应体系体积为10 μL,用量分别为:SYBR Green 5.0 μL、cDNA 1.0 μL、上游引物0.4 μL、下游引物0.4 μL,DEPC水3.2 μL。反应条件:95 ℃预变性30 s,(95 ℃变性5 s,60 ℃退火60 s)×40个循环。FoxM1的mRNA相对表达量采用2-ΔΔCt公式计算。
1.2.5 Western blot检测FoxM1及Wnt信号通路相关基因的蛋白水平人鼻咽癌5-8F细胞转染48 h后,分别提取FoxM1-siRNA组、NC-siRNA阴性对照组、空白对照组细胞总蛋白及核蛋白。沸水高温变性10 min后,行100 g/L SDS-PAGE,PVDF转膜,5%蛋白干粉TBST封闭2 h,分别加入1:800稀释的兔抗人FoxM1 mAb,1:5 000兔抗人β-catenin mAb,1:2 000兔抗人MMP-2 mAb、兔抗人MMP-9 mAb、兔抗人GAPDH mAb,1:600兔抗人C-Myc mAb、兔抗人Cyclin D1 mAb,4 ℃孵育过夜。TBST清洗3次,每次5 min,加入1:2 000稀释的辣根过氧化酶标记山羊抗兔IgG于37 ℃敷箱孵育1 h。TBST清洗3次,每次约10 min,ECL化学发光试剂盒显影,实验重复3次。
1.2.6 MTT法检测下调FoxM1后对5-8F细胞增殖的影响人鼻咽癌5-8F细胞转染24 h后,收集各组细胞制成悬液,于96孔板接种细胞,每孔200 μL体系,每孔细胞2×103个,设6个复孔,置于敷箱中培养。分别在培养24、48、72、96 h后,每孔加入5 mg/mL的MTT溶液20 μL,敷箱中培养4 h,抽去液体,每孔加入150 μL DMSO,避光震荡10 min,酶标仪检测各孔光密度值[D(570)],绘制生长曲线。
1.2.7 Transwell小室法检测下调FoxM1对5-8F细胞迁移能力的影响在24孔板内放置Transwell小室,转染人鼻咽癌5-8F细胞,24 h后制成细胞悬液,将含4×103个细胞的悬液400 μL加入上室。含10%胎牛血清的RPMI1640培养基600 μL加入下室。置于敷箱内培养,培养20 h,取出小室,40 g/L多聚甲醛固定20 min,结晶紫染色5 min。PBS冲洗后,显微镜下随机5个视野(×100)计数穿膜细胞,每组实验重复3次。
1.2.8 Annexin V-FITC/PI双染色结合流式细胞术检测5-8F细胞凋亡细胞转染48 h后,收集各组细胞,预冷PBS清洗2遍,加入500 μL的结合缓冲液重悬细胞,再加入5 μL的Annexin V-FITC,混匀后避光温室敷育15 min,上机前5 min,加入5 μL的PI染色,每组实验重复3次。
1.2.9 流式细胞术检测细胞周期细胞转染48 h后,收集各组细胞,预冷PBS清洗2遍,以700 mL/L预冷无水乙醇重悬,4 ℃固定过夜后,PBS清洗2次,加入50 μg/mL PI和100 μg/mL RNA酶A,4 ℃避光孵育30 min后检测。
1.3 统计学分析采用Graphpad软件对数据进行统计学分析,计量资料以x±s表示,两组比较采用独立样本的t检验,多组比较采用方差分析。检验水准α=0.05。
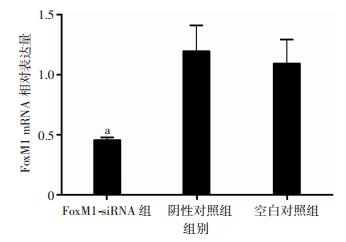
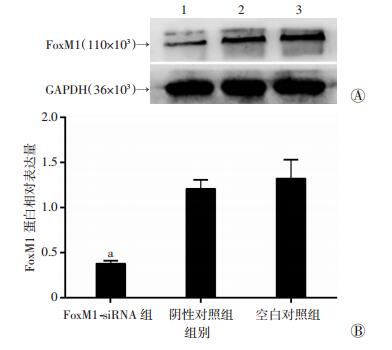
2 结果 2.1 siRNA转染5-8F细胞后FoxM1 mRNA和蛋白表达水平降低荧光定量PCR检测结果显示,FoxM1-siRNA组中FoxM1 mRNA表达水平较阴性对照组和空白对照组显著降低(P<0.05,图 1)。Western blot检测结果显示,FoxM1-siRNA组中FoxM1蛋白表达水平较阴性对照组和空白对照组显著降低(P<0.05,图 2)。阴性对照组和空白对照组间差异无统计学意义(P>0.05)。
|
| a:P<0.05,与空白对照组和阴性对照组比较 图 1 荧光定量PCR检测各组细胞转染siRNA 48 h后FoxM1 mRNA的表达 |
|
| A:Western blot检测结果 1:FoxM1-siRNA组;2:阴性对照组;3:空白对照组;B:半定量分析结果 a:P<0.05, 与空白对照组和阴性对照组比较 图 2 Western blot检测各组细胞转染siRNA 48 h后FoxM1蛋白的表达 |
2.2 下调FoxM1表达可抑制5-8F细胞增殖
采用MTT法检测下调FoxM1表达后对5-8F细胞增殖的影响,结果显示,FoxM1-siRNA组D(570)值增长缓于阴性对照组和空白对照组(P<0.05,图 3),细胞增殖受到抑制。阴性对照组和空白对照组间差异无统计学意义(P>0.05)。

|
| a:P<0.05,与空白对照组和阴性对照组比较 图 3 MTT法检测下调FoxM1后对5-8F细胞增殖的影响 |
2.3 下调FoxM1表达诱导5-8F细胞凋亡
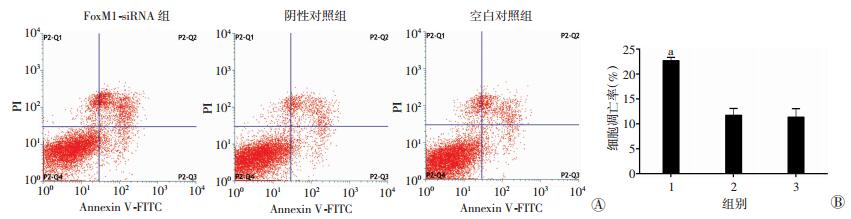
细胞转染48 h后采用流式细胞术检测5-8F细胞凋亡率,结果显示,FoxM1-siRNA组的凋亡率较阴性对照组和空白对照组明显提高(P<0.05,图 4);阴性对照组和空白对照组间差异无统计学意义(P>0.05)。
|
| A:流式细胞术检测各组细胞凋亡;B:细胞凋亡率半定量分析 1:FoxM1-siRNA组;2:阴性对照组;3:空白对照组; a:P<0.05, 与空白对照组和阴性对照组比较 图 4 流式细胞术检测下调FoxM1表达后对5-8F细胞凋亡的影响 |
2.4 下调FoxM1表达诱导5-8F细胞周期G0/G1期阻滞
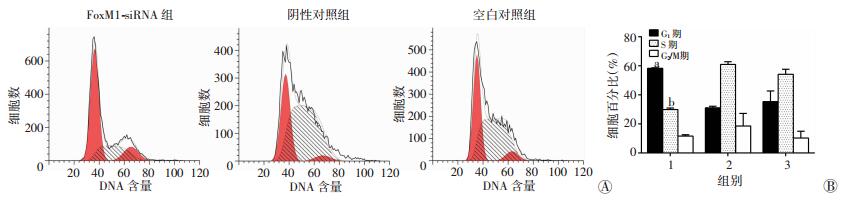
细胞转染48 h后采用流式细胞术检测5-8F细胞周期,结果显示,下调FoxM1表达后,G0/G1期细胞数量增加,FoxM1-siRNA组G0/G1期比例较阴性对照组和空白对照组提高(P<0.05)。与对照组相比,下调FoxM1表达后,S期细胞数量明显减少(P<0.01);G2期无显著改变(P>0.05,图 5)。
|
| A:流式细胞术检测结果;B:细胞周期分布 1:FoxM1-siRNA组;2:阴性对照组;3:空白对照组;a:P<0.05,b:P<0.01,与空白对照组和阴性对照组比较 图 5 流式细胞术检测下调FoxM1对各组5-8F细胞凋亡的影响 |
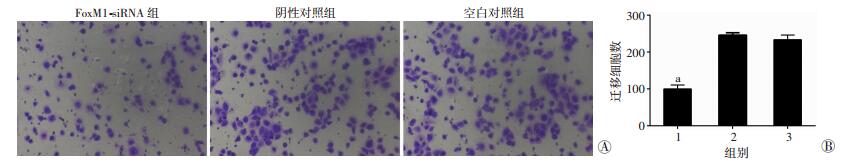
2.5 下调FoxM1表达可抑制5-8F细胞迁移能力
Transwell迁移实验结果显示,FoxM1-siRNA组细胞穿膜数明显低于阴性对照组和空白对照组,细胞迁移能力降低,差异均有统计学意义(P<0.01,图 6)。阴性对照组和空白对照组间差异无统计学意义(P>0.01)。
|
| A:Transwell检测结果(结晶紫×100);B:各组迁移细胞数 1:FoxM1-siRNA组;2:阴性对照组;3:空白对照组; a:P<0.01,与空白对照组和阴性对照组比较 图 6 下调FoxM1对各组5-8F细胞迁移能力的影响 |
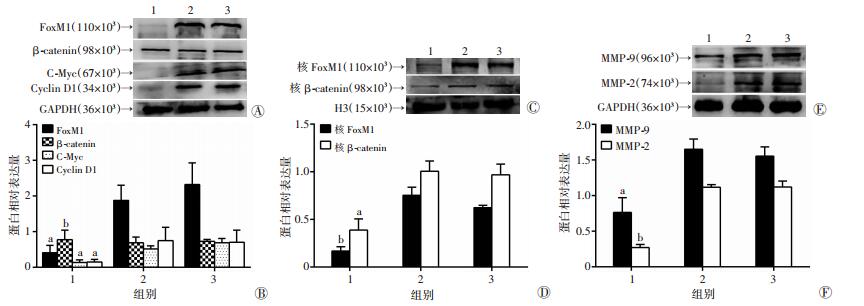
2.6 下调FoxM1对Wnt通路下游蛋白表达的影响
Western blot检测各组细胞中Wnt通路相关蛋白的表达,结果显示,在细胞总蛋白水平,FoxM1-siRNA组C-Myc、Cyclin D1、MMP-2、MMP-9表达较空白对照组、阴性对照组明显下调(P<0.05)。β-catenin蛋白表达量差异无统计学意义(P>0.05),而在细胞核中,FoxM1-siRNA组β-catenin蛋白表达水平明显下调(P<0.01,图 7)。
|
|
1:FoxM1-siRNA组;2:阴性对照组;3:空白对照组 A、C、E:Western blot检测5-8F细胞β-catenin、C-Myc、Cyclin D1、MMP-2、MMP-9表达水平;B、D、F:5-8F细胞β-catenin、C-Myc、Cyclin D1、MMP-2、MMP-9表达水平半定量分析 a:P<0.05,b:P<0.01,与空白对照组和阴性对照组比较 图 7 下调FoxM1对Wnt通路下游蛋白表达的影响 |
3 讨论
鼻咽癌具有种族易感性与地域集中性。早期鼻咽癌患者以放疗为主,但有约30%的鼻咽癌患者出现复发或远处转移,严重影响预后及生存[2]。随着放化疗方案逐渐演变,靶向治疗、免疫抑制剂和其他免疫治疗陆续被提出,迫切要求研究鼻咽癌恶性生物学行为的分子机制,为鼻咽癌治疗提供新策略。
FoxM1又名HNF-3、HFH-11、MPP2、Win或者Trident[10],作为经典的增殖相关性转录因子,调控细胞周期G1/S、G2/M期与有丝分裂[11]。研究表明,FoxM1广泛高表达于多种恶性肿瘤,引起基因组失稳与细胞分裂失控,在胰腺、结肠、胃、肝脏、肺部、脑部、胸部、前列腺、神经系统和血液系统肿瘤中均有报道[12]。
本研究首先利用RT-PCR与Western blot技术,验证课题组前期筛选出的最优FoxM1-siRNA序列,结果显示,FoxM1-siRNA实验组中FoxM1的mRNA、蛋白表达水平较对照组明显降低,提示FoxM1下调成功。随后对3组细胞行MTT实验,流式细胞术检测细胞凋亡与细胞周期,结果显示,下调FoxM1后人鼻咽癌5-8F细胞增殖能力明显减弱,细胞凋亡率上升,细胞周期阻滞在G0/G1期。与WEI等[13]在黑素瘤细胞A375和SK-MEL-2中,BARGER等[14]在卵巢癌细胞COV362中的研究结果一致。本课题组研究发现,叉头结构域抑制物6(FDI-6)通过下调细胞核FoxM1增加喉癌细胞凋亡并抑制其侵袭和迁移[15]。有研究表明,在三阴性乳腺癌中,FoxM1通过调节真核延伸因子2激酶eEF2K,促进肿瘤侵袭迁移[16]。MicroRNA630通过靶向调节FoxM1抑制胃癌细胞侵袭迁移[17]。FoxM1通过与HSPA5启动子结合提高其转录水平,促进结直肠癌的侵袭迁移[2]。本研究进一步行细胞迁移实验,结果显示,下调FoxM1表达后,5-8F细胞的迁移能力也明显减弱。
而FoxM1对人鼻咽癌5-8F细胞恶性生物学行为造成以上影响的机制如何呢?Wnt信号通路的失调已被证实与多种肿瘤恶性生物学行为密切相关,Wnt信号通路异常激活,通过GSK3-Axin复合体,抑制FoxM1磷酸化,使其与去泛素化酶USP5相互作用,从而导致FoxM1去泛素化并维持其稳定性[18]。FoxM1在细胞核中积累,并促进Wnt通路靶基因启动子招募β-catenin,通过使β-catenin/TCF4复合体免受ICAT竞争性抑制激活Wnt信号通路[18]。Wnt通路激活引起的FoxM1去泛素化,是调控经典Wnt信号通路与细胞增殖的重要机制。在骨肉瘤中,FoxM1与β-catenin可在细胞质与细胞核内直接结合,增强β-catenin核转录,促进其与TCF4形成复合物结合在Wnt靶基因启动子上,增强Wnt通路活性[19]。JIANG等[20]也报道,下调β-catenin可抑制人鼻咽癌细胞CNE2增殖、降低其侵袭能力、影响肿瘤干性。针对MNK-eIF4E轴的抑制剂CGP57380下调β-catenin入核后,可抑制鼻咽癌细胞增殖与细胞周期进展、降低其迁移、侵袭和转移能力[21]。
本实验Western blot检测发现,成功下调FoxM1后β-catenin核蛋白表达明显降低,并伴随Wnt通路靶基因C-Myc、Cyclin D1蛋白表达下降,提示FoxM1可能通过影响β-catenin入核,异常激活Wnt信号通路,影响鼻咽癌恶性生物学行为。Cyclin D1作为Wnt通路下游靶基因,是调节细胞周期的关键蛋白,可与CDK4/CDK6结合,在细胞周期G1到S期转换中起重要作用[22]。而C-Myc是MYC癌基因家族中的一员,其在多种肿瘤细胞中高表达,并可促进细胞周期由静止期向S期转换[23-24]。又有研究表明,MMP-2、MMP-9为Wnt/β-catenin信号通路下游靶基因[25],而本实验成功下调FoxM1后,MMP-2、MMP-9蛋白表达明显降低,进一步说明FoxM1可通过Wnt/β-catenin通路调节5-8F细胞侵袭迁移能力。
肿瘤的发生、发展是多因素共同作用的结果,本实验表明,FoxM1可能通过Wnt/β-catenin通路调节5-8F细胞的恶性生物学行为,而FoxM1又与多条肿瘤相关信号通路的异常激活相关,FoxM1是EGF-P13K-AKT-FOXO信号轴增殖和化疗药物相关的重要下游效应因子[4],FoxM1可激活SMAD3/SMAD4信号通路,促进TGF-β依赖的肿瘤侵袭[26],FoxM1参与多行性胶质母细胞瘤的发展,MELK-FOXM1信号轴是潜在的治疗目标[27]。此外,FoxM1还与NF-κB、P53、JNK、MAPK、RAF等信号通路关系密切[4, 28-29]。Wnt通路也能够协同或拮抗其他信号通路调节肿瘤的增殖,迁移和侵袭[30]。鼻咽癌中FoxM1与多条通路之间的相互关联有待进一步研究。
总之,通过siRNA下调FoxM1,可抑制鼻咽癌细胞5-8F的增殖、诱导细胞凋亡、降低细胞迁移能力,使细胞周期阻滞于G0/G1期。其机制可能是通过抑制Wnt通路关键蛋白β-catenin的核转位,抑制其与下游启动子结合而抑制下游基因的转录水平实现的。本实验表明,可通过影响Wnt/β-catenin通路靶向FoxM1,从而为鼻咽癌治疗提供新思路。研究鼻咽癌中Wnt-FoxM1相关性,进一步深入β-catenin作为转录因子与下游启动子的相关关系研究,筛选主要靶基因和靶向药物,成为课题组后续主要目标。
| [1] | JIA W H, HUANG Q H, LIAO J, et al. Trends in incidence and mortality of nasopharyngeal carcinoma over a 20-25 year period (1978/1983-2002) in Sihui and Cangwu counties in Southern China[J]. BMC Cancer, 2006, 6: 178. DOI:10.1186/1471-2407-6-178 |
| [2] | LEE A W, SZE W M, AU J S, et al. Treatment results for nasopharyngeal carcinoma in the modern era:the Hong Kong experience[J]. Int J Radiat Oncol Biol Phys, 2005, 61(4): 1107–1116. DOI:10.1016/j.ijrobp.2004.07.702 |
| [3] | LAOUKILI J, STAHL M, MEDEMA R H, et al. FoxM1: at the crossroads of ageing and cancer[J]. Biochim Biophys Acta, 2007, 1775(1): 92–102. DOI:10.1016/j.bbcan.2006.08.006 |
| [4] | BELLA L, ZONA S, NESTAL DE MORAESG, et al. FOXM1: A key oncofoetal transcription factor in health and disease[J]. Semin Cancer Biol, 2014, 29: 32–39. DOI:10.1016/j.semcancer.2014.07.008 |
| [5] | GENTLES A J, NEWMAN A M, LIU C L, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers[J]. Nat Med, 2015, 21(8): 938–945. DOI:10.1038/nm.3909 |
| [6] | ACEBRON S P, KARAULANOV E, BERGER B S, et al. Mitotic Wnt signaling promotes protein stabilization and regulates cell size[J]. Mol Cell, 2014, 54(4): 663–674. DOI:10.1016/j.molcel.2014.04.014 |
| [7] | ZHANG N, WEI P, GONG A, et al. FoxM1 promotes beta-catenin nuclear localization and controls Wnt target-gene expression and glioma tumorigenesis[J]. Cancer Cell, 2011, 20(4): 427–442. DOI:10.1016/j.ccr.2011.08.016 |
| [8] |
江黎珠, 王棚, 陈鸿雁. FoxM1和COX-2在鼻咽癌组织中的表达及临床意义[J].
第二军医大学学报, 2013, 34(6): 645–649.
JIANG L L, WANG P, CHEN HY. Expression of FoxM1 COX-2 in nasopharyngeal carcinoma tissues and the related clinical singnificance[J]. Acad J Second Mil Med Univ, 2013, 34(6): 645–649. DOI:10.3724/SP.J.1008.2013.00645 |
| [9] | JIANG L, WANG P, CHEN L, et al. Down-regulation of FoxM1 by thiostrepton or small interfering RNA inhibits prolife-ration, transformation ability and angiogenesis, and induces apoptosis of nasopharyngeal carcinoma cells[J]. Int J Clin Exp Pathol, 2014, 7(9): 5450–5460. |
| [10] | LUO X, YAO J, NIE P, et al. FOXM1 promotes invasion and migration of colorectal cancer cells partially dependent on HSPA5 transactivation[J]. Oncotarget, 2016, 7(18): 26480–26495. DOI:10.18632/oncotarget.8419 |
| [11] | HALASI M, GARTEL A L. FOX(M1) news—it is cancer[J]. Mol Cancer Ther, 2013, 12(3): 245–254. DOI:10.1158/1535-7163.mct-12-0712 |
| [12] | SONGX, FIATI KENSTON S S, ZHAO J, et al. Roles of FoxM1 in cell regulation and breast cancer targeting therapy[J]. Med Oncol, 2017, 34(3): 41. DOI:10.1007/s12032-017-0888-3 |
| [13] | WEI Y, SUN Q, ZHAOL, et al. LncRNA UCA1-miR-507-FOXM1 axis is involved in cell proliferation, invasion and G0/G1 cell cycle arrestin melanoma[J]. Med Oncol, 2016, 33(8): 88. DOI:10.1007/s12032-016-0804-2 |
| [14] | BARGER C J, ZHANG W, HILLMANJ, et al. Genetic determinants of FOXM1 overexpression in epithelial ovarian cancer and functional contribution to cell cycle progression[J]. Oncotarget, 2015, 6(29): 27613–27627. DOI:10.18632/oncotarget.4546 |
| [15] |
刘亚男, 祝琳, 文韬宇, 等. 叉头结构域抑制物6(FDI-6)通过下调细胞核FoxM1增加喉癌细胞凋亡并抑制其侵袭和迁移[J].
细胞与分子免疫学杂志, 2017, 33(5): 611–616.
LIU Y N, ZHU L, WEN T Y, et al. Forkhead domain inhibitor-6(FDI-6)increases apoptosis and inhibits invasion and migration of laryngeal carcinoma cells by down-regulating nuclear FoxM1[J]. Chin J Cell Mol Immunol, 2017, 33(5): 611–616. |
| [16] | HAMURCUZ, ASHOUR A, KAHRAMANN, et al. FOXM1 regulates expression of eukaryotic elongation factor 2 kinase and promotes proliferation, invasion and tumorogenesis of human triple negative breast cancer cells[J]. Oncotarget, 2016, 7: 16619–16635. DOI:10.18632/oncotarget.7672 |
| [17] | FENG J, WANG X, ZHU W, et al. MicroRNA 630 suppresses epithelial to mesenchymal transition by regulating FoxM1 in gastric cancer cells[J]. Biochemistry (Mosc), 2017, 82(6): 707–714. DOI:10.1134/S0006297917060074 |
| [18] | CHEN Y, LI Y, XU EJ, et al. Wnt-induced deubiquitination FoxM1 ensures nucleus b-catenin transactivation[J]. EMBO J, 2016, 35(6): 668–684. DOI:10.15252/embj.201592810 |
| [19] | ZHANG W, DUAN N, ZHANG Q, et al. DNA methylation mediated down-regulation of miR-370 regulates cell growth through activation of the Wnt/β-catenin signaling pathway in human osteosarcoma cells[J]. Int J Biol Sci, 2017, 13(5): 561–573. DOI:10.7150/ijbs.19032 |
| [20] | JIANG R, NIU X, HUANG Y, et al. β-Catenin is important for cancer stem cell generation and tumorogenic activity in nasopharyngeal carcinoma[J]. Acta Biochim Biophys Sin(Shanghai), 2016, 48(3): 229–237. DOI:10.1093/abbs/gmv134 |
| [21] | WANG W, WEN Q, LUO J, et al. Suppression of β-catenin nuclear translocation By CGP57380 decelerates poor progression and potentiates radiation-induced apoptosis in nasopharyngeal carcinoma[J]. Theranostics, 2017, 7(7): 2134–2149. DOI:10.7150/thno.17665 |
| [22] | CANAVESE M, SANTO L, RAJE N. Cyclin dependent kinasesincancer: potential for therapeutic intervention[J]. Cancer Biol Ther, 2012, 13(7): 451–457. DOI:10.4161/cbt.19589 |
| [23] | HERMEKING H, RAGO C, SCHUHMACHER M, et al. Identification of cdk4 as a target of c-myc[J]. Proc Natl Acad Sci USA, 2000, 97(5): 2229–2234. DOI:10.1073/pnas.050586197 |
| [24] | ORIAN A, VAN STEENSEL B, DELROW J, et al. Genomic binding by the drosophila Myc, Max, Mad/Mnt transcription factor network[J]. Genes Dev, 2003, 17(9): 1101–1114. DOI:10.1101/gad.1066903 |
| [25] | WU B, CRAMPTON S P, HUGHES C C. Wnt signaling induces matrix metalloproteinase expression and regulates T cell transmigration[J]. Immunity, 2007, 26(2): 227–239. DOI:10.1016/j.immuni.2006.12.007 |
| [26] | XUE J, LIN X, CHIU W T, et al. Sustained activation of SMAD3/SMAD4 by FoxM1 promotes TGF-β-dependent cancer metastasis[J]. J Clin Invest, 2014, 124(2): 564–579. DOI:10.1172/JCI71104 |
| [27] | JOSHI K, BANASAVADI-SIDDEGOWDA Y, MO X, et al. MELK-dependent FOXM1 phosphorylation is essential for proliferation of glioma stem cells[J]. Stem Cells, 2013, 31(6): 1051–1063. DOI:10.1002/stem.1358 |
| [28] | JIN B, WANG C, LI J, et al. Anthelmintic niclosamide disrupts the interplay of p65 and FOXM1/beta-catenin and eradicates leukemia stem cells in chronic myelogenous leukemia[J]. Clin Cancer Res, 2017, 23(3): 789–803. DOI:10.1158/1078-0432.CCR-16-0226 |
| [29] | WANG Z, AHMAD A, LI Y, et al. Forkhead box M1transcription factor: a novel target for cancer therapy[J]. Cancer Treat Rev, 2010, 36(2): 151–156. DOI:10.1016/j.ctrv.2009.11.006 |
| [30] |
张世苹, 张旭. Wnt信号通路在肿瘤调控方面的研究进展[J].
中国药理学通报, 2017, 33(1): 14–18.
ZHANG S P, ZHANG X. Research progress on role of Wnt signaling pathway in regulation of tumors[J]. Chin Pharmacol Bull, 2017, 33(1): 14–18. DOI:10.3969/j.issn.1001-1978.2017.01.003 |



