2型糖尿病(type 2 diabetic mellitus, T2DM)是严重危害全球人类生命健康的常见慢性非传染性疾病,其中我国的T2DM发病增长尤为迅速,成为我国的重大公共卫生问题。大量研究证据表明,脂质在骨骼肌、肝脏等非脂肪组织中的异位沉积可引起胰岛素抵抗(insulin resistance, IR),继而参与T2DM的发生、发展过程[1]。骨骼肌作为机体内最大的糖脂代谢库,改善骨骼肌中的脂质异位沉积对于T2DM防治具有重要意义。紫檀芪(pterostilbene,PTT)作为一种芪类化合物,广泛存在于小浆果和红酒中[2],是白藜芦醇的同系物,具有与白藜芦醇相似的降血脂、抗氧化、抗癌等多种生物学作用[3-5]。但PTT较白藜芦醇具有更高的生物吸收利用率,因而其在慢性病防治当中更具实际应用前景。已有研究表明,PTT可通过增加胰岛素抵抗大鼠骨骼肌中的葡萄糖转运蛋白4(glucose transport protein 4, GLUT4)表达促进骨骼肌摄取葡萄糖,继而改善血糖控制[6],但其对骨骼肌脂质异位沉积的影响尚不清楚。Plin5是近年发现的一种围脂滴蛋白,可促进脂质分解,并增加脂肪酸的氧化代谢[7]。本研究采用棕榈酸(palmitate,PA)处理大鼠L6肌管细胞建立骨骼肌脂质异位沉积体外模型,观察PTT干预对骨骼肌脂质异位沉积及胰岛素抵抗的影响,并探讨Plin5通路在其中的可能作用,为进一步研究PTT应用于T2DM、代谢综合征等胰岛素抵抗相关疾病的防治提供科学依据。
1 材料与方法 1.1 试剂与细胞株大鼠L6成肌细胞购于中国科学院;DMEM培养基和马血清购自美国Gibco公司;胎牛血清购于美国HyClone公司;Opti减血清培养基购于美国Gibco公司;紫檀芪购于成都曼斯特生物科技有限公司;甘油三酯(TG)检测试剂盒、牛血清白蛋白(BSA)和油红O染色试剂购于南京建成生物科技研究所;葡萄糖摄取检测试剂盒(荧光比色法)购于美国Sigma公司;KRPH缓冲液购于青岛捷世康生物科技有限公司;Plin5 siRNA购于美国SANTA公司;胰岛素、Plin5抗体购于美国Thermo Fisher公司;FGF21抗体购于英国Abcam公司。
1.2 方法 1.2.1 L6成肌细胞分化将大鼠L6成肌细胞置于含10%胎牛血清的高糖DMEM培养基中,并在温度为37 ℃含5%CO2饱和湿度条件下孵育,当细胞融合达到70%左右的时候,更换培养基为含2%马血清的培养基继续孵育直至观察到细胞分化形成肌管。
1.2.2 CCK-8法检测细胞活力当L6肌管细胞形成后,分为:空白组(Ab),正常细胞对照组(Ac),不同浓度PTT(10、20、40、80 μmol/L)处理实验组(As),每组设5个平行。24 h后加入CCK-8溶液并继续孵育2 h,使用酶标仪测定450 nm处的光密度值[D(450)]。以正常细胞对照组细胞活力为100%,实验组细胞活力=[(As-Ab)/(Ac-Ab)]×100%。
1.2.3 油红O染色当L6肌管细胞形成后,分为:正常对照组,PA处理组(0.75 mmol/L),PA+不同浓度PTT(10、20、40、80 μmol/L)处理组,16 h后吸弃培养基并用PBS洗3次,4%多聚甲醛固定30 min,然后用蒸馏水冲洗3次,加入60%异丙醇,30 s后吸弃,再使用5%的油红O染液密封染色30 min,随后加入60%异丙醇洗30 s,蒸馏水洗3次至背景透明,最后加入苏木精染核4 min,BX51型倒置显微镜(日本Olympus公司)下观察并拍照。
1.2.4 TG含量测定实验分组及处理同1.2.3。各组细胞处理结束后,吸弃培养液并用PSB洗2次,然后按照TG含量检测试剂盒说明书方法检测细胞内TG含量。
1.2.5 荧光法检测细胞葡萄糖摄取能力实验分组及处理同1.2.3。各组细胞处理结束后,PBS冲洗3次后,每孔加入100 μL含2%BSA KRPH缓冲液孵育40 min,然后加入或不加入100 nmol/L胰岛素处理20 min,再加入10 μL的2-DG6P孵育20 min,PBS冲洗3次,之后按照葡萄糖检测试剂盒说明方法检测细胞内葡萄糖含量。
1.2.6 Western blot检测蛋白表达实验分组及处理同1.2.3。各组细胞处理结束后,裂解细胞后离心取上清液收集蛋白,并用BCA法检测蛋白浓度。样品加入上样缓冲液后于90 ℃变性10 min。将样品于SDS-PAGE胶中以80 V/30 min,120 V/90 min进行电泳,220 mA/150 min进行湿转将蛋白转移到PVDF膜上。以5%脱脂奶粉封闭2 h后加入一抗并在4 ℃过夜,使用TBST洗膜3次(10 min/次)后加入辣根过氧化物酶标记的二抗(1 :8 000)并继续孵育1 h,再次使用TBST洗膜3次(10 min/次)后加入化学发光液,使用分子成像仪成像。以β-actin为内参,并使用Quality one软件进行灰度值分析。
1.2.7 沉默Plin5对PTT干预效应的影响L6骨骼肌细胞分化为肌管后,分为:对照组(转染对照siRNA)、PA处理组(转染对照siRNA)、PA+PTT处理组(转染对照siRNA)、PA+PTT+Plin5 siRNA处理组。siRNA转染按照Lipofectamine 2000转染说明书步骤进行,转染6 h后更换含10%胎牛血清的高糖DMEM培养基继续孵育24 h,然后使用PA、PTT处理16 h后,检测FGF21蛋白水平、TG含量和葡萄糖摄取能力。
1.3 统计学分析使用Excel录入数据,GraphPad Prism 6软件对数据进行作图,计量数据以x±s表示,SPSS 13.0进行统计学分析,组间两两比较采用TuKey检验,多组间比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 PTT对L6肌管细胞活力无明显影响不同浓度PTT共同处理L6肌管细胞24 h后,CCK-8法检测细胞活力结果显示:与对照组相比,各浓度PTT处理对细胞活力均无明显影响(P>0.05,图 1)。
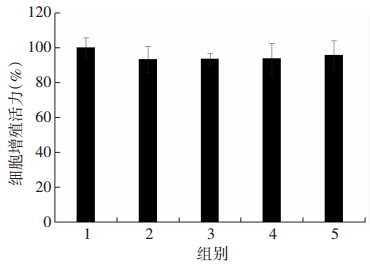
|
| 1:对照组;2:10 μmol/L PTT处理组;3:20 μmol/L PTT处理组;4:40 μmol/L PTT处理组;5:80 μmol/L PTT组 图 1 CCK-8检测各组L6肌管细胞增殖活力 |
2.2 PTT抑制PA诱导的L6肌管细胞内脂滴形成
0.75 mmol/L PA处理L6肌管细胞16 h后,油红O染色脂质结果显示:与对照组相比,PA处理组细胞内可见大量的脂滴,而一定剂量的PTT(20、40、80 μmol/L)干预后,细胞内脂滴数量减少,提示PTT可抑制PA诱导的骨骼肌中脂质沉积。见图 2。
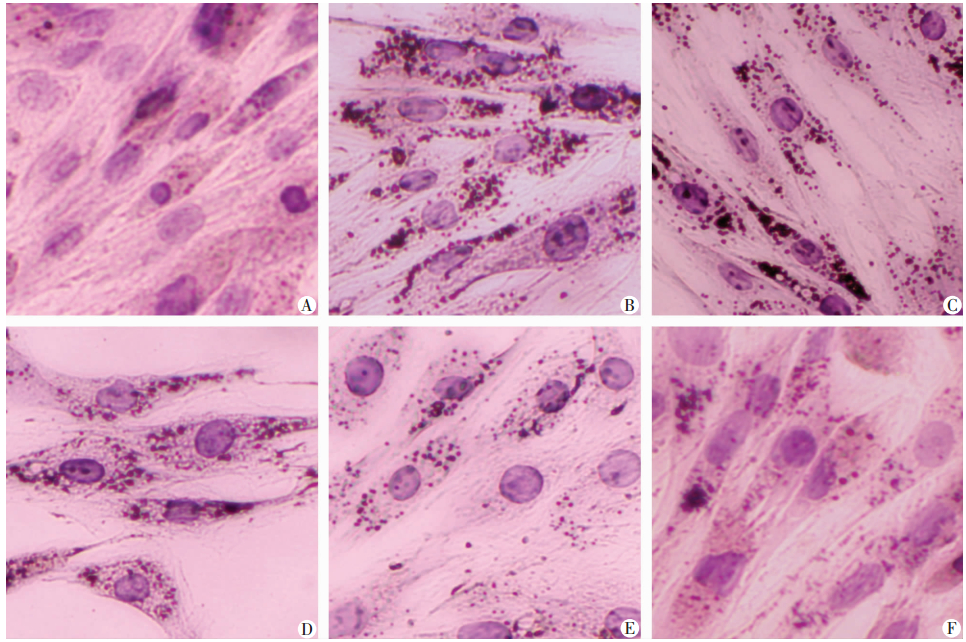
|
| A:对照组;B:PA处理组;C:PA+10 μmol/L PTT处理组;D:PA+20 μmol/L PTT处理组;E:PA+40 μmol/L PTT处理组;F:PA+80 μmol/L PTT处理组 图 2 倒置显微镜观察PTT干预对PA处理的各组L6肌管细胞脂质沉积的影响 (油红O×200) |
2.3 PTT抑制PA诱导的L6肌管细胞内TG含量升高
0.75 mmol/L PA处理L6肌管细胞16 h后,细胞内TG含量较对照组显著升高(P < 0.05),而不同浓度的PTT(20、40、80 μmol/L)干预后,细胞内TG含量明显降低(P < 0.05),进一步证实了PTT可以抑制PA诱导的L6肌管细胞内脂质沉积(图 3)。
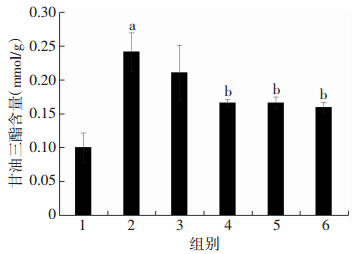
|
| 1:对照组;2:PA处理组;3:PA+10 μmol/L PTT处理组;4:PA+20 μmol/L PTT处理组;5:PA+40 μmol/L PTT处理组;6:PA+80 μmol/L PTT处理组;a:P < 0.05,与对照组比较;b: P < 0.05,与PA处理组比较 图 3 PTT干预对PA处理的各组L6肌管细胞内TG含量的影响 |
2.4 PTT抑制PA诱导的L6肌管细胞葡萄糖摄取能力下降
胰岛素刺激状态下的葡萄糖摄取能力反映了胰岛素敏感性。由图 4可见,PA处理组细胞在胰岛素刺激下的葡萄糖摄取能力较正常对照组明显降低(P < 0.05),而不同浓度PTT(20、40、80 μmol/L)干预处理组细胞葡萄糖摄取能力较PA处理组显著增加(P < 0.05),提示PTT可以改善PA诱导的L6肌管细胞胰岛素抵抗。
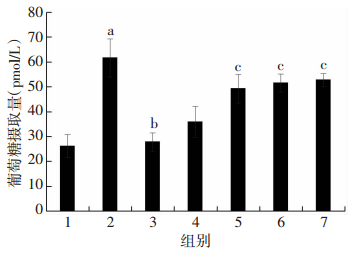
|
| 1:对照组;2:胰岛素刺激组;3:PA+胰岛素刺激组;4:PA+胰岛素+10 μmol/L PTT处理组;5:PA+胰岛素+20 μmol/L PTT处理组;6:PA+胰岛素+40 μmol/L PTT处理组;7:PA+胰岛素+80 μmol/L PTT处理组;a:P < 0.05,与对照组比较;b: P < 0.05,与胰岛素刺激组比较;c:P < 0.05,与PA+胰岛素处理组比较 图 4 PTT干预对PA处理的各组L6肌管细胞葡萄糖摄取能力的影响 |
2.5 PTT抑制PA诱导的L6肌管细胞Plin5和FGF21蛋白水平降低
与对照组相比,PA处理的L6肌管细胞内Plin5和FGF21蛋白水平明显降低(P < 0.05),而PTT(20、40、80 μmol/L)干预组细胞内Plin5、FGF21蛋白水平较PA处理组显著增加(P < 0.05),提示PTT干预可以逆转PA诱导的L6肌管细胞Plin5和FGF21蛋白水平下降(图 5)。
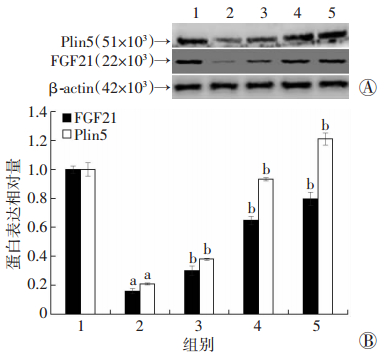
|
| 1:对照组;2:PA处理组;3:PA+20 μmol/L PTT处理组;4:PA+40 μmol/L PTT处理组;5:PA+80 μmol/L PTT处理组;a: P < 0.05,与对照组比较;b: P < 0.05,与PA处理组比较 图 5 Western blot检测PTT干预对PA处理的各组L6肌管细胞Plin5、FGF21蛋白表达的影响 |
2.6 沉默Plin5削弱PTT对PA诱导的L6肌管细胞脂质沉积和胰岛素抵抗的改善效应
为明确Plin5基因在PTT抑制PA诱导的L6肌管细胞内脂质沉积和胰岛素抵抗中的作用,采用siRNA沉默Plin5基因后观察PTT的抑制效应变化。由图 6可见,沉默Plin5后PTT对PA诱导的FGF21蛋白水平下降、TG含量增加及胰岛素刺激下的葡萄糖摄取能力下降的抑制作用均被明显削弱(P < 0.05),表明PTT可能是通过Plin5/FGF21通路抑制PA诱导的L6肌管细胞脂质沉积和胰岛素抵抗。
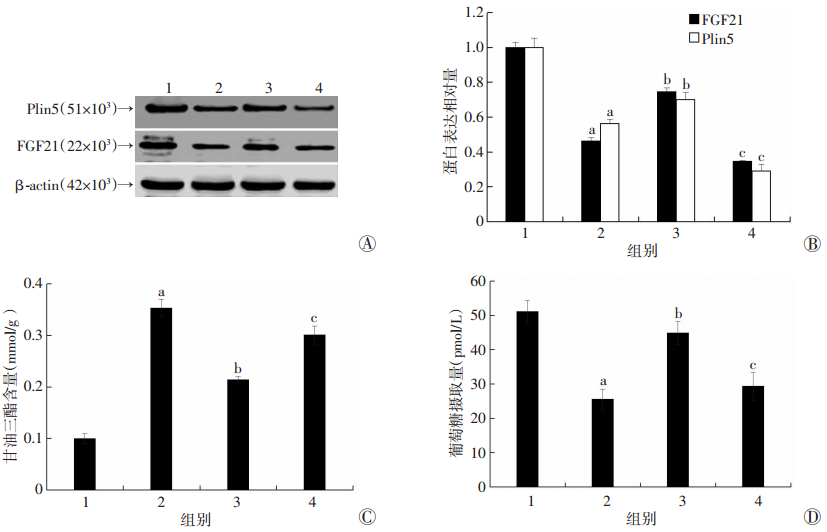
|
|
A:Western blot检测Plin5和FGF21蛋白;B:Plin5和FGF21蛋白相对表达水平;C:甘油三酯含量;D:葡萄糖摄取能力 1:对照组;2:PA处理组;3:PA+20 μmol/L PTT处理组;4:PA+20 μmol/L PTT +Plin5 siRNA处理组;a: P < 0.05,与对照组比较;b: P < 0.05,与PA处理组比较;c: P < 0.05,与PA+20 μmol/L PTT处理组比较 图 6 沉默Plin5后PTT干预对PA处理的各组L6肌管细胞FGF21蛋白水平、TG含量及葡萄糖摄取能力变化的影响 |
3 讨论
近年来,随着我国居民饮食结构的变迁和生活方式的改变,T2DM的发病率也越来越高,已成为严重威胁居民健康的常见慢性病之一。胰岛素抵抗是一种生理浓度胰岛素作用下的葡萄糖摄取功能受损的一种表现,且胰岛素抵抗可能先于T2DM发病10~20年[8]。骨骼肌作为机体内最大的糖脂代谢组织,负责了整个机体80%~90%的葡萄糖代谢,所以骨骼肌胰岛素抵抗被认为是T2DM发病的初始诱因[9]。大量研究证据表明,骨骼肌细胞内的脂质异位沉积与胰岛素抵抗发生紧密相关[10-11]。因此,改善骨骼肌内脂质异位沉积成为防治T2DM的重要策略之一。
膳食植物化学物改善骨骼肌胰岛素抵抗进而防治T2DM、代谢综合征等胰岛素抵抗相关疾病的作用备受关注。已有研究表明,二氢山奈酚衍生物、黄岑苷等黄酮类化合物可通过抑制骨骼肌脂质异位沉积的途径改善骨骼肌胰岛素抵抗[12-13]。PTT是白藜芦醇3位和5位羟基被甲氧基替代的同系物,由于PTT的二甲醚结构增强了对细胞膜的亲脂性和通透性,从而使其生物利用率高于白藜芦醇,因此PTT在慢性病防治中的潜在应用价值更受重视[14]。新近的动物实验研究结果表明,PTT可以有效改善胰岛素抵抗[6, 15],但PTT对高脂诱导下的骨骼肌脂质沉积的影响尚不清楚。本研究采用PA诱导大鼠L6肌管细胞建立胰岛素抵抗细胞模型,观察了PTT干预对PA诱导的骨骼肌胰岛素抵抗及脂质沉积的影响,油红O染色结果显示PTT可以抑制PA诱导的脂质沉积,定量分析证实PTT可显著降低PA诱导的L6肌管细胞内TG含量上升。同时,葡萄糖摄取能力检测发现,PA显著降低L6肌管细胞在胰岛素刺激下的葡萄糖摄取能力,而PTT干预后细胞葡萄糖摄取能力明显增加。上述结果提示,PTT可抑制高脂诱导的骨骼肌脂质沉积和胰岛素抵抗。
Plin5是一种脂滴表面蛋白,可通过调节脂质分解降低脂毒性损伤作用[16]。生理状态下,骨骼肌细胞内Plin5抑制TG分解[17],当骨骼肌细胞受到刺激后,Plin5可以促进TG分解进而降低细胞内TG含量[18]。因此,Plin5被认为是一种维持细胞内脂质稳态的重要调节蛋白。研究表明,骨骼肌Plin5过表达小鼠的FGF21表达明显升高[19],而FGF21可改善PA诱导的骨骼肌胰岛素抵抗[20]。推测Plin5可通过调控FGF21表达调节骨骼肌细胞对胰岛素的敏感性。本实验结果显示,PA明显下调L6肌管细胞中的Plin5、FGF21蛋白水平,PTT干预则可显著抑制PA诱导的Plin5、FGF21蛋白水平下降,而采用siRNA沉默Plin5基因后,PTT对PA诱导的FGF21蛋白水平下降、TG含量增加及胰岛素刺激下的葡萄糖摄取能力降低的抑制作用被显著削弱,提示PTT对PA诱导的骨骼肌细胞脂质沉积和胰岛素抵抗的抑制作用可能与其调节Plin5/FGF21通路有关。
综上所述,本实验结果显示:PTT可通过调节Plin5/FGF21通路抑制高脂诱导的骨骼肌脂质沉积并改善胰岛素抵抗。本研究的局限性在于未深入探讨PTT调节Plin5/FGF21通路的上游分子机制,且没有对现有结果进行相应的动物实验研究予以证实。下一步将对此进一步开展深入研究,为开发PTT应用于T2DM防治提供科学依据。
| [1] | LAURENS C, MORO C. Intramyocellular fat storage in metabolic diseases[J]. Horm Mol Biol Clin Investig, 2016, 26(1): 43–52. DOI:10.1515/hmbci-2015-0045 |
| [2] | ESTRELA J M, ORTEGA A, MENA S, et al. Pterostilbene: biomedical applications[J]. Crit Rev Clin Lab Sci, 2013, 50(3): 65–78. DOI:10.3109/10408363.2013.805182 |
| [3] | DOS SANTOS LACERDA D, TÜRCK P, GAZZI DE LIMA-SEOLIN B, et al. Pterostilbene reduces oxidative stress, prevents hypertrophy and preserves systolic function of right ventricle in cor pulmonale model[J]. Br J Pharmacol, 2017, 174(19): 3302–3314. DOI:10.1111/bph.13948 |
| [4] | MA Z, YANG Y, DI S, et al. Pterostilbene exerts anticancer activity on non-small-cell lung cancer via activating endoplasmic reticulum stress[J]. Sci Rep, 2017, 7(1): 8091. DOI:10.1038/s41598-017-08547-0 |
| [5] | HANNAN P A, KHAN J A, ULLAH I, et al. Synergistic combinatorial antihyperlipidemic study of selected natural antioxidants; modulatory effects on lipid profile and endogenous antioxidants[J]. Lipids Health Dis, 2016, 15: 151. DOI:10.1186/s12944-016-0323-3 |
| [6] | GÓMEZ-ZORITA S, FERNÁNDEZ-QUINTELA A, AGUIRRE L, et al. Pterostilbene improves glycaemic control in rats fed an obesogenic diet: involvement of skeletal muscle and liver[J]. Food Funct, 2015, 6(6): 1968–1976. DOI:10.1039/c5fo00151j |
| [7] | MASON R R, WATT M J. Unraveling the roles of PLIN5: linking cell biology to physiology[J]. Trends Endocrinol Metab, 2015, 26(3): 144–152. DOI:10.1016/j.tem.2015.01.005 |
| [8] | WARRAM J H, MARTIN B C, KROLEWSKI A S, et al. Slow glucose removal rate and hyperinsulinemia precede the development of type Ⅱ diabetes in the offspring of diabetic parents[J]. Ann Intern Med, 1990, 113(12): 909–915. DOI:10.7326/0003-4819-113-12-909 |
| [9] | DEFRONZO R A, TRIPATHY D. Skeletal muscle insulin resistance is the primary defect in type 2 diabetes[J]. Diabetes Care, 2009, 32(2): S157–S163. DOI:10.2337/dc09-s302 |
| [10] | TUMOVA J, ANDEL M, TRNKA J. Excess of free fatty acids as a cause of metabolic dysfunction in skeletal muscle[J]. Physiol Res, 2016, 65(2): 193–207. |
| [11] | JOHANNSEN D L, TCHOUKALOVA Y, TAM C S, et al. Effect of 8 weeks of overfeeding on ectopic fat deposition and insulin sensitivity: testing the "adipose tissue expandability" hypothesis[J]. Diabetes Care, 2014, 37(10): 2789–2797. DOI:10.2337/dc14-0761 |
| [12] | XI Y L, LI H X, CHEN C, et al. Baicalin attenuates high fat diet-induced insulin resistance and ectopic fat storage in skeletal muscle, through modulating the protein kinase B/Glycogen synthase kinase 3 beta pathway[J]. Chin J Nat Med, 2016, 14(1): 48–55. DOI:10.3724/SP.J.1009.2016.00048 |
| [13] |
顾业芸, 周启程, 公欣华, 等. 二氢山奈酚衍生物调控AMPK/PGC-1α通路抑制棕榈酸诱导的C2C12成肌分化细胞脂质沉积[J].
第三军医大学学报, 2017, 39(16): 1606–1611.
GU Y Y, ZHOU Q C, GONG X H, et al. Dihydrokaempferol derivatives inhibit palmitic acid-induced lipid deposition in C2C12 myotubes through AMPK/PGC-1α pathway[J]. J Third Mil Med Univ, 2017, 39(16): 1606–1611. DOI:10.16016/j.1000-5404.201612097 |
| [14] | NAGAO K, JINNOUCHI T, KAI S, et al. Pterostilbene, a dimethylated analog of resveratrol, promotes energy metabolism in obese rats[J]. J Nutr Biochem, 2017, 43: 151–155. DOI:10.1016/j.jnutbio.2017.02.009 |
| [15] | KOSURU R, SINGH S. Pterostilbene ameliorates insulin sensitivity, glycemic control and oxidative stress in fructose-fed diabetic rats[J]. Life Sci, 2017, 182: 112–121. DOI:10.1016/j.lfs.2017.06.015 |
| [16] | BINDESBØLL C, BERG O, ARNTSEN B, et al. Fatty acids regulate perilipin5 in muscle by activating PPARδ[J]. J Lipid Res, 2013, 54(7): 1949–1963. DOI:10.1194/jlr.M038992 |
| [17] | WANG C, ZHAO Y, GAO X, et al. Perilipin 5 improves hepatic lipotoxicity by inhibiting lipolysis[J]. Hepatology, 2015, 61(3): 870–882. DOI:10.1002/hep.27409 |
| [18] | RAMOS S V, MACPHERSON R E K, TURNBULL P C, et al. Higher PLIN5 but not PLIN3 content in isolated skeletal muscle mitochondria following acute in vivo contraction in rat hindlimb[J]. Physiological Reports, 2014, 2(10): e12154–e12154. DOI:10.14814/phy2.12154 |
| [19] | HARRIS L A, SKINNER J R, SHEW T M, et al. Perilipin 5-Driven lipid droplet accumulation in skeletal muscle stimulates the expression of fibroblast growth factor 21[J]. Diabetes, 2015, 64(8): 2757–2768. DOI:10.2337/db14-1035 |
| [20] | LEE M S, CHOI S E, HA E S, et al. Fibroblast growth factor-21 protects human skeletal muscle myotubes from palmitate-induced insulin resistance by inhibiting stress kinase and NF-κB[J]. Metab Clin Exp, 2012, 61(8): 1142–1151. DOI:10.1016/j.metabol.2012.01.012 |



