骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一种生物学和临床上的异质性克隆造血系统疾病,其特征是骨髓分化异常、无效造血和日益增加的基因组不稳定性,在临床表现为血细胞减少,髓系细胞一系或多系病态造血,高风险转化为急性髓系白血病等[1]。由于缺乏明确的分子靶点,前线的药理学疗法没有明显疗效,因而除了有资格进行干细胞移植的一小部分患者外,大多数MDS患者的预后都不良[2-3]。因此,迫切需要描述阐明MDS发病机制中涉及的分子机制,以便建立良好的诊断标准和具体有效的靶向治疗。
2006年STEINBACH等[4]研究发现在急性髓系白血病患者中SPAG6与WT1等7个基因表达明显增高,提示该基因在白血病中可能具促癌效应。本课题组前期研究表明SPAG6基因沉默后具有抑制MDS细胞生长,促进其凋亡的作用[5-6]。进一步研究提示SPAG6可能是通过抑制FADD的表达及其与死亡受体DR4/DR5之间的相互作用进而抑制TRAIL信号通路的线粒体途径和非线粒体途径来调控细胞凋亡[7]。而P53作为最重要的抑癌基因之一,在TRAIL信号通路中既可诱导TRAIL死亡受体DR4和DR5的表达调控线粒体通路;又可诱导Bax等凋亡蛋白的表白,抑制Bcl-2抗凋亡蛋白的表达调控非线粒体通路[8]。基于以上事实,本研究拟通过慢病毒载体介导的RNA干扰技术,降低SKM-1细胞中P53和SPAG6的表达,研究SPAG6基因是否以P53依赖方式促进TRAIL诱导的MDS细胞凋亡。为进一步阐明SPAG6在MDS发病中的作用机制提供理论依据和奠定实验基础。
1 材料与方法 1.1 主要试剂RPMI1640培养基、胰蛋白酶消化液(美国Corning公司);胎牛血清(德国PAN-Biotech GmbH公司);DMEM培养基(美国HyClone公司);嘌呤霉素(Sigma公司);RNA提取试剂盒、逆转录试剂盒、定量PCR试剂盒、SPAG6、P53及GAPDH上下游引物(日本TaKaRa公司);BCA蛋白定量试剂盒(Beyotime);P53、Caspase-8、PARP、cleaved-PARP等兔单克隆抗体及SPAG6兔多克隆抗体(美国Abcam公司);GAPDH兔多克隆抗体、山羊抗鼠二抗(Beyotime);山羊抗兔二抗(美国Abbkine公司);CCK-8试剂盒(日本同仁化学DOJINDO);人结肠癌细胞株HCT116来自本院消化内科实验室赠送;人MDS细胞株SKM-1细胞由本课题组冻存;上海吉凯基因化学技术有限公司提供包括质粒pHelper1.0、pHelper2.0及GV118载体和GV298载体等在内的慢病毒载体系统。
1.2 方法 1.2.1 细胞培养HCT116细胞和SKM-1细胞培养于含10%胎牛血清的RPMI1640培养基中;293T细胞培养于含10%胎牛血清的DMEM培养基中。
1.2.2 慢病毒载体的构建针对目的基因序列,根据RNAi序列设计原则设计3条RNA干扰P53基因的靶点序列及1条通用型阴性对照序列(表 1)。合成双链DNA寡核苷酸→转化感受态大肠杆菌DH5α→筛选阳性克隆并测序鉴定→感染293T细胞收集浓度慢病毒→测定慢病毒滴度[5]。
| 序列名称 | 靶序列(5′→3′) | 基因中的位置 | GC含量(%) |
| TP53-siRNA1 | GACTCCAGTGGTAATCTAC | 420~439 bp | 47.40 |
| TP53-siRNA2 | CCATCCACTACAACTACAT | 350~369 bp | 42.10 |
| TP53-siRNAi3 | GCACAGAGGAAGAGAAT | 375~392 bp | 47.10 |
| NC-siRNA | TTCTCCGAACGTGTCACGT | - | 52.63 |
1.2.3 P53kd RNA慢病毒感染HCT116
取对数期生长的HCT116细胞计数后以3×104/孔铺12孔板,实验分为1个阴性对照组和3个干扰组。24 h后细胞融合度在20%~30%时,用上述得到的经测序验证正常的对应慢病毒液按MOI=15分别加入上述对应组的孔板中,12 h后吸弃含病毒的上清培养液,添加新鲜完全培养基,于CO2孵箱中继续培养,隔天换液。5 d后荧光显微镜下观察红色荧光蛋白(RFP)的表达,并将细胞消化离心重悬混匀后取部分用流式细胞术检测转染率。
1.2.4 RT-PCR分析成功感染后于第8天分别提取细胞总RNA,测浓度后反转录为cDNA,再利用特异性引物(表 2)进行定量PCR扩增反应,以GAPDH为内参,2-ΔΔCt法分析P53 mRNA的相对表达水平。
| 基因 | 引物序列(5′→3′) | 产物长度(bp) |
| P53 | 上游5′-GAGGTTGGCTCTGACTGTACC-3′ 下游5′-TCCGTCCCAGTAGATTACCAC-3′ |
133 |
| SPAG6 | 上游5′-CCTTTCAGCTCTCAGTCAGGTTTC-3′ 下游5′-TCTTCACGTTTCATCCTTGTCCTT-3′ |
119 |
| GAPDH | 上游5′-CTTTGGTATCGTGGAAGGACTC-3′ 下游5′-GTAGAGGCAGGGATGATGTTCT-3′ |
132 |
1.2.5 Western blot检测P53 mRNA的干扰效果
成功感染后于第8天提取细胞总蛋白,测浓度后按最低浓度配平并按比例加上样缓冲液煮沸3~5 min变性后于-20 ℃保存。制备10%的凝胶,取50 μg总蛋白进行SDS-PAGE电泳2 h后湿转1 h到PVDF膜上,用含5%牛血清白蛋白(BSA)的TBST封闭液封闭4 h。TBST洗3次后孵育一抗4 ℃过夜。第2天TBST洗涤5次,与二抗室温孵育1 h。TBST洗涤3次。Quantity One软件分析灰度值,以目的蛋白灰度值/GAPDH灰度值表示目的蛋白的相对表达量,结果以3次及以上取平均值表示。
1.2.6 SKM-1 P53kd细胞株的建立 1.2.6.1 SKM-1细胞的P53慢病毒感染将P53kd RNA和P53kd RNA慢病毒载体取MOI=20感染SKM-1细胞,每组加入终浓度为5 μg/mL的polybrene感染增强剂。12 h后离心弃上清,添加新鲜培养液。48 h后更换含有终浓度0.5 μg/mL嘌呤霉素的培养基进行筛选。15 d后荧光显微镜下观察RFP表达情况。
1.2.6.2 RT-PCR和Western blot检测P53的表达方法同1.2.4和1.2.5。
1.2.7 SPAG6kd RNA慢病毒的感染将SPAG6慢病毒以MOI=20感染SKM-1细胞和SKM-1 P53kd细胞,每组均加入终浓度5 μg/mL的polybrene,不加嘌呤霉素。6 d后在荧光显微镜下观察绿色荧光(GFP)表达情况,取部分细胞用流式细胞术检测转染效率。
1.2.8 RT-PCR和Western blot检测SPAG6的干扰情况方法同1.2.4和1.2.5。
1.2.9 CCK-8检测细胞增殖在SKM-1细胞和SKM-1 P53kd细胞中成功干扰SPAG6第6天后,取细胞接种于96孔板,每孔100 μL培养液中接种1×104个细胞,接种24 h后分别加入0、10、30、100、300、1 000 ng/mL不同浓度的rTRAIL蛋白,12 h后每孔加入10 μL CCK-8试剂,37 ℃孵育3.5 h后在酶标仪上测定光密度值D (450)。绘制细胞生长曲线并按照公式计算出能明显引起细胞抑制的rTRAIL蛋白浓度。
1.2.10 rTRAIL诱导细胞凋亡用上述实验得到的rTRAIL蛋白浓度处理成功干扰SPAG6的SKM-1细胞和SKM-1P53kd细胞12 h后,提取总蛋白,Western blot检测各组细胞Caspase-8、cleaved-PARP、PARP的表达变化。方法同1.2.5。
1.3 统计学方法采用SPSS 18.0统计软件,多组间数据的差异采用单因素方差分析,两独立样本组间比较采用t检验,计量资料以x±s表示,检验水准α=0.05。
2 结果 2.1 HCT116细胞中P53kd RNA慢病毒载体的转染率及敲低P53基因有效靶点的确定在P53kd RNA慢病毒载体转染HCT116后,荧光显微镜下可见:与白光下对比,几乎所有细胞均表达红色荧光,流式细胞术检测转染率均在85%以上。提示P53kd RNA慢病毒载体成功转染了HCT116细胞。qRT-PCR检测结果显示,3条靶序列均能有效降低P53 mRNA表达水平(P < 0.01);Western blot检测结果也提示,相对于阴性对照组(0.68±0.01),3条干扰序列均能有效抑制P53蛋白表达(分别为0.09±0.01,0.17±0.04,0.17±0.04,P < 0.01),其中P53kd RNA1的干扰效率最高,定为后续实验使用序列(图 1)。

|
| A:白光观察干扰组HCT116细胞变化(×40);B:荧光观察干扰组HCT116细胞变化(×40);C:流式细胞术检测转染率;D:实时定量RT-PCR检测P53 mRNA表达;E:Western blot检测P53蛋白表达;1:阴性对照组;2:P53kd RNA1干扰组;3:P53kd RNA2干扰组;4:P53kd RNA3干扰组;a:P < 0.01,与阴性对照组比较 图 1 P53kd RNA慢病毒的干扰序列在HCT116细胞中筛选及验证 |
2.2 SKM-1 P53kd细胞模型的建立
在P53kd RNA1慢病毒载体转染SKM-1,经嘌呤霉素筛选后,荧光显微镜下见:与白光下对比,细胞几乎都表达RFP,转染率均在95%以上。提示P53kd RNA1慢病毒载体成功转染了HCT116细胞。qRT-PCR检测结果显示,干扰组中P53 mRNA表达水平显著降低(0.11±0.01,P < 0.01);Western blot检测结果也提示,相对于阴性对照组(0.74±0.02),干扰组能明显抑制P53蛋白表达(0.10±0.01,P < 0.01,图 2)。
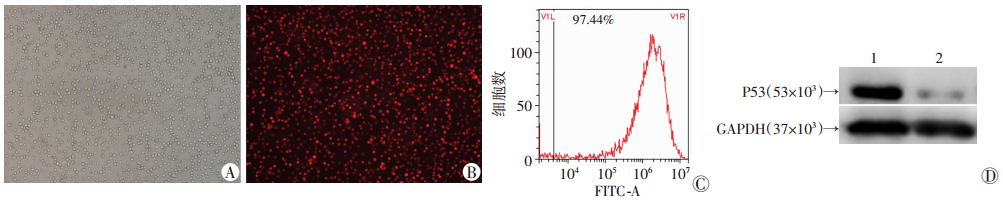
|
| A:白光观察干扰组SKM-1细胞变化(×40);B:荧光观察干扰组SKM-1细胞变化(×40);C:流式细胞术检测转染效率;D:Western blot检测P53蛋白表达;1:阴性对照组;2:P53kd RNA1干扰组 图 2 P53kd RNA慢病毒载体转染SKM-1细胞的转染效率及效果验证 |
2.3 在SKM-1和SKM-1 P53kd
细胞中敲低SPAG6基因的表达在SPAG6kd RNA慢病毒载体感染SKM-1和SKM-1 P53kd细胞,第6天后荧光显微镜下观察:与白光下细胞对比,绿光下大部分细胞均表达GFP,转染率在90%以上。RT-PCR检测结果显示,SPAG6kd RNA慢病毒载体能有效降低SKM-1和SKM-1 P53kd细胞中SPAG6 mRNA表达水平(分别为0.24±0.02,0.16±0.03,P < 0.01);Western blot检测结果显示,在两种细胞中相对于阴性对照组(分别为1.54±0.09,0.87±0.13),干扰组均能有效抑制SPAG6蛋白表达(分别为0.41±0.03,0.25±0.03,P < 0.01,图 3)。
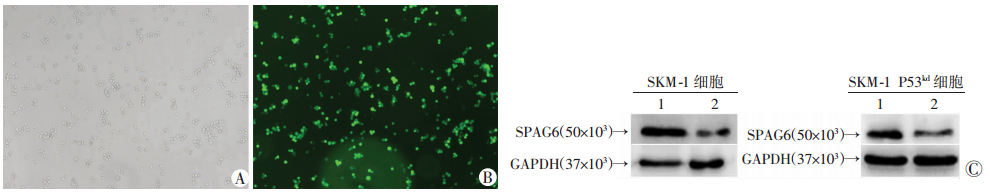
|
| A:白光观察干扰组SKM-1细胞变化(×40);B:绿色荧光观察干扰组SKM-1细胞变化(×40);C:Western blot检测SPAG6蛋白表达;1:阴性对照组;2:SPAG6kd RNA慢病毒干扰组 图 3 SPAG6kd RNA慢病毒载体转染SKM-1及SKM-1 P53kd细胞的转染效率及效果验证 |
2.4 不同浓度rTRAIL蛋白激活细胞TRAIL凋亡通路
CCK-8法检测结果显示,TRAIL处理细胞12 h后,30 ng/mL TRAIL诱导的细胞凋亡与对照组差异没有统计学意义,100 ng/mL和300 ng/mL TRAIL显著诱导SPAG6kd细胞凋亡,而P53基因沉默与否并没有影响该结果(P < 0.05,图 4)。
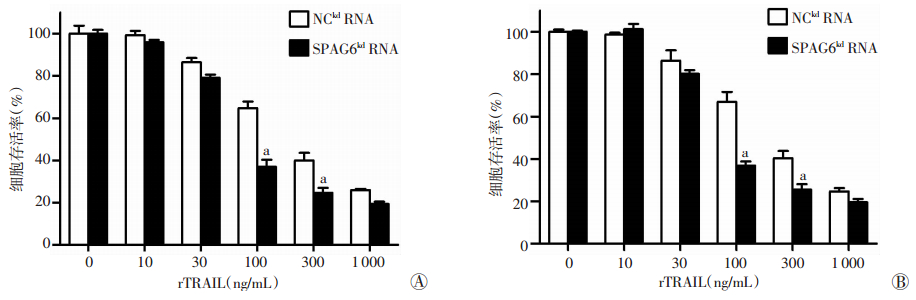
|
| a:P < 0.05,与NCkd RNA比较 图 4 CCK-8检测SKM-1细胞(A)和SKM-1 P53kd细胞(B)转染慢病毒SPAG6后第6天用不同浓度rTRAIL处理后细胞的增殖变化 |
2.5 rTRAIL诱导细胞凋亡在SKM-1细胞和SKM-1 P53kd细胞中相似
100 ng/mL和300 ng/mL的rTRAIL处理细胞后,能显著诱导SPAG6kd细胞凋亡,取差异相对最显著的100 ng/mL TRAIL处理细胞后,Western blot检测细胞凋亡标志分子,Quantity One分析结果提示:SKM-1细胞中,与对照组相比,SPAG6kd细胞组Caspase-8和cleaved-PARP的蛋白表达较对照组显著升高,PARP表达差异无统计学意义(P < 0.05, P < 0.01,图 5A、B)。SKM-1 P53kd细胞和SKM-1细胞结果相似(P < 0.05,P < 0.01,图 5C、D)。

|
| 1:SPAG6kd RNA+ rTRAIL组;2:SPAG6kd RNA组;3:NCkdRNA+ rTRAIL组;4:NCkdRNA组;a:P < 0.05, 与NCkdRNA+ rTRAIL组比较;b:P < 0.05,与NCkdRNA组比较 图 5 Western blot检测SKM-1细胞(A、B)和SKM-1 P53kd细胞(C、D)中PARP、cleaved-PARP及Caspase-8的表达 |
3 讨论
SPAG6基因是NEILSON等[9]在1999年首次成功克隆出来的,该基因位于10p12.3。目前对该基因的认识还比较局限,既往研究表明SPAG6基因高度保守,主要在睾丸中高度表达,在具有运动纤毛的组织中少量表达,其他正常组织几乎不表达,当其缺失或沉默时,小鼠表现为精子鞭毛运动能力下降[10-11],所以一般认为SPAG6主要与生殖相关。2011年SILINA等[12]研究发现在包括胃癌、肺癌等多种实体瘤患者癌组织中SPAG6表达明显增高,提示SPGA6可能与肿瘤的形成有关。在采用SNP芯片技术研究中发现,半数以上的MDS病例,包含SPAG6等7个基因在内的UPD区域仅出现于MDS髓系细胞,而在对应T细胞中并未出现,并且该研究组在检测MDS患者所有基因组mRNA表达情况时发现SPAG6基因在MDS患者中表达较正常对照组明显增高[13-14],表明SPAG6可能在MDS的发病机制中起重要的促癌作用。
RNA干扰技术是一个强大的抑制特定基因的表达工具,慢病毒载体是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,可以将外源基因特异地整合至宿主染色体上从而达到持久性表达[15]。因此我们采用RNA干扰的方式建立P53基因低表达的SKM-1 P53kd模型,并且成功创建SPAG6和P53双基因敲低模型。在TRAIL凋亡通路中,TRAIL结合死亡受体DR4和DR5通过衔接蛋白FADD产生启动型Caspase-8,启动型Caspase-8可以通过线粒体介导及非线粒体介导两种凋亡途径引起细胞凋亡[8]。多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)是Caspase-3的经典产物之一,它被启动型Caspase-3切割后功能丧失,进而引起细胞凋亡[16]。因此,我们选取PARP、cleaved-PARP及Caspase-8作为监测TRAIL信号通路中细胞凋亡的指标分子。
本研究用rTRAIL诱导细胞后,发现随着rTRAIL浓度的增加,细胞凋亡也在增加,而沉默SPAG6基因后的细胞对rTRAIL的刺激更为敏感,说明SPAG6基因具有抵抗凋亡效应。进一步研究发现,rTRAIL诱导后,SPAG6kd组细胞凋亡显著高于对照组,而P53基因沉默与否并没有影响该结果。结合前期研究结果SPAG6调控细胞TRAIL凋亡机制可能是通过抑制FADD的表达及其与死亡受体间的相互作用[13],说明SPAG6可能以非P53依赖的方式促进TRAIL诱导的MDS细胞凋亡,补充阐明MDS在TRAIL信号通路中的作用机制,为后续深入的MDS机制研究提供理论参考依据。不足之处在于本研究主要是在体外细胞水平完成,缺乏相应的体内动物实验和临床实验数据支持,我们将在后续的实验中进一步验证。
| [1] | COGLE C R, CRAIG B M, ROLLISON D E, et al. Incidence of the myelodysplastic syndromes using a novel claims-based algorithm: high number of uncaptured cases by cancer registries[J]. Blood, 2011, 117(26): 7121–7125. DOI:10.1182/blood-2011-02-337964 |
| [2] | GANGAT N, PATNAIK M M, TEFFERI A. Myelodysplastic syndromes: contemporary review and how we treat[J]. Am J Hematol, 2016, 91(1): 76–89. DOI:10.1002/ajh.24253 |
| [3] | ZEIDAN A M, LINHARES Y, GORE S D. Current therapy of myelodysplastic syndromes[J]. Blood Rev, 2013, 27(5): 243–259. DOI:10.1016/j.blre.2013.07.003 |
| [4] | STEINBACH D, SCHRAMM A, EGGERT A, et al. Identification of a set of seven genes for the monitoring of minimal residual disease in pediatric acute myeloid leukemia[J]. Clin Cancer Res, 2006, 12(8): 2434–2441. DOI:10.1158/1078-0432.CCR-05-2552 |
| [5] |
杨碧慧, 张玉琳, 王利, 等. SPAG6基因RNAi慢病毒载体的构建及其对SKM-1细胞凋亡的影响[J].
第三军医大学学报, 2015, 37(5): 474–479.
YANG B H, ZHANG Y L, WANG L. Construction of lentiviral vector for SPAG6 RNA interference and its influence on apoptosis of SKM-1 cells[J]. J Third Mil Med Univ, 2015, 37(5): 474–479. DOI:10.16016/j.1000-5404.201408199 |
| [6] | YANG B, WANG L, LUO X, et al. SPAG6 silencing inhibits the growth of the malignant myeloid cell lines SKM-1 and K562 via activating p53 and caspase activation-dependent apoptosis[J]. Int J Oncol, 2015, 46(2): 649–656. DOI:10.3892/ijo.2014.2768 |
| [7] | LI X, YANG B, WANG L, et al. SPAG6 regulates cell apoptosis through the TRAIL signal pathway in myelodysplastic syndromes[J]. Oncol Rep, 2017, 37(5): 2839–2846. DOI:10.3892/or.2017.5540 |
| [8] | ZHAO J, LU Y, SHEN H M. Targeting p53 as a therapeutic strategy in sensitizing TRAIL-induced apoptosis in cancer cells[J]. Cancer Lett, 2012, 314(1): 8–23. DOI:10.1016/j.canlet.2011.09.040 |
| [9] | NEILSON L I, SCHNEIDER P A, VAN DEERLIN P G, et al. cDNA cloning and characterization of a human sperm antigen (SPAG6) with homology to the product of the Chlamydomonas PF16 locus[J]. Genomics, 1999, 60(3): 272–280. DOI:10.1006/geno.1999.5914 |
| [10] | SAPIRO R, TARANTINO L M, VELAZQUEZ F, et al. Sperm antigen 6 is the murine homologue of the Chlamydomonas reinhardtii central apparatus protein encoded by the PF16 locus[J]. Biol Reprod, 2000, 62(3): 511–518. DOI:10.1095/biolreprod62.3.511 |
| [11] | ZHANG Z, JONES B H, TANG W, et al. Dissecting the axoneme interactome: the mammalian orthologue of Chlamydomonas PF6 interacts with sperm-associated antigen 6, the mammalian orthologue of Chlamydomonas PF16[J]. Mol Cell Proteomics, 2005, 4(7): 914–923. DOI:10.1074/mcp.M400177-MCP200 |
| [12] | SILIŅA K, ZAYAKIN P, KALNIŅA Z, et al. Sperm-associated antigens as targets for cancer immunotherapy: expression pattern and humoral immune response in cancer patients[J]. J Immunother, 2011, 34(1): 28–44. DOI:10.1097/CJI.0b013e3181fb64fa |
| [13] | WANG L, FIDLER C, NADIG N, et al. Genome-wide analysis of copy number changes and loss of heterozygosity in myelodysplastic syndrome with del(5q) using high-density single nucleotide polymorphism arrays[J]. Haematologica, 2008, 93(7): 994–1000. DOI:10.3324/haematol.12603 |
| [14] | BOULTWOOD J, PELLAGATTI A, CATTAN H, et al. Gene expression profiling of CD34+ cells in patients with the 5q-syndrome[J]. Br J Haematol, 2007, 139(4): 578–589. DOI:10.1111/j.1365-2141.2007.06833.x |
| [15] | MAO Y, YAN R, LI A, et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells[J]. Int J Med Sci, 2015, 12(5): 407–415. DOI:10.7150/ijms.11270 |
| [16] | KRISHNAKUMAR R, KRAUS W L. The PARP side of the nucleus: molecular actions, physiological outcomes, and clinical targets[J]. Mol Cell, 2010, 39(1): 8–24. DOI:10.1016/j.molcel.2 |



