随着人类饮食结构的改变,高尿酸血症(hyperuricemia,HUA)和痛风的发生率逐年增加,并有低龄化的倾向[1]。HUA是以血尿酸(serum uric acid,SUA)升高为主要特征的一组疾病,不仅引起痛风,而且有研究表明HUA可能是高血压、血脂异常、脂肪肝、胰岛素抵抗、慢性肾病等多种代谢相关性疾病和心血管疾病发生、发展的独立危险因素[2],且SUA升高伴发的相关危害程度的广泛性已经成为威胁全人类生活质量的一大健康隐患。因此探索HUA与其他代谢性疾病相互作用机制以及研究防治HUA和痛风的药物成为现如今医学界的研究热点;而建立高效、稳定、持久的HUA动物模型是对其机制和药物研究的重要基础。
果糖是一种以游离状态广泛存在于水果的浆汁和蜂蜜中的己糖,为葡萄糖的同分异构体;而许多软饮料、糖果、甜点等加工食品中也含有多量果糖。近年来高果糖饮食的广泛摄入正在影响着人类的健康[3-5]。本研究拟以5%和10%的果糖水,探索长期果糖摄入对SUA和肾功能的影响。目前已有很多研究者以果糖作为HUA的造模药物[6-7],但是单独应用果糖诱导的SUA水平不稳定,而氧嗪酸钾是目前国内外常用的抑制尿酸酶活性的造模药物,但在体内排泄较快[8],一般不单独使用。故本实验拟单独应用果糖水(5%、10%Fru组)以及果糖和氧嗪酸钾联用(5%、10%FO组)诱导HUA动物模型,旨在为后续探索机制和治疗手段奠定基础。
1 材料与方法 1.1 实验试剂与仪器果糖(D-果糖,美国Amresco公司,批号DS089-1);氧嗪酸钾(美国Sigma公司,批号156124);氯化钠(分析纯,成都西亚化工股份有限公司);羧甲基纤维素钠(分析纯,成都西亚化工股份有限公司);尿酸试剂盒(南京建成生物工程研究所,批号C012);尿素氮试剂盒(南京建成生物工程研究所,批号C013-2);肌酐试剂盒(南京建成生物工程研究所,批号C011-1);离心机(美国Thermo);酶标仪(美国Thermo)。
1.2 实验动物雄性SPF级Sprague-Dawley(SD)大鼠60只,体质量(160±20)g,购于重庆医科大学动物实验中心[动物合格证号:SCXK(渝)2002-0001]。实验室温度为(24±2)℃,湿度50%~70%,光照12 h(8:00~20:00)。实验开始前先将动物适应性饲养1周。
1.3 方法 1.3.1 动物模型建立与给药雄性SD大鼠60只,按随机数字表法分为6组,每组10只,分别为5%果糖组(5%Fru)、5%果糖+氧嗪酸钾组(5%FO)、10%果糖组(10%Fru)、10%果糖+氧嗪酸钾组(10%FO)、氧嗪酸钾组(Oaps)、对照组(Con),其中Con组和Oaps组予以清水喂养,5%Fru、5%FO和10%Fru、10%FO分别予以5%和10%的果糖水喂养;Oaps组、5%FO组和10%FO组按100 mg/(kg·d)的量平均分2次于每日8:00和18:00皮下注射氧嗪酸钾乳悬液,所有大鼠用标准大鼠饲料喂养;连续14周。所有大鼠自由摄食、饮水。
1.3.2 摄食、饮水量及体质量测定实验期间每日测量大鼠体质量;记录大鼠摄食量、饮水量及果糖水摄入量。
1.3.3 样本收集与处理于实验开始后每周日早晨8点,将大鼠禁食12 h后断尾采集血液0.5~1.0 mL,血样4 ℃静置凝血,3 500 r/min离心15 min,收集血清备用。
1.3.4 血清生化指标测定分别用酶比色法测定血清尿酸(serum uric acid,SUA)水平,脲酶法测定血清尿素氮(serum urea nitrogen,BUN)水平,苦味酸法测定血清肌酐(serum creatinine,SCr)水平。
1.3.5 组织病理学观察在第14周末将4%多聚甲醛进行心脏灌注后,摘取肝肾组织以4%多聚甲醛进行固定,行常规脱水、透明、浸蜡、包埋、切片、HE染色,在光镜(×20和×40)下观察。
1.4 统计学分析采用SPSS 17.0统计软件进行统计分析。计量资料以x±s表示,两组间均数比较采用两独立样本t检验,多组比较运用单因素方差分析,多组间比较若方差齐,采用LSD后续处理,若方差不齐采用Tamhane。检验水准:α=0.05。
2 结果 2.1 大鼠摄食、饮水量及体质量变化 2.1.1 实验大鼠体质量的变化实验期间各组大鼠体质量呈逐渐增长的趋势(表 1)。与Con组相比(除第1周外),Oaps组大鼠体质量低于Con组,其中在第3、13、14周显著低于Con组(P < 0.01);5%Fru、5%FO、10%FO与Con组相比差异无统计学意义(P>0.05)。10%Fru组体质量均高于其他组(除第1周外),其中在第4、5、6、12、14周10%Fru组显著高于5%FO组(P < 0.05,P < 0.01),在第3、4周10%Fru组显著高于10%FO组(P < 0.01);10%Fru组与其他组相比差异无统计学意义(P>0.05)。与Oaps组相比,5%FO、10%FO组体质量均高于Oaps组,其中5%FO组在第3、6、14周显著高于Oaps组(P < 0.01),10%FO组在第3、5、11、14周显著高于Oaps组(P < 0.01);而5%FO、10%FO两组体质量值相比差异无统计学意义(P>0.05)。
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 213.10±5.15 | 236.20±8.59 | 275.70±19.64 | 287.90±20.75 | 310.30±23.27 | 321.10±19.28 | 345.30±21.60 | 352.30±20.90 | 367.80±21.88 | 387.80±26.96 | 408.30±31.35 | 424.30±30.74 | 441.10±28.49 | 462.90±28.14 |
| 5%FO组 | 209.10±8.95 | 229.30±10.00 | 262.80±14.93f | 278.40±15.34d | 298.80±14.54de | 316.60±12.61cf | 333.80±15.80 | 341.50±15.03 | 363.90±15.26 | 381.60±14.68 | 402.70±13.97e | 417.40±14.85c | 435.70±9.07e | 448.20±10.16df |
| 10%Fru组 | 208.10±6.06 | 238.20±15.16 | 276.80±14.89 | 301.10±17.99 | 327.70±19.75 | 334.50±20.70 | 348.00±22.34 | 357.90±20.70 | 376.50±26.54 | 401.70±33.05 | 428.80±38.75 | 442.70±37.61 | 460.80±36.31 | 482.40±34.54 |
| 10%FO组 | 212.20±5.31 | 231.50±8.29 | 259.90±9.89df | 280.20±10.16d | 312.30±14.88f | 328.30±14.42e | 336.20±15.38 | 344.50±15.39 | 357.20±15.82 | 384.60±20.75 | 411.70±14.43f | 425.30±14.76e | 439.40±17.14e | 453.60±17.22f |
| Oaps组 | 213.20±6.75 | 222.70±15.20 | 240.70±16.49b | 265.40±22.55 | 282.70±18.69a | 304.00±27.75 | 320.20±24.06 | 342.80±25.82 | 351.90±23.85 | 362.40±26.24 | 380.80±27.21 | 396.70±30.69a | 408.70±29.28b | 421.50±27.74b |
| Con组 | 210.20±7.50 | 227.20±10.81 | 269.00±21.34 | 283.60±26.18 | 308.90±27.37 | 318.00±27.09 | 334.60±31.20 | 345.30±29.68 | 359.90±28.50 | 378.30±28.65 | 401.60±25.65 | 426.10±24.99 | 448.80±21.78 | 461.50±20.18 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较 | ||||||||||||||
2.1.2 摄食量及饮水量变化
实验期间,10%Fru、10%FO组摄食量明显低于其他4组(P < 0.01),而饮水量均显著高于其他4组(P < 0.01)。10%Fru组摄食、饮水量变化较10%FO组波动性大,其中在第9、11、14周,10%Fru组饮水量显著高于10%FO组(P < 0.05,P < 0.01),而摄食量低于10%FO组(P < 0.01);其余时间段两组间差异无统计学意义(P>0.05)。5%Fru、5%FO、Oaps、Con组间比较饮水量、摄食量差异无统计学意义(P>0.05,表 2、3)。
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 76.71±3.25 | 74.54±2.84d | 74.93±1.47d | 73.71±3.10d | 72.60±1.45d | 71.47±1.56d | 72.19±1.34d | 72.19±0.16d | 68.50±2.29d | 66.23±2.67d | 66.76±2.48d | 62.96±1.93d | 63.05±0.99d | 58.18±1.28d |
| 5%FO组 | 74.29±3.20 | 74.53±2.18d | 75.46±1.19d | 74.84±1.39d | 72.09±1.73d | 71.99±0.98d | 71.62±1.22d | 71.95±0.81d | 67.89±2.50d | 66.40±2.41d | 66.54±2.46d | 64.26±1.09d | 61.64±0.99d | 58.43±1.42d |
| 10%Fru组 | 74.00±1.91 | 66.96±1.95b | 67.11±2.17b | 66.04±1.55b | 64.61±1.48b | 64.12±1.10b | 63.76±1.06b | 63.56±1.64b | 56.65±3.43b | 59.71±2.66b | 51.55±2.20b | 59.05±2.52b | 57.55±1.24b | 53.17±1.77b |
| 10%FO组 | 76.14±2.85 | 68.81±1.17b | 66.99±2.46bfh | 66.17±2.40bfh | 63.69±1.08bfh | 64.23±1.39bfh | 64.19±1.00bfh | 62.96±1.52bfh | 62.03±2.15bdfh | 59.89±2.24bfh | 62.41±1.95bdfh | 59.49±2.25bfh | 58.76±0.88bfh | 56.02±1.23bdfh |
| Oaps组 | 75.29±3.04 | 74.76±3.10 | 75.27±1.61 | 74.68±2.40 | 71.50±1.49 | 72.55±1.62 | 73.01±1.21 | 72.28±0.85 | 67.34±2.62 | 67.64±3.31 | 67.23±2.53 | 65.47±1.87 | 62.42±1.33 | 58.67±1.36 |
| Con组 | 75.14±2.14 | 74.93±2.23 | 76.03±1.11 | 74.80±1.28 | 72.14±1.03 | 72.70±1.40 | 72.83±1.34 | 72.04±1.47 | 68.03±2.41 | 68.16±1.83 | 67.17±2.04 | 65.22±2.58 | 61.95±1.78 | 58.74±1.11 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较;g:P < 0.05,h:P < 0.01,与5%FO组比较 | ||||||||||||||
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 150.17±12.12d | 153.87±7.61d | 148.89±6.74d | 148.84±11.90d | 146.13±10.84d | 150.25±9.45d | 142.80±8.69d | 145.16±14.18d | 146.57±15.13d | 146.07±5.38d | 153.19±13.82d | 147.57±15.19d | 149.77±18.20d | 140.52±16.98d |
| 5%FO组 | 147.70±12.82d | 154.74±9.54d | 152.79±8.12d | 153.17±10.73d | 143.77±12.52d | 145.49±10.58d | 138.81±8.00d | 141.79±10.31d | 141.55±10.28d | 142.68±9.07d | 148.09±12.01d | 147.02±12.89d | 150.84±17.63d | 147.23±20.62d |
| 10%Fru组 | 233.06±13.77b | 247.58±10.83b | 233.54±9.35b | 238.05±10.33b | 218.71±14.40b | 226.50±18.08b | 216.16±12.43b | 219.30±12.88b | 240.25±12.51b | 206.20±6.20b | 220.14±7.34b | 207.37±5.29b | 201.12±8.74b | 201.74±8.27b |
| 10%FO组 | 238.93±9.31bfh | 250.28±8.31bfh | 230.84±12.73bfh | 235.73±16.87bfh | 225.96±17.17bfh | 218.53±12.15bfh | 218.90±15.93bfh | 220.36±12.31bfh | 210.58±9.22bdfh | 209.17±8.09bfh | 208.10±7.13bcfh | 206.88±7.39bfh | 201.17±8.98bfh | 188.97±3.07bdfh |
| Oaps组 | 140.26±6.63 | 144.97±7.73 | 143.21±7.40 | 141.46±9.85 | 132.81±10.61 | 135.81±10.97 | 128.95±13.15 | 132.91±6.23 | 130.86±9.73 | 134.44±9.17 | 137.28±11.44 | 137.13±4.47 | 132.48±14.66 | 128.01±19.30 |
| Con组 | 143.60±7.79 | 147.54±7.06 | 142.85±9.57 | 142.69±9.83 | 135.01±12.61 | 138.89±10.49 | 132.03±10.59 | 133.60±9.50 | 133.62±12.01 | 137.82±10.68 | 139.33±9.56 | 135.28±4.18 | 139.66±16.92 | 133.10±20.62 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较;g:P < 0.05,h:P < 0.01,与5%FO组比较 | ||||||||||||||
2.2 各组大鼠血清学变化 2.2.1 各组大鼠SUA水平变化
造模第1周开始,5%FO、10%Fru、10%FO组SUA水平均显著高于Con组(P < 0.01);实验第4周开始,5%Fru组SUA水平高于Con组(P < 0.05,P < 0.01)。实验期间10%Fru、5%FO组SUA水平均显著高于5%Fru组(P < 0.01)。与5%FO、10%FO组相比,10%Fru组SUA水平稳定性较差,其中在第10、11周10%Fru组SUA水平显著低于其余2组(P < 0.01);其余时间段该3组间比较差异无统计学意义(P>0.05)。与Oaps组相比,5%FO、10%FO组SUA水平显著增高(P < 0.01,表 4)。
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 194.48±27.93d | 154.55±28.75d | 169.66±33.19d | 220.0±26.04ad | 212.12±30.9ad | 223.23±25.12ad | 233.55±30.08ad | 205.41±26.9ad | 264.29±32.47ad | 226.67±22.89bd | 243.64±24.54ad | 216.77±31.49ad | 237.89±28.16bd | 219.51±27.31ad |
| 5%FO组 | 361.38±19.29bf | 363.64±33.20bf | 428.97±34.68bf | 420.0±32.26bf | 424.24±32.32bf | 434.0±27.50bf | 438.71±39.89bf | 436.76±39.87bf | 412.86±40.66bf | 442.42±29.83bdf | 440.0±37.92bdf | 438.71±38.47bf | 411.58±32.33bf | 441.95±29.10bf |
| 10%Fru组 | 390.34±71.83b | 378.18±44.37b | 411.03±30.36b | 428.97±34.68b | 414.54±49.09b | 445.16±22.96b | 432.26±35.07b | 437.84±50.77b | 410.00±21.35b | 340.61±31.53b | 350.30±20.16b | 428.39±39.79b | 408.42±23.51b | 458.54±24.77b |
| 10%FO组 | 420.69±29.97bf | 385.46±37.16bf | 427.59±26.01bf | 409.66±28.38bf | 425.46±49.96bf | 446.45±35.57bf | 441.29±38.85bf | 445.41±46.34bf | 435.71±38.83bf | 459.39±32.55bdf | 449.70±24.54bdf | 433.55±41.34bf | 420.0±23.51bf | 453.66±53.69bf |
| Oaps组 | 219.31±33.44 | 158.18±28.49 | 157.24±27.74 | 203.53±22.22 | 184.24±29.58 | 188.39±50.96 | 211.61±39.04 | 187.03±30.17 | 221.43±32.47 | 169.70±26.18 | 190.30±28.12 | 197.90±18.43 | 197.89±18.43 | 178.54±21.10 |
| Con组 | 193.10±35.61 | 160.0±28.17 | 166.90±34.07 | 194.12±18.60 | 173.33±37.05 | 179.36±42.34 | 194.84±35.18 | 174.05±29.91 | 211.43±47.52 | 162.42±29.25 | 185.46±35.25 | 190.53±18.86 | 190.53±18.86 | 189.26±23.99 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较 | ||||||||||||||
2.2.2 各组大鼠血清BUN水平变化
10%Fru、10%FO组BUN水平从第6周开始高于其余4组(P < 0.05,P < 0.01),但其值波动较大;其中10%Fru组在第9、11、14周下降到与其余4组相同水平(P>0.05),与10%FO组相比差异有统计学意义(P < 0.01)。其余各组间比较差异无统计学意义(P>0.05,表 5)。
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 4.25±0.58 | 4.41±0.26 | 4.51±0.31 | 5.70±1.22 | 5.22±0.61 | 5.16±0.53c | 4.77±0.66d | 5.05±0.58d | 5.23±0.47 | 6.05±0.56d | 5.98±0.51 | 5.45±0.54d | 5.16±0.50d | 5.33±0.82 |
| 5%FO组 | 4.30±0.59 | 4.42±0.36 | 4.57±0.52 | 5.79±0.69 | 5.17±0.63 | 5.11±0.57c | 4.83±0.53d | 4.90±0.57d | 5.08±0.46 | 6.17±0.64d | 6.13±0.56 | 5.58±0.26d | 5.25±0.37d | 5.32±0.65 |
| 10%Fru组 | 4.31±0.87 | 4.52±0.45 | 4.79±0.73 | 6.01±1.25 | 5.57±0.77 | 6.59±1.84a | 10.05±1.18b | 9.42±0.55b | 5.37±0.65 | 10.55±0.64b | 5.66±1.12 | 10.36±0.47b | 9.57±0.86b | 5.22±0.77 |
| 10%FO组 | 4.25±0.55 | 4.56±0.27 | 4.44±0.47 | 5.80±1.06 | 5.45±0.72 | 6.04±0.79aeg | 9.39±0.98bfh | 9.58±0.63bfh | 8.94±0.88bdfh | 10.82±0.51bfh | 9.12±0.90bdfh | 10.34±0.67bfh | 9.69±0.49bfh | 9.62±0.81bdfh |
| Oaps组 | 4.45±0.45 | 4.58±0.33 | 4.45±0.51 | 5.61±0.77 | 5.19±0.81 | 5.10±0.57 | 5.04±0.46 | 4.86±0.46 | 5.01±0.61 | 5.93±0.39 | 5.92±0.39 | 5.38±0.31 | 5.19±0.42 | 5.35±0.46 |
| Con组 | 4.29±0.48 | 4.64±0.30 | 4.62±0.50 | 5.95±0.87 | 5.38±0.51 | 5.15±0.44 | 5.22±0.54 | 4.74±0.65 | 5.00±0.56 | 6.18±0.45 | 5.79±0.54 | 5.67±0.36 | 5.06±0.52 | 5.45±0.57 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较;g:P < 0.05,h:P < 0.01,与5%FO组比较 | ||||||||||||||
2.2.3 各组大鼠血清SCr水平变化
在第4周10%Fru组SCr水平与其他各组相比有一过性增高(P < 0.01)。10%Fru、10%FO组SCr水平在第7周开始高于其余4组(P < 0.05,P < 0.01);但在第13周,10%Fru组SCr值与其余各组相当,但与10%FO组相比,差异存在统计学意义(P < 0.01)。其余各组间比较差异无统计学意义(P>0.05,表 6)。
| 组别 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 | 13周 | 14周 |
| 5%Fru组 | 57.62±9.64 | 56.53±8.03 | 50.50±6.16 | 53.87±8.92d | 51.41±3.78 | 48.25±4.79 | 52.29±3.62c | 49.50±7.19c | 53.88±6.84d | 54.05±6.40d | 56.64±5.17d | 56.72±6.86d | 58.19±7.35 | 53.12±6.98d |
| 5%FO组 | 59.52±10.23 | 60.60±9.36 | 46.54±9.09 | 51.62±7.0d | 49.98±5.22 | 45.99±5.68 | 54.73±4.20c | 53.37±7.73c | 54.72±7.92d | 54.53±9.28d | 53.91±8.37d | 59.01±8.56d | 57.66±5.75 | 56.136±6.98d |
| 10%Fru组 | 59.76±12.67 | 66.71±16.01 | 48.65±9.91 | 77.45±9.20b | 49.26±6.88 | 47.60±12.39 | 78.57±20.52a | 71.30±23.35a | 98.27±25.34a | 91.98±15.36a | 97.14±17.03a | 97.97±7.85a | 53.67±6.72 | 89.28±8.52a |
| 10%FO组 | 61.43±13.08 | 63.15±6.55 | 49.98±6.53 | 54.55±7.19d | 52.37±5.57 | 45.03±8.84 | 74.78±11.22bfh | 69.26±10.30aeg | 90.46±16.97bfh | 96.72±12.88bfh | 94.68±8.08bfh | 106.56±10.53bfh | 91.40±9.47bdfh | 95.69±11.26bfh |
| Oaps组 | 56.90±13.68 | 62.13±5.39 | 45.22±8.68 | 50.94±5.01 | 49.02±5.88 | 47.60±4.75 | 52.02±3.08 | 52.96±5.43 | 57.23±6.35 | 53.10±7.35 | 56.37±7.43 | 55.57±9.76 | 55.80±5.74 | 54.25±4.05 |
| Con组 | 63.57±9.53 | 59.33±5.37 | 48.92±5.61 | 52.30±3.80 | 48.07±5.22 | 46.64±6.30 | 54.46±2.70 | 53.78±7.34 | 56.68±6.45 | 57.85±6.63 | 55.27±8.24 | 57.86±9.53 | 54.47±5.35 | 52.74±6.89 |
| a:P < 0.05,b:P < 0.01,与Con组比较;c:P < 0.05,d:P < 0.01,与10%Fru组比较;e:P < 0.05,f:P < 0.01,与Oaps组比较;g:P < 0.05,h:P < 0.01,与5%FO组比较 | ||||||||||||||
2.3 各组大鼠肝肾组织学观察 2.3.1 各组大鼠肝脏组织学观察
肉眼观察:各组大鼠肝脏呈红褐色,明亮有光泽;与其他组相比,10%Fru组、10%FO组大鼠肝脏体积略有增大。光镜下:各组大鼠肝小叶结构完整,中央静脉扩张空虚,肝细胞索以肝小叶中央静脉为中心呈放射状排列(图 1)。
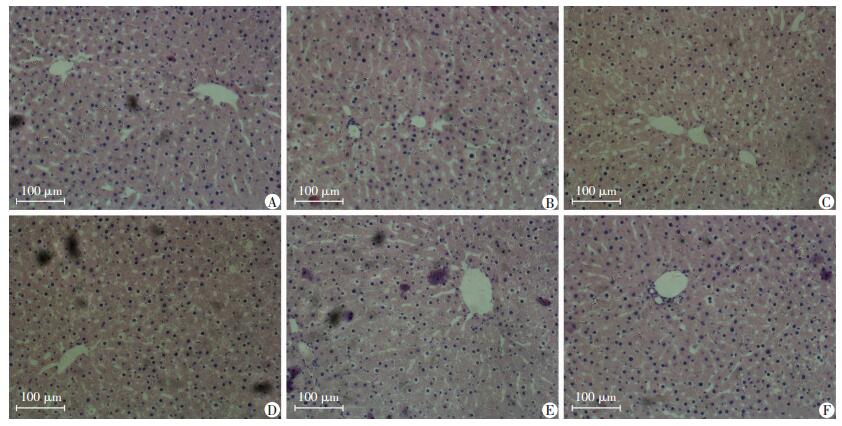
|
| A:5%Fru组;B: 5%FO组;C:10%Fru组;D:10%FO组;E:Oaps组;F:Con组 图 1 各组大鼠肝脏组织学HE染色观察结果(LM) |
2.3.2 各组大鼠肾脏组织病理观察
肉眼观察:各组大鼠肾脏呈红褐色,表面光滑且有光泽;10%Fru组、10%FO组与其他几组相比,肾脏体积略增大,切面皮质尚清晰,肾周膜有白色脂肪组织沉积。光镜下:5%Fru组、Oaps组、Con组大鼠肾小球大小结构正常,均匀分布于肾皮质中,肾小管结构正常,未见细胞变性样改变;5%FO组肾小球系膜区基质稍增多,肾小管管壁略微增厚;10%Fru组、10%FO组肾小球数量减少,肾小球囊腔增厚系膜基质增多,肾小管管壁增厚,部分管腔可见结晶物沉积;10%FO组大鼠偶可见肾小管细胞核条梭样改变(图 2)。
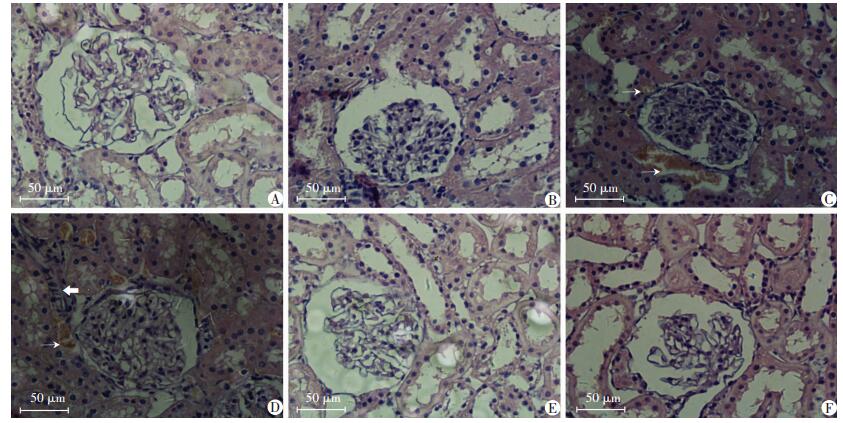
|
|
↑:尿酸盐结晶;⇧:细胞核呈条梭样改变 A:5%Fru组;B:5%FO组;C:10%Fru组;D:10%FO组;E:Oaps组;F:Con组 图 2 各组大鼠肾脏组织学HE染色观察结果(LM) |
3 讨论
目前根据HUA的发病机制,多采用增加UA的来源、抑制UA的排泄、抑制UA酶的活性等方法来升高SUA,但HUA动物模型尚无公认的评价标准[8-11]。本实验在前期研究的基础上[6, 12],长期应用不同浓度的果糖和氧嗪酸钾干预大鼠,定期监测SUA、BUN、SCr水平,探索了长期应用果糖和氧嗪酸钾对肝肾脏的影响,并采用果糖与氧嗪酸钾联用的方法,初步建立了比较稳定、可靠的HUA大鼠模型。
本研究结果显示,在短时间内果糖与氧嗪酸钾联用,能够迅速升高SUA,并且持续稳定在较高水平,表明建模成功;虽然单独应用10%浓度的果糖也能快速升高SUA水平,但其稳定性较差,在实验某些时间段内SUA出现下降趋势,说明果糖与氧嗪酸钾联合建模优于单独使用10%的果糖建模。另外在应用5%浓度的果糖干预4周以后,其SUA水平与Con组相比,差异具有统计学意义,表明大鼠长期应用果糖可能会影响SUA水平。果糖是唯一能使SUA升高的糖类,有研究调查显示,长期摄入高果糖能使SUA水平迅速升高[13]。这与本实验探索结果相同,其机制有可能有以下几点:①果糖激酶在催化果糖代谢途径中,无负性反馈的抑制机制,使进入细胞的果糖迅速被磷酸化,导致细胞内ATP耗竭产生大量AMP,而ATP耗竭能使嘌呤代谢酶被激活,使AMP进一步代谢生成次黄嘌呤,后者在黄嘌呤氧化酶的作用下氧化成黄嘌呤,最后生成UA;且果糖大量磷酸化使磷酸耗竭,加速了AMP的分解,使UA急剧增加[14]。②过量果糖摄入可引起血压的变化、血脂异常及收缩皮质血管和损伤肾脏微血管,使肾脏血流动力学和排泄功能改变,而肾脏血管和肾小管的改变使UA肾脏途径排泄减少,进一步导致UA增加[15]。③果糖摄入损伤肾脏,有研究显示肾脏损伤后UA转运体系统紊乱,UA排泄受阻和重吸收增加,UA升高[16]。氧嗪酸钾属于三氮杂苯类化合物,因其结构与UA的嘌呤环类似,可竞争性地与尿酸酶结合,部分抑制尿酸酶的活性,使体内SUA水平在短时间内增高[17],且低剂量氧嗪酸钾长期应用相对安全,故以低剂量氧嗪酸钾以期弥补单用果糖造模时血UA不稳定的缺陷。
本实验共造模14周,大鼠呈自然生长状态,各组大鼠体表状态无明显差异。结果显示:摄入10%浓度果糖水会使大鼠的摄食量减少。10%Fru组体质量高于其他组,说明摄入较高浓度的果糖,会影响大鼠体质量;Oaps组体质量与其他组比较差异具有统计学意义,可能与每天皮下注射氧嗪酸钾时大鼠的应激反应消耗能量有关。组织学观察结果显示,10%Fru组、10%FO组可见肾周膜有脂质沉积,镜下观察见肾小球数量减少,肾小球囊腔增厚系膜基质增多,肾小管管壁增厚,部分管腔可见结晶物沉积,且10%FO组可见肾小管细胞核呈条梭样改变;而5%FO组未见明显组织学改变,可能在一定程度上说明长期摄入较高浓度果糖对大鼠肾脏有一定的损伤。目前对于HUA肾病模型多采用酵母、腺嘌呤、乙胺丁醇、氧嗪酸钾等相互联用来制备模型,但都具有一定的局限性,且腺嘌呤有毒性,长期服用使动物死亡率较高。本研究发现在果糖干预一段时间后,10%Fru组、10%FO组BUN、SCr水平开始升高,5%FO组未见升高。以上结果表明:5%果糖加氧嗪酸钾可以建立无症状损伤的HUA动物模型,适合于不伴肾脏损伤的原发性HUA的研究;10%果糖加氧嗪酸钾可产生一定程度的肾脏损害,且其BUN、SCr的改变状态更符合人类由于不良饮食结构导致的HUA伴轻微肾脏损伤的研究。有研究显示果糖摄入会改变肝脏状态[18],但本实验各组均未见明显肝脏病理性改变,可能是由于其果糖浓度未达到肝脏可逆性损伤水平以及本实验区别于其他研究无需使用高脂饲料[19]。
综上所述,长期摄入果糖会影响大鼠血清UA水平,提示应合理食用含果糖食物。果糖与氧嗪酸钾联用能够快速形成高效、稳定、持续的HUA动物模型,且效果明显优于单一物质的造模,5%果糖与氧嗪酸钾联用未见肾脏损伤,可作为与人类相似的无症状HUA动物模型机制和治疗药物的应用研究;而10%果糖联合氧嗪酸钾有明显肾脏病理性改变,适合于慢性肾脏损伤伴HUA的实验性研究。本实验成功构建了HUA大鼠模型,但对其机制和应用尚需进一步探索。
| [1] | RYU S, CHANG Y, ZHANG Y, et al. A cohort study of hyperuricemia in middle-aged South Korean men[J]. Am J Epidemiol, 2012, 175(2): 133–143. DOI:10.1093/aje/kwr291 |
| [2] | KARIS E, CRITTENDEN D B, PILLINGER M H. Hyperuricemia, gout, and related comorbidities: cause and effect on a two-way street[J]. South Med J, 2014, 107(4): 235–241. DOI:10.1097/SMJ.0000000000000082 |
| [3] | GORAN M I, ULIJASZEK S J, VENTURA E E. High fructose corn syrup and diabetes prevalence: A global perspective[J]. Glob Public Health, 2013, 8(1): 55–64. DOI:10.1080/17441692.2012.736257 |
| [4] | SCHWARZ J M, NOWOROLSKI S M, WEN M J, et al. Effect of a high-fructose weight-maintaining diet on lipogenesis and liver fat[J]. J Clin Endocrinol Metab, 2015, 100(6): 2434–2442. DOI:10.1210/jc.2014-3678 |
| [5] | MALIK A H, AKRAM Y, SHETTY S, et al. Impact of sugar-sweetened beverages on blood pressure[J]. Am J Cardiol, 2014, 113(9): 1574–1580. DOI:10.1016/j.amjcard.2014.01.437 |
| [6] |
李丽玉, 林志健, 张冰, 等. 连续高果糖饮水对大鼠尿酸水平的影响及其病理机制[J].
中华临床营养杂志, 2014, 22(6): 368–374.
LI L Y, LIN Z J, ZHANG B, et al. Effect of high fructose drinking water on uric acid level in rats and the underlying pathological mechanism[J]. Chin J Clin Nutr, 2014, 22(6): 368–374. |
| [7] | CHEN G, JIA P. Allopurinol decreases serum uric acid level and intestinal glucose transporter-5 expression in rats with fructose-induced hyperuricemia[J]. Pharmacological Rep, 2016, 68(4): 782–786. DOI:10.1016/j.pharep.2016.04.014 |
| [8] | ZHU C, TAI L L, WAN X C, et al. Comparative effects of green and black tea extracts on lowering serum uric acid in hyperuricemic mice[J]. Pharm Biol, 2017, 55(1): 2123–2128. DOI:10.1080/13880209.2017.1377736 |
| [9] | ZHU L, DONG Y, NA S, et al. Saponins extracted from Dioscorea collettii rhizomes regulate the expression of urate transporters in chronic hyperuricemia rats[J]. Biomed Pharmacother, 2017, 93: 88–94. DOI:10.1016/j.biopha.2017.06.022 |
| [10] | CHEN Y, CHEN X L, XIANG T, et al. Total saponins from dioscorea septemloba thunb reduce serum uric acid levels in rats with hyperuricemia through OATP1A1 up-regulation[J]. J Huazhong Univ Sci Technolog Med Sci, 2016, 36(2): 237–242. DOI:10.1007/s11596-016-1573-z |
| [11] | LIU Z, CHEN T, NIU H, et al. The establishment and characteristics of rat model of atherosclerosis induced by hyperuricemia[J]. Stem Cells Inter, 2016, 2016: 1–7. DOI:10.1155/2016/1365257 |
| [12] |
别凤仪, 姜懿宸, 葛冰, 等. 酵母联合高果糖饲料对大鼠嘌呤代谢影响[J].
营养学报, 2017, 39(2): 144–150.
BIE F Y, JIANG Y C, GE B, et al. Effect of diet supplemented with yeast and high fructose on purine metabolism in rats[J]. Acta Nutrimenta Sin, 2017, 39(2): 144–150. DOI:10.13325/j.cnki.acta.nutr.sin.2017.02.010 |
| [13] | DALBETH N, PHIPPSGREEN A, HOUSE M E, et al. Body mass index modulates the relationship of sugar-sweetened beverage intake with serum urate concentrations and gout[J]. Arthr Res Ther, 2015, 17(1): 1–7. DOI:10.1186/s13075-015-0781-4. |
| [14] | CALICETI C, CALABRIA D, RODA A, et al. Fructose intake, serum uric acid, and cardiometabolic disorders: a critical review[J]. Nutrients, 2017, 9(4): 395. DOI:10.3390/nu9040395 |
| [15] | ABDULLA M H, SATTAR M A, ABDULLAH N A, et al. The effect of high-fructose intake on the vasopressor response to angiotensin Ⅱ and adrenergic agonists in Sprague-Dawley rats[J]. Pak J Pharm Sci, 2013, 26(4): 727–732. |
| [16] | LECOULTRE V, EGLI L, THEYTAZ F, et al. Fructose-induced hyperuricemia is associated with a decreased renal uric acid excretion in humans[J]. Diabetes Care, 2013, 36(9): e149–e150. DOI:10.2337/dc13-0866 |
| [17] | XILIFU D, ABUDULA A, REHEMU N, et al. Effect of rosuvastatin on hyperuricemic rats and the protective effect on endothelial dysfunction[J]. Exp Ther Med, 2014, 8(6): 1683–1688. DOI:10.3892/etm.2014.2027 |
| [18] | CHEN H L, TSAI T C, TSAI Y C, et al. Kefir peptides prevent high-fructose corn syrup-induced non-alcoholic fatty liver disease in a murine model by modulation of inflammation and the JAK2 signaling pathway[J]. Nutr Diabetes, 2016, 6(12): e237. DOI:10.1038/nutd.2016.49 |
| [19] | CHRISTOPHER, LEUNG, CHANDANA, et al. Dietary advanced glycation end-products aggravate non-alcoholic fatty liver disease[J]. World J Gastroenterol, 2016, 22(35): 8026–8040. DOI:10.3748/wjg.v22.i35.8026 |



