胃癌腹腔转移率高,其具体分子机制不清[1-2]。根据经典的种子土壤学说,腹腔脱落癌细胞作为种子细胞在胃癌腹腔转移中发挥重要作用。既往研究发现腹腔散在的、单个脱落癌细胞通常发生失巢凋亡,而多个癌细胞聚合而成的多细胞团簇(multicellular aggregates, MCAs)具有抗失巢凋亡能力,能够在乏氧的腹腔微环境中生长、增殖,是胃癌腹腔转移的真正“种子”细胞,但其抗失巢凋亡机制不清。而揭示胃癌MCAs抗“失巢凋亡”的分子机制对胃癌腹腔转移防治具有重要意义[3-4]。
原癌基因c-Src是1976年发现的第1个细胞癌基因,属于Src家族激酶(SFKs)成员。目前研究表明Src蛋白与胃癌发生、发展、预后关系密切[5-6]。然而它在胃癌腹腔转移多细胞团簇抗失巢凋亡中是否发挥重要作用,目前尚不清楚。本研究拟探讨Src对胃癌MCAs抗失巢凋亡的影响。
1 材料与方法 1.1 主要试剂与材料胃癌细胞株:BGC-823细胞株购自中国科学院细胞库(上海),MKN-45细胞株来源于本实验室保存备用。贴壁细胞培养于含10% FBS 1640完全培养基中,于37 ℃,5% CO2细胞培养箱中进行常规培养。
1.2 胃癌细胞体外3D培养将对数生长期的人低分化胃腺癌细胞株MKN45、BGC823单层贴壁细胞用适量胰酶消化成细胞悬液,加入配好的DMEM/F12培养基终止消化,离心,然后用DMEM/F12重悬,细胞计数,调整细胞数为1×104/mL,接种至超低黏附皿中(6孔板超低黏附皿,每孔接种2 mL;2黏附4孔超低皿,每孔接种0.5 mL)。培养液采用含有20 ng/mL EGF,10~20 ng/mL FGF,1×B27的无血清DMEM/F12培养基。
实验分为3个组。①空白对照组:使用正常含10%胎牛血清的培养基培养细胞,然后取对数期生长的贴壁细胞进行3D成球培养。②阴性对照组:使用正常含10%胎牛血清的培养基培养细胞并转染control siRNA,然后取对数期生长的贴壁细胞进行3D成球培养。③siRNA组:使用正常含10%胎牛血清的培养基培养细胞并转染Src siRNA,然后取对数期生长的贴壁细胞进行3D成球培养。
1.3 细胞总RNA抽提及cDNA制备收集细胞,采用TRIzol试剂抽提细胞总RNA,紫外分光光度计测定其浓度。按照逆转录试剂盒说明书进行逆转录,制备cDNA。反应体系如下:2 μg模板RNA,65 ℃热变性5 min,立即置于冰上冷却,加入4 μL的5×RT Master Mix,加入超纯水至终体积20 μL。反应参数如下:37 ℃ 15 min,52 ℃ 5 min,98 ℃ 5 min。逆转录后所得的cDNA于-20 ℃保存备用。
1.4 Real-time PCR检测炎症因子mRNA表达变化取同1个cDNA为模板进行Src和β-actin的PCR反应。反应体系如下:1 μL cDNA模板,上下游引物各0.5 μL,10 μL 2×SYBR Green PCR Master Mix,无核酸酶水8 μL。PCR反应条件为:95 ℃ 3 min,95 ℃ 15 s,60 ℃ 30 s,40个循环。得出各反应的扩增曲线和Ct值。采用相对定量2-△△Ct法比较各基因的表达差异。
Real-time PCR所用引物序列:Src正义链,5′-GA-GCGGCTCCAGATTGTCAA-3′,反义链,5′-CTGGGGATGTAGCCTGTCTGT-3′;β-actin正义链,5′-CATGTACGTTGCTATCCAGGC-3′,反义链,5′-CTCCTTAATGTCACGCACGAT-3′。构建Src siRNA慢病毒表达载体,转染胃癌细胞,观察抑制效率。
1.5 CCK-8法检测转染后细胞生长细胞感染后48 h,从细胞培养箱中取出6孔板,采用胰酶消化后,进行三维培养,接种24孔板中。分别于第0、2、4、6天取出90 μL细胞悬液,加入10 μL CCK-8试剂,轻轻混匀,接种到96孔板,孵育1~4 h。酶标仪上测定各孔在波长为450 nm处的光密度值[D(450)]。实验重复3次,并保存数据。
1.6 流式细胞术检测各组胃癌MCAs的凋亡情况收集稳定感染后的三维培养细胞(第7天),1 000 r/min,离心5 min,弃上清。加入1 mL PBS轻轻重悬细胞沉淀。1 000 r/min离心5 min,弃上清;重复上述步骤1次,目的是去除细胞中残留的培养基。配制染液:每份样品按照100 μL结合缓冲液,2.5 μL Annexin V-FITC和2.5 μL PI,避光配制并轻轻混匀。弃上清;加入预先配制好的凋亡染液轻轻重悬细胞,轻轻混匀,室温避光孵育15 min。1 h之内进行流式细胞仪检测。
1.7 Western blot检测收集三维培养和单层贴壁培养的两种胃癌细胞,加入蛋白裂解液,制备蛋白样品。具体实验步骤参考文献[7]。抗体使用浓度分别为:Src、GAPDH (1: 1 000)一抗4 ℃孵育过夜。TBST洗涤后用1: 1 000相应二抗37 ℃孵育1 h,再次洗涤后用ECL显影成像。采用Image J软件扫描特异性条带净灰度值,将目的基因条带的灰度值除以内参GAPDH条带灰度值作为最终结果进行统计分析。
1.8 统计学分析采用SPSS 21.0统计软件进行分析。数据以x±s表示,样本用方差齐性检验,符合正态分布的用独立样本t检验,不符合正态分布的用χ2检验,实验至少独立重复3次。检验水准:α=0.05。
2 结果 2.1 Src在体外三维培养的BGC823和MKN45 MCAs中显著高表达Western blot检测结果显示两种胃癌细胞BGC823和MKN45 MCAs中Src相对表达量明显高于各自单层培养胃癌细胞中Src的表达水平[0.615±0.068 vs (0.219±0.017),P < 0.01; MKN45:(0.657±0.087) vs (0.420±0.015),P < 0.05,图 1]。
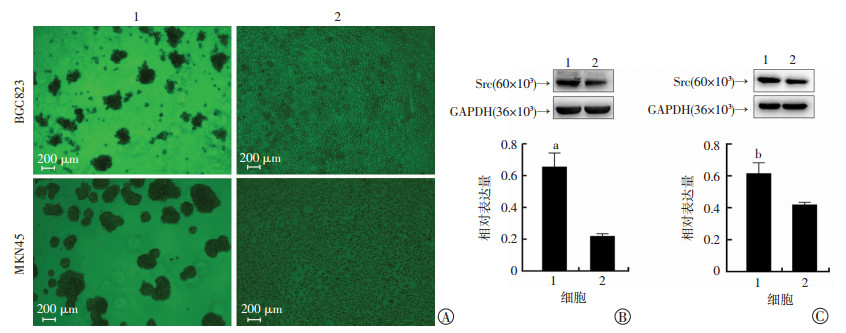
|
| 1:3D培养的胃癌多细胞团簇(MCAs,第7天);2:单层贴壁胃癌细胞A:BGC823和MKN45三维培养和单层贴壁培养的形态变化(×40);B、C:Western blot检测胃癌BGC823(B)和MKN45(C) MCAs和单层贴壁胃癌细胞中Src的表达水平a:P < 0.01,b:P < 0.05,与单层贴壁胃癌细胞比较 图 1 三维培养对BGC8823和MKN45细胞形态和Src表达的影响 |
2.2 实时定量PCR检测慢病毒siRNA介导Src mRNA沉默效应
RT-PCR检测结果表明感染慢病毒后,胃癌BGC823 MCAs Src表达量为(0.386±0.087),明显低于正常对照组和阴性对照组(P < 0.05);MKN45 MCAs Src表达量(0.506±0.188),显著低于正常对照组和阴性对照组(P < 0.05,图 2)。

|
| 1:正常对照组;2:阴性对照组;3:siRNA干扰组a:P < 0.05,与阴性对照组比较 图 2 qRT-PCR检测siRNA慢病毒对BGC823(A)和MKN45(B)MCAs中Src表达的影响 |
2.3 Src siRNA慢病毒感染后显著抑制胃癌MCAs的生长
我们采用稳定感染后的细胞进行三维培养。阴性对照组胃癌BGC823MCAs和MKN45 MCAs没有明显的变化。然而siRNA慢病毒感染组胃癌BGC823和MKN45成团簇生长的能力受到抑制,出现类似凋亡的改变(图 3)。
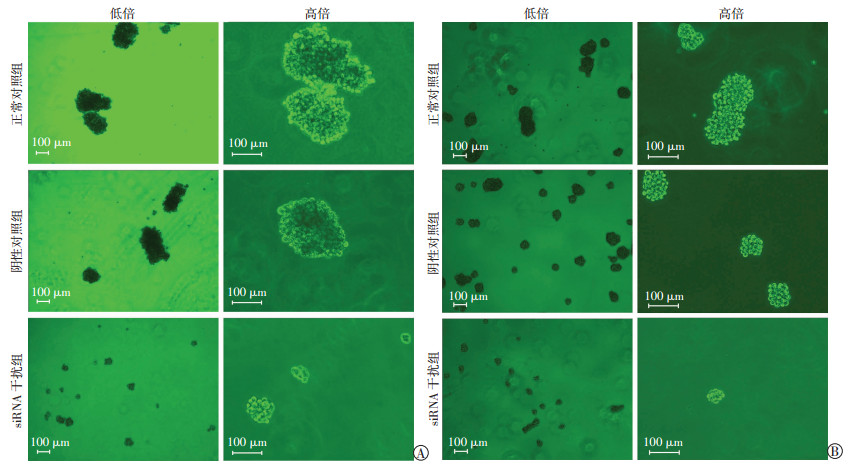
|
| 图 3 siRNA慢病毒感染第7天BGC823(A)和MKN45(B) MCAs的形态学变化 |
2.4 抑制Src表达后对胃癌BGC823 MCAs和MKN45 MCAs活力的影响
CCK-8检测结果表明,在第4天和第6天时,与阴性对照组相比,BGC823 MCAs和MKN45 MCAs慢病毒组的增殖明显受到抑制,活细胞数量明显降低于对照组[第4天:BGC823 MCAs:(1.604±0.156) vs (1.043±0.063),P < 0.05, MKN45 MCAs:(1.634±0.136) vs (1.125±0.042),P < 0.05;第6天:BGC823 MCAs:(2.414±0.147) vs (1.456±0.075),P < 0.01,MKN45 MCAs:(2.356±0.143) vs (1.541±0.055),P < 0.01,图 4]。表明抑制Src后可以显著抑制BGC823 MCAs和MKN45 MCAs的增殖。
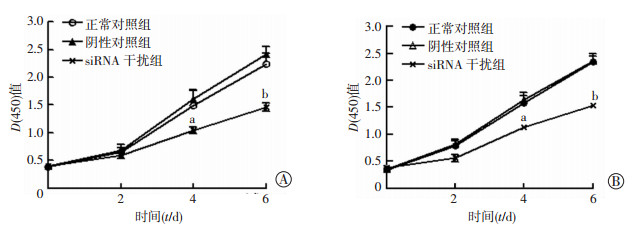
|
| a:P < 0.05,b:P < 0.01,与阴性对照组比较 图 4 siRNA慢病毒感染后对BGC823(A)和MKN45(B) MCAs细胞活力的影响 |
2.5 抑制Src表达后对胃癌BGC823 MCAs和MKN45 MCAs凋亡的影响
流式细胞术检测结果表明,与阴性对照组相比,抑制Src的表达可以显著诱导BGC823 MCAs和MKN45 MCAs凋亡[BGC823 MCAs:(9.456±0.209) vs (3.026±0.201),P < 0.01;MKN45 MCAs:(9.356±0.416) vs (2.541±0.251),P < 0.05,图 5]。
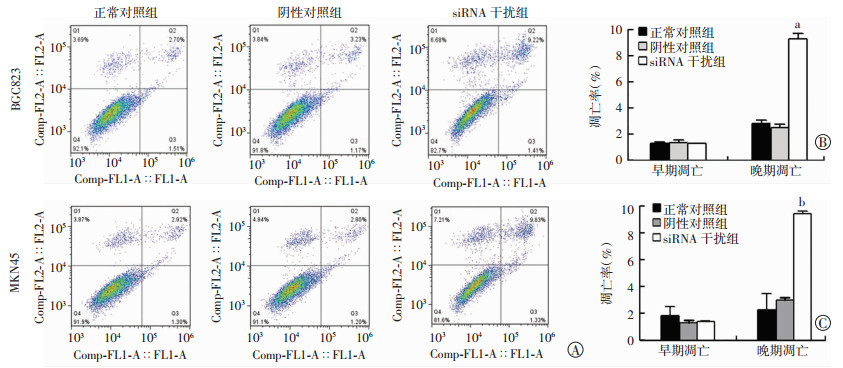
|
| A:流式细胞术检测siRNA慢病毒感染后对BGC823和NKN45 MCAs凋亡的影响;B、C:分别为siRNA慢病毒感染后BGC823和MKN45 MCAs凋亡率的变化a:P < 0.01,b:P < 0.05,与阴性对照组比较 图 5 流式细胞术检测siRNA慢病毒感染后对BGC823 MCAs和MKN45 MCAs凋亡的影响 |
3 讨论
胃癌是常见消化系统恶性肿瘤,腹腔转移是其最常见的形式[8]。研究表明,腹腔脱落胃癌细胞通常以两种形式存在:一为散在的、单个游离癌细胞;二为以多个细胞相互粘连形成多细胞团簇或多细胞球(multicellular aggregates/spheroids, MCAs/MCS)。前者通常会发生失巢凋亡,而MCAs具有一定的抗失巢凋亡能力,能够在乏氧的腹腔微环境中生长、增殖。这些肿瘤多细胞团簇可能在胃癌患者的腹腔转移中发挥着重要作用[9]。因此,深入揭示MCAs抗失巢凋亡的分子机制对于胃癌防治具有重要意义。
原癌基因c-Src是最早发现的与人类疾病密切相关的一种非受体依赖性酪氨酸蛋白激酶[10-12]。Src蛋白具有促进胃癌细胞增殖、肿瘤血管生成、参与癌细胞黏附和侵袭、通过生长因子受体与生长因子相互作用共同调节肿瘤生长等作用[13-15]。既往已有研究表明,胃癌组织中Src表达明显上调[16]。提示Src表达上调可能与胃癌多细胞团簇的获得抗失巢凋亡能力密切有关。在本研究中,首先采用Western blot检测体外三维培养的胃癌MCAs细胞和单层培养胃癌细胞Src表达情况,结果显示体外三维培养胃癌MCAs的Src蛋白表达水平明显高于单层贴壁培养胃癌细胞。这与文献[17]报道的实验结果相一致。
为了进一步证实Src在胃癌细胞多细胞团簇抗失巢凋亡中的作用,本研究采用siRNA抑制两种不同的胃癌细胞株BGC823和MKN45的Src表达,检测其对胃癌MCAs细胞增殖及凋亡的影响。形态学和细胞活力检测结果显示,抑制Src表达会导致三维培养BGC823 MCAs和MKN45 MCAs的生长增殖受到明显限制,出现类似凋亡的改变。在第4天和第6天的时候,与阴性对照组相比,siRNA干扰组增殖减弱,活细胞数量明显降低。细胞凋亡和细胞周期在调节细胞增殖的过程起到关键的作用。为了进一步证实Src对胃癌BGC823 MCAs和MKN45 MCAs细胞活力的影响,我们采用流式细胞术检测Src对BGC823和MKN45细胞凋亡的影响。结果表明:抑制Src表达可以显著诱导胃癌BGC823和MKN45 MCAs发生凋亡,进一步证实Src在胃癌腹腔转移肿瘤多细胞团簇抗失巢凋亡中发挥了重要作用。
综上所述,Src是胃癌腹腔转移多细胞团簇抗失巢凋亡的关键分子,抑制Src的表达可以显著抑制胃癌BGC823和MKN45细胞在悬浮环境中的成团生长,从而影响癌细胞增殖,诱导细胞凋亡。Src有可能成为胃癌腹腔转移的重要标志物及治疗的靶点。
| [1] | DE ANDRADE J P, MEZHIR J J. The critical role of peritoneal cytology in the staging of gastric cancer: an evidence-based review[J]. J Surg Oncol, 2014, 110(3): 291–297. DOI:10.1002/jso.23632 |
| [2] | TUSTUMI F, BERNARDO W M, DIAS A R, et al. Detection value of free cancer cells in peritoneal washing in gastric cancer: a systematic review and meta-analysis[J]. Clinics (Sao Paulo), 2016, 71(12): 733–745. DOI:10.6061/clinics/2016(12)10 |
| [3] | SHIELD K, ACKLAND M L, AHMED N, et al. Multicellular spheroids in ovarian cancer metastases: biology and pathology[J]. Gynecol Oncol, 2009, 113(1): 143–148. DOI:10.1016/j.ygyno.2008.11.032 |
| [4] | SAKUMA Y, TAKEUCHI T, NAKAMURA Y, et al. Lung adenocarcinoma cells floating in lymphatic vessels resist anoikis by expressing phosphorylated Src[J]. J Pathol, 2010, 220(5): 574–585. DOI:10.1002/path.2676 |
| [5] | MELLO A A, LEAL M F, REY J A, et al. Deregulated expression of SRC, LYN and CKB kinases by DNA methylation and its potential role in gastric cancer invasiveness and metastasis[J]. PLoS ONE, 2015, 10(10): e0140492. DOI:10.1371/journal.pone.0140492 |
| [6] | HONG Y S, KIM J, PECTASIDES E, et al. Src mutation induces acquired lapatinib resistance in ERBB2-Amplified human gastroesophageal adenocarcinoma models[J]. PLoS ONE, 2014, 9(10): e109440. DOI:10.1371/journal.pone.0109440 |
| [7] | TANG B, PENG Z H, YU P W, et al. Aberrant expression of Cx43 is associated with the peritoneal metastasis of gastric cancer and Cx43-mediated gap junction enhances gastric cancer cell diapedesis from peritoneal mesothelium[J]. PLoS ONE, 2013, 8(9): e74527. DOI:10.1371/journal.pone.0074527 |
| [8] |
赵骏杰, 周荣健, 张启, 等. 胃癌腹膜转移风险评估模型的建立及其预测价值[J].
中华胃肠外科杂志, 2017, 20(1): 47–52.
ZHAO J, ZHOU R, ZHANG Q, et al. Establishment of risk evaluation model of peritoneal metastasis in gastric cancer and its predictive value[J]. Chin J Gastrointest Surg, 2017, 20(1): 47–52. DOI:10.3760/cma.j.issn.1671-0274.2017.01.010 |
| [9] | HUANG J, ZHANG L, HE C, et al. Claudin-1 enhances tumor proliferation and metastasis by regulating cell anoikis in gastric cancer[J]. Oncotarget, 2015, 6(3): 1652–1665. DOI:10.18632/oncotarget.2936 |
| [10] | LIU W, KOVACEVIC Z, PENG Z, et al. The molecular effect of metastasis suppressors on Src signaling and tumorigenesis: new therapeutic targets[J]. Oncotarget, 2015, 6(34): 35522–35541. DOI:10.18632/oncotarget.5849 |
| [11] | Liu C, Li Y, Xing Y, et al. The interaction between cancer stem cell marker CD133 and Src protein promotes focal adhesion kinase (FAK) phosphorylation and cell migration[J]. J Biol Chem, 2016, 291(30): 15540–15550. DOI:10.1074/jbc.M115.712976 |
| [12] | NAKAYAMA Y, SOEDA S, IKEUCHI M, et al. Cytokinesis failure leading to chromosome instability in v-Src-induced oncogenesis[J]. Int J Mol Sci, 2017, 18(4): 811. DOI:10.3390/ijms18040811 |
| [13] | MIZRACHY-SCHWARTZ S, COHEN N, KLEIN S, et al. Up-regulation of AMP-activated protein kinase in cancer cell lines is mediated through c-Src activation[J]. J Biol Chem, 2011, 286(17): 15268–15277. DOI:10.1074/jbc.M110.211813 |
| [14] | CARDOSO A P, PINTO M L, PINTO A T, et al. Macrophages stimulate gastric and colorectal cancer invasion through EGFR Y(1086), c-Src, Erk1/2 and Akt phosphorylation and small GTPase activity[J]. Oncogene, 2014, 33(16): 2123–2133. DOI:10.1038/onc.2013.154 |
| [15] | LAI Y H, CHEN M H, LIN S Y, et al. Rhodomycin A, a novel Src-targeted compound, can suppress lung cancer cell progression via modulating Src-related pathways[J]. Oncotarget, 2015, 6(28): 26252–26265. DOI:10.18632/oncotarget.4761 |
| [16] | OKAMOTO W, OKAMOTO I, YOSHIDA T, et al. Identification of c-Src as a potential therapeutic target for gastric cancer and of MET activation as a cause of resistance to c-Src inhibition[J]. Mol Cancer Ther, 2010, 9(5): 1188–1197. DOI:10.1158/1535-7163.MCT-10-0002 |
| [17] | EGUCHI R, FUJITA Y, TABATA C, et al. Inhibition of Src family kinases overcomes anoikis resistance induced by spheroid formation and facilitates cisplatin-induced apoptosis in human mesothelioma cells[J]. Oncol Rep, 2015, 34(5): 2305–2310. DOI:10.3892/or.2015.4200 |



