2. 400038 重庆,陆军军医大学(第三军医大学):军事预防医学院全军复合伤研究所,重庆市纳米医药工程技术研究中心,重庆生物材料与再生医学工程技术中心;
3. 100101 北京,中国科学院遗传与发育生物学研究所,分子发育生物学国家重点实验室
2. Institute of Combined Injury of PLA, Chongqing Engineering Research Center for Nanomedicine, Chongqing Engineering Research Center for Biomaterials and Regenerative Medicine, College of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. 3State Key Laboratory of Molecular Developmental Biology, Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing, 100101, China
随着纳米科技的飞速发展,纳米材料在各个领域都有了广泛的应用,尤其在生物医学领域。纳米材料的兴起,给生物医学带来一次技术变革。金纳米颗粒(gold nanoparticles, AuNP)由于具有特殊的光、电、热、催化等理化性质以及较好的生物相容性,其在生物医学领域是应用最早、最广泛的纳米材料之一,在生物传感器、疾病诊断与治疗、卫生检测、生物成像、靶向载药等领域展现出了广阔的应用前景。金纳米颗粒具有良好的生物相容性、较高的比表面积、尺寸易调等优势,且透皮性良好,将其作为药物载体携带药物透过皮肤的研究越来越多,利用纳米颗粒透皮特性实现局部透皮给药也得到了科学界极大的关注。将纳米材料用作载体,在实现药物的靶向运送,增加药物对靶器官或者组织指向性,降低药物对正常细胞杀伤作用的同时,可以大幅减少药物用量,为提高治疗药物的生物利用度奠定基础[1-4]。
神经营养因子(neurotrophin, NT)是一类神经元生长与存活所必需的蛋白质分子,广泛存在于人和多种动物体内,目前已经分离了4种主要的神经营养因子,分别是神经生长因子(nerve growth factor, NGF)、脑源神经营养因子(brain derived neurotrophic factor, BDNF)、神经营养因子3 (neurotrophin-3, NT3)和神经营养因子4/5 (neurotrophin-4/5, NT4/5)[5]。NT3是一种小分子多肽,大量的研究结果显示,NT3具有促进神经再生的作用,但是多数集中在中枢神经系统的研究,而关于NT3与皮下神经再生的作用报道极少,有待进一步研究[6-7]。皮肤是控制皮肤感觉神经支配的NT3的主要来源,NT3不仅在表皮中表达,而且在成纤维细胞和内皮细胞表达。
随着生活水平的提高,人们对美的追求更高,皮肤移植等美容医学发展迅速。目前,临床上烧伤、烫伤等外伤较为常见,皮肤移植虽然可以在外观上给患者以美学上的改变,但皮肤深层的损害切实存在,如何修复皮下神经功能至关重要,也是困扰皮肤移植治疗的一个难题[8]。但由于皮肤的天然屏障作用,一般的涂抹药物属于外源性物质,很难单独透过皮肤进入皮下进行神经修复。因此利用纳米颗粒透皮特性实现局部透皮给药成为皮肤损伤修复的一个热点课题。研究表明,NT3具有神经修复的功能,皮下给予NT3有利于皮下神经细胞再生,改善神经细胞功能。本研究结合纳米金的透皮特性和NT3的神经修复作用,研究AuNP偶联NT3透皮后对皮下神经的作用,为临床开发皮下非侵袭性给药提供依据。
1 材料与方法 1.1 材料及仪器表面带羧基的金纳米颗粒为本实验室合成并保存(直径约11 nm),NT3(his标记,重组表达的人NT3)、牛血清白蛋白(bovine serum albumin,BSA)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC]和N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)均购自Sigma公司,ELISA定量试剂盒购自云克隆公司(美国),免疫组化试剂盒购自Affinity公司。
透射电子显微镜(TEM, JEM-1400, 日本),马尔文粒度分析仪(Nano ZS, Malvern Instruments, 英国),光学显微镜(Carl Zeiss, Jena, 德国)。
1.2 纳米金与NT3偶联取羧基修饰的金纳米颗粒(AuNP-PEG-COOH)[9],调整浓度至2×1011个/mL。取2 mL的AuNP-PEG-COOH溶液,加入24 μL EDC(1 mg/mL)和24 μL NHS-sulfo(1 mg/mL)混匀,室温震荡孵育,20 min后加入1 mL NT3 (10 μg/mL),再孵育30 min,4 ℃存放过夜。用超滤离心管对混合液进行离心洗涤,洗涤3次后得金纳米颗粒与NT3的偶联物(AuNP-CONH-NT3),保存于PBS中备用。对照组中用相同的方法将AuNP-PEG-COOH与BSA偶联得到偶联物(AuNP-CONH-BSA)。将样品混合均匀,滴一滴到400目的铜网上,自然晾干。重复三次以保证有足够的纳米金负载到铜网上,用透射电镜检测样品的形貌和粒径尺寸。取1 mL溶液加入到样品池,用马尔文粒度分析仪检测样品的表面电荷。
1.3 动物实验60只BALB/c小鼠(雌性,6~7周龄,购自重庆第三军医大学动物实验中心)采用随机数字法分为4组,每组15只。6%水合氯醛麻醉后,对背部皮肤进行脱毛处理(3 cm×3 cm),脱毛区域用生理盐水浸泡后的纱布覆盖,保湿10 min后干燥。随后裸露皮肤用2 cm×2 cm无菌纱布覆盖,分别滴加300 μL的AuNP-CONH-NT3和AuNP-CONH-BSA,阳性对照组直接皮下注射300 μL NT3,空白对照加入300 μL PBS。
给药处理24 h后,取5只小鼠处死,进行免疫组化分析,检测药物透皮效果。将小鼠皮肤在4%多聚甲醛中固定24 h,脱水,并包埋在石蜡中。将皮肤组织纵向切成4 μm长度的切片,常规脱蜡,并用山羊血清工作液(ZLI-9002,ZSGB-BIO,中国)密封。加入His抗体(H1029,Sigma-Aldrich,美国),将切片在37 ℃的加湿箱中孵育60 min,随后室温过夜。第2天滴加辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(pv-6002,ZSGB-BIO,中国),用PBS洗涤后,切片用苏木精复染色,加入3,3’-二氨基联苯胺(DAB,ZLI-9018,ZSGB-BIO,中国)显色,然后加入蒸馏水停止显色,中性树胶密封后,在显微镜下观察染色后的组织,并采集图像分析。其余10只小鼠分别于给药后1个月和3个月处死,免疫组化过程同皮下His检测过程,高倍镜下采集图像,每只小鼠采取3张切片,每张切片随机选取3个视野,统计神经丝蛋白200(neuropeptide,NF200)阳性细胞与总的细胞数量的比值。
2 结果 2.1 金纳米颗粒与NT3偶联结果从透射电镜图(图 1A)可以看出,与NT3偶合后的金纳米粒仍呈近球形颗粒,具有良好的分散性。通过马尔文粒度分析仪测得AuNP-CONH-NT3的Zeta电位为-10.8 mV,为负电荷(图 1B)。根据课题组前期工作,带负电荷的金纳米颗粒具有更高的透皮效率[9],因此理论上AuNP-CONH-NT3有较好的透皮性,为下一步实验提供基础。

|
| A:AuNP-CONH-NT3透射电镜图; B:AuNP-CONH-NT3 Zeta电位 图 1 AuNP-PEG-COOH与NT3结合后表征结果 |
2.2 AuNP-CONH-NT3透皮实验结果
通过对4组小鼠进行透皮实验,取皮肤组织进行免疫组化检测His标签标记的NT3。免疫组化分析结果显示,在给予AuNP-CONH-NT3的实验组小鼠和NT3注射阳性对照组小鼠皮肤组织中,均检测到了His标签,而其他组并未检测到His标签(图 2)。由此可知,羧基修饰的纳米金颗粒和NT3偶联后可以穿过皮肤屏障到达皮下区域,与直接注射达到相似的目的,实现透皮给药。

|
| A:空白对照组; B:AuNP-CONH-BSA组; C:AuNP-CONH-NT3组; D:NT3注射组 图 2 透皮24 h免疫组化分析 (S-P) |
2.3 NF200免疫组化结果
为了进一步验证透皮后的NT3是否仍能发挥生物学效应,我们在小鼠经皮肤治疗1个月和3个月后,对皮肤进行免疫组织化学分析。结果显示,1、3个月各组中均能检测到NF200阳性细胞(图 3),同时,AuNP-CONH-NT3组NF200阳性细胞数量所占百分比明显大于AuNP-CONH-BSA组和空白对照组(Control NT3)(P < 0.01,图 4),对比直接注射组比较,则差异无统计学意义(P >0.05)。结果表明AuNP-CONH-NT3载药系统对于NF200蛋白表达具有促进作用和改善皮下神经功能的意义。对比不同时间点的实验结果,实验组AuNP-CONH-NT3中,3个月NF200阳性细胞数量所占百分比与1个月时NF200阳性细胞数量比较,差异无统计学意义(P >0.05),但NF200阳性细胞平均数量有所增加。而在NT3注射组中,3个月NF200阳性细胞数量所占百分比与1个月时对比,差异无统计学意义(P>0.05),且NF200阳性细胞平均数量基本没有变化,表明AuNP-CONH-NT3载药系统具有一定的NT3缓释功能,更加长效地促进NF200阳性细胞增殖,从而改善皮下神经功能。
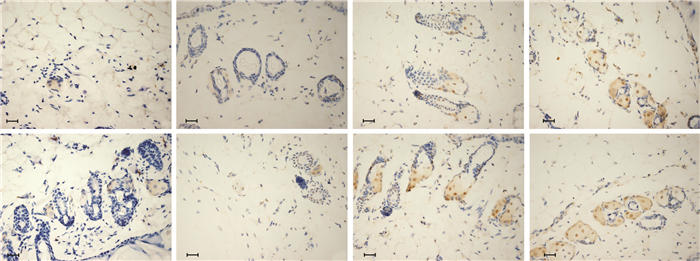
|
| 图 3 透皮治疗1、3个月后NF200免疫染色结果 (S-P) |
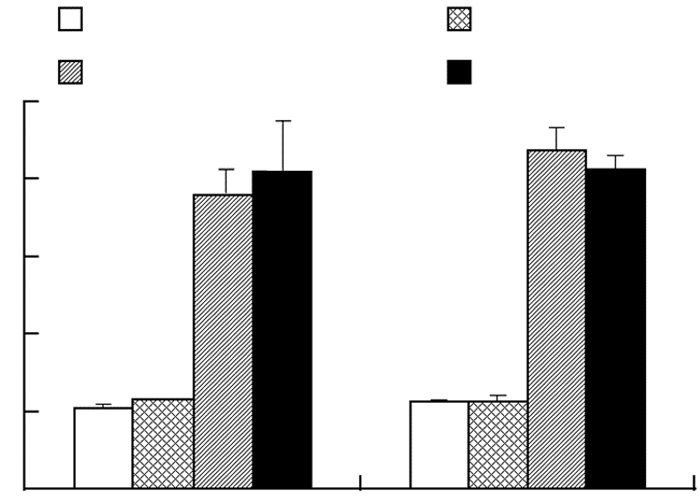
|
| a: P < 0.01,与AuNP-CONH-NT3组比较 图 4 NF200表达量化分析 |
3 讨论 3.1 透皮载药体系的研究
皮肤是人体最大的器官,是机体防御系统的第一道屏障,对于防止致病因子入侵具有重要功能。正因为如此,药物大分子很难透过皮肤进入体内发挥药效[10-11]。如何将药物大分子输送至皮下,一直是临床研究的热点问题。近年来,随着纳米科技的发展,各种纳米材料作为载体,运载大分子物质进行靶向给药取得了可喜的成果,为非侵入性皮下给药提供了理论基础[12-13]。目前,基于纳米载药的运载体系主要限于低剂量或小分子药物,对于高剂量或高分子药物的透皮递送,需要借助高剂量表面活性剂或促进药物吸收的物理手段,但使用高剂量表面活性剂无疑会影响载药体系的生物相容性[14-15]。如何开发新的透皮载药体系,改善载药体系转运的安全性和有效性,是目前亟须解决的问题。
随着纳米科技的飞速的发展,纳米材料合成方法不断更新,使纳米材料在各个领域得到广泛应用[16]。纳米材料具有粒径小、表面积大以及特殊的光热等理化特性,纳米金等纳米材料在医学领域的应用已经十分普遍[17]。研究结果表明,金纳米颗粒具有很好的透皮特性,而且经表面修饰后,可以达到很好的生物相容性,其安全、无毒,为应用于体内载药体系提供了保障[18]。本课题组的前期研究结果显示,经羧基修饰后的纳米金颗粒,可以与生物蛋白相连,细胞毒性试验结果显示其毒性较低,具有应用于体内实验的巨大潜力[9]。在此基础上,前期课题组进一步研究了AuNPs的透皮试验,证实其具有显著的透皮效应。同时,前期工作研究显示,带负电荷的AuNPs比带正电荷或不带电荷的颗粒透皮递送药物的效果更好。因此,带负电荷的AuNPs是用于载药体系的首选载体,其偶联NT3后,整个体系仍然带负电荷,可以保障偶联后新的复合物的透皮效果。通过构建小鼠模型,经24 h透皮给药试验,免疫组化分析结果证明,新的载药体系将NT3递送至皮下,达到了理想的透皮效果。
3.2 NT3的生物学作用研究NT3是神经营养因子超家族的成员之一,其生理功能广泛,可在体或离体调解周围神经系统。但是生物蛋白分子提取效率低,且在体内易被稀释或降解失活,吸收率不高,临床应用缺乏安全、有效的给药途径[19]。有学者将NT3基因导入成纤维细胞后植入周围神经损伤部位,以促进轴突再生,但成纤维细胞易形成瘢痕,阻碍神经组织的修复[20-21]。施新革等[22]利用转染NT3基因的雪旺细胞移植于受损的坐骨神经,研究发现其具有促进神经生长、髓鞘再生的作用,局部释放的NT3能加快轴突再生速度以促进周围神经再生,减缓失神经支配肌肉的萎缩,然而基因转染用于临床治疗还存在风险和伦理学等问题。
本研究分析了NT3对于皮下神经元的作用,经过NF200免疫组化分析可知,NT3促进了神经元分泌NF200,同时实验组在给药后1个月和3个月,NF200阳性细胞数量有一定的增加,而侵入性皮下注射给药,1个月和3个月时,神经元分泌的NF200没有显著性变化,说明纳米载药体系对神经元的功能具有持续的影响,可能与该载药系统的缓释功能有关,不断释放出NT3进行神经修复。本研究对于皮肤损伤后,通过非侵入性透皮给药,促进神经生长具有重要的临床应用价值。本研究对纳米金的研究仅限于一次性给药的动物实验结果,如果纳米金载药长期大量用于临床治疗,对其在生物体内是否会蓄积也是一个需要考虑的问题。
综上所述,纳米金运载NT3是一种非侵入性药物递送方法,对于皮肤损伤以及美容等领域,具有潜在的临床应用前景。但是其真正应用于临床仍然有很长的路要走,需要进一步研究纳米材料在生物体内的慢性毒性作用,阐明整个载药体系在生物体内的代谢和转归、排泄等,但是纳米金载药体系为临床非侵入性透皮给药提供了一个新的研究方向,其应用前景值得期待。
| [1] | FERNANDES R, SMYTH N R, MUSKENS O L, et al. Interactions of skin with gold nanoparticles of different surface charge, shape, and functionality[J]. Small, 2015, 11(6): 713–721. DOI:10.1002/smll.201401913 |
| [2] | HUANG Y, YU F, PARK Y S, et al. Co-administration of protein drugs with gold nanoparticles to enable percutaneous delivery[J]. Biomaterials, 2010, 31(34): 9086–9091. DOI:10.1016/j.biomaterials.2010.08.046 |
| [3] | LABOUTA H I, SCHNEIDER M. Interaction of inorganic nanoparticles with the skin barrier: current status and critical review[J]. Nanomedicine, 2013, 9(1): 39–54. DOI:10.1016/j.nano.2012.04.004 |
| [4] | PALMER B C, DELOUISE L A. Nanoparticle-enabled transdermal drug delivery systems for enhanced dose control and tissue targeting[J]. Molecules, 2016, 21(12): 1719–1736. DOI:10.3390/molecules21121719 |
| [5] | STREITER S, FISCH B, SABBAH B, et al. The importance of neuronal growth factors in the ovary[J]. Mol Hum Reprod, 2016, 22(1): 3–17. DOI:10.1093/molehr/gav057 |
| [6] | YAN Y H, LI S H, GAO Z, et al. Neurotrophin-3 promotes proliferation and cholinergic neuronal differentiation of bone marrow-derived neural stem cells via notch signaling pathway[J]. Life Sci, 2016, 166: 131–138. DOI:10.1016/j.lfs.2016.10.004 |
| [7] | GUO Y, SU Z J, CHEN Y K, et al. Brain-derived neurotrophic factor/neurotrophin 3 regulate axon initial segment location and affect neuronal excitability in cultured hippocampal neurons[J]. J Neurochem, 2017, 142(2): 260–271. DOI:10.1111/jnc.14050 |
| [8] | SCHIEFER J L, HELD M, FUCHS P C, et al. Growth differentiation factor 5 accelerates wound closure and improves skin quality during repair of full-thickness skin defects[J]. Adv Skin Wound Care, 2017, 30(5): 223–229. DOI:10.1097/01.ASW.0000515078.69041.3c |
| [9] | CHEN Y, WU Y, GAO J, et al. Transdermal Vascular Endothelial Growth Factor Delivery with Surface Engineered Gold Nanoparticles[J]. ACS Appl Mater Interfaces, 2017, 9(6): 5173–5180. DOI:10.1021/acsami.6b15914 |
| [10] | HURTLEY S M. Orchestrating pathogen defenses in the skin[J]. Science, 2017, 356(6341): 919–920. DOI:10.1126/science.356.6341.919-d |
| [11] | CHAN L C, CHAILI S, FILLER S G, et al. Innate Immune Memory Contributes to Host Defense against Recurrent Skin and Skin Structure Infections Caused by Methicillin-Resistant Staphylococcus aureus[J]. Infection and Immunity, 2016, 85(2): e00876–e00816. DOI:10.1128/iai.00876-16 |
| [12] | MITRAGOTRI S, ANDERSON DG, CHEN X, et al. Accelerating the Translation of Nanomaterials in Biomedicine[J]. ACS Nano, 2015, 9(7): 6644–6654. DOI:10.1021/acsnano.5b03569 |
| [13] |
李家萌, 曹颖, 赵媛, 等. 纳米金在生物医学技术应用的研究现状[J].
中国寄生虫学与寄生虫病杂志, 2016, 34(2): 166–170.
LI J M, CAO Y, ZHAO Y. Research status of application of gold nanoparticles in medical biotechnogy[J]. Chin J Parasitol Paras Dis, 2016, 34(2): 166–170. |
| [14] | ITA K. Current Status of Ethosomes and Elastic Liposomes in Dermal and Transdermal Drug Delivery[J]. Curr Pharm Des, 2016, 22(33): 5120–5126. DOI:10.2174/1381612822666160511150228 |
| [15] | XHAUFLAIRE-UHODA E, VROOME V, CAUWENBERGH G, et al. Dynamics of skin barrier repair following topical applications of miconazole nitrate[J]. Skin Pharmacol Physiol, 2006, 19(5): 290–294. DOI:10.1159/000093985 |
| [16] |
张虎, 李英姿, 汪德州, 等. AuNCs@SiO2金纳米簇复合粒子制备及其对体外口腔癌细胞毒性的研究[J].
中国实验诊断学, 2017, 21(3): 471–474.
ZHANG H, LI Y Z, WANG D Z, et al. Preparation of silica-coated gold nanoclusters and its evaluation of oral cytotoxicity in vitro[J]. Chin J Lab Diagn, 2017, 21(3): 471–474. DOI:10.3969/j.issn.1007-4287.2017.03.030 |
| [17] |
冷玉敏, 贺艳婷, 冷玉芹, 等. 金纳米粒子在生物医学领域应用综述[J].
南阳师范学院学报, 2015, 14(9): 38–45.
LENG Y M, HE Y T, LENG Y Q, et al. Application of gold nanoparticles in biomedicine[J]. J Nanyang Normal Univ, 2015, 14(9): 38–45. DOI:10.3969/j.issn.1671-6132.2015.09.010 |
| [18] |
洪锦勇, 尹红梅, 沈阳, 等. 表面化学修饰纳米金粒子对肝癌细胞增殖和迁移的影响[J].
生物医学工程学杂志, 2015, 32(2): 373–379.
HONG J Y, YIN H M, CHEN Y, et al. Effect of gold (Au) nanoparticles modified by surface chemistry on the proliferation and migration of hepatocellular carcinoma cells in vitro[J]. J Biomed Eng, 2015, 32(2): 373–379. DOI:10.7507/1001-5515.20150068 |
| [19] |
万圣祥, 肖颖锋, 王发斌, 等. 神经营养因子-3转基因治疗失神经肌萎缩的实验研究[J].
中华显微外科杂志, 2007, 30(1): 47–49.
WAN S X, XIAO Y F, WANG F B, et al. Experimental study of neurotrophic-3 transgenic therapy for denervated[J]. Chin J Microsurg, 2007, 30(1): 47–49. DOI:10.3760/cma.j.issn.1001-2036.2007.01.016.cma.j.issn.1001-2036.2007.01.016 |
| [20] | NAMIKI J, KOJIMA A, TATOR C H. Effect of brain-derived neurotrophic factor, nerve growth factor, and neurotrophin-3 on functional recovery and regeneration after spinal cord injury in adult rats[J]. J Neurotrauma, 2000, 17(12): 1219–1231. DOI:10.1089/neu.2000.17.1219 |
| [21] | KUO L T, GROVES M J, SCARAVILLI F, et al. Neurotrophin-3 administration alters neurotrophin, neurotrophin receptor and nestin mRNA expression in rat dorsal root ganglia following axotomy[J]. Neuroscience, 2007, 147(2): 491–507. DOI:10.1016/j.neuroscience.2007.04.023 |
| [22] |
施新革, 宗海斌, 董玉珍, 等. 神经营养因子3基因修饰的雪旺细胞对神经损伤的修复作用[J].
军事医学, 2011, 35(7): 556–558.
SHI X G, ZONG H B, DONG Y Z, et al. Effects of neurotrophic 3 gene modified Schwann cells on nerve injury[J]. Mil Med Sci, 2011, 35(7): 556–558. DOI:10.3969/j.issn.1674-9960.2011.07.019 |



