新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿期常见的胃肠道危急重症之一,是造成新生儿致死、致残的重要因素。而存活者也可遗留不同程度的后遗症,如短肠综合征、胆汁淤积症或神经系统发育障碍等[1]。在出生体质量低于1 500 g的早产儿中发病率达7%,病死率达20%~30%[2]。NEC病情重,易反复,并发症多,其确切机制尚不完全清楚。目前认为NEC是多种因素引起的肠道炎性病变[3],肠黏膜屏障结构和功能损坏被认为是其发病的中心环节。随着人们对人体共生微生物的逐渐认识,已有不少研究提出,病毒也是人体共生微生物的一类[4]。有报道鼠诺如病毒(murine norovirus,MNV)与铜绿假单胞菌混合感染可以提高急性铜绿假单胞菌肺部感染小鼠的生存率,降低体内促炎因子IL-6、TNF-α的表达[5],并且MNV在肠道中扮演与肠道共生菌群类似的作用:维持肠道黏膜形态以及淋巴细胞功能避免过度的炎症反应,提高炎症抑制因子IL-10家族中相关因子如IL-22的表达[6]。3型天然淋巴细胞(type 3 innate lymphoid cells,ILC3)主要分布在肠道黏膜,通过分泌IL-22等因子在肠道黏膜屏障功能维持和促进组织修复等方面发挥着重要作用[7];目前获得性免疫缺陷者体内ILC3细胞会出现数量减少及功能变化。
新生儿本身肠道免疫状态与儿童、成人不同,MNV在NEC肠道损伤中的作用机制尚不清楚,肠黏膜屏障结构和功能损坏被认为是NEC发病的中心环节,我们猜测MNV在NEC模型中是否可能通过促进ILC3细胞表达IL-22,从而维持肠道黏膜屏障功能?本实验通过建立NEC小鼠模型,给予MNV干预,检测ILC3细胞数量及分泌的IL-22等相关因子的水平,探讨MNV在NEC中的作用,分析其可能的作用机制,以期为NEC的病原学及治疗提供新思路及新认识。
1 材料与方法 1.1 主要材料75只SPF级新生1 d的C57BL/6J小鼠,雌雄不限,体质量1.2~1.5 g(重庆医科大学动物中心),贝克幼犬奶粉(贝克公司,美国),雅培婴幼儿奶粉(雅培公司,美国),琼脂粉(Sangon Biotech,中国),细胞RNA提取试剂盒、逆转录试剂盒(TaKaRa公司,日本),组织RNA提取试剂盒(QIAGEN公司,德国),组织及细胞裂解液、IL-10 ELISA检测试剂盒(RayBiotech公司,美国),红细胞裂解液(天根公司,中国),HBSS平衡盐溶液(Gibco公司,美国),胶原酶、DNA酶(Sigma-Aldrich公司,美国),流式抗体CD3(clone 17A2),CD11b(clone M1/70)、CD45R/B220(clone RA3-6B2)、Ly-6G/Ly-6C(clone RB6-8C5)、TER-119/Erythroid cells(cloneTer-119)、CD45(clone 30-F11)均是美国BioLegend公司产品,ROR-rt+[(clone Q31-378), BD公司,美国],Foxp3 Staining Buffer Set(eBioscience公司,美国),蛋白酶抑制剂混合物(凯基生物,中国)。
1.2 方法 1.2.1 实验动物分组及处理将75只出生1 d的C57BL/6J小鼠按随机数字表法分为3组(n=25):正常对照组、给予PBS的NEC模型组(PBS+NEC组)、给予MNV干预的NEC模型组(MNV+NEC组)。正常对照组:与母鼠同笼,不予任何处理;NEC组:新生小鼠于生后第1天开始在每日上午9:00给予联合抗生素[氨苄西林钠(25 mg/kg)、甲硝唑(50 mg/kg)、万古霉素(10 mg/kg)、哌拉西林钠他唑巴坦钠(100 mg/kg)]灌胃,连续处理10 d[8],灌胃体积0.03~ 0.05 mL/kg;MNV+NEC组:在第1、2、5、6、9、10天15:00给予MNV(2×106 pfu)灌胃处理。第11天开始建立NEC模型[9]:新生11 d的小鼠与母鼠分开,放置在保育箱内,控制保育箱内温度(36±1)℃,湿度45%~60%。经口插入PICC管灌胃喂养,采用鼠乳代用品[10]人工喂养。灌胃奶量每次为0.03~0.05 mL/kg,每4小时喂养1次,共6次。每日灌胃时间:08:00、12:00、16:00、20:00、24:00、04:00。将小鼠放入自制的缺氧箱内,检查自制缺氧箱的密闭性,连接测氧仪和缺氧箱,向缺氧箱充入纯氮气(N2),控制N2流量为9 L/min,当缺氧箱内N2浓度达100%,计时器开始计时,2 min后关闭氮气阀门并将新生小鼠取出。4 min后立即将新生小鼠置于4 ℃冰箱中冷刺激10 min。缺氧、冷刺激分别于每日09:30、15:30、21:30各进行1次,每天进行3次,连续3 d,建模前后称量小鼠体质量,第14天断头杀老鼠,取标本。
1.2.2 MNV的体外扩增及定量检测待RAW264.7细胞铺满瓶底60%~80%时接种病毒,解冻MNV病毒母液,按1:10吸取相应单位的病毒母液到细胞培养瓶中,孵育,细胞培养箱中培养,待细胞出现70%病变时收获病毒,4 ℃下12 000 r/min离心10 min,取上清液,直接冻于-80 ℃保存,如此反复。采用空斑试验对MNV进行定量检测,24孔板培养细胞,接种病毒液0.1 mL/孔,细胞培养箱培养1 h,加入低熔点琼脂糖1 mL/孔覆盖培养基,3 d后,吸弃培养基,加入5%甲醛1 mL/孔固定4 min,加入结晶紫0.8 mL/孔染色20 min,计算孔斑数。
1.2.3 小鼠一般状况及体质量变化观察各组新生小鼠一般情况,如体格发育、刺激反应、有无腹胀、腹泻、大便性状、活动度、灌胃进食及精神状态等情况,并记录统计,建模前后称量小鼠体质量。
1.2.4 小鼠肠组织大体形态各组小鼠于建模第4天空腹后断头处死,取出十二指肠下端至回盲部肠管,置于培养皿内用无菌PBS漂洗后,观察小鼠肠腔有无积气、出血、坏死及肠管的色泽、弹性等变化。
1.2.5 小鼠回盲部肠组织病理学形态观察取小鼠回盲部2~3 cm肠组织,将其固定于4%中性甲醛溶液中,石蜡包埋、切片、HE染色,封片,光学显微镜下观察肠组织病理学变化。
1.2.6 实时荧光定量PCR检测TLR-3、MDA-5、IL-6、IL-10、IL-1β、IL-22水平从-80 ℃冰箱取出冻存的回盲部肠组织,按照组织RNA提取试剂盒步骤提取肠组织总RNA。从液氮罐中取出保存的肠道固有层淋巴细胞,按照细胞RNA提取试剂盒步骤提取肠道固有层淋巴细胞的总RNA。NANODROP 2000测定每个样本RNA浓度,按照逆转录试剂盒步骤将RNA逆转率为cDNA,然后以cDNA为模板,在Bio-Rad CFX90 Real-Time PCR仪上进行TLR-3、MDA-5、IL-6、IL-10、IL-1β、IL-22扩增。Real-Time PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,56.2 ℃退火5 s,65 ℃延伸5 s,共39个循环。目的基因相对表达量采用2-ΔΔCt(ΔCt=目的基因Ct值-内参Ct值)进行分析,以GAPDH为内参。引物序列见表 1。
| 基因 | 序列(5′→3′) | 片段大小 |
| TLR-3 | 上游:AAGTTATTCGCCCTCCTCTTGA | 95 bp |
| 下游:AGATTCTGGATGCTTGTGTTTGA | ||
| MDA-5 | 上游:AGTTTGGCAGAAGGAAGTGTC | 482 bp |
| 下游:GGAGTTTTCAAGGATTTGAGC | ||
| IL-6 | 上游:ACAACCACGGCCTTCCCTACTT | 129 bp |
| 下游:CACGATTTCCCAGAGAACATGTG | ||
| IL-10 | 上游:GCCGTCATTTTCTGCCTCAT | 131 bp |
| 下游:GCTTCCCTATGGCCCTCATT | ||
| IL-1β | 上游:ATGAGAGCATCCAGCTTCAA | 157 bp |
| 下游:TGAAGGAAAAGAAGGTGCTC | ||
| IL-22 | 上游:GACCAAACTCAGCAATCAGCTC | 174 bp |
| 下游:TACAGACGCAAGCATTTCTCAG | ||
| GAPDH | 上游:TGCCCCCATGTTTGTGATG | 151 bp |
| 下游:TGTGGTCATGAGCCCTTCC |
1.2.7 ELISA检测回盲部肠组织炎症抑制因子IL-10水平
取出-80 ℃冰箱中冻存的回盲部肠组织,按照组织裂解液步骤研磨肠组织,100 mg肠组织加入500 μL RayBiotech组织裂解液,同时加入相应体积的蛋白酶抑制剂混合物,4 ℃ 14 000 r/min离心10 min,吸取上清液,保存于-80 ℃。严格按照IL-10 ELISA检测试剂盒操作步骤测定IL-10水平。
1.2.8 流式细胞仪检测ILC3数量首先,取小鼠肠组织标本,加入HBSS平衡液及消化液得到肠道固有层淋巴细胞(intestinal lamina propria lymphocytes,LPL)。其次,总体积保证每个流式上样管细胞数约为1×106个,加入表染抗体2 μL,孵育20 min;PBS洗涤2次,加入400 μL的固定/破膜工作液(Fixation/Permeabilization),旋涡混匀,避光4 ℃孵育45 min;加入1 mL缓冲液(Permeabilization Buffer)洗涤2次,加入细胞内染色抗体2 μL, 避光4 ℃孵育45 min;加入1 mL缓冲液(Permeabilization Buffer)洗涤2次,200 μL PBS重悬细胞,于BD FACSCantoⅡ仪器上机检测并分析。
1.3 统计学方法采用SPSS 22.0统计软件。数据以x±s表示,符合正态分布且方差齐的计量资料两组间比较采用独立样本t检验,3组间比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 小鼠一般情况及体质量变化情况3组小鼠的体质量在建模前(即第10天)差异无统计学意义(P>0.05)。正常对照组活动正常,生长发育良好,进食及排便正常,皮下脂肪丰满,第14天体质量为(5.98±0.65) g,明显增加。PBS+NEC组[(3.29±0.78) g]与MNV+NEC组[(3.77±0.24) g]体质量均显著低于正常对照组(P < 0.01)。NEC组建模后出现明显的活动减少、倦怠懒动、胃潴留、腹胀、喂养困难,甚至黑便、血便,第14天体质量明显降低,但MNV+NEC组体质量下降较PBS+NEC组少(P < 0.05)。
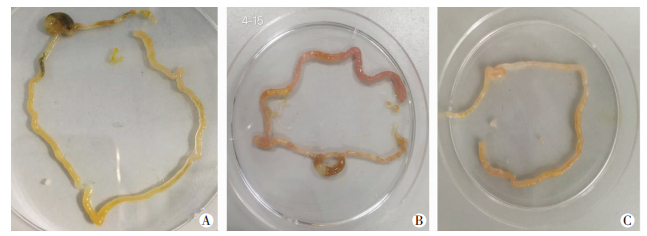
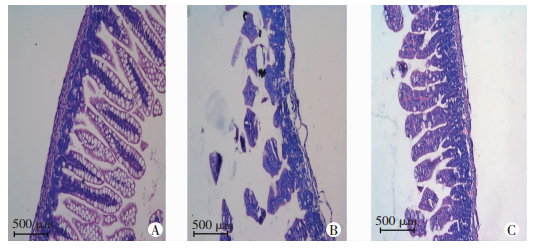
2.2 肠组织大体形态及回盲部肠道组织病理学改变肠组织大体标本肉眼观察显示:正常对照组小鼠肠组织肠管呈淡黄色,色泽鲜嫩,弹性佳,无出血、积气、水肿等表现(图 1A)。PBS+NEC组小鼠肠组织弹性差,易破损,肠管呈黑红色改变,肠管积气明显、扩张,肠壁变薄,甚至呈串珠样改变,并有出血表现(图 1B)。MNV+NEC组小鼠肠组织肠管主要呈黄色,弹性尚可,有红色,但未见黑红色改变,肠腔可见轻中度积气,无串珠样及出血表现(图 1C)。普通光学显微镜下观察可见:正常对照组小鼠回盲部肠组织结构清晰完整,肠上皮完整连续,绒毛高耸,腺体清晰整齐,黏膜层、黏膜下层及固有层均未见充血水肿或断裂分离,肌层较厚(图 2A)。PBS+NEC组小鼠回盲部肠组织坏死严重,腺体排列紊乱,绒毛变性水肿,参差不齐,部分绒毛坏死、脱落或消失,黏膜层、黏膜下层及固有层可见重度水肿,肌层变薄甚至断裂(图 2B)。而MNV+NEC组小鼠回盲部肠组织黏膜层、黏膜下层及固有层仅可见轻中度充血水肿,腺体结构稍紊乱,绒毛轻度水肿,肌层稍变薄,但未见明显断裂(图 2C)。
|
| A:正常对照组;B:PBS+NEC组;C:MNV+NEC组 图 1 3组小鼠肠组织肉眼观察 |
|
| A:正常对照组;B:PBS+NEC组;C:MNV+NEC组 图 2 3组小鼠回盲部肠组织病理学形态观察(HE) |
2.3 回盲部肠组织TLR-3、MDA-5、IL-6、IL-10、IL-1β mRNA及LPL的IL-22 mRNA水平
MNV+NEC组与PBS+NEC组相比,肠组织表达的MDA-5、TLR-3有升高趋势(0.98±0.35 vs 0.67±0.39,P>0.05;0.73±0.26 vs 0.62±0.40,P>0.05);IL-10表达显著升高(1.22±0.36 vs 0.60±0.31,P < 0.01);IL-6、IL-1β表达显著下降(0.75±0.33 vs 1.22 ± 0.34,P < 0.05;0.39±0.20 vs 1.25±0.59,P < 0.01);LPL表达IL-22显著升高(1.20±0.38 vs 0.65±0.22,P < 0.05)。
2.4 ELISA检测炎症抑制因子IL-10水平与qPCR结果一致,MNV+NEC组与PBS+NEC组相比,IL-10显著升高[(165.55±53.51) pg/mL vs (129.59±26.22) pg/mL,P < 0.05]。
2.5 流式细胞术检测ILC3数量PBS+NEC组和MNV+NEC组ILC3数量比较差异无统计学意义[(12.80±0.76)% vs (12.88±1.45)%, P>0.05]。
3 讨论目前,流行病学提示NEC与新生儿肠道功能不成熟、肠黏膜缺氧缺血、感染及配方奶喂养等因素有关[11]。肠道黏膜屏障防止肠腔内的有害物质穿过肠黏膜进入机体其他组织、器官及血液[12],在新生儿NEC发病机制中起关键作用。ILC3在肠道黏膜屏障功能维持和促进肠组织修复等方面发挥着重要作用[13]。KERNBAUER等[6]研究表明:MNV在肠道中扮演着重要作用。本研究显示,NEC组小鼠在体质量、一般情况、肠道大体形态及回盲部肠组织病理学损伤等方面均明显区别于正常对照组,说明模型建立成功[14],MNV+NEC组小鼠体质量下降较PBS+NEC组少,小鼠一般情况较好,肠道大体形态及肠组织病理学损伤较轻微,说明MNV在NEC小鼠动物模型中起保护作用。肠上皮细胞是黏膜免疫系统的第一个应答者,MNV进入机体肠道,被肠上皮细胞M细胞模式识别受体MDA-5识别,摄取并递呈至下游的巨噬细胞和树突状细胞[15]。本研究qPCR结果显示,MNV+NEC组MDA-5增高趋势明显,说明MNV主要通过模式识别受体MDA-5进入肠道,刺激巨噬细胞及树突状细胞,从而启动肠道固有免疫系统。ILC3为近年来被广泛研究的一种固有免疫细胞,与T细胞和B细胞不同,该细胞不表达抗原特异性受体,在调节获得性免疫反应、维持肠道黏膜屏障功能及促进肠组织修复方面发挥着重要作用。本研究结果显示,给予MNV+NEC组在ILC3数量上与PBS+NEC组没有差异,但是肠组织固有层淋巴细胞的qPCR结果显示其表达的IL-22明显高于PBS+NEC组,说明MNV可能通过促进ILC3分泌IL-22。IL-22属于IL-10家族中一员[16],IL-22受体信号激活后可诱导肠道上皮细胞增殖因子和抗凋亡因子表达,促进上皮细胞产生抗菌肽、黏蛋白、防御素,并参与构成上皮细胞紧密连接的完整性[17]。一方面,IL-22增强黏膜屏障作用的机制包括促进肠黏膜上皮细胞增殖,产生抗菌肽,包括脂质运载蛋白2、C型凝集素再生蛋白Reg3β、Reg3r及整合锌、锰等金属离子的钙结合蛋白S100A8、S100A9等[18];另一方面,IL-22增强抗凋亡因子表达,从而维持肠黏膜的屏障功能。缺乏IL-22或者ILC3的小鼠肠上皮细胞调亡增加,同时上皮紧密连接相关蛋白、黏蛋白和抗菌肽表达减少[19],缺少IL-22+ILC3引起克罗恩病病情进展,补充IL-22可以缓解病情[20]。因此,ILC3可发挥调节炎症反应、修复受损组织和维持上皮完整性的功能。ILC3还是肠道GM-CSF的主要来源,ILC3释放GM-CSF,从而控制单核吞噬细胞及树突状细胞的数量和功能,并通过分泌维A酸及IL-10维持肠道Treg的稳态[21],与PBS+NEC组比较,MNV+NEC组qPCR结果显示其炎症因子IL-6、IL-1β表达降低,IL-6、IL-1β是常见的促炎因子,能募集、激活其他免疫细胞,诱导其他炎症介质,放大局部和全身炎症反应。而炎症抑制因子IL-10在转录和蛋白水平上表达都升高,说明MNV可以降低NEC肠道炎症。
综上所述,本实验成功建立NEC动物模型并检测肠组织MDA-5表达水平,炎症因子IL-6、IL-1β表达水平,炎症抑制因子IL-10表达水平,ILC3细胞数量及IL-22的表达水平,得出MNV可能主要通过肠上皮细胞M细胞MDA-5识别,摄取并呈递给下游的树突状细胞及巨噬细胞,从而启动固有免疫系统,促进ILC3细胞分泌IL-22,而ILC3细胞又可反过来控制单核吞噬细胞及树突状细胞的数量和功能,并通过分泌IL-10维持肠道Treg的稳态,从而维持肠道稳态。然而MNV作用于肠道的具体分子结构和机制,以及利用IL-22的阻断剂是否会阻断MNV的作用,添加重组IL-22是否可以达到治疗NEC的目的,仍需进一步研究。
| [1] | FROST B L, MODI B P, JAKSIC T, et al. New medical and surgical insights into neonatal necrotizing enterocolitis: a review[J]. JAMA Pediatr, 2017, 171(1): 83–88. DOI:10.1001/jamapediatrics.2016.2708 |
| [2] | LIM J C, GOLDEN J M, FORD H R. Pathogenesis of neonatal necrotizing enterocolitis[J]. Pediatr Surg Int, 2015, 31(6): 509–518. DOI:10.1007/s00383-015-3697-9 |
| [3] | HACKAM D J, UPPERMAN J S, GRISHIN A, et al. Disordered enterocyte signaling and intestinal barrier dysfunction in the pathogenesis of necrotizing enterocolitis[J]. Semin Pediatr Surg, 2005, 14(1): 49–57. DOI:10.1053/j.sempedsurg.2004.10.025 |
| [4] | CADWELL K. Expanding the role of the virome: commensalism in the gut[J]. J Virol, 2015, 89(4): 1951–1953. DOI:10.1128/JVI.02966-14 |
| [5] | TH PAUT M, GRANDJEAN T, HOBER D, et al. Protective role of murine norovirus against Pseudomonas aeruginosa acute pneumonia[J]. Vet Res, 2015, 46: 91. DOI:10.1186/s13567-015-0239-3 |
| [6] | KERNBAUER E, DING Y, CADWELL K. An enteric virus can replace the beneficial function of commensal bacteria[J]. Nature, 2014, 516(7529): 94–98. DOI:10.1038/nature13960 |
| [7] |
张昕, 涂波, 赵娟娟, 等. 3型天然淋巴细胞在HIV-1慢性感染中的免疫特征及其与疾病进展的关系研究[J].
传染病信息, 2016, 29(3): 144–147.
ZHANG X, TU B, ZHAO J J, et al. Characteristics of group 3 innate lymphoid cells in chronic HIV-1 infection and their associations with disease progression[J]. Infect Dis Info, 2016, 29(3): 144–147. DOI:10.3969/j.issn.1007-8134.2016.03.005 |
| [8] | TANOUE T, ATARASHI K, HONDA K. Development and maintenance of intestinal regulatory T cells[J]. Nat Rev Immunol, 2016, 16(5): 295–309. DOI:10.1038/nri.2016.36 |
| [9] | QUINTANILLA H D, LIU Y, FATHEREE N Y, et al. Oral administration of surfactant protein-a reduces pathology in an experimental model of necrotizing enterocolitis[J]. J Pediatr Gastroenterol Nutr, 2015, 60(5): 613–620. DOI:10.1097/MPG.0000000000000678 |
| [10] | GON ALVES F L, SOARES L M, FIGUEIRA R L, et al. Evaluation of the expression of I-FABP and L-FABP in a necrotizing enterocolitis model after the use of Lactobacillus acidophilus[J]. J Pediatr Surg, 2015, 50(4): 543–549. DOI:10.1016/j.jpedsurg.2014.07.007 |
| [11] | THYOKA M, DE COPPI P, EATON S, et al. Advanced necrotizing enterocolitis part 1: mortality[J]. Zeitschrift fur Kinderchirurgie, 2012, 22(1): 8–12. DOI:10.1055/s-0032-1306263 |
| [12] | ECKBURG P B, BIK E M, BERNSTEIN C N, et al. Diversity of the human intestinal microbial flora[J]. Science, 2005, 308(5728): 1635–1638. DOI:10.1126/science.1110591 |
| [13] | PICKARD J M, MAURICE C F, KINNEBREW M A, et al. Rapid fucosylation of intestinal epithelium sustains host-commensal symbiosis in sickness[J]. Nature, 2014, 514(7524): 638–641. DOI:10.1038/nature13823 |
| [14] |
宋朝敏, 王红, 吴斌, 等. 新生鼠坏死性小肠结肠炎动物模型建立及评价[J].
中国新生儿科杂志, 2007, 22(5): 280–284.
SONG C M, WANG H, WU B, et al. Establishment and evaluation of necrotizing enterocolitis model in neonatal rat[J]. Chin J Neonatol, 2007, 22(5): 280–284. DOI:10.3969/j.issn.1673-6710.2007.05.008 |
| [15] | NEWMAN K L, LEON J S. Norovirus immunology: Of mice and mechanisms[J]. Eur J Immunol, 2015, 45(10): 2742–2757. DOI:10.1002/eji.201545512 |
| [16] | ZHENG Y, VALDEZ P A, DANILENKO D M, et al. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens[J]. Nat Med, 2008, 14(3): 282–289. DOI:10.1038/nm1720 |
| [17] | HANASH A M, DUDAKOV J A, HUA G, et al. Interleukin-22 protects intestinal stem cells from immune-mediated tissue damage and regulates sensitivity to graft versus host disease[J]. Immunity, 2012, 37(2): 339–350. DOI:10.1016/j.immuni.2012.05.028 |
| [18] | CELLA M, FUCHS A, VERMI W, et al. A human natural killer cell subset provides an innate source of IL-22 for mucosal immunity[J]. Nature, 2008, 457(7230): 722–725. DOI:10.1038/nature07537 |
| [19] | SONNENBERG G F, ARTIS D. Innate lymphoid cells in the initiation, regulation and resolution of inflammation[J]. Nat Med, 2015, 21(7): 698–708. DOI:10.1038/nm.3892 |
| [20] | SONNENBERG G F, MONTICELLI L A, ALENGHAT T, et al. Innate lymphoid cells promote anatomical containment of lymphoid-resident commensal bacteria[J]. Science, 2012, 336(6086): 1321–1325. DOI:10.1126/science.1222551 |
| [21] | MORTHA A, CHUDNOVSKIY A, HASHIMOTO D, et al. Microbiota-dependent crosstalk between macrophages and ILC3 promotes intestinal homeostasis[J]. Science, 2014, 343(6178): 1249288. DOI:10.1126/science.1249288 |


