2. 650032 昆明, 成都军区昆明总医院: 病理实验科;
3. 650030 昆明, 云南省第二人民医院急诊科;
4. 655400 云南宣威, 云南省宣威市第一人民医院心胸外科
2. Department of Pathology, Kunming General Hospital of Chengdu Military Command, Kunming, Yunnan Province, 650032;
3. Department of Emergency, Second People's Hospital of Yunnan Province, Kunming, Yunnan Province, 650032;
4. Department of Cardiothoracic Surgery, First People's Hospital of Xuanwei, Xuanwei, Yunnan Province, 655400, China
肺癌是世界范围内发病率及病死率最高的恶性肿瘤之一[1]。近年来,肺腺癌的发病率有明显上升趋势,且预后不良[2]。研究表明肺腺癌可在早期发生转移[3],多数患者入院时可能在外周血中已经存在肿瘤细胞,这些在外周血中的癌细胞被称为循环肿瘤细胞(circulating tumor cell,CTC),由于多数肿瘤细胞并不具备在远处成瘤的能力,因此单纯检测CTC并不能有效评测患者的转移[4]。肿瘤干细胞学说[5-7]认为肿瘤细胞存在异质性,其中的肿瘤干细胞(cancer stem cell,CSCs)具有自我更新、分化、高致瘤的特征,是恶性肿瘤发生远处转移的关键[8-9]。因此,监测肺腺癌患者外周血中具有干性特征的CTC可以有效地判断预后和指导治疗[10]。目前有多种方法可以富集肿瘤患者外周血中的CTC,密度梯度离心是较为广泛应用的方式[11],但离心获得细胞为多种细胞混合,需要进一步对CTC进行标识。细胞角蛋白(cytokeratin,CK)普遍表达在上皮源性恶性肿瘤,可标记外周血中的肺腺癌细胞。近年来肿瘤干细胞的研究越来越受到重视,CD133是一个跨膜糖蛋白[12],表达在干细胞和肿瘤干细胞,是肺癌干细胞表面标志物[13-14]。本研究拟通过联合检测肺腺癌患者外周血CTC和肺癌干性标志物CD133 的表达,分析其临床意义,探寻肺腺癌患者的外周血监测方案。
1 材料与方法 1.1 样本收集与临床病理信息经医院伦理委员会批准,收集成都军区昆明总医院和宣威市第一人民医院住院肺腺癌手术病例。研究对象为肺腺癌患者外周血中的CTC及CD133 基因,用以诊断性研究,选用横断面调查,在手术前收集患者外周血用于检测。肺腺癌手术患者入选时间段为2014年6月至2016年6月,入组患者未进行术前化疗、放疗,手术后3个月内死亡与>80岁患者不纳入研究,共入组178例,中位年龄59岁,其中男性78例,女性100例。所有患者均经病理组织学确诊为肺腺癌,组织学分型参见国际肺癌研究协会/美国胸科协会的新分类[15],TNM分期方法参考第8版分期方法,临床病理资料详见表 1。手术前,收集患者术前外周血标本10 mL,5 mL制备琼脂糖细胞蜡块,进行CK免疫细胞化学染色,另5 mL血样提取DNA,进行PCR检测CD133 的表达。同时收集患者手术切除的肿瘤组织,用于病理形态学观察和免疫组化检测。
| 分组标准 | 数量 |
| 性别 | 178 |
| 男 | 78 |
| 女 | 100 |
| 年龄(岁) | |
| ≤60 | 84 |
| >60 | 94 |
| 临床分期 | |
| Ⅰ | 30 |
| Ⅱ | 64 |
| Ⅲ | 63 |
| Ⅳ | 21 |
| 肿瘤长径 | |
| ≤3 cm | 49 |
| >cm | 129 |
| 组织学级别 | |
| 高分化 | 21 |
| 中分化 | 115 |
| 低分化 | 42 |
| 区域淋巴结 | |
| N0 | 73 |
| N1 | 63 |
| N2-3 | 42 |
1.2 方法 1.2.1 制备细胞蜡块
将收集的静脉血5 mL,EDTA抗凝,用5 mL Hanks平衡液稀释,加入50 mL红细胞溶解液(贝源鑫生物),按说明书操作,充分混匀,快速离心后弃上清,加入2 mL Hanks液重悬,使用专用细胞块离心管(专利号2015 2 0543819.2,获赠于成都军区昆明总医院病理实验科赵稳兴副教授),将细胞悬液加入专用离心管的基质层表面,水域加热待基质胶液化后,离心使细胞富集在基质胶底层,常温下基质凝固,将基质从离心管推出,石蜡包埋,制备细胞蜡块,常规切片(3 μm)。A549细胞复苏,常规培养到4代,胰酶消化,10 mL培养液离心,用2 mL Hanks液重悬,使用专用细胞块离心管制备细胞蜡块(方法同前),常规切片(3 μm)。
1.2.2 细胞免疫组化实验检测外周血中细胞CK表达细胞蜡块切片,PBS漂洗次,加入小鼠抗人CK(即用型,福州迈新),4 oC过夜孵育,漂洗后,滴加二抗(福州迈新),37 ℃温箱孵育1 h,漂洗后DAB显微镜下显色,中性树胶封片。阳性对照为A549细胞系(肺腺癌细胞系,购自中科院细胞库)细胞蜡块切片20张,阴性对照为20例成年健康志愿者的外周血5 mL,操作步骤同上,光学显微镜下观察、照相。CTC阳性检测的判读标准为在细胞爬片上查见细胞质CK免疫组化呈棕黄色着色,并且阳性细胞大小>4个淋巴细胞。
1.2.3 PCR实验检测外周血CD133 基因表达将收集的5mL静脉血,EDTA抗凝,使用血液DNA提取系统(北京天根)提取DNA,按中量全血提取操作步骤,向5 mL血液中加入5 mL细胞裂解液CLA,颠倒混匀后离心,弃上清(缓慢操作,使用尖底离心管),然后加入现配的FGA与Proteinase K的混合液(3.3 mL),间断涡旋震荡并65 ℃水浴(30 min),加入3.3 mL异丙醇,充分上下混合至出现丝状或簇状物,离心、弃上清,然后加入5 mL 70%乙醇,涡旋振荡、离心、弃上清,空气干燥DNA沉淀,最后加入500 μL缓冲液TB,65 ℃加热溶解DNA。引物由英杰公司合成,CD133 (上游引物:TTACGGCACTCTTCACCT,下游引物:TATTCCACAAGCAGCAAA,β-actin为内参:(上游引物:TTGCGTTACACCCTTTCTTG,下游引物:CACCT-TCACCGTTCCAGTTT),PCR所用试剂购自TaKaRa公司。将扩增产物在1.5%琼脂糖凝胶中电泳,用凝胶成像系统(Gel Doc XR)分析CD133 产物。PCR检测CD133 ,将扩增CD133 产物与对应β-actin产物进行灰度值比值,大于阴性对照组为阳性组。PCR的对照为健康成年志愿者外周血样本。
1.2.4 免疫组化法检测肺腺癌组织中CK、Vim、TTF-1、Ki-67、CD133蛋白的表达手术切除标本均经4%中性福尔马林固定,常规脱水、包埋、切片。分别添加一抗CK、Vim、TTF-1、Ki-67(均为即用型,福州迈新)、CD133(即用型,中杉公司),过夜4 ℃孵育,漂洗后,滴加二抗(福州迈新),37 ℃温箱孵育1 h,漂洗后DAB显微镜下显色,中性树胶封片。用PBS代替一抗作空白对照。结果判读:由病理医师显微镜下判读,棕黄色染色为阳性着色,CK、Vim、CD133定位于细胞质,TTF-1和Ki-67定位于细胞核,采用半定量方法进行评分,Ki-67分界值参考既往文献[16]定义为25%。
1.3 统计学方法外周血CK免疫组化染色结果和CD133 基因的PCR结果判读为“阳性(+)”和“阴性(-)”,肺癌组织免疫组化检测结果采用半定量方法判读为“高表达”和“低表达”。临床病理因素数据使用计数资料(病例数),组间差异采用t检验或方差分析。统计分析采用SPSS 16.0软件。
2 结果 2.1 CK蛋白在肺腺癌患者外周血中的表达178例肺腺癌患者外周血细胞块共86例检出CK阳性(即循环肿瘤细胞,CTC),CTC的检出阳性率为48.3%。如图 1A所示,CTC(CK+大细胞)细胞质棕黄色染色,细胞类圆形,体积较大。淋巴细胞未见棕黄色着色,细胞较小。图 1B示肺腺癌A549细胞系CK呈细胞质棕黄色染色。
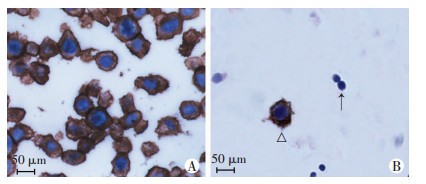
|
| △:示CK+大细胞,↑:示淋巴细胞 图 1 肺腺癌细胞系A549细胞(A)及外周血制备细胞块(B)中CK免疫组化染色结果 |
2.2 CD133 基因在肺腺癌患者外周血中的表达
30名成年健康志愿者(对照组)外周血中CD133 mRNA表达阳性率为16.5%(5/30) 平均灰度值为(0.158 9±0.070 2);178例肺腺癌患者术前外周血中CD133表达阳性率为66.6%(119/178),平均灰度值为(2.268 0±0.515 5);肺腺癌患者外周血中CD133 基因表达显著高于健康组(P < 0.05),见图 2。
|
| ↑:示肺腺癌细胞 图 2 肺腺癌组织免疫组化染色结果 |
2.3 肺腺癌外周血中CK表达、CD133 表达与癌组织中CK、Vim、TTF-1、Ki-67、CD133表达的关系
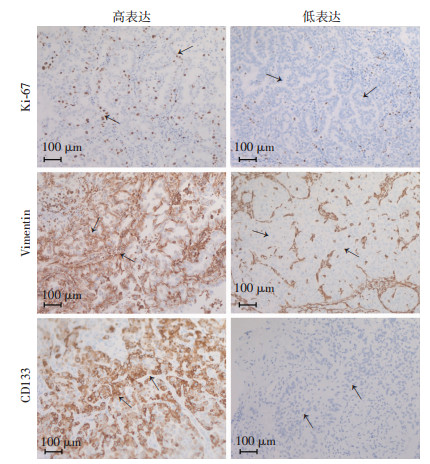
178例肺腺癌组织中免疫组化染色:71例Ki-67高表达(图 3),74例Vim高表达(图 3),98例检出CD133高表达(图 3)。肺腺癌外周血中CK阴性组病例中Ki-67高表达30例,CK阳性组病例中Ki-67高表达41例,两组间有显著差异(P < 0.05)。肺腺癌外周血中CK阴性组病例中Vim高表达29例,CK阳性组病例中Vim高表达45例,两组间有显著差异(P < 0.05)。肺腺癌外周血中CD133 阴性组病例中Vim高表达17例,CK阳性组病例中Vim高表达57例,两组间有显著差异(P < 0.05)。外周血CD133 检测阴性组中有20例病例肺癌组织中CD133呈高表达,CD133 阳性组病例中CD133 高表达78例,两组间有显著差异(P < 0.05)。外周血中CD133 基因表达与癌组织中CK、TTF-1、Ki-67表达无相关性,与Vim表达、CD133表达呈正相关。
| 分组标准 | n | CK | P | CD133 | P | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||
| 性别 | |||||||
| 男 | 78 | 36 | 42 | 0.610 | 55 | 23 | 0.360 |
| 女 | 100 | 50 | 50 | 64 | 36 | ||
| 年龄(岁) | |||||||
| ≤60 | 84 | 35 | 49 | 0.093 | 59 | 25 | 0.037 |
| >60 | 94 | 51 | 43 | 60 | 34 | ||
| 临床分期 | |||||||
| Ⅰ | 30 | 10 | 20 | 0.029 | 15 | 15 | 0.088 |
| Ⅱ | 64 | 26 | 38 | 46 | 18 | ||
| Ⅲ | 63 | 36 | 27 | 46 | 17 | ||
| Ⅳ | 21 | 14 | 7 | 12 | 9 | ||
| 肿瘤大小 | |||||||
| ≤3 cm | 49 | 19 | 30 | 0.117 | 34 | 15 | 0.658 |
| >3 cm | 129 | 67 | 62 | 85 | 44 | ||
| 组织学级别 | |||||||
| 高分化 | 21 | 8 | 13 | 10 | 11 | ||
| 中分化 | 115 | 54 | 61 | 0.321 | 79 | 36 | 0.130 |
| 低分化 | 42 | 24 | 18 | 30 | 12 | ||
| 区域淋巴结 | |||||||
| N0 | 73 | 29 | 44 | 41 | 32 | ||
| N1 | 63 | 31 | 32 | 0.071 | 45 | 18 | 0.031 |
| N2-3 | 42 | 26 | 16 | 33 | 9 | ||
| 因素 | n | CK/CD133 | P | |
| 双阳性组 | 非双阳性组 | |||
| 性别 | ||||
| 男 | 78 | 21 | 57 | 0.462 |
| 女 | 100 | 32 | 68 | |
| 年龄(岁) | ||||
| ≤60 | 84 | 28 | 56 | 0.326 |
| >60 | 94 | 25 | 69 | |
| 临床分期 | ||||
| Ⅰ | 30 | 4 | 26 | |
| Ⅱ | 64 | 17 | 47 | 0.031 |
| Ⅲ-Ⅳ | 84 | 32 | 52 | |
| 肿瘤大小 | ||||
| ≤3 cm | 49 | 10 | 39 | 0.092 |
| >3 cm | 129 | 43 | 86 | |
| 组织学级别 | ||||
| 高分化 | 21 | 2 | 19 | |
| 中分化 | 115 | 30 | 85 | 0.001 |
| 低分化 | 42 | 21 | 21 | |
| 区域淋巴结 | ||||
| N0 | 73 | 12 | 61 | |
| N1 | 63 | 25 | 38 | 0.005 |
| N2-3 | 42 | 16 | 26 | |
2.4 肺腺癌外周血CK表达、CD133 表达与临床病理因素的关系
外周血CK表达与临床分期呈统计学相关(P=0.029),随阳性表达增多,区域淋巴结转移率增高,与性别、年龄、肿瘤大小、组织学分级无关。外周血CD133 基因表达与区域淋巴结转移率呈统计学相关(P=0.031),与患者年龄相关(P=0.037)。
2.5 肺腺癌患者外周血CTC阳性检出组中CD133 表达与临床病理因素的关系外周血86例检出CTC,其中53例CD133 阳性,即CK+/CD133 +双阳组53例,非双阳性组125例,CK+/CD133 +双阳性组的临床分期显著增高(P=0.031),组织学分级显著降低(P=0.001),区域淋巴结转移率显著增高(P=0.005)。
2.6 肺腺癌外周血CK+/CD133 +双阳组的随访复检结果及转移率分析外周血CK+/CD133 +双阳组53例,电话定期随访,失访7人,余46例,1年后复测外周血CK及CD133 表达:46例中31例双阳性,31例双阳性组21例转移,比率67.7%;15例非双阳性组4例转移(26.7%),其余104例(失访21例)中15例转移(14.4%)。外周血CK+/CD133 +双阳组患者转移率显著增高(P < 0.05)。
3 讨论近年来,肺腺癌发病率有明显上升趋势,且预后不良[2]。肺腺癌患者的症状体征常不典型,患者入院时可能在外周血中已经存在肿瘤细胞,这些在外周血中的癌细胞被称为CTC,显然这些细胞与肺腺癌的预后不良密切相关,但后续的研究发现单纯检测CTC并不能有效评测患者的转移[4]。新近研究提出肿瘤细胞存在异质性,其中肿瘤干细胞具有自我更新、分化以及强大的成瘤能力[8],有报道单个肿瘤干细胞可以成瘤[9]。因此我们认为血液中具有干性功能的CTC才是肺腺癌发生远处转移,导致预后不良的关键。
目前CTC的检测方法有免疫细胞化学、流式细胞术、PCR、检测芯片等[17-18]。由于受临床使用成本及技术复杂的限制,流式细胞术和检测芯片技术的推广受限。PCR的敏感性和特异性都很高,但易产生假阳性结果。免疫细胞化学法是指以显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和细胞化学的呈色反应,其综合了免疫反应的特异性、组织化学的可见性,有较好的使用价值。外周血收集CTC常用密度梯度离心法[11],离心所得细胞同时包括有外周血淋巴细胞,为标识肺腺癌患者外周血中的CTC细胞,本文使用细胞蜡块法,并用CK标记CTC,结果显示腺癌患者外周血CK阳性的CTC检出比率为48.3%,与文献[19]报道基本一致。而20例成年健康志愿者的外周血细胞块均未检出CTC,表明本研究采用的方法具有较高的特异性,将细胞块和免疫细胞化学技术结合可以有效检测肺腺癌患者外周血中的循环肿瘤细胞。
肿瘤干细胞是恶性肿瘤的“种子”,是肿瘤复发、转移的关键[9],具有干性特征的循环肿瘤细胞是发生转移的祸首。CD133表达在干细胞和肿瘤干细胞[20-22],是肺癌干细胞的标记物[14]。为检测肺腺癌患者外周血的肿瘤干性特征,我们提取了肺腺癌患者外周血中的DNA,进行CD133 基因检测,PCR检测结果显示CD133 阳性表达率为66.9%,外周血检测结果与肺腺癌组织中CD133蛋白的表达有较好的一致性,表明外周血中CD133 基因检测可较好地反应肺腺癌的干性特征。我们将外周血CK检测结果和CD133 基因检测结果组合,将CK/CD133 双阳性组定义为具有干性特征的CTC。结果显示外周血CK/CD133 双阳组的淋巴结转移率显著增高(P < 0.05),肺腺癌细胞组织学分化级别显著降低(P < 0.05),肺腺癌患者临床分期显著提高(P < 0.05),并且转移率显著增高(P < 0.05)。
综上,肺腺癌外周血中CK与CD133 双阳性表达,提示患者存在具有干性特征的循环肿瘤细胞并预后不良。检测外周血CK与CD133 的方法简易,检出敏感性和特异性均较好,可用于判断肺腺癌患者预后和检测治疗效果。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | HANAGIRI T, BABA T, SO T, et al. Time trends of surgical outcome in patients with non-small cell lung cancer[J]. Journal of Thoracic Oncology, 2010, 5(6): 825–829. DOI:10.1097/JTO.0b013e3181d5e47f |
| [3] | MOLINA JR, YANG P, CASSIVI SD, et al. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clin Proc, 2008, 83(5): 584–594. DOI:10.1016/S0025-6196(11)60735-0 |
| [4] | ZHOU L, DICKER D T, MATTHEW E, et al. Circulating tumor cells: silent predictors of metastasis[J]. F1000Res, 2017, 6: 1445. DOI:10.12688/f1000redearch.11313.1 |
| [5] | REYA T, MORRISON S J, CLARKE F, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001, 414(6859): 105–111. DOI:10.1038/35102167 |
| [6] | BURKERT J, WRIGHT N A, ALISON M R. Stem cells and cancer: an intimate relationship[J]. J Pathol, 2006, 209(3): 287–297. DOI:10.1002/path.2016 |
| [7] | LOBO N A, SHIMONO Y, QIAN D, et al. The biology of cancer stem cells[J]. Annu Rev Cell Dev Biol, 2007, 23: 675–699. DOI:10.1146/annurev.cellbio.22.010305.104154 |
| [8] | MENDOZA M, KHANNA C. Revisiting the seed and soil in cancer metastasis[J]. Int J Biochem Cell Biol, 2009, 41(2009): 1452–1462. DOI:10.1016/j.biocel.2009.01.015 |
| [9] | BRYAN C, BARNHAR1 M C S. Metastasis and stem cell pathways[J]. Cancer Metastasis Rev, 2007, 26(2): 261–271. DOI:10.1007/s10555-007-9053-3 |
| [10] | KOREN A, MOTALN H, CUFER T. Lung cancer stem cells: a biological and clinical perspective[J]. Cell Oncol (Dordr), 2013, 36(4): 265–275. DOI:10.1007/s13402-013-0141-9 |
| [11] | FEHM T, SOLOMAYER E F, MENG S, et al. Methods for isolating circulating epithelial cells and criteria for their classification as carcinoma cells[J]. Cytotherapy, 2005, 7(2): 171–185. DOI:10.1080/14653240510027082 |
| [12] | YIN A H, MIRAGLIA S, ZANJANI E D, et al. AC133, a novel marker for human hematopoietic stem and progenitor cells[J]. Blood, 1997, 90(12): 5002–5012. |
| [13] | WU H, QI XW, YAN GN, et al. Is CD133 expression a prognostic biomarker of non-small-cell lung cancer? a systematic review and meta-analysis[J]. PLoS ONE, 2014, 9(6): e100168. DOI:10.1371/journal.pone.0100168 |
| [14] | TIRINO V, CAMERLINGO R, FRANCO R, et al. The role of CD133 in the identification and characterisation of tumour-initiating cells in non-small-cell lung cancer[J]. Eur J Cardiothorac Surg, 2009, 36: 446–453. DOI:10.1016/j.ejcts.2009.03.063 |
| [15] | TRAVIS W D, BRAMBILLA E, NOGUCHI M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol, 2011, 6(2): 244–285. DOI:10.1097/JTO.0b013e318206a221 |
| [16] | CIANCIO N, GALASSO M G, CAMPISI R, et al. Prognostic value of p53 and Ki67 expression in fiberoptic bronchial biopsies of patients with nonsmall cell lung cancer[J]. Multidisciplinary Respiratory Medicine, 2012, 7(1): 29. DOI:10.1186/2049-6958-7-29 |
| [17] | MARCHETTI A, DEL GRAMMASTRO M, FELICIONI L, et al. Assessment of EGFR mutations in circulating tumor cell preparations from NSCLC patients by next generation sequencing:toward a real-time liquid biopsy for treatment[J]. PLoS ONE, 2014, 9(8): e103883. DOI:10.1371/journal.pone.0103883 |
| [18] | HANSSEN A, LOGES S, PANTEL K, et al. Detection of circulating tumor cells in non-Small cell lung cancer[J]. Front Oncol, 2015, 5(207): 1–5. DOI:10.3389/fonc.2015.00207 |
| [19] | HOFMAN V, ILIE M I, LONG E, et al. Detection of circulating tumor cells as a prognostic factor in patients undergoing radical surgery for non-small-cell lung carcinoma: comparison of the efficacy of the CellSearch Assay? and the isolation by size of epithelial tumor cell method[J]. International Journal of Cancer, 2011, 129(7): 1651–60. DOI:10.1002/ijc.25819 |
| [20] | ZEPPERNICK F, AHMADI R, CAMPOS B, et al. Stem cell marker CD133 affects clinical outcome in glioma patients[J]. Clin Cancer Res, 2008, 14(1): 123–129. DOI:10.1158/1078-0432.CCR-07-0932 |
| [21] | WOO T, OKUDELA K, MITSUI H, et al. Prognostic value of CD133 expression in stage Ⅰ lung adenocarcinomas[J]. International Journal of Clinical and Experimental Pathology, 2011, 4(1): 32–42. |
| [22] | WEN L, CHEN X Z, YANG K, et al. Prognostic value of cancer stem cell marker CD133 expression in gastric cancer: a systematic review[J]. PLoS ONE, 2013, 8(3): e59154. DOI:10.1371/journal.pone.0059154 |



