2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院药学部
2. Department of Pharmacy, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
鲍曼不动杆菌是引起院内感染的重要机会致病菌,特别是住ICU病房的患者[1]。由于具有天然和获得性耐药性,鲍曼不动杆菌不仅引起医院感染暴发流行,而且导致患者高致病率和死亡率[2]。碳青霉烯类抗菌药物对大部分β-内酰胺酶高度稳定,有较强的青霉素结合蛋白亲和力,是治疗耐药不动杆菌重症感染的首选药物[3]。然而近年来耐碳青霉烯类鲍曼不动杆菌的增加使该类药物在临床的应用受到了严峻的挑战,因此可供选择治疗鲍曼不动杆菌感染的抗菌药物越来越少,从而导致多重耐药菌、泛耐药菌的大量出现。鲍曼不动杆菌在患者呼吸道内定殖是其最常见的感染途径,是患者发病和死亡的主要原因[4]。我院呼吸科鲍曼不动杆菌的分离率和耐药率比较高,且有逐年增加的趋势,已经引起临床医师的高度重视[5]。目前很多文献研究院内感染患者特别是ICU患者感染鲍曼不动杆菌的耐药性和耐药机制[6-7],然而关于呼吸科鲍曼不动杆菌感染的流行病学研究报道很少。虽然我们前期研究了呼吸科ICU患者感染鲍曼不动杆菌的耐药性和流行病学特征[8],但是ICU患者比普通住院患者更易获得院内感染,不能代表呼吸科鲍曼不动杆菌的整体耐药特性。因此本研究以我院呼吸科鲍曼不动杆菌为研究对象,考察其耐药性和流行病学特征,为临床进行更有效的感染控制提供理论依据。
1 材料与方法 1.1 实验菌株2015年1-12月陆军军医大学第一附属医院呼吸科住院患者共3 368例,男性1 888例,女性1 480例,平均年龄61.4(14~96)岁。从住院感染患者送检标本中分离出69株鲍曼不动杆菌,其中痰液42株,伤口泌物8株,腹水6株,血液5株,导管3株,胆汁2株,灌洗液2株,脑脊液1株,剔除同一患者的重复菌株。本研究只包括住院48 h后出现感染的患者,患者的临床资料从西南医院电子病历系统获得。本研究获第三军医大学西南医院医学伦理委员会批准(审批号:KY200508)。质控菌株ATCC25922和ATCC27853保存于陆军军医大学第一附属医院临床药理基地。
1.2 抗菌药物哌拉西林(批号:130419-201606)、头孢他啶(批号:130484-201205)、头孢吡肟(批号:130524-201404)、庆大霉素(批号:130326-201015)、妥布霉素(批号:130527-200402)、环丙沙星(批号:130451-201203)、左氧氟沙星(批号:130455-201106)、阿米卡星(批号:130335-200204)、美洛培南(批号:130506-201403)、米诺环素(批号:130514-200401)购自中国食品药品检定研究院。亚胺培南(批号:64221-86-9)购自美国Sigma公司。
1.3 最低抑菌浓度(minimal inhibitory concentration,MIC)的检测采用琼脂平板倍比稀释法检测鲍曼不动杆菌MIC。鲍曼不动杆菌划线接种于血琼脂平板,放置37 ℃孵箱培养过夜。用接种环挑取单菌落至盐水管,将细菌比浊至0.5个麦氏单位(约108CFU/mL)。抗菌药物用生理盐水进行倍比稀释后,取1 mL加到培养皿中,然后加入M-H培养基使其药物终浓度为0.25~256 μg/mL。用多点接种仪将稀释菌液接种至含不同浓度药物的M-H琼脂平板上,37 ℃培养18 h。MIC结果判读参照美国临床实验室标准化协会(CLSI)2016年标准进行。大肠杆菌ATCC25922和铜绿假单胞菌ATCC27853作为药敏质控菌株。
1.4 碳青霉烯酶耐药基因检测取100 μL鲍曼不动杆菌过夜培养物加至10 mL LB,37 ℃、180 r/min条件下振荡培养18 h。细菌DNA提取按照DNA抽提试剂盒说明书进行。采用Primer Premier 6.0软件设计碳青霉烯酶基因引物,引物序列见表 1。PCR反应体系(20 μL):2×Es Taq Master Mix 10 μL,上下游引物各0.3 μL,DNA 0.4 μL,ddH2O 9 μL。扩增条件:94 ℃ 5 min,94 ℃ 30 s;52~56 ℃ 30 s;72 ℃ 30 s;共35个循环,最后72 ℃延伸10 min。扩增完毕,PCR反应产物进行琼脂糖凝胶电泳检测,选取阳性产物进行纯化和测序。测序结果在NCBI上进行BLAST比对。
| 基因 | 引物序列(5′→3′) | 长度 (bp) |
扩增温度 (℃) |
| IMP | GGAATAGAGTGGCTTAAYTCTC GGTTTAAYAAAACAACCACC |
232 | 56 |
| VIM | GATGGTGTTTGGTCGCATA CGAATGCGCAGCACCAG |
390 | 52 |
| NDM | GGTTTGGCGATCTGGTTTTC CGGAATGGCTCATCACGATC |
621 | 56 |
| SPM | AAAATCTGGGTACGCAAACG ACATTATCCGCTGGAACAGG |
271 | 52 |
| KPC | GTATCGCCGTCTAGTTCTGC GGTCGTGTTTCCCTTTAGCC |
638 | 56 |
| GES | GCTTCATTCACGCACTATT CGATGCTAGAAACCGCTC |
323 | 52 |
| OXA-23 | GATCGGATTGGAGAACCAGA ATTTCTGACCGCATTTCCAT |
501 | 56 |
| OXA-51 | TAATGCTTTGATCGGCCTTG TGGATTGCACTTCATCTTGG |
353 | 52 |
| OXA-24 | GGTTAGTTGGCCCCCTTAAA AGTTGAGCGAAAAGGGGATT |
246 | 52 |
| OXA-48 | TTGGTGGCATCGATTATCGG GAGCACTTCTTTTGTGATGGC |
744 | 52 |
| OXA-58 | AAGTATTGGGGCTTGTGCTG CCCCTCTGCGCTCTACATAC |
599 | 56 |
1.5 脉冲场凝胶电泳分型 1.5.1 胶块制备
取1 mL鲍曼不动杆菌过夜培养物离心去除上清,然后用1 mL TE Buffer洗涤沉淀后加入180 μL EC Buffer和20 μL溶菌酶,充分涡旋混匀,37 ℃孵育至澄清。制备1% AgaroseⅢ TM凝胶并保温于54 ℃水浴中。在菌悬液中加入10 μL蛋白酶K,颠倒混匀后再快速加入200 μL琼脂糖液,混匀。快速吸取200 μL混合液加入模具相应的孔道中,4 ℃冰箱凝固5 min。将胶块转移至含有1 mL CLB/蛋白酶K混合液的1.5 mL EP管中,54 ℃孵育至澄清。孵育完毕,倒掉混合液,加入1 mL预热ddH2O,54 ℃孵育15 min。倒掉水,加入1 mL预热TE Buffer,54 ℃洗涤3次,孵育时间分别为15、15 min和30 min。洗涤完毕后加入1 mL常温TE Buffer,4 ℃冰箱保存备用。
1.5.2 胶块内DNA酶切取1/3制备好的胶块放入酶切管中,加入100 μL酶切缓冲液,37 ℃保温15 min。用移液器将酶切液吸除干净,加入100 μL ApaⅠ内切酶混合液,37 ℃保温5 h。
1.5.3 加样吸出内切酶混合液,加入100 μL 0.5× TBE冲洗胶块,小心吸出。梳子平放于桌面,将胶块放在梳齿上,然后将梳子放入制胶槽,确保胶块底部与制胶板底部轻触。加入1%电泳胶液,室温放置30 min使胶块凝固。
1.5.4 电泳在电泳槽中加入2.2 L 0.5×TBE电泳缓冲液,接通电源,设置电泳参数:线性范围20~300 kb,电压6 V/s,脉冲角度120°,脉冲始末转化时间为5~30 s,电泳20 h。电泳完毕用EB染色30 min,H2O洗涤2次,每次30 min。
1.5.5 结果判读通过BioNumerics version 6.6软件对结果进行聚类分析,将同源性超过80%(即图谱相同或相差不超过2~3个条带)定义为同一型。
1.6 统计学分析采用SPSS 17.0软件对数据进行统计分析。鲍曼不动杆菌感染与非鲍曼不动杆菌感染患者之间的差异性采用χ2检验,住院时间采用Mann-Whitney U检验,检验水准α=0.05。
2 结果 2.1 鲍曼不动杆菌感染患者临床特征我院呼吸科住院患者共3 368例,感染率为16.4% (553/3 368),鲍曼不动杆菌感染率为2.0%。鲍曼不动杆菌感染患者平均年龄为67.5(14~93)岁,住院时间为(17.4±12.6)d。鲍曼不动杆菌感染患者的临床特征见表 2。与非鲍曼不动杆菌感染患者相比,鲍曼不动杆菌感染患者在呼吸机使用、住院前抗菌药物使用及住院时间上差异具有统计学意义(P < 0.001)。
| 组别 | n | 性别[%(n)] | 年龄[岁,%(n)] | 呼吸机使用[%(n)] | 住院前抗菌药物使用 [%(n)] |
中心静脉导管使用 [%(n)] |
尿管使用 [%(n)] |
住院时间 (d,x±s) |
||||
| 男 | 女 | < 18 | 18~65 | >65 | ||||||||
| 鲍曼不动杆菌感染组 | 69 | 60.9(42) | 39.1(27) | 2.9(2) | 36.2(25) | 60.9(42) | 33.3(23) | 76.8(53) | 37.7(26) | 21.7(15) | 17.4±12.6 | |
| 非鲍曼不动杆菌感染组 | 3 299 | 56.0(1 846) | 44.0(1 453) | 8.7(286) | 34.5(1 137) | 56.9(1 876) | 10.3(341) | 50.7(1 673) | 32.3(1 065) | 15.5(511) | 11.5±12.8 | |
| P | 0.416 | 0.237 | < 0.001 | < 0.001 | 0.343 | 0.157 | < 0.001 | |||||
2.2 鲍曼不动杆菌MIC测定结果
鲍曼不动杆菌对抗菌药物的耐药性见表 3。鲍曼不动杆菌对大多数抗菌药物具有较高的耐药性,而对米诺环素的敏感性较高,耐药率为26.1%。
| 抗菌药物 | 耐药率(n=69) [%(n)] |
MIC范围 (μg/mL) |
MIC90 (μg/mL) |
| 哌拉西林 | 92.8(64) | 64~>256 | >256 |
| 头孢他啶 | 84.1(58) | 4~>256 | >256 |
| 头孢吡肟 | 81.2(56) | 2~>256 | 256 |
| 庆大霉素 | 71.0(49) | < 0.25~128 | 64 |
| 妥布霉素 | 73.9(51) | < 0.25~256 | 128 |
| 环丙沙星 | 76.8(53) | < 0.25~128 | 128 |
| 左氧氟沙星 | 75.4(52) | < 0.25~128 | 128 |
| 阿米卡星 | 62.3(43) | 8~>256 | >256 |
| 亚胺培南 | 73.9(51) | < 0.25~256 | 128 |
| 美洛培南 | 78.3(54) | < 0.25~>256 | 256 |
| 米诺环素 | 26.1(18) | < 0.25~64 | 32 |
2.3 碳青霉烯酶基因检测
所有鲍曼不动杆菌菌株均携带OXA-51基因,51株携带OXA-23基因,13株携带VIM基因,2株携带IMP-4基因,而未检测到其他碳青霉烯酶耐药基因。
2.4 PFGE分型根据电泳产生条带的位置和数量不同,69株鲍曼不动杆菌共分为9个型和19个亚型(图 1)。其中D型和H型在院内感染比较广泛流行,分别占24.6%(17株)和17.4%(12株);其中D2亚型有15株,H1亚型有8株。其他基因型菌株均为散发株,菌株数在1~5株之间。
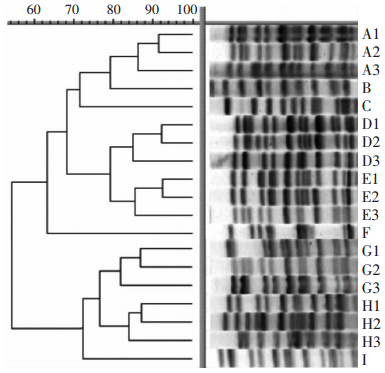
|
| 图 1 鲍曼不动杆菌MLST分型 |
3 讨论
鲍曼不动杆菌广泛分布于自然界、医院环境及健康人体皮肤表面,在临床标本分离中仅次于铜绿假单胞菌,常引起体弱和免疫力低下患者的呼吸道、泌尿道、血液及伤口等感染[9-11]。在呼吸科,由于住院患者年龄较大,身体免疫力低下且其病情反复发作,长期大量使用抗菌药物,因此极易感染鲍曼不动杆菌。在本研究中,鲍曼不动杆菌感染患者临床特征结果显示,呼吸机使用、抗菌药物使用及住院天数是其感染的危险因素,这与文献[12-13]报道一致。因此,对于具有以上危险因素的患者,我们应采取有效的感染控制策略并合理使用抗菌药物。
近年来,随着抗菌药物的大量使用,鲍曼不动杆菌耐药率明显上升,多重耐药菌不断出现,给临床治疗带来了巨大困难。2015年全国耐药监测网显示,鲍曼不动杆菌对碳青酶烯耐药率为59.0%,对亚胺培南耐药率为58.0%,相比2012年对亚胺培南的耐药率增长12.2%。因此,耐药鲍曼不动杆菌严重威胁着人类健康。在本研究中,除米诺环素外,鲍曼不动杆菌对其他抗菌药物均具有较高的耐药性,耐药率大于60%,这与国内外报道类似[14-15]。然而由于米诺环素具有一定的毒副作用,在国内临床治疗中很少使用。结果表明我院鲍曼不动杆菌耐药形势严峻,临床抗菌药物选择有限。最近虽然有研究表明多粘菌素与碳青霉烯类(美洛培南或多利培南)抗菌药物联合应用在体外对多重耐药鲍曼不动杆菌具有协同作用[16-17],然而抗菌药物的过度使用和滥用促进了多重耐药鲍曼不动杆菌在医院暴发流行,因此全球在合理使用抗生素方面应作出努力以减少多重耐药鲍曼不动杆菌的出现。
鲍曼不动杆菌对碳青霉烯类抗菌药物耐药的主要机制包括:产生β-内酰胺酶(主要为B类和D类β-内酰胺酶)、药物作用靶位的改变、外膜通透性的改变及外排泵的过度表达[18]。而产碳青霉烯酶是鲍曼不动杆菌耐药最关键的因素,其中以OXA碳青霉烯酶最为普遍[19]。OXA-51和OXA-23是最流行的D类β-内酰胺酶基因,在本研究中所有菌株含有OXA-51基因,73.9%菌株含有OXA-23基因。此外,我们还检出VIM和IMP B类β-内酰胺酶基因。前期我们研究发现我院呼吸科ICU鲍曼不动杆菌含有IMP基因,但并没有检出VIM基因[8]。而GONG等[6]研究发现我院烧伤科ICU鲍曼不动杆菌含有VIM基因,而没有检出IMP基因。本研究β-内酰胺酶高检出率解释了鲍曼不动杆菌对测试抗菌药物高耐药的原因。PFGE具有重复性好、分辨率高、易比较的优点,通常被认为是细菌流行病学分型的“黄金标准”,可以作为鲍曼不动杆菌院内感染暴发流行检测的有力工具。PFGE结果显示69株细菌共有9个基因型,其中D型和H型是流行型,其他分型菌株均为散发状态。这与其他文献报道鲍曼不动杆菌感染具有较高同源性一致[20]。此外,D2和H1亚型菌株分别有12和8株,根据在医疗机构或其科室的患者中短时间内发生3例以上同种同源感染病例的现象即为医院感染暴发[21],提示我院呼吸科鲍曼不动杆菌存在小规模的暴发流行。此外,OXA-23、VIM和IMP基因分布于不同的基因型,同一个基因型上含有不同的基因,提示鲍曼不动杆菌耐药基因存在水平传播。本研究分析我院呼吸科分离鲍曼不动杆菌的流行病学特征及其感染的危险因素,虽然研究的时间跨度较短且仅纳入呼吸科的分离菌株,但其可以体现我院鲍曼不动杆菌的耐药和流行特征,为我院鲍曼不动杆菌的治疗和感染控制政策的制定提供理论依据。
| [1] | HOWARD A, OƊONOGHUE M, FEENEY A, et al. Acinetobacter baumannii: an emerging opportunistic pathogen[J]. Virulence, 2012, 3(3): 243–250. DOI:10.4161/viru.19700 |
| [2] | PEREZ F, HUJER A M, HUJER K M, et al. Global challenge of multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2007, 51(10): 3471–3484. DOI:10.1128/AAC.01464-06 |
| [3] |
施腾飞, 陈惠瑜, 刘银环, 等. 福州地区碳青霉烯类耐药鲍曼不动杆菌碳青霉烯酶基因型研究[J].
中国微生态学杂志, 2017, 29(2): 155–158.
SHI T F, CHEN H Y, LIU Y H, et al. The genotypes of carbapenemases in carbapenem-resistant Acinetobacter baumannii in fuzhou area[J]. Chin J Microecol, 2017, 29(2): 155–158. DOI:10.13381/j.cnki.cjm.201702008 |
| [4] | SHETE V B, GHADAGE D P, MULEY V A, et al. Multi-drug resistant Acinetobacter ventilator-associated pneumonia[J]. Lung India, 2010, 27(4): 217–220. DOI:10.4103/0970-2113.71952 |
| [5] |
孙凤军, 戴晓天, 冯伟, 等. 2003-2011年某院呼吸科病原菌的分布及耐药性分析[J].
重庆医学, 2015, 44(14): 1931–1933.
SUN F J, DAI X T, FENG W, et al. Analysis on distribution and drug resistance of pathogens in respiratory department from 2003 to 2011[J]. Chongqing Med, 2015, 44(14): 1931–1933. DOI:10.3969/j.issn.1671-8348.2015.14.022 |
| [6] | GONG Y, SHEN X, HUANG G, et al. Epidemiology and resistance features of Acinetobacter baumannii isolates from the ward environment and patients in the burn ICU of a Chinese hospital[J]. J Microbiol, 2016, 54(8): 551–558. DOI:10.1007/s12275-016-6146-0 |
| [7] | SUN F, OU Q, WANG Q, et al. The resistance and transmission mechanism of Acinetobacter baumannii isolates in a tertiary care hospital, China[J]. J Chemother, 2016, 28(6): 476–481. DOI:10.1080/1120009X.2016.1139335 |
| [8] | DAI X T, SUN F J, CHEN Z H, et al. The epidemiology and resistance mechanisms of Acinetobacter baumannii isolates from the respiratory department ICU of a hospital in China[J]. Microb Drug Resist, 2014, 20(6): 618–622. DOI:10.1089/mdr.2014.0005 |
| [9] | DIJKSHOORN L, NEMEC A, SEIFERT H. An increasing threat in hospitals: multidrug-resistant Acinetobacter baumannii[J]. Nat Rev Microbiol, 2007, 5(12): 939–951. DOI:10.1038/nrmicro1789 |
| [10] | RAMOS T, DEDESKO S, SIEGEL J A, et al. Spatial and temporal variations in indoor environmental conditions, human occupancy, and operational characteristics in a new hospital building[J]. PLoS ONE, 2015, 10(3): e0118207. DOI:10.1371/journal.pone.0118207 |
| [11] | LUO T L, RICKARD A H, SRINIVASAN U, et al. Association of blaOXA-23 and bap with the persistence of Acinetobacter baumannii within a major healthcare system[J]. Front Microbiol, 2015, 6: 182. DOI:10.3389/fmicb.2015.00182 |
| [12] | JI Y J, PARK M S, SONG E K, et al. Risk factors for multi-drug resistant Acinetobacter baumannii bacteremia in patients with colonization in the intensive care unit[J]. BMC Infectious Dis, 2010, 10(1): 228. DOI:10.1186/1471-2334-10-228 |
| [13] |
马明远, 徐杰, 于娜, 等. 综合ICU内鲍曼不动杆菌的耐药性和相关因素分析[J].
中华危重病急救医学, 2013, 25(11): 686–689.
MA M Y, XU J, YU N, et al. Analysis of drug resistance of Acinetobacter baumannii and its related factors in ICU[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2013, 25(11): 686–689. DOI:10.3760/cma.j.issn.2095-4352.2013.11.012 |
| [14] | ZHENG W, YUAN S, LI L. Analysis of hospital departmental distribution and antibiotic susceptibility of Acinetobacter isolated from sputum samples[J]. Am J Infect Control, 2013, 41(8): e73–e76. DOI:10.1016/j.ajic.2012.11.004 |
| [15] | YAN Z Q, SHEN D X, CAO J R, et al. Susceptibility patterns and molecular epidemiology of multidrug-resistant Acinetobacter baumannii strains from three military hospitals in China[J]. Int J Antimicrob Agents, 2010, 35(3): 269–273. DOI:10.1016/j.ijantimicag.2009.10.016 |
| [16] | PARK G C, CHOI J A, JANG S J, et al. In vitro interactions of antibiotic combinations of colistin, tigecycline, and doripenem against extensively drug-resistant and multidrug-resistant Acinetobacter baumannii[J]. Ann Lab Med, 2016, 36(2): 124–130. DOI:10.3343/alm.2016.36.2.124 |
| [17] | MINH V L, NHU N T K, PHAT V V, et al. In vitro activity of colistin in antimicrobial combination against carbapenem-resistant Acinetobacter baumannii isolated from patients with ventilator-associated pneumonia in Vietnam[J]. J Med Microbiol, 2015, 64(10): 1162–1169. DOI:10.1099/jmm.0.000137 |
| [18] | POGUE J M, MANN T, BARBER K E, et al. Carbapenem-resistant Acinetobacter baumannii: epidemiology, surveillance and management[J]. Expert Rev Anti Infect Ther, 2013, 11(4): 383–393. DOI:10.1586/eri.13.14 |
| [19] | OPAZO A, DOMÍNGUEZ M, BELLO H, et al. OXA-type carbapenemases in Acinetobacter baumannii in South America[J]. J Infect Dev Ctries, 2012, 6(4): 311–316. DOI:10.3855/jidc.2310 |
| [20] |
王振, 黄文祥, 辛小娟, 等. 泛耐药鲍曼不动杆菌医院感染流行病学研究[J].
第三军医大学学报, 2011, 33(21): 2244–2248.
WANG Z, HUANG W X, XIN X J, et al. Epidemiological study on nosocomial infection of Acinetobacter baumannii[J]. J Third Mil Med Univ, 2011, 33(21): 2244–2248. |
| [21] | CHEN H, YUEHUA X, SHEN W, et al. Epidemiology and resistance mechanisms to imipenem in Klebsiella pneumoniae: a multicenter study[J]. Mol Med Rep, 2013, 7(1): 21–25. DOI:10.3892/mmr.2012.1155 |



