结直肠癌是一种常见的消化系统恶性肿瘤。最新数据统计,结直肠癌的发病率为恶性肿瘤的第3位,死亡率分别为男女性恶性肿瘤的第2位和第3位[1]。尽管近年来结直肠癌的诊断和治疗取得了一定的成果,但结直肠癌早期不易诊断,且多数患者就诊时已处于中晚期或发生转移,5年生存率仅有11.7%[2-3]。因此,不断研究新的肿瘤分子标志物和作用机制来提高结直肠癌早期诊断和治愈率十分重要。TCEAL7[transcription elongation factor A(SⅡ)like 7]属于TCEAL家族成员之一,DNA全长2 138 bp,编码100个氨基酸,是通过基因芯片研究卵巢上皮细胞及癌细胞、早期及晚期卵巢癌组织间基因表达差异时发现的[4]。近年研究表明,TCEAL7在胃癌、卵巢癌和子宫内膜癌等多种肿瘤中为低表达,与肿瘤的发生、发展及预后密切相关[5-7],但目前关于TCEAL7对结直肠癌的生物学行为的调控及相关作用机制尚少见报道。本实验拟检测TCEAL7在结直肠癌细胞株中的表达,并通过质粒转染的方法过表达TCEAL7来研究其对结直肠癌细胞增殖、迁移、侵袭及凋亡的影响,并探索可能的作用机制。
1 材料与方法 1.1 材料Caco2、HT29、HCT116、SW480人结直肠癌细胞购自分子肿瘤与表观遗传学重庆市重点实验室。RPMI1640培养基购自HyClone公司,胎牛血清购自四季青公司。TCEAL7基因引物由南京金斯瑞生物科技公司合成,RNA提取试剂盒购自TaKaRa公司,逆转录及PCR试剂盒购自Promega公司。RIPA裂解液、PMSF、BCA试剂盒、ECL发光试剂盒和AnnexinV-FITC/PI凋亡检测试剂盒购自碧云天生物公司;兔抗人TCEAL7多克隆抗体购自Proteintech公司,小鼠抗人NF-κB、Cyclin D1、c-Myc、E-cadherin、N-cadherin和vimentin单克隆抗体购自Santa Cruz公司,兔抗人GAPDH单克隆抗体、辣根过氧化物酶标记的抗兔和抗鼠IgG二抗体购自CST公司。无内毒素质粒提取试剂盒购自Omega公司,质粒pEZ-M98-TCEAL7和pEZ-M98由重庆莱博斯生物公司合成,LipofectamineTM2000购自Invitrogen公司, G418购自Biosharp公司。Matrigel基质胶购自BD公司,CCK-8试剂盒购自Biotool公司,Transwell小室(8 μm孔径)购自Corning公司。
1.2 方法 1.2.1 细胞培养用含10%胎牛血清的RPMI1640培养基培养Caco2、HT29、HCT116、SW480结直肠癌细胞,在50 mL/L CO2、37 ℃孵箱内培养,1~2 d更换培养基,待细胞长至约80%用胰酶传代。
1.2.2 结直肠正常组织于重庆医科大学附属第一医院胃肠外科取结直肠癌手术患者结直肠正常组织2例(距离肿瘤组织至少5 cm以外),保存于液氮中。
1.2.3 RT-PCR检测TCEAL7在结直肠癌细胞和正常组织中的mRNA表达使用TRIzol试剂盒提取各细胞及组织总RNA,应用Promega逆转录试剂将提取的总RNA逆转录成cDNA。TCEAL7上游引物5′-AAGAGGGAGGAAAAACGCCC-3′,下游引物5′-GTCCCGAGAATGCCTATGGTT-3′,产物长度234 bp;β-actin上游引物为5′-TCCTGTGGCATCCACGAAACT-3′,下游引物为5′-GAAGCATTTGCGGTGGACGAT-3′,产物长度315 bp。根据PCR试剂盒说明书进行PCR反应,扩增产物进行2%琼脂糖凝胶电泳,应用Bio-Rad凝胶成像系统进行曝光。
1.2.4 细胞转染与G418筛选Caco2接种于6孔板中,待细胞长至融合度60%时用脂质体LipofectamineTM 2000将重组质粒pEZ-M98-TCEAL7和空质粒组pEZ-M98进行转染。首先将5 μL脂质体和4 μg质粒分别加至500 μL RPMI1640培养基中,室温静置5 min,再将两者轻轻混合,室温静止20 min。RPMI1640培养基洗涤细胞2次后每孔先加入1 mL上述混合液,再加入RPMI1640培养基共补足至2 mL, 孵箱培养4~6 h后更换为含10%胎牛血清培养液。转染48 h后,每孔加入300 μg/mL(加药前已经筛选出的最低死亡浓度) G418,每隔2~3 d换液加药;筛选14 d左右,肉眼可见单克隆形成,然后G418剂量减半,继续培养。
1.2.5 蛋白提取及Western blot检测Caco2细胞转染48 h后提取转染组pEZ-M98-TCEAL7及空质粒组pEZ-M98总蛋白。每瓶细胞PBS洗涤后加入适量RIPA和PMSF混合液(100 :1),4 ℃摇床10 min后刮下蛋白,每隔5 min振荡1次,共30 min;4 ℃、12 000 r/min离心10 min后吸取上清液即为细胞总蛋白,BCA法测蛋白浓度,加入总体积1/4的上样缓冲液,煮沸蛋白。配制12%的分离胶和5%的浓缩胶,以40 μg/孔蛋白进行SDS-PAGE凝胶电泳,PVDF膜进行转膜,用含50 g/L脱脂奶粉室温封闭2 h;加入兔抗人TCEAL7(1 :200)、鼠抗人NF-κB、Cyclin D1、c-Myc、E-cadherin、N-cadherin和vimentin(1 :400),兔抗人GAPDH(1 :400),4 ℃摇床过夜;TBST洗膜3次,室温孵育二抗(1 :3 000)2 h,TBST再洗膜3次,ECL发光液显影,Fusion软件曝光。
1.2.6 CCK-8检测Caco2细胞增殖Caco2细胞分为pEZ-M98-TCEAL7转染组和pEZ-M98空质粒组,分别将两组中处于对数生长期的细胞种于96孔板,每组设3个复孔,每孔约5 000个细胞,于种板后0、24、48、72 h分别在每孔中重新加入100 μL培养液(含10 μL CCK-8试剂),孵箱中孵育2 h,测量时除去气泡,酶标仪检测450 nm波长处的光密度值D(450)。
1.2.7 克隆形成实验分别取稳定转染pEZ-M98-TCEAL7与pEZ-M98的处于对数生长期Caco2细胞,接种于6孔板中,每孔500个细胞,每组设3个复孔,2~3 d换液1次,培养10~12 d,长至肉眼可见的克隆团即终止培养;弃培养液,用PBS清洗,每孔加入4%多聚甲醛1 mL,固定20 min,吸尽多聚甲醛,每孔加入结晶紫1 mL,染色20 min,PBS清洗,干燥后拍照。
1.2.8 Transwell实验检测Caco2细胞迁移、侵袭能力 1.2.8.1 迁移实验将转染48 h后的在24孔板对应孔中加入700 μL含10%胎牛血清的pEZ-M98-TCEAL7转染组和pEZ-M98空质粒组Caco2细胞消化离心后,用无血清培养基重悬,调整细胞密度至5× 104/mL;培养基,放入Transwell小室,小室中加入200 μL细胞悬液,孵箱培养48 h后取出小室;PBS小心清洗小室,用棉签小心擦去小室内细胞,后用4%多聚甲醛700 μL固定小室30 min,用结晶紫700 μL染色30 min,PBS洗涤2~3次,干燥后置于光学显微镜下观察计数穿膜细胞。
1.2.8.2 侵袭实验先将无血清培养基与Matrigel基质胶按照7 :1比例混合,小室上室各加入80 μL混合液,放入孵箱内3~4 h,使其凝固。将2组细胞消化离心后,用无血清培养基重悬,调整细胞密度至10×104/mL,余下步骤同迁移实验。
1.2.9 流式细胞术检测细胞凋亡pEZ-M98-TCEAL7转染组和pEZ-M98空质粒组的Caco2细胞转染48 h后,用预冷的PBS洗涤细胞,不含EDTA的胰酶消化细胞,离心,PBS重悬后收集5×106个细胞。加入500 μL Binding Buffer重悬细胞,加入5 μL annexin Ⅴ-FITC和5 μL PI,室温避光10 min,流式细胞仪检测。
1.3 统计学分析采用SPSS 21.0软件分析,计量资料以x±s表示,两组间均数比较采用t检验, 多组间比较采用ANOVA分析,检验水准α=0.05。
2 结果 2.1 结肠癌细胞中TCEAL7 mRNA的表达通过RT-PCR检测结直肠癌细胞Caco2、HT29、HCT116、SW480 TCEAL7 mRNA的表达量分别为(0.19±0.02)、(0.25±0.03)、(0.30±0.03)、(0.28±0.04),与正常结直肠组织(1.03±0.03)、(1.06±0.07)相比明显下降,差异有统计学意义(P < 0.01,图 1)。

|
| 1: Caco2结直肠癌细胞;2: HT29结直肠癌细胞;3: HCT116结直肠癌细胞;4: SW480结直肠癌细胞;5~6:结直肠正常组织 图 1 RT-PCR验证TCEAL7在人结直肠癌细胞和正常组织中的表达 |
2.2 转染TCEAL7的Caco2细胞中TCEAL7mRNA和蛋白水平均增加
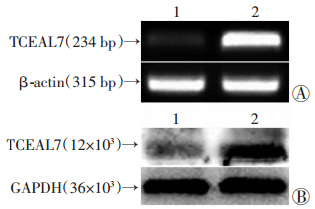
Caco2细胞转染48 h后分别提取pEZ-M98-TCEAL7转染组和pEZ-M98对照组细胞总RNA和总蛋白,RT-PCR和Western blot法进行验证,结果显示,转染组TCEAL7 mRNA和蛋白表达量(1.08±0.13)、(1.01±0.15)均明显高于对照组(0.43±0.20)、(0.53±0.10),差异有统计学意义(P < 0.01,图 2)。说明TCEAL7成功转入Caco2细胞。
|
| 1: pEZ-M98对照组;2: pEZ-M98-TCEAL7转染组;A:RT-PCR检测结果;B:Western blot检测结果 图 2 转染48 h后Caco2细胞TCEAL7mRNA和蛋白的表达 |
2.3 TCEAL7对Caco2细胞增殖的影响
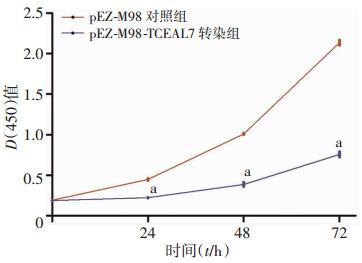
通过检测pEZ-M98-TCEAL7转染组和pEZ-M98对照组在0、24、48、72 h 4个时间点的光密度值D(450),绘制细胞增殖曲线,结果表明转染组细胞增殖活力明显低于对照组,差异具有统计学意义(P < 0.01,图 3),说明过表达TCEAL7能抑制Caco2细胞增殖能力。
|
| a:P < 0.01,与pEZ-M98对照组比较 图 3 CCK-8法检测TCEAL7对Caco2细胞增殖的影响 |
2.4 克隆形成实验
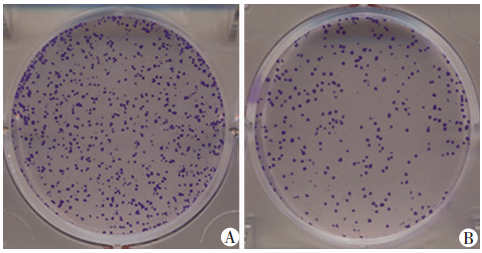
克隆形成实验结果显示,转染pEZ-M98-TCEAL7的Caco2细胞克隆形成数为(101±22)个,转染pEZ-M98的克隆形成数为(213±20)个,差异有统计学意义(P < 0.01,图 4),说明过表达TCEAL7可抑制Caco2细胞的克隆形成能力。
|
| A: pEZ-M98对照组;B: pEZ-M98-TCEAL7转染组 图 4 克隆形成实验结果 |
2.5 TCEAL7对Caco2细胞的迁移和侵袭的影响
Transwell迁移实验结果显示pEZ-M98-TCEAL7转染组穿膜细胞数(108±18)个,明显少于PEZ-M98对照组穿膜细胞数(395±24)个,差异具有统计学意义(P < 0.01)。侵袭实验结果显示pEZ-M98-TCEAL7转染Caco2细胞穿膜细胞数为(32±6)个,同样明显少于pEZ-M98对照组(286±5)个, 差异具有统计学意义(P < 0.01)。见图 5。以上结果说明过表达TCEAL7可明显抑制Caco2细胞迁移及侵袭能力。

|
| 图 5 Transwell检测TCEAL7对Caco2细胞迁移和侵袭的影响 (结晶紫×100) |
2.6 TCEAL7对Caco2细胞凋亡的影响
流式细胞术检测Caco2细胞转染组pEZ-M98-TCEAL7凋亡率为(23.83±1.56)%,明显高于对照组pEZ-M98凋亡率(4.77±1.24)%,差异有统计学意义(P < 0.01,图 6)。说明过表达TCEAL7可促进Caco2细胞凋亡。

|
| A: pEZ-M98对照组;B: pEZ-M98-TCEAL7转染组 图 6 流式细胞术检测TCEAL7对Caco2细胞凋亡的影响 |
2.7 过表达TCEAL7对NF-κB及其下游蛋白表达的影响
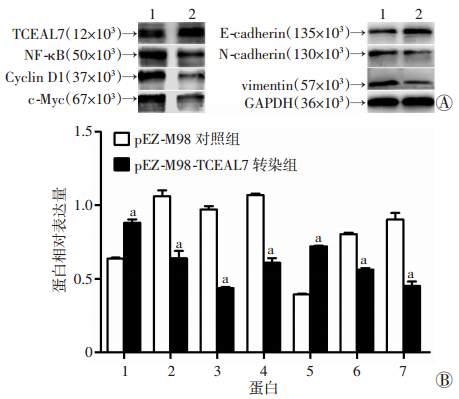
Western blot检测结果显示,与pEZ-M98对照组相比,Caco2细胞pEZ-M98-TCEAL7转染组NF-κB、Cyclin D1、c-Myc、N-cadherin和vimentin表达下降,E-cadherin的表达升高,差异有统计学意义(P < 0.01,图 7)。
|
| A:Western blot检测结果;1: pEZ-M98对照组,2: pEZ-M98-TCEAL7转染组;B:半定量分析结果;1:TCEAL7;2:NF-κB;3:Cyclin D1;4:c-Myc;5:E-cadherin;6:N-cadherin;7:vimentin;a:P < 0.01,与pEZ-M98对照组比较 图 7 Western blot检测NF-κB、Cyclin D1、c-Myc、E-cadherin、N-cadherin和vimentin蛋白的表达 |
3 讨论
结直肠癌的发生、进展是癌基因与抑癌基因发生遗传学与表观遗传学改变所致的结果[8]。表观遗传学是指未涉及DNA序列的改变但发生的可遗传的基因表达上的修饰,如DNA异常甲基化、非编码RNA和组蛋白修饰等[9]。研究表明在结直肠癌患者的血液、粪便、癌组织中均能检测到异常DNA甲基化[10]。CHIEN等[6]在卵巢癌的研究中发现TCEAL7基因启动子区异常甲基化可能是导致其表达下降抑癌作用失活的原因。本实验结果显示TCEAL7在结直肠癌细胞中存在表达下调,提示这一现象可能与DNA异常甲基化相关,因此,为TCEAL7在结直肠癌中机制的探索提供了新方向。
TCEAL为转录延伸因子A样家族,均位于X染色体长臂22.1~22.2区域,含有TFA结构域,可作为核磷酸蛋白通过依赖启动子的方式调节转录水平[11-12]。研究表明TCEAL家族成员在肿瘤中可起着抑癌基因的作用[13-15]。TCEAL7属于TCEAL家族成员之一,也在多种肿瘤中发挥抑癌基因的作用。CHIEN等[6]发现TCEAL7在卵巢癌组织和细胞中低表达甚至无表达,过表达TCEAL7可抑制卵巢癌细胞增殖活力,促进癌细胞凋亡,并可在转录水平抑制NF-κB、c-Myc和Cyclin D1的表达[11, 16]。HUANG等[5]报道在胃癌组织和胃癌细胞中TCEAL7为低表达,且TCEAL7的表达量与胃癌的大小、分期、淋巴结转移有关,提示TCEAL7可能作为胃癌患者判断预后的根据。GUO等[7]证实TCEAL7作为miR-182的靶基因,miR-182可通过调控TCEAL7从而抑制子宫内膜癌细胞的增殖和克隆形成。本实验我们首先以正常结直肠组织为对照,验证了TCEAL7基因在结肠直癌细胞中mRNA表达水平下调,筛选出TCEAL7表达下降的结直肠癌细胞Caco2,在此基础上将重组质粒pEZ-M98-TCEAL7转入Caco2细胞中,RT-PCR及Western blot检测结果显示转染组TCEAL7 mRNA及蛋白表达明显升高;然后,我们进一步探讨了TCEAL7对Caco2细胞生物学功能的影响。CCK-8和克隆形成实验验证了TCEAL7可明显抑制细胞增殖和克隆形成能力,Transwell实验证明TCEAL7可显著降低癌细胞迁移和侵袭能力,流式细胞术检测结果显示了TCEAL7可促进癌细胞凋亡。本实验结果与TCEAL7能抑制卵巢癌和子宫内膜癌癌细胞的增殖一致,同时也发现TCEAL7基因可以抑制肿瘤细胞的迁移和侵袭,提示TCEAL7在结直肠癌中充分发挥着抗肿瘤的作用。接下来,我们初步研究了TCEAL7在结直肠癌中可能的作用机制。
NF-κB是一种重要的核转录因子,被激活后由细胞质进入细胞核内,通过与下游靶基因的启动子或增强子结合,调控其表达,从而调节细胞的增殖、血管形成、凋亡等生理过程[17-18]。NF-κB可增加Cyclin D1与c-Myc的表达,提高了肿瘤细胞的抗凋亡和增殖能力[19]。NF-κB也可通过诱导肿瘤上皮间质转化,促使极性上皮细胞向有活动能力的间质细胞转化,破坏肿瘤细胞间的连接,降低肿瘤细胞间的黏附,促进肿瘤细胞迁移、侵袭和转移[20-22]。本实验Western blot检测结果显示,在结直肠癌Caco2细胞中过表达TCEAL7可抑制NF-κB的表达,进而下调了Cyclin D1及c-Myc的表达,E-cadherin(上皮细胞标志物)表达升高,而N-cadherin和vimentin(间质细胞标志物)表达降低,因此为解释过表达TCEAL7可抑制结直肠癌细胞的增殖和转移的现象提供了一定的依据,提示TCEAL7可能是通过调控NF-κB从而参与调节各种信号通路发挥其抑癌基因的作用。但TCEAL7在结直肠癌中具体通过何种机制调控NF-κB有待进一步研究。
通过以上实验我们发现TCEAL7基因在结直肠癌细胞中表达下降,过表达TCEAL7能够明显抑制Caco2细胞增殖、迁移及侵袭能力,促进细胞凋亡,能抑制NF-κB及下游靶基因Cyclin D1和c-Myc表达,逆转上皮间质转化,提示TCEAL7基因在结直肠癌中发挥抑癌基因的作用,可能为结直肠癌的诊断及治疗提供了一个新的依据。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | SIEGEL R, DESANTIS C, JEMAL A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2): 104–117. DOI:10.3322/caac.21220 |
| [3] | LI L, DUAN T, WANG X, et al. KCTD12 regulates colorectal cancer cell stemness through the ERK pathway[J]. Sci Rep, 2016, 6: 20460. DOI:10.1038/srep20460 |
| [4] | SHRIDHAR V, SEN A, CHIEN J, et al. Identification of underexpressed genes in early-and late-stage primary ovarian tumors by suppression subtraction hybridization[J]. Cancer Res, 2002, 62(1): 262–270. |
| [5] | HUANG C Y, CHEN Y M, ZHAO J J, et al. Decreased expression of transcription elongation factor A-like 7 is associated with gastric adenocarcinoma prognosis[J]. PLoS ONE, 2013, 8(1): e54671. DOI:10.1371/journal.pone.0054671 |
| [6] | CHIEN J, STAUB J, AVULA R, et al. Epigenetic silencing of TCEAL7 (Bex4) in ovarian cancer[J]. Oncogene, 2005, 24(32): 5089–5100. DOI:10.1038/sj.onc.1208700 |
| [7] | GUO Y, LIAO Y, JIA C, et al. MicroRNA-182 promotes tumor cell growth by targeting transcription elongation factor A-like 7 in endometrial carcinoma[J]. Cell Physiol Biochem, 2013, 32(3): 581–590. DOI:10.1159/000354462 |
| [8] | YAN W, WU K, HERMAN J G, et al. Epigenetic regulation of DACH1, a novel Wnt signaling component in colorectal cancer[J]. Epigenetics, 2013, 8(12): 1373–1383. DOI:10.4161/epi.26781 |
| [9] |
刘纲毅, 黄志卓, 张明明. DNA异常甲基化与结直肠癌研究进展[J].
广西医学, 2017, 39(2): 248–251.
LIU G Y, HUANG Z Z, ZHANG M M. Research progress of aberrant methylation of DNA and colorectal cancer[J]. Guangxi Med J, 2017, 39(2): 248–251. DOI:10.11675/j.issn.0253-4304.2017.02.29 |
| [10] |
白盈盈, 朱光旭, 潘兴华. DNA甲基化检测在结直肠癌诊断中的应用[J].
中国实验诊断学, 2016, 20(12): 2139–2142.
BAI Y Y, ZHU G X, PAN X H. Detection of DNA methylation in the diagnosis of colorectal cancer[J]. Chin J Lab Diagn, 2016, 20(12): 2139–2142. DOI:10.3969/j.issn.1007-4287.2016.12.060 |
| [11] | CHIEN J, NARITA K, RATTAN R, et al. A role for candidate tumor-suppressor gene TCEAL7 in the regulation of c-Myc activity, cyclin D1 levels and cellular transformation[J]. Oncogene, 2008, 27(58): 7223–7234. DOI:10.1038/onc.2008.360 |
| [12] |
高金亮, 周勇. 抑癌基因TCEAL7在乳腺组织中的表达及与人端粒酶逆转录酶的关系[J].
广东医学, 2016, 37(7): 1030–1034.
GAO J L, ZHOU Y. Expression of tumor suppressor gene TCEAL7 in breast tissue and its relationship with human telome[J]. Guangdong Med J, 2016, 37(7): 1030–1034. DOI:10.13820/j.cnki.gdyx.2016.07.019 |
| [13] | PILLUTLA R C, SHIMAMOTO A, FURUICHI Y, et al. Genomic structure and chromosomal localization of TCEAL1, a human gene encoding the nuclear phosphoprotein p21/SⅡR[J]. Genomics, 1999, 56(2): 217–220. DOI:10.1006/geno.1998.5705 |
| [14] | MAKINO H, TAJIRI T, MIYASHITA M, et al. Differential expression of TCEAL1 in esophageal cancers by custom cDNA microarray analysis[J]. Dis Esophagus, 2005, 18(1): 37–40. DOI:10.1111/j.1442-2050.2005.00432.x |
| [15] | AKAISHI J, ONDA M, OKAMOTO J, et al. Down-regulation of transcription elongation factor A (SⅡ) like 4 (TCEAL4) in anaplastic thyroid cancer[J]. BMC Cancer, 2006, 6: 260. DOI:10.1186/1471-2407-6-260 |
| [16] | RATTAN R, NARITA K, CHIEN J, et al. TCEAL7, a putative tumor suppressor gene, negatively regulates NF-kappaB pathway[J]. Oncogene, 2010, 29(9): 1362–1373. DOI:10.1038/onc.2009.431 |
| [17] |
方兴保. NF-κB与结直肠癌[J].
中国肿瘤生物治疗杂志, 2013, 20(3): 356–359.
FANG X B. Nf-κB and colorectal cancer[J]. Chin J Cancer Biotherap, 2013, 20(3): 356–359. DOI:10.3872/j.issn.1007-385X.2013.03.018 |
| [18] | ZHAO X, JIANG K, LIANG B, et al. Anticancer effect of xanthohumol induces growth inhibition and apoptosis of human liver cancer through NF-κB/p53-apoptosis signaling pathway[J]. Oncol Rep, 2016, 35(2): 669–675. DOI:10.3892/or.2015.4455 |
| [19] | YANG Z, LI C, WANG X, et al. Dauricine induces apoptosis, inhibits proliferation and invasion through inhibiting NF-kappaB signaling pathway in colon cancer cells[J]. J Cell Physiol, 2010, 225(1): 266–275. DOI:10.1002/jcp.22261 |
| [20] | MA J, GAO Q, ZENG S, et al. Knockdown of NDRG1 promote epithelial-mesenchymal transition of colorectal cancer via NF-κB signaling[J]. J Surg Oncol, 2016, 114(4): 520–527. DOI:10.1002/jso.24348 |
| [21] | HUR K, TOIYAMA Y, TAKAHASHI M, et al. MicroRNA-200c modulates epithelial-to-mesenchymal transition (EMT) in human colorectal cancer metastasis[J]. Gut, 2013, 62(9): 1315–1326. DOI:10.1136/gutjnl-2011-301846 |
| [22] | JIA Z, LIU W, GONG L, et al. Downregulation of RASAL2 promotes the proliferation, epithelial-mesenchymal transition and metastasis of colorectal cancer cells[J]. Oncol Lett, 2017, 13(3): 1379–1385. DOI:10.3892/ol.2017.5581 |



