2. 610083 成都, 中国人民解放军成都总医院康复医学科
2. Department of Rehabilitation Medicine, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确的损肝因素所致, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1]。线粒体不仅是机体细胞内最重要的能量工厂, 也是一动态的细胞器, 能通过网架的动态重构和持续的融合和分裂来适应细胞能量需求的变化[2]。新近研究发现, 线粒体融合与分裂的动态改变在NAFLD的发病中起着重要作用[3-4]。二氢杨梅素(dihydromyricetin, DHM)是一种黄酮类化合物, 主要存在于藤茶、枳椇子、乌墨等药食两用植物中, 具有多种生物学以及药理活性作用[1]。业已证实, DHM对糖、脂代谢具有调节作用[5], 并对NAFLD的发生、发展具有一定的防治作用[6], 但其是否通过调节线粒体的融合与分裂来改善肝脏的脂肪蓄积并不清楚。动力相关蛋白1(dynamin-related protein 1, Drp1)和分裂蛋白1(fission 1, Fis1)主要负责线粒体的分裂, 而融合蛋白2(mitofusion 2, Mfn2)、视神经萎缩蛋白1(optic atrophy1, Opa1)主要负责线粒体的融合, 这些融合、分裂蛋白的变化与线粒体的形态、结构和功能有着密切的联系[7]。本研究观察了DHM干预对高脂喂养诱导的C57BL/6J小鼠肝脏脂肪蓄积及肝脏线粒体融合与分裂相关基因表达的影响, 探讨二者的相关性, 旨在进一步阐明DHM防治NAFLD的潜在作用机制。
1 材料与方法 1.1 实验动物分组6周龄雄性SPF级C57BL/6小鼠45只, 体质量为(19.7±1.0) g[第三军医大学野战外科研究所实验动物中心, 合格证号:SCXK(京)2014-0004]。饲养于第三军医大学实验动物中心SPF级动物房, 相对湿度50% ~60%, 室温(23±1) ℃, 明暗周期12 h, 自由进食和饮水。适应性喂养1周后, 按照随机数字表法分为3组(n=15):普通饲料组(CON), 高脂饲料组(HFD)和高脂+二氢杨梅素100 mg/(kg·d)干预组(HFD+DHM)。普通饲料由第三军医大学实验动物中心提供; 高脂饲料(北京华阜康生物科技股份有限公司, H10045)的能量比例:碳水化合物35%、蛋白质20%、脂肪45%。二氢杨梅素配成20 mg/mL的浓度(PBS 20 mL溶解0.4 g DHM), 按照体质量每日使用标准灌胃针灌胃完成。灌胃期间死亡3只。干预12周后, 进行相关指标的检测。
1.2 主要试剂二氢杨梅素(纯度>98%)购于成都曼斯特公司, Drp1、Mfn1、Mfn2、Opa1抗体均购于美国Abcam公司, ACTB(β-actin)抗体购自上海贝博生物公司, QPCR逆转录试剂购于日本TaKaRa公司, DNA合成均来自上海生工生物工程股份有限公司, 增强型ATP检测试剂盒购自上海碧云天生物技术有限公司。
1.3 主要检测指标及方法 1.3.1 体质量指标使用第三军医大学实验动物中心提供的EL303-IC电子天平, 每周称量动物体质量。
1.3.2 生化指标实验结束后, 按随机数字表法每组取10只小鼠, 空腹8 h后, 乙醚麻醉。先取鼠尾血测定小鼠空腹血糖值(FPG), 后眼球取血, 4 ℃静置2 h后, 1 100×g离心15 min, 取上层血清生理盐水稀释3倍后, 在西南医院检验科, 使用东芝生化分析仪, 测定甘油三酯(TG, GPO-PAP法)、总胆固醇(TCH, CHOD-PAP法)和高密度脂蛋白(HDL)、低密度胆固醇(LDL, 直接法-选择抑制法)。在西南医院核医学科, 使用γ-放射免疫分析仪, 按照125Ⅰ胰岛素放射免疫分析药盒说明书测定血清中空腹胰岛素水平(FINS)。
1.3.3 肝脏指数实验结束后, 在上述操作采取血液标本后, 用针头将小鼠四肢固定于操作台上, 沿腹中线纵向切开小鼠皮肤及皮下, 找到并充分暴露小鼠肝脏, 沿肝周系带小心分离完整肝脏组织后置于锡箔纸上称量。小鼠肝指数=肝质量/体质量×100%。
1.4 小鼠肝脏组织油红O染色和HE染色分别取3组实验小鼠肝脏右叶组织(2 cm×1 cm×1 cm), OCT试剂包埋后, 冰冻切片机切片, 进行油红O染色, 苏木精复染细胞核; 同时取3组同样大小的肝脏组织, 4%多聚甲醛固定, 石蜡包埋切片, 进行HE染色。显微镜下观察并保存图像。
1.5 荧光定量PCR检测各组肝脏组织中线粒体分裂与融合相关基因的表达按照RNA试剂盒说明书, 每个标本取20 mg组织样品加入1 mL TRIzol裂解离心并收集上清, 使用核酸蛋白仪测定细胞RNA纯度和浓度。提取500 ng的RNA后按照反转录试剂盒说明书操作配置反应液, 将反应液混匀后在定量PCR仪上进行反转录反应。反转录反应完成后按照实时定量试剂盒说明书配置反应体系, 每个基因做3个平行组, 并在实时定量PCR仪上进行PCR反应。绘制溶解曲线并使用参照基因△Ct法计算mRNA表达, 比值(参照/目的)=2△CT(参照)-△CT(目的)。各引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 产物长度(bp) |
| Fis1 | 上游:AGGCTCTAAAGTATGTGCGAGG 下游:GGCCTTATCAATCAGGCGTTC |
183 |
| Drp1 | 上游:CGTGACAAATGAAATGGTGC 下游:CATTAGCCCACAGGCATCAG |
216 |
| Mfn2 | 上游:CCTACTGCTCCTTCTAACCCA 下游:AGGGACGCCAATCCTGTGA |
202 |
| Opa1 | 上游:CTGAGGCCCTTCTCTTGTTAGG 下游:CTGACACCTTCCTGTAATGCTTG |
205 |
| β-actin | 上游:ACCCCAGCCATGTACGTAGC 下游:GTGTGGGTGACCCCGTCTC |
211 |
1.6 Western blot检测各组肝脏组织线粒体分裂与融合蛋白水平
取小鼠肝脏组织30 mg, 加入600 μL配置好的含有蛋白酶抑制剂的组织裂解液RIPA, 磁珠破碎后, 冰上裂解30 min, 离心后提取上清, BCA法测定蛋白浓度。配置10%的SDS-PAGE胶, 样本按照蛋白40 μg/孔上样, 2组共上样6孔, 电泳进行蛋白分裂, 并湿转至PVDF膜上。5%脱脂奶粉室温封闭2 h后, 按照目的蛋白和β-actin分子量裁膜并4 ℃孵育一抗过夜。PBST洗膜3次, 室温孵育二抗1 h, PBST再次洗膜3次, 使用VILBER FUSION FX7成像系统自动曝光。以β-actin蛋白为内参照, 采用Image J软件进行灰度值分析。
1.7 ATP含量检测取右叶肝脏组织20 mg, 加入200 μL裂解液, 放入磁珠充分匀浆后裂解30 min后, 4 ℃ 12 000×g离心5 min, 取上清, 用ATP标准溶液制作ATP标准曲线, 按照增强型ATP含量测定试剂盒(S0027)说明书进行ATP含量的检测。
1.8 统计学分析数据使用Excel表格录入, 计量资料用x ±s表示, 采用GraphPad Prism 6.0软件对数据进行统计和绘图, 多组间比较采用单因素方差分析Turkey检验。
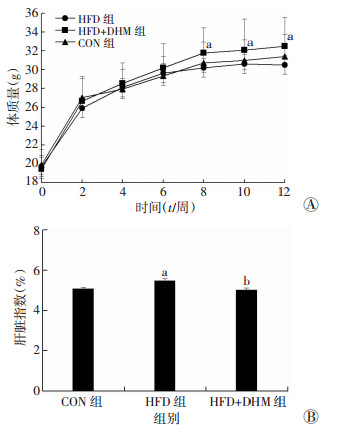
2 结果 2.1 DHM干预降低高脂喂养小鼠的肝脏指数与CON组相比, HFD组小鼠从第8周起体质量显著增高(P < 0.05, 图 1A), 肝脏指数显著升高(P < 0.05, 图 1B); 与HFD组相比, HFD+DHM组小鼠体质量并无显著改变, 而肝脏指数显著降低(P < 0.05, 图 1B)。
|
| a:P < 0.05, 与CON组比较; b:P < 0.05, 与HFD组比较 图 1 DHM对小鼠体质量(A)和肝脏指数(B)的影响(n=15, x ±s) |
2.2 DHM干预抑制高脂喂养小鼠部分血清生化指标的改变
与CON组相比, HFD组TG、TCH、LDL、空腹血糖和胰岛素水平均显著升高, HDL显著降低(P < 0.05, 表 2); 与HFD组相比, HFD-DHM组TG、空腹血糖和胰岛素水平显著降低, HDL显著升高(P < 0.05, 表 2), 但TCH和LDL并无显著改变。
| 组别 | TG | TCH | LDL | HDL | FPG | FINS |
| CON组 | 1.01±0.04 | 2.78±0.31 | 0.36±0.08 | 3.76±0.24 | 5.45±0.85 | 14.18±5.04 |
| HFD组 | 1.17±0.10a | 5.09±0.08a | 0.66±0.15a | 2.15±0.18a | 8.10±0.89a | 57.04±5.41a |
| HFD+DHM组 | 0.98±0.09b | 4.56±0.42a | 0.48±0.05 | 3.26±0.25ab | 5.47±0.61b | 53.57±6.47a |
| a:P < 0.05, 与CON组比较; b:P < 0.05, 与HFD组比较 | ||||||
2.3 DHM干预减少高脂喂养小鼠肝脏脂质蓄积
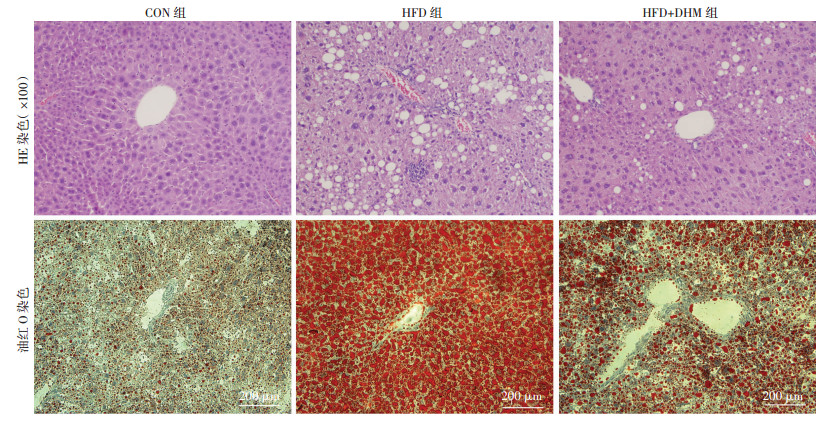
CON组小鼠肝脏外观呈红褐色, 质地软韧。经HE染色可见肝小叶结构清晰, 细胞排列整齐, 大小均匀, 未见脂肪空泡; HFD组小鼠肝内见大量脂肪空泡, 肝细胞气球样变广泛可见; HFD+DHM组脂肪空泡数量明显减少, 体积减小, 少量肝细胞呈气球样变(图 2)。肝组织油红O染色结果显示:HFD组小鼠肝细胞内见大量红染脂肪滴, DHM干预后脂滴变小, 数量变少(图 2)。
|
| 图 2 HE染色和油红O染色观察各组小鼠肝组织脂质蓄积和炎症情况 |
2.4 DHM干预提高高脂喂养小鼠肝脏组织ATP含量
与CON组[(0.304±0.012)nmol/mg]相比, HFD组[(0.188±0.015)nmol/mg]小鼠肝脏ATP含量显著降低(P < 0.05);与HFD组相比, HFD-DHM组[(0.271±0.027)nmol/mg]小鼠肝脏ATP含量明显升高(P < 0.05)。
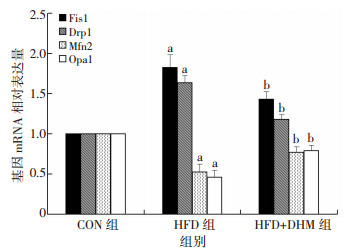
2.5 DHM干预拮抗高脂喂养小鼠肝脏线粒体融合、分裂相关基因mRNA表达的变化与CON组相比, HFD组分裂基因Fis1和Drp1的mRNA表达水平显著增加(P < 0.05), 融合基因Mfn2、opa1的表达水平显著降低(P < 0.05);与HFD组相比, HFD-DHM组Fis1、Drp1基因表达显著降低(P < 0.05), 而Mfn2、Opa1基因表达显著升高(P < 0.05, 图 3)。
|
| a:P < 0.05, 与CON组比较; b:P < 0.05, 与HFD组比较 图 3 荧光定量PCR检测各组小鼠肝脏线粒体动力学相关基因的表达(n=10, x ±s) |
2.6 DHM干预抑制高脂喂养小鼠肝脏线粒体融裂、分裂相关基因蛋白水平的变化
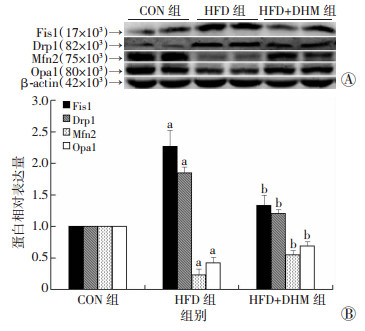
与CON相比, HFD组分裂蛋白Fis1、Drp1表达显著增高, 而融合蛋白Mfn2、Opa1显著降低(P < 0.05, 图 4); 与HFD组相比, HFD+DHM组HFD组蛋白Fis1、Drp1的表达显著降低, 同时Mfn2、Opa1表达显著增强(P < 0.05, 图 4)。
|
| A:Western blot检测Fis1、Drp1、Mfn2、Opa1的表达; B:Fis1、Drp1、Mfn2、Opa1蛋白相对表达量分析(n=10, x ±s), a:P < 0.05, 与CON组比较; b:P < 0.05, 与HFD组比较 图 4 Western blot检测各组肝脏线粒体融裂相关蛋白的表达 |
3 讨论
NAFLD是一种弥漫性肝细胞大泡性脂肪变为主要病理特征的代谢综合征, 其发生、发展涉及遗传、环境、生活习惯等诸多方面的因素, 并且与肥胖、糖尿病、高脂血症等疾病的发病密切相关[8]。因此, 改善肝脏的脂肪蓄积对防治NAFLD以及其他代谢性疾病具有重要意义[9]。本实验采用高脂喂养C57BL/6J小鼠建立NAFLD模型小鼠。结果发现, 高脂喂养12周后, C57BL/6J小鼠糖脂代谢异常, 肝脏脂肪蓄积明显, 表现为体质量、肝脏指数、甘油三酯(TG)、总胆固醇(Tch)、低密度脂蛋白(LDL)、空腹血糖和胰岛素水平明显升高; HE染色发现大量脂肪空泡和气泡样肝细胞; 油红O染色见明显脂滴蓄积。DHM干预后, 能够显著地改善糖脂代谢异常、肝脏脂肪蓄积, 显著降低肝脏指数, 但对小鼠体质量并无显著影响。高脂导致肝脏脂肪蓄积, 而二氢杨梅素可显著逆转这一过程, 这与本室前期研究结果[5-6]一致。
线粒体是机体内最重要的能量工厂, 也是肝脏进行脂肪酸β氧化的主要部位[2]。大量研究表明肝细胞线粒体可能在非酒精性脂肪肝发病机制中发挥重要作用[3], 随着肝脏脂质蓄积, 过多的游离脂肪酸在线粒体参与β氧化, 导致β氧化超载, 引起了线粒体的损伤, 多余的游离脂肪酸在肝细胞中蓄积, 进一步加重了肝脏的脂肪变性[10-11]。本研究通过检测肝脏组织ATP的产生量发现模型组小鼠肝脏ATP的含量显著降低, 而DHM干预后能够明显的拮抗此效应。提示:高脂喂养可能导致了线粒体的功能障碍, 进而引起肝脏ATP的产生减少, 而DHM有效地改善了线粒体的功能障碍, 增加ATP的产量。近期研究发现线粒体是一动态的细胞器, 能通过网架的动态重构和持续的融合和裂解来适应细胞能量需求的变化[12]。病理状态下, 氧化应激产物来自于细胞线粒体, 而氧化应激又可加重线粒体的功能和结构的不稳定性, 主要表现为线粒体的分裂增加, 融合降低[13-15]。而肝脏线粒体融合与分裂功能的稳态对维持肝脏细胞的代谢至关重要。Fis1、Drpl与Mfn1/2、Opa1基因分别执行调控线粒体的分裂与融合功能, 对线粒体动力学的稳态起关键作用[16-17]。线粒体分裂蛋白表达水平升高、融合蛋白表达降低, 引起线粒体网络结构的片段化, 线粒体嵴结构破坏, 引起线粒体损伤, ATP产量减少[18]; 而分裂蛋白的表达减弱、融合蛋白表达增强, 则会逆转线粒体的片段化, 随着线粒体网络结构的修复, ATP的产出增加[12]。业已证实, 线粒体分裂与融合的异常与NAFLD的发生发展密切相关[10, 19]。在NAFLD的细胞模型研究中发现, 棕榈酸诱导肝细胞脂肪蓄积的过程中, Drpl表达增高, Mfn2表达降低, 促使了线粒体的分裂增多, 而融合减少, 使线粒体产生更多的氧化应激产物, 并加重了细胞的损伤[20]。本研究检测了高脂喂养小鼠肝脏线粒体的分裂(Fis1、Drp1)、融合(Mfn2、Opa1)相关基因mRNA和蛋白表达的情况, 结果显示:高脂喂养导致分裂基因和蛋白表达显著增加, 而融合基因及蛋白表达明显降低; DHM(100 mg/kg)干预12周后明显抑制了上述变化, 小鼠肝脏分裂基因和蛋白表达显著降低, 融合基因及蛋白表达明显升高。该结果提示高脂饮食诱导肝脏脂肪蓄积可能与肝脏线粒体融合与分裂功能失调有关, 而DHM干预可抑制高脂诱导的肝脏线粒体融合与分裂异常, 并改善高脂饮食导致的肝脏脂肪蓄积。
综上所述, 本动物实验研究结果初步表明高脂饮食诱导的肝脏脂肪蓄积可能与其导致肝脏线粒体融合与分裂功能异常存在关联, 而DHM干预则可能通过抑制高脂诱导的肝脏线粒体融合与分裂失调继而改善肝脏脂肪蓄积, 但这一结论还需在体外细胞实验研究中做进一步验证。
| [1] | GALLOWAY C A, LEE H, BROOKES P S, et al. Decreasing mitochondrial fission alleviates hepatic steatosis in a murine model of nonalcoholic fatty liver disease[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 307(6): G632–G641. DOI:10.1152/ajpgi.00182.2014 |
| [2] | SCOTT I, YOULE R J. Mitochondrial fission and fusion[J]. Essays Biochem, 2010, 47: 85–98. DOI:10.1042/bse0470085 |
| [3] | SERVIDDIO G, BELLANTI F, VENDEMIALE G, et al. Mitochondrial dysfunction in nonalcoholic steatohepatitis[J]. Expert Rev Gastroenterol Hepatol, 2011, 5(2): 233–244. DOI:10.1586/egh.11.11 |
| [4] | MISHRA P. Interfaces between mitochondrial dynamics and disease[J]. Cell Calcium, 2016, 60(3): 190–198. DOI:10.1016/j.ceca.2016.05.004 |
| [5] | CHEN S, ZHAO X, WAN J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease:A randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74–81. DOI:10.1016/j.phrs.2015.05.009 |
| [6] |
李成凤, 曾祥龙, 黄娟, 等. 二氢杨梅素上调SIRT1信号通路改善HepG2细胞甘油三酯蓄积[J].
第三军医大学学报, 2016, 38(5): 443–448.
LI C F, ZENG X L, Huang Juan, et al. Dihydromyricetin improves triglyceride accumulation in hepg2 cells by regulating SIRT1 signaling pathway[J]. J Third Mil Med Univ, 2016, 38(5): 443–448. DOI:10.16016/j.1000-5404.201509009 |
| [7] | HORBAY R, BILYY R. Mitochondrial dynamics during cell cycling[J]. Apoptosis, 2016, 21(12): 1327–1335. DOI:10.1007/s10495-016-1295-5 |
| [8] | BASARANOGLU M, KAYACETIN S, YILMAZ N, et al. Understanding mechanisms of the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2010, 16(18): 2223–2226. DOI:10.3748/wjg.v16.i18.2223 |
| [9] | IBRAHIM MA, KELLENI M, GEDDAWY A. Nonalcoholic fatty liver disease:current and potential therapies[J]. Life Sci, 2013, 92(2): 114–118. DOI:10.1016/j.lfs.2012.11.004 |
| [10] | NASSIR F, IBDAH J A. Role of mitochondria in alcoholic liver disease[J]. World J Gastroenterol, 2014, 20(9): 2136–2142. DOI:10.3748/wjg.v20.i9.2136 |
| [11] | Basaranoglu M, Basaranoglu G, Sent rk H. From fatty liver to fibrosis:a tale of "second hit"[J]. World J Gastroenterol, 2013, 19(8): 1158–1165. DOI:10.3748/wjg.v19.i8.1158 |
| [12] |
李香云, 余剑波. 线粒体的融合、分裂与炎症反应研究进展[J].
中国病理生理杂志, 2016, 32(12): 2295–2299.
LI X Y, YU J B. Progress in mitochondrial fusion, fission and inflammatory response[J]. Chin J Pathophysiol, 2016, 32(12): 2295–2299. DOI:10.3969/j.issn.1000-4718.2016.12.030 |
| [13] | BEGRICHE K, MASSART J, ROBIN M A, et al. Mitochondrial adaptations and dysfunctions in nonalcoholic fatty liver disease[J]. Hepatology, 2013, 58(4): 1497–1507. DOI:10.1002/hep.26226 |
| [14] | SPAHIS S, DELVIN E, BORYS J M, et al. Oxidative stress as a critical factor in nonalcoholic fatty liver disease pathogenesis[J]. Antioxid Redox Signal, 2017, 26(10): 519–541. DOI:10.1089/ars.2016.6776 |
| [15] | HOU X, TONG Q, WANG W, et al. Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways[J]. Life Sci, 2015, 130: 38–46. DOI:10.1016/j.lfs.2015.03.007 |
| [16] | MICHALSKA B, DUSZYŃSKI J, SZYMAŃSKI J. Mechanism of mitochondrial fission-structure and function of Drp1 protein[J]. Postepy Biochem, 2016, 62(2): 127–137. |
| [17] | KAWALEC M, BERESEWICZ M, ZABŁOCKI K, et al. Mitofusin 2 and mitochondrial dynamics in norm and pathology[J]. Postepy Biochem, 2016, 62(2): 149–157. |
| [18] | PERNAS L, SCORRANO L. Mito-morphosis:mitochondrial fusion, fission, and cristae remodeling as key mediators of cellular function[J]. Annu Rev Physiol, 2016, 78: 505–531. DOI:10.1146/annurev-physiol-021115-105011 |
| [19] | GRATTAGLIANO I, DE BARI O, BERNARDO T C, et al. Role of mitochondria in nonalcoholic fatty liver disease—from origin to propagation[J]. Clin Biochem, 2012, 45(9): 610–618. DOI:10.1016/j.clinbiochem.2012.03.024 |
| [20] |
郑靖宇, 吴欢, 汤雯, 等. Drp1和Mfn2在棕榈酸诱导大鼠肝细胞损伤中的作用机制及姜黄素衍生物L6H4的干预作用[J].
温州医科大学学报, 2016, 46(7): 469–475, 481.
ZHENG J Y, WU H, TANG W, et al. Roles of drp1 and mfn2 in palmitate induced rat hepatocyte injury and the effects of curcumin derivative l6h4 on it[J]. J Wenzhou Med Univ, 2016, 46(7): 469–475, 481. DOI:10.3969/j.issn.2095-9400.2016.07.001 |



