尿道下裂是儿童常见的先天畸形之一,高居儿童泌尿生殖系统发育畸形的第二位。国内外相关流行病学调查显示其发病率为1:200~1:300,并呈现逐年上升的趋势[1-2]。尿道下裂的主要临床表现为阴茎下弯、尿道开口位置异常,对儿童的心理健康、成年后生育能力有很大的影响[2]。目前关于尿道下裂被认为是基因、环境和内分泌等多因素所致的疾病,其具体机制尚不明确[2-3]。邻苯二甲酸二-(2-乙基己基)酯[di(2-ethylhexyl) phthalate,DEHP]属于邻苯二甲酸盐类(phthalates,PEs)的一员,是我国应用最为广泛的通用型增塑剂。它作为一种典型的环境内分泌污染物能够导致雄性生殖系统的发育异常[4-5]。
目前关于DEHP致尿道下裂发生机制的研究主要集中在机体雄激素水平失衡、雄激素受体表达异常等方面[2-3]。有研究表明DEHP进入机体后可产生大量的活性氧簇(reactive oxygen species,ROS),直接导致细胞凋亡[6]。尿道下裂的发生与体内维生素A异常减少有关[7],维生素E可有效拮抗DEHP诱导的SD大鼠发生尿道下裂的发育毒性[8]。维生素A、E都是哺乳动物体内重要的非酶类抗氧化物质[7, 9-10],可有效拮抗机体的氧化应激状态。因此我们推测,氧化应激与抗氧化系统失衡可能在DEHP致尿道下裂发生过程中发挥了至关重要的作用。我们拟通过本研究探索DEHP对SD大鼠孕期暴露诱导尿道下裂发生过程中氧化应激机制所起的作用。
1 材料与方法 1.1 试剂和主要仪器设备DEHP(分析纯度,浓度>99%,上海阿达玛斯试剂有限公司,16114C)、玉米油(分析纯度,浓度>99%,阿拉丁,8001-30-7)、维生素A HPLC分析级标准品、维生素E HPLC分析级标准品、高效液相色谱-串联质谱仪(HPLC-MSMS)。电子游标卡尺(德国美耐特®,MNT-150T)、TP电子天平(最小量程0.01 g)、解剖显微镜、扫描电镜(日立公司,S-3000N)、病理组织石蜡包埋机(BMJ-B型,常州中威电子仪器厂)、自动固定脱水机(VIP-E300F-4897,日本政府赠送)。兔抗红细胞系-2 p45相关因子2(nuclear factor erythroid-2 p45-related factor 2,Nrf2)多克隆抗体(Abcam,ab31163),兔抗血红素加氧酶(heme oxygenase-1,HO-1)单克隆抗体(Abcam,ab68477),兔抗谷胱甘肽过氧化酶(glutathione peroxidase,Gpx)单克隆抗体(Abcam,ab108429),兔抗超氧化物酶歧化酶1(superoxide dismutase 1,SOD1)多克隆抗体(Abcam,ab16831),抗凋亡蛋白Bcl2(Boster,BA0412),促凋亡蛋白Bax(Boster,BA0315),兔抗活化型半胱天冬酶-3(cleaved caspase-3,CST,9664S),TUNEL试剂盒(Roche,11684817910)。
1.2 实验动物SPF级SD大鼠由重庆医科大学实验动物中心提供[实验动物生产许可证号SYXK(渝)20017-0001],未妊娠过的成年雌鼠20只,10~12周龄,体质量(240±20)g;成年雄鼠40只,12~16周龄,体质量(300±20)g。饲养于重庆医科大学附属儿童医院动物中心,按雌:雄=1:2合笼,次日上午12点寻找阴栓,找到阴栓当日记为妊娠期(gestation day,GD)第0.5天,继续常规饲料、饮水无限制条件下饲养,昼夜交替12 h,温度、湿度适宜。
动物建模参见文献[11]。GD8.5孕鼠20只,按完全随机分为玉米油对照组[750 mg/(kg·d),n=10]与DEHP暴露组[750 mg/(kg·d),n=10],于GD8.5~18.5每日上午12点灌胃处理。GD19.5时,10%水合氯醛液(4 mL/kg)腹腔注射麻醉妊娠大鼠后,剖宫取出胎鼠,以有无睾丸判断胎鼠的雌雄,并在解剖显微镜下观察有无尿道下裂的发生,按有无尿道下裂分为2组,正常对照组:为玉米油对照组无尿道下裂雄性胎鼠;尿道下裂组:为DEHP暴露组有尿道下裂雄性胎鼠。收集两组阴茎组织。
1.3 肛门生殖器距离测量和计算肛门生殖指数为了消除误差,请接受规范、标准化培训后的非本课题组人员使用电子游标卡尺,并用统一的测量方法测量雄性胎鼠的肛门开口至外生殖器基底部下缘的距离,即肛门生殖器距离(anogenital distance,AGD)[12],测量3次取平均值(mm),除以体质量记为肛门生殖指数(anogenital index,AGI)[12]。
1.4 阴茎组织形态学检查各组阴茎组织于戊二醛中在4 ℃条件下固定48 h,脱水,喷金,经扫描电镜(scanning electron microscope,SEM)观察组织形态。各组阴茎组织制成4 μm石蜡切片后,HE染色:组织使用多聚甲醛在室温条件下固定48 h,进行脱水、石蜡包埋,切片后在60 ℃烤箱中烘烤8 h以上,再经二甲苯Ⅰ 30 min,二甲苯Ⅱ 30 min,无水乙醇3 min,95%乙醇2 min,85%乙醇2 min,75%乙醇3 min,自来水冲洗1 min,苏木精5 min,自来水冲洗1 min,盐酸酒精5 s,自来水冲洗1 min,饱和碳酸锂5 s,95%乙醇1 min,伊红10 s,95%乙醇10 s,无水乙醇Ⅰ 2 min,无水乙醇Ⅱ 2 min,二甲苯3 min,封片。
1.5 组织抗氧化应激维生素水平测定采用高效液相色谱法(high performance liquid chromatography,HPLC)测定胎鼠肝脏中维生素A、维生素E的水平[13]。取新鲜胎鼠肝脏组织50 mg,加入950 μL 4 ℃冷生理盐水中充分研磨,16 100×g、4 ℃条件离心15 min,取上清液20 μL装入EP管内,加50 μL甲醇后震荡2 min以去除蛋白,再加入200 μL氯仿后震荡2 min,19 490×g、4 ℃条件离心10 min,取最下层液体180 μL,氮气吹干,再加入100 μL甲醇复活。上机测浓度。
1.6 组织氧化应激水平、组织凋亡测定Western blot检测GD19.5胎鼠的阴茎组织中Nrf2、HO-1、Gpx、SOD1、cleaved caspase-3、Bax、Bcl2的表达情况,使用Image J软件测算以上指标的灰度值,比去内参β-actin的灰度值得到相对浓度后,再用统计软件进行统计。免疫荧光法检测GD19.5各组胎鼠阴茎组织中Nrf2、SOD1、cleaved caspase-3的表达情况:脱蜡(步骤同1.4中HE染色)后于枸橼酸盐修复液微波加热15 min,冷却后PBS冲洗5 min,3% H2O2灭活过氧化酶,PBS冲洗5 min,0.2% TRITON打孔15 min,PBS冲洗5 min,0.5% BSA 37 ℃封闭1 h,PBS冲洗10 min,3次,抗体4 ℃过夜孵育,PBS冲洗10 min,3次,1:200荧光二抗37 ℃孵育1 h,PBS冲洗10 min,3次,1:200 DAPI染核37 ℃ 40 min,PBS冲洗10 min,3次,封片。参照Roche试剂盒内说明书,TUNEL法检测GD19.5各组胎鼠阴茎组织凋亡情况。
1.7 统计学处理实验数据以x±s或率(%)表示,采用SPSS 22.0统计软件,组间比较采用t检验和χ2检验。P<0.05认为差异具有统计学意义。
2 结果 2.1 雄性胎鼠尿道下裂建模情况与玉米油对照组相比,DEHP暴露组妊娠胎鼠数目、雄胎鼠数目无差异;尿道下裂发生率明显增高(P<0.05);同时,发生尿道下裂的胎鼠体质量、AGD、AGI明显减小(P<0.05)。DEHP暴露组除发生尿道下裂畸形外,还发生无脑畸形2例、发育停止1例,未纳入本研究。各组结果见表 1。
| 组别 | 孕鼠数目 (只) |
胎鼠数目 (只) |
雄性胎鼠 (只) |
尿道下裂 (只) |
尿道下裂发生率(%) | GD19.5雄鼠 | 其他畸形 [只(%)] |
||
| 体质量(g,x±s) | AGD(mm,x±s) | AGI(mm/g,x±s) | |||||||
| 玉米油对照组 | 10 | 111 | 57 | 0 | 0 | 3.100±0.280 | 2.003±0.219 | 0.646±0.044 | 0(0.00) |
| DEHP暴露组 | 10 | 108 | 58 | 16 | 27.59a | 2.976±0.324 | 1.508±0.528a | 0.509±0.179a | 3(2.78)a |
| a:P<0.05,与玉米油对照组比较 | |||||||||
2.2 雄性胎鼠阴茎形态学观察
妊娠的中晚期是哺乳动物的泌尿生殖系统发育关键时期,雄性SD大鼠的阴茎于GD19.5时已基本发育成型。正常对照组胎鼠尿道板卷曲形成正常的尿道,尿道皱褶于腹侧的融合形成包皮、阴茎体等组织,冠状沟清晰、尿道口开口于龟头正中位(图 1)。尿道下裂组胎鼠则出现尿道皱褶融合障碍,冠状沟界限不清、尿道口位于阴茎腹侧等位置(图 1)。

|
| ↘:示尿道口位置;←→:示尿道下裂中尿道皱褶融合失败;▲:示尿道皱褶;T1、T2……:示阴茎横切面位置 图 1 GD19.5雄性胎鼠阴茎形态学观察 |
2.3 GD19.5胎鼠肝脏中维生素A、E的测定
正常对照组中维生素A水平为(0.028±0.004)ng/μL,维生素E水平为(0.148±0.051)ng/μL。尿道下裂组胎鼠中维生素A水平为(0.009±0.005)ng/μL,维生素E水平为(0.044±0.050)ng/μL,均较正常对照组明显下降(P<0.05)。结果表明DEHP诱导发生尿道下裂的胎鼠体内,具有抗氧化作用的维生素A、E水平明显下降。
2.4 胎鼠阴茎组织中氧化应激水平的测定Nrf2-HO-1信号通路及下游的Gpx、SOD1等抗氧化蛋白在氧化应激中有重要的作用。与正常对照组相比,尿道下裂组中氧化应激相关蛋白Nrf2、HO-1、Gpx和SOD1的表达水平显著下降(P<0.05,图 2、3)。
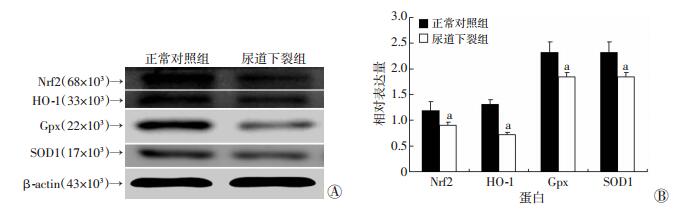
|
| A:Western blot检测结果;B:蛋白相对表达量(n=4,x±s) a:P<0.05,与正常对照组比较 图 2 GD19.5胎鼠阴茎组织中氧化应激相关蛋白Nrf2、HO-1、Gpx、SOD1表达水平检测 |
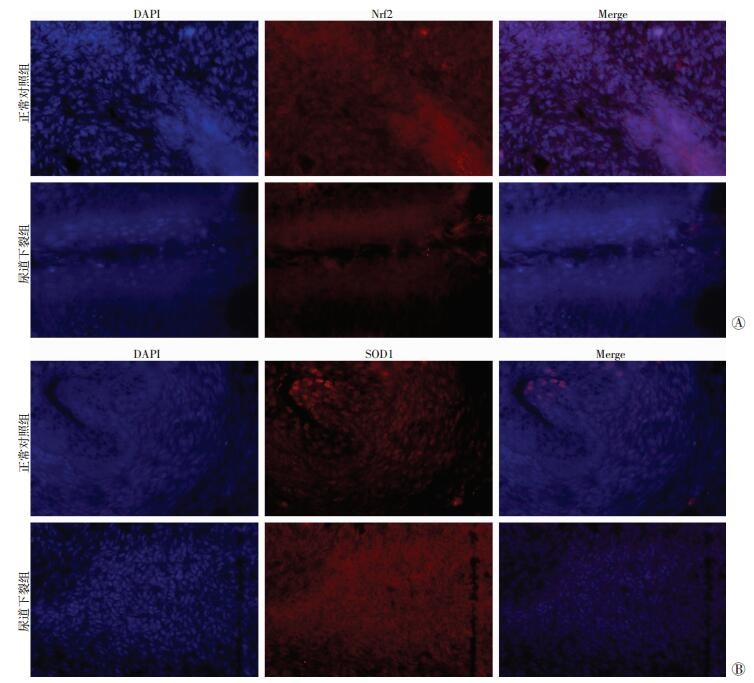
|
| A:Nrf2; B:SOD1 图 3 GD19.5胎鼠阴茎组织氧化应激相关蛋白检测 (免疫荧光×400) |
2.5 GD19.5胎鼠阴茎组织中凋亡检测
与正常对照组相比,发生尿道下裂的胎鼠阴茎组织中,具有启动凋亡程序作用的促凋亡蛋白Bax、凋亡执行蛋白cleaved caspase-3表达明显增加(P<0.05),而具有抗凋亡作用的Bcl2表达下调(P<0.05,图 4、5)。TUNEL结果也提示发生尿道下裂的胎鼠阴茎组织中细胞凋亡增多,凋亡指数差异具有统计学意义(P<0.05,图 6)。

|
| A:Western blot检测结果;B:蛋白相对表达量(n=4,x±s) a:P<0.05,与正常对照组比较 图 4 GD19.5胎鼠阴茎组织中凋亡相关蛋白cleaved caspase-3、Bax、Bcl2表达水平检测 |

|
| 图 5 GD19.5胎鼠阴茎组织凋亡相关蛋白cleaved caspase-3检测 (免疫荧光×200) |

|
| 图 6 GD19.5胎鼠阴茎中细胞凋亡情况 绿点为凋亡阳性细胞 (TUNEL×100) |
3 讨论
邻苯二甲酸二-(2-乙基己基)酯[di(2-ethylhexyl)phthalate,DEHP]作为一种在国内广泛使用的塑化剂,难以在环境中自然降解,并能在生物体内富集,具有环境内分泌干扰物效能[5]。研究证明,DEHP暴露可对雄性生殖器官造成损伤,在妊娠期和幼年发育期更为敏感。在SD大鼠泌尿生殖系统发育关键时期(GD12~GD18),孕鼠暴露DEHP后其雄性后代可出现隐睾、尿道下裂、精子质量下降、生育能力下降等[4-5]。本研究通过构建DEHP宫内暴露诱导尿道下裂发生的SD大鼠动物模型,检测胎鼠阴茎中的氧化应激水平和凋亡情况,探究氧化应激损伤所致的凋亡异常在尿道下裂发生中的可能机制。
维生素A是机体内视黄醇、视黄酯、视黄酸物质的总称,是一种具有抗氧化作用的脂溶性维生素。它对于哺乳动物的正常发育必不可少,维生素A缺乏可导致流产、胎儿畸形、胎儿中枢神经系统发育迟缓等一系列问题[10]。维生素E又名生育酚(tocopherol),是人体内具有广泛生理功能的脂溶性维生素,具有抗氧化作用[9]。它参与调节诸多重要的信号通路,包括生殖结节发育信号中心的TGF-β信号通路[14]。课题组前期已证实维生素E具有拮抗DEHP对尿道发育的毒性作用[8],为进一步阐明其可能的机制,我们进行了氧化应激相关检测。
Nrf2-HO-1信号通路在活性氧自由基介导的氧化应激损伤中具有重要作用,能够间接反映机体氧化压力[15]。Gpx和SOD1作为体内最重要的内源性酶类抗氧化物质,可以直接反映机体内抗氧化能力[15-16]。DEHP进入体内后迅速水解为活性单酯代谢产物邻苯二甲酸单-2-乙基己酯(mono-2-ethylhexyl phthalate,MEHP),MEHP可进入细胞并作用于线粒体,抑制线粒体的呼吸作用,产生过量的活性氧自由基、过氧化氢等物质,使得细胞或机体内的氧化压力增加[6]。本研究检测了各组阴茎组织4种蛋白的表达量来评估氧化应激水平,结果表明Nrf2-HO-1信号通路被抑制,下游的Gpx、SOD1等抗氧化蛋白表达减少。有研究者发现在DEHP致使幼年期SD雄性大鼠睾丸损伤中,Nrf2-HO-1信号通路被异常抑制,使用维生素C、E干预后能够改善氧化应激水平和睾丸损伤[17]。大量ROS的爆发破坏了体内氧化-抗氧化的平衡,机体失去正常的调节功能,进而对正常细胞、组织造成损伤[18]。
雄性生殖器官的发育除了与睾酮有关之外,还涉及其他的调控因素。细胞凋亡作为细胞生理性死亡的一种主要形式,与胚胎的发生、发育,器官的正常形成等有密切的关系。SUZUKI等[19]研究发现凋亡对于雄性生殖结节(GTs)和前尿道的正常胚胎发育是必要的条件。MORGAN等[20]发现在Hoxa13突变的尿道下裂小鼠模型的尿道中出现了凋亡的异常改变,进而导致了远端尿道融合失败。本研究发现,尿道下裂阴茎组织中凋亡执行蛋白cleaved caspase-3以及上游的激动剂Bax蛋白表达异常增加,具有拮抗作用的Bcl2蛋白异常减少,凋亡细胞亦明显增加。而尿道发育成型的关键是尿道板向中线卷曲融合,如该过程中发生凋亡异常,则可以导致尿道下裂的发生[2, 21]。
综上所述,DEHP的妊娠期暴露使SD大鼠的胎鼠阴茎组织产生大量ROS,机体处于氧化应激失衡状态;胚胎中具有抗氧化作用的维生素A、E被大量消耗而最终减少;同时Nrf2-HO-1信号通路被抑制,内源性酶类具有抗氧化作用的Gpx、SOD1表达减少;进而使胎鼠阴茎组织中凋亡异常增加,可能最终导致了尿道下裂发生。
| [1] | CHEVRIER C, PETIT C, PHILIPPAT C, et al. Maternal urinary phthalates and phenols and male genital anomalies[J]. Epidemiology, 2012, 23(2): 353–356. DOI:10.1097/EDE.0b013e318246073e |
| [2] | WANG M H, BASKIN L S. Endocrine disruptors, genital development, and hypospadias[J]. J Androl, 2008, 29(5): 499–505. DOI:10.2164/jandrol.108.004945 |
| [3] | CUNHA G R, SINCLAIR A, RISBRIDGER G, et al. Current understanding of hypospadias: relevance of animal models[J]. Nat Rev Urol, 2015, 12(5): 271–280. DOI:10.1038/nrurol.2015.57 |
| [4] | WANG Y, LIU W, YANG Q, et al. Di (2-ethylhexyl) phthalate exposure during pregnancy disturbs temporal sex determination regulation in mice offspring[J]. Toxicology, 2015, 336: 10–16. DOI:10.1016/j.tox.2015.07.009 |
| [5] | SKINNER M K. Endocrine disruptors in 2015: Epigenetic transgenerational inheritance[J]. Nat Rev Endocrinol, 2016, 12(2): 68–70. DOI:10.1038/nrendo.2015.206 |
| [6] | TETZ L M, CHENG A A, KORTE C S, et al. Mono-2-ethylhexyl phthalate induces oxidative stress responses in human placental cells in vitro[J]. Toxicol Appl Pharmacol, 2013, 268(1): 47–54. DOI:10.1016/j.taap.2013.01.020 |
| [7] | CHEN Y, REESE D H. Disruption of retinol (vitamin A) signaling by phthalate esters: SAR and mechanism studies[J]. PLoS ONE, 2016, 11(8): e0161167. DOI:10.1371/journal.pone.0161167 |
| [8] |
陈柏林, 刘星, 吴盛德, 等. 维生素E拮抗邻苯二甲酸二(2-乙基)己酯尿道发育毒性的实验研究[J].
中华小儿外科杂志, 2011, 32(8): 616–621.
CHEN B L, LIU X, WU S D, et al. The therapeutic effects of vitamin E on urethral development toxicity induced by di(2-ethylhexyl) phthalate[J]. Chin J Pediatr Surg, 2011, 32(8): 616–621. |
| [9] | RUMBOLD A, OTA E, HORI H, et al. Vitamin E supplementation in pregnancy[J]. Cochrane Database Syst Rev, 2015(9): CD004069.. DOI:10.1002/14651858.CD004069.pub3 |
| [10] | CLAGETT-DAME M, DELUCA H F. The role of vitamin A in mammalian reproduction and embryonic development[J]. Annu Rev Nutr, 2002, 22: 347–381. DOI:10.1146/annurev.nutr.22.010402.102745E |
| [11] |
李明勇, 陈柏林, 邱林, 等. 塑化剂邻苯二甲酸二(2-乙基)己酯诱导大鼠尿道下裂的研究[J].
第三军医大学学报, 2012, 34(20): 2124–2126.
LI M Y, CHEN B L, QIU L, et al. The research of di(2-ethylhexyl) phthalate induced hypospadias in SD rat[J]. J Third Mil Med Univ, 2012, 34(20): 2124–2126. DOI:10.16016/j.1000-5404.2012.20.018 |
| [12] | THANKAMONY A, PASTERSKI V, ONG K K, et al. Anogenital distance as a marker of androgen exposure in humans[J]. Andrology, 2016, 4(4): 616–625. DOI:10.1111/andr.12156 |
| [13] | PENG J, SHEN L, CHEN J, et al. New discovery of cryptorchidism: Decreased retinoic acid in testicle[J]. Saudi Pharm J, 2016, 24(3): 279–285. DOI:10.1016/j.jsps.2016.04.020 |
| [14] | AZZI A, GYSIN R, KEMPNá P, et al. Vitamin E mediates cell signaling and regulation of gene expression[J]. Ann N Y Acad Sci, 2004, 1031: 86–95. DOI:10.1196/annals.1331.009 |
| [15] | PAUL M K, BISHT B, DARMAWAN D O, et al. Dynamic changes in intracellular ROS levels regulate airway basal stem cell homeostasis through Nrf2-dependent Notch signaling[J]. Cell Stem Cell, 2014, 15(2): 199–214. DOI:10.1016/j.stem.2014.05.009 |
| [16] | FANG Y, LIU X, ZHAO L, et al. RhGLP-1 (7-36) protects diabetic rats against cerebral ischemia-reperfusion injury via up-regulating expression of Nrf2/HO-1 and increasing the activities of SOD[J]. Korean J Physiol Pharmacol, 2017, 21(5): 475–485. DOI:10.4196/kjpp.2017.21.5.475 |
| [17] | AFOLABI A O, OLOTU O O, ALAGBONSI I A. Vitamins E and C alleviate the germ cell loss and oxidative stress in cryptorchidism when administered separately but not when combined in rats[J]. ISRN Pharmacol, 2012, 2012: 843569. DOI:10.5402/2012/843569 |
| [18] | BIGARELLA C L, LIANG R, GHAFFARI S. Stem cells and the impact of ROS signaling[J]. Development, 2014, 141(22): 4206–4218. DOI:10.1242/dev.107086 |
| [19] | SUZUKI K, BACHILLER D, CHEN Y P, et al. Regulation of outgrowth and apoptosis for the terminal appendage: external genitalia development by concerted actions of BMP signaling[J]. Development, 2003, 130(25): 6209–6220. DOI:10.1242/dev.00846 |
| [20] | MORGAN E A, NGUYEN S B, SCOTT V, et al. Loss of Bmp7 and Fgf8 signaling in Hoxa13-mutant mice causes hypospadia[J]. Development, 2003, 130(14): 3095–3109. |
| [21] | CUNHA G R, BASKIN L. Development of the penile urethra[J]. AdvExp Med Biol, 2004, 545: 87–102. DOI:10.1007/978-1-4419-8995-6 |



