肺动脉高压(pulmonary artery hypertension,PAH)是体-肺分流型先天性心脏病(congenital heart disease,CHD)患者常见的并发症,重度PAH增加CHD患者围手术期风险,甚至影响其手术效果和预后[1]。肺血管重构(pulmonary vascular remodeling,PVR)是CHD-PAH的重要病理基础[2],患者高速、高流量的血液对肺循环血管壁的切应力增加合并缺氧引起血管内皮细胞(endothelial cell,EC)合成、释放血管内皮生长因子(vascular endothelial growth factor,VEGF)、内皮素-1(endothelin-1, ET-1)等血管活性物质失衡是其形成的重要机制[3]。大量文献表明包括VEGF、ET-1在内的上百种基因均受缺氧诱导因子家族(hypoxia inducible factors,HIFs)调控。HIFs是一组对机体缺氧反应性和适应性至关重要的转录因子,通过与目的基因的缺氧应答元件(hypoxia response elements,HRE)结合来调节下游靶基因,从而介导机体病理情况,低氧时其可致肺部结构发生重大改变而形成PAH[4]。本研究通过构建腹主动脉-下腔静脉分流法建立高肺血流性肺动脉高压模型,动态观察HIF-1α,HIF-2α在PAH大鼠肺组织中的表达情况,探讨两者在高肺血流性PAH病理发展过程中的作用,以期对临床上先心病引起的肺动脉高压的治疗时机及靶点提供参考。
1 材料与方法 1.1 实验动物及试剂仪器SPF级健康雄性SD大鼠64只[6~7周龄,体质量(200±20)g,由重庆医科大学实验动物中心提供],饲养环境湿度保持在50%,温度维持在(25±2) ℃。
TKR-200C型小动物呼吸机(江西特力麻醉呼吸机设备公司),压力传感器及PM-9000多导生理记录仪(深圳迈瑞生物医疗电子股份有限公司),全蛋白提取试剂盒、BCA蛋白定量试剂盒(中国,凯基生物),HIF-1α兔抗鼠抗体、HIF-2α兔抗鼠抗体(美国, GENETEX公司),MILLIPORE化学发光试剂盒(美国, Merck Limited Unit), 高纯总RNA提取试剂盒(中国,北京百泰克生物技术有限公司),TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser、TaKaRa SYBR Premix Ex TaqTM Ⅱ(中国,大连宝生物工程有限公司)。
1.2 动物模型建立及实验分组用电脑随机数字法将64只SD大鼠随机分为肺动脉高压组和假手术组,每组32只。大鼠禁食12 h后,腹腔注射10%水合氯醛(3 mL/kg)麻醉,保留自主呼吸,将大鼠仰卧固定。肺动脉高压组大鼠参照Garcia等[5]的方法建立高肺血流性肺动脉高压模型:腹部正中切口打开腹腔,用甲状腺小拉钩将大鼠腹腔内容物拉向一侧,暴露腹主动脉和下腔静脉,18 mm血管夹于腹主动脉上端近肾动脉处及下端两侧髂总动脉分叉处分别游离后夹闭,用18G静脉穿刺针于腹主动脉中下段正上方穿入腹主动脉后,以45°角斜向右上方穿破腹主动脉-下腔静脉联合壁,造成腹主动脉-下腔静脉瘘,迅速拔出穿刺针后,氰基丙基酸盐黏合剂黏合动脉穿刺口,约45 s待黏合剂固化后松开腹主动脉两端血管夹。此时可观察到鲜红的动脉血自腹主动脉瞬时涌入下腔静脉使下腔静脉增粗并搏动,初步证实动物模型建立成功。清理腹腔并观察片刻,如腹腔内无出血,则将腹腔内脏器复位后关闭。假手术组大鼠仅开腹夹闭腹主动脉45 s后松开血管夹,不做腹主动脉-下腔静脉造瘘处理。两组大鼠分别在手术后4、8、12、16周进行实验观察指标的测量及标本的收集, 每组每个时间点均8只大鼠。
1.3 平均肺动脉压力及右室肥厚指数测定大鼠称量体质量后,腹腔注射10%水合氯醛(3 mL/kg)麻醉,将大鼠仰卧位固定,经颈正中切口后暴露气管,气管切开后用16G静脉留置针套管置入模拟气管插管,连接TKR-200C型小动物呼吸机控制大鼠呼吸,设置呼吸频率为50次/min,潮气量2 mL/100 g,在右3、4肋间打开胸腔,将20G静脉留置针套管直接置入肺动脉处,连接压力传感器及PM-9000多导生理记录仪,待稳定后记录平均肺动脉压(mean pulmonary artery pressure, mPAP)。肺动脉压测定完毕后剖胸取出大鼠心脏,分离出右心室(RV)和左心室+室间隔(LV+SP)组织,滤纸吸干后分别称量右心室(RV)及左心室+室间隔(LV+SP)重量。按下式计算右室肥厚指数(right ventricular hypertrophy index, RVHI): RVHI=RV/(LV+SP)×100%。
1.4 肺动脉形态学观察每只大鼠均取左肺上叶,生理盐水清洗干净后滤纸吸干,4%多聚甲醛固定48 h后脱水,常规石蜡包埋,4 μm切片行HE染色,观察各组大鼠肺血管形态学变化。
1.5 肺组织HIF-1α和HIF-2α蛋白及mRNA表达检测取大鼠右上肺组织,生理盐水清洗血迹,滤纸吸干后液氮中保存,用于后续检测。
1.5.1 Western blot检测按照全蛋白提取试剂盒说明书,将蛋白裂解液加入大鼠肺组织后研磨,于4 ℃、12 000 r/min离心15 min,吸取上清,用BCA定量试剂盒进行蛋白定量,取60 μg蛋白进行8%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,将分离胶上的蛋白湿转至PVDF膜上,非特异性封闭1 h,加入一抗于4℃摇床上过夜,洗膜后加入辣根过氧化物酶标记的二抗室温孵育1 h,加入ECL发光剂1 mL,曝光、显影、定影。β-actin作内参。
1.5.2 Real-time PCR检测按照BioTeKe全RNA提取试剂盒说明书进行RNA提取,紫外分光光度计检测纯度和定量。cDNA的合成采用20 μL逆转录反应体系,其中5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,RNA 500 ng,RNase Free dH2O补至总体积10 μL; 42 ℃反应2 min,后将反应液置于冰上,加入PrimeScript RT Enzyme Mix 1 μL,RT Primer Mix×4 1 μL,5×PrimeScript Buffer 2 4 μL,RNase Free dH2O 4 μL。PCR扩增引物序列由生工生物工程(上海)股份有限公司设计合成(表 1),用制备的标准品作为模板,确定最佳反应体系和反应条件。进行SYBR Green-Ⅰ荧光定量PCR扩增。PCR体系为10 μL,包含cDNA 0.8 μL,上下游引物(10 μmol/L)各0.4 μL,SYBR Premix ExTaq酶5 μL,用灭菌蒸馏水补至10 μL。PCR反应参数:95 ℃预变性30 s; 95 ℃、5 s; 60 ℃、30 s,共扩增40个循环。以磷酸甘油醛脱氢酶(GAPDH)作为内参,通过各目的基因与内参比较得出其相对表达量。
| 基因 | 引物序列 | 产物大小(bp) |
| HIF-1α | 上游5′-ATCTAGTGAACAGGATGGAAT-3′ 下游5′-TTCTGCTGCCTTGTATGGGAG-3′ |
155 |
| HIF-2α | 上游5′-ACTCCTGGTAGATGGTGGCT-3′ 下游5′-CACTTGATGTGGAAACGAATG-3′ |
171 |
| GAPDH | 上游5′-GCAAGTTCAACGGCACAGTC-3′ 下游5′-TCACCCCATTTGATGTTAGCG-3′ |
106 |
1.6 统计学分析
采用SPSS17.0统计软件,计量资料用x±s表示,若数据呈正态分布且方差齐性,采用双因素方差分析,否则采用基于秩次的方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 肺动脉压力及右室肥厚指数变化肺动脉高压组大鼠分流术4周后mPAP、RVHI呈现逐渐增高趋势,mPAP于术后12周显著升高且高于同时间点对照组(P < 0.05);RVHI于术后16周显著增高且高于同时间点对照组(P < 0.05,表 2)。且不同处理的大鼠与时间变化的交互效应有统计学意义(P =0.037),说明不同组别大鼠不同时间点的mPAP、RVHI变化趋势不同。
| 组别 | mPAP(mmHg) | RVHI |
| 假手术组 | ||
| 4周 | 12.7±1.2 | 21.9±1.1 |
| 8周 | 16.7±2.1 | 22.7±1.9 |
| 12周 | 19.7±4.0 | 22.7±1.4 |
| 16周 | 18.0±5.0 | 23.2±2.3 |
| 肺动脉高压组 | ||
| 4周 | 18.7±3.8 | 22.6±2.9 |
| 8周 | 24.3±2.1 | 24.5±1.5 |
| 12周 | 32.0±4.3ab | 25.7±4.0 |
| 16周 | 45.3±0.5ab | 33.6±1.8ab |
| a:P < 0.05, 与同时间点对照组比较; b:P < 0.05,与肺动脉高压组其他时间点比较 | ||
2.2 肺血管重构的形态学变化
SD大鼠左上肺HE染色后,光镜下可见假手术组各时间点的肺动脉EC扁平,内膜光滑。而分流手术4周后,随着时间的变化,大鼠肺动脉内膜、中膜的EC及平滑肌细胞(smooth muscle cell,SMC)逐渐增殖; 术后8周时,EC仅表现为轻度增生,排列紊乱; 术后12周时,上述变化愈加明显,SMC增生较明显,排列紊乱,管腔狭窄; 术后16周时,SMC肥大并呈脂肪样变性,增生显著,排列更紊乱,管腔不对称、狭窄以至于接近闭塞(图 1)。

|
| ↑:肺血管 图 1 各组大鼠肺血管形态学变化 (HE ×400) |
2.3 HIF-1α和HIF-2α蛋白表达
HIF-1α和HIF-2α在假手术组大鼠肺组织并无明显表达; 而在肺动脉高压组8周及以后均呈现先增强后又下降的趋势(图 2),于术后8、12周时,HIF-1α和HIF-2α的表达量与内参蛋白比值较同时间点对照组均有显著差异(P < 0.05),HIF-1α表达量在术后8周达高峰,而HIF-2α的表达量在术后12周达高峰,其于HIF-1α的表达高峰呈现相对滞后的趋势。且不同处理组的大鼠与时间变化的交互效应差异有统计学意义(P =0.029),说明不同组别大鼠不同时间点的HIF-1α和HIF-2α蛋白表达变化趋势是不同的。
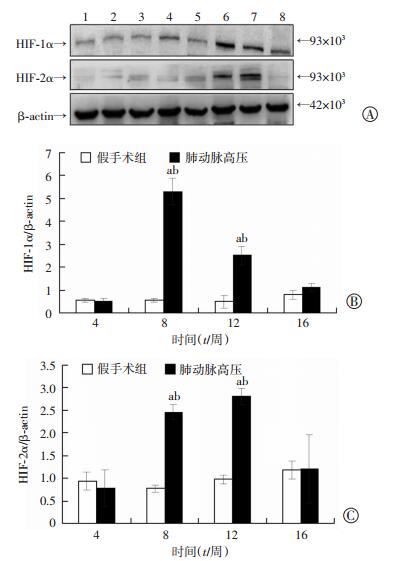
|
| A:Western blot检测1~4:分别为假手术组4、8、12、16周; 5~8分别为肺动脉高压组4、8、12、16周; B、C:分别为HIF-1α、HIF-2α蛋白表达的半定量分析a:P < 0.05, 与同时间点对照组比较,b:P < 0.05,与肺动脉高压组其他时间点比较 图 2 Western blot检测两组大鼠不同时间点HIF-1α、HIF-2α蛋白表达 |
2.4 大鼠肺组织HIF-1α、HIF-2α mRNA的表达
HIF-1α、HIF-2α mRNA表达在分流手术8周及以后均呈现先增强后又下降的趋势(表 3),于术后8、12时, 其表达较同时间点对照组差异均有统计学意义(P < 0.05),且变化趋势与蛋白表达一致。
| 组别 | HIF-1α | HIF-2α |
| 假手术组 | ||
| 4周 | 0.54±0.12 | 0.58±0.08 |
| 8周 | 0.47±0.05 | 0.52±0.10 |
| 12周 | 0.52±0.12 | 0.54±0.25 |
| 16周 | 0.49±0.04 | 0.53±0.14 |
| 肺动脉高压组 | ||
| 4周 | 0.51±0.14 | 0.51±0.10 |
| 8周 | 1.35±0.23ab | 1.10±0.03ab |
| 12周 | 1.07±0.06ab | 1.46±0.21ab |
| 16周 | 0.60±0.05 | 0.86±0.09 |
| a:P < 0.05, 与同时间点对照组比较; b:P < 0.05,与肺动脉高压组其他时间点比较 | ||
3 讨论
PAH是体-肺分流型CHD患者的常见并发症, 而先心病患者最根本的治疗是手术治疗,若术前未有效控制患者的肺动脉压,其可能发展成为艾森曼格氏综合征[6],丧失手术机会。近期的研究表明,CHD-PAH患者即使心脏术后,其PAH仍将持续影响患者生存质量[7]。PAH是一种进行性致死性肺血管疾病[8-9],纵使病因复杂多样,但肺血管重塑是其形成的共同病理改变[10]。肺循环高灌注可导致肺血管壁张力及剪切力增加损伤EC致其生物功能紊乱[11],SMC增生,管壁增厚,促使PVR的发生,最终形成不可逆的PAH,而CHD-PAH被认为是唯一一种肺血管病变可在早期阶段完全逆转的PAH[12-13],目前厄待有效的靶向治疗阻止其发展至不可逆阶段。本研究所采用的SD大鼠,分流术后mPAP及RVHI随时间延长持续增高,且到一定时间点均显著高于同时间点对照组,肺动脉形态学变化与肺动脉压力变化一致,表明腹主动脉-下腔静脉分流法可成功建立高肺血流性PAH模型。
缺氧诱导因子家族成员(HIF-1、HIF-2)是普遍存在机体内通过与目的基因的HRE结合来调节下游靶基因, 从而介导机体生理或病理作用的转录因子,其结构均包括两个亚单位,即低氧调控的α亚基(HIF-1α、HIF-2α)和对氧不敏感的β亚基,常氧条件下,α亚基表达不稳定,降解迅速。本研究发现,HIF-1α、HIF-2α蛋白及mRNA在高肺血流性PAH大鼠肺组织病变过程中均呈现先升高后下降的趋势,且其升高早期并未发生显著的肺血管病变及压力增高,可能因为肺血管病变前期(术后8周前),随着高肺血流对血管壁的切应力增加,刺激肺血管EC、SMC[14]分泌HIF-1α, HIF-2α,同时激活其下游靶基因,启动血管保护性机制以对抗病程的发展,故此时肺动脉高压组大鼠mPAP、RVHI升高不明显,此阶段属于血管病变的可逆阶段。而随着时间延长,病程后期(术后8周后)高肺血流对血管EC、SMC损伤达不可逆阶段,无法分泌足量的HIF-1α及HIF-2α来启动机体一系列血管保护性机制,故两者表达量又逐渐降低,而肺血管病变及肺动脉压力出现显著恶化。
本研究主要目的是希望对临床上先心病引起的肺动脉高压的治疗时机及靶点有一定的指导作用。目前研究有一定局限性,若在肺血管病变可逆阶段将HIF-1α及HIF-2α作为干预治疗的靶点,能否遏制PAH的发生还有待进一步研究。
目前已经证实的受HIFs调控的基因包括VEGF、血红素氧合酶-1(HO-1)、ET-1在内的上百种,且转录因子HIF-1、HIF-2有着不同的转录目标[15-16],其在不同疾病中的不同阶段发挥保护还是恶化作用仍有争议[17-18]。本研究中相对于HIF-1α的升高峰值,HIF-2α出现滞后的趋势,亦说明它们所调控的目的基因不同,发挥作用的时间亦有所不同。同时证实HIF-1α主要是介导机体急性期反应,而HIF-2α主要应对慢性机体反应[19]。本研究结果表明,HIF-1α和HIF-2α可能在大鼠高肺血流性肺动脉高压形成过程中的肺血管病变可逆阶段发挥了一过性的血管保护作用,但仍无法遏制肺动脉高压的形成。
| [1] | MYERS P O, TISSOT C, BEGHETTI M. Assessment of operability of patients with pulmonary arterial hypertension associated with congenital heart disease[J]. Circ J, 2014, 78(1): 4–11. |
| [2] | STENMARK K R, FAGAN K A, FRID M G. Hypoxia-induced pulmonary vascular remodeling: cellular and molecular mechanisms[J]. Circ Res, 2006, 99(7): 675–691. DOI:10.1161/01.RES.0000243584.45145.3f |
| [3] |
齐建光, 杜军保. 肺动脉高压发病机制和诊治研究进展[J].
中国循证儿科杂志, 2006, 1(1): 46–56.
J G, DU J B. Advances in pathogenesis, diagnosis and treatment of pulmonary hypertension[J]. Chin J Evid Based Pediatr, 2006, 1(1): 46–56. DOI:10.3969/j.issn.1673-5501.2006.01.010 |
| [4] | VEITH C, SCHERMULY R T, BRANDES R P, et al. Molecular mechanisms of hypoxia-inducible factor-induced pulmonary arterial smooth muscle cell alterations in pulmonary hypertension[J]. J Physiol (Lond), 2016, 594(5): 1167–1177. DOI:10.1113/JP270689 |
| [5] | GARCIA R, DIEBOLD S. Simple, rapid, and effective method of producing aortocaval shunts in the rat[J]. Cardiovasc Res, 1990, 24(5): 430–432. DOI:10.1093/cvr/24.5.430 |
| [6] | CALDER N-COLMENERO J, SANDOVAL Z RATE J, Beltr n G mez M. Pulmonary hypertension associated with congenital heart disease and Eisenmenger syndrome[J]. Arch Cardiol Mex, 2015, 85(1): 32–49. DOI:10.1016/j.acmx.2014.11.008 |
| [7] | GATZOULIS M A, BEGHETTI M, LANDZBERG M J, et al. Pulmonary arterial hypertension associated with congenital heart disease : Recent advances and future directions[J]. Int J Cardiol, 2014, 177(2): 340–347. DOI:10.1016/j.ijcard.2014.09.024 |
| [8] | HOEPER M M, BOGAARD H J, CONDLIFFE R, et al. Definitions and diagnosis of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62(25 Suppl): D42–D50. DOI:10.1016/j.jacc.2013.10.032 |
| [9] | GALIÈ N, CORRIS P A, FROST A, et al. Updated treatment algorithm of pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2013, 62(25 Suppl): D60–D72. DOI:10.1016/j.jacc.2013.10.031 |
| [10] |
汪健春, 钟前进, 肖颖彬. bcl-2/bax表达在左向右分流型肺动脉高压肺血管重构中的作用[J].
第三军医大学学报, 2009, 31(24): 2425–2428.
WANG J C, ZHONG Q J, XIAO Y B. Role of bcl-2 and bax expressions in pulmonary vascular remodeling of PAH rats secondary to left-right shunt CHD[J]. Third Mil Med Univ, 2009, 31(24): 2425–2428. DOI:10.3321/j.issn:1000-5404.2009.24.005 |
| [11] | L VY M, MAUREY C, CELERMAJER D S, et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease[J]. J Am Coll Cardiol, 2007, 49(7): 803–810. DOI:10.1016/j.jacc.2006.09.049 |
| [12] | WAGENVOORT C A, WAGENVOORT N, DRAULANS-NO Y. Reversibility of plexogenic pulmonary arteriopathy following banding of the pulmonary artery[J]. J Thorac Cardiovasc Surg, 1984, 87(6): 876–886. |
| [13] | VAN DER FEEN D E, BARTELDS B, DE BOER R A, et al. Pulmonary arterial hypertension in congenital heart disease: translational opportunities to study the reversibility of pulmonary vascular disease[J]. Eur Heart J, 2017, 38(26): 2034–2041. DOI:10.1093/eurheartj/ehx034 |
| [14] | YU A Y, FRID M G, SHIMODA L A, et al. Temporal, spatial, and oxygen-regulated expression of hypoxia-inducible factor-1 in the lung[J]. Am J Physiol, 1998, 275(4 Pt 1): L818–L826. |
| [15] | LOBODA A, JOZKOWICZ A, DULAK J. HIF-1 and HIF-2 transcription factors--similar but not identical[J]. Mol Cells, 2010, 29(5): 435–442. DOI:10.1007/s10059-010-0067-2 |
| [16] | LOBODA A, JOZKOWICZ A, DULAK J. HIF-1 versus HIF-2--is one more important than the other[J]. Vascul Pharmacol, 2012, 56(5-6): 245–251. DOI:10.1016/j.vph.2012.02.006 |
| [17] |
窦梦怡, 秦富忠, 李保. 缺氧诱导因子在心脏重构和心力衰竭中的作用[J].
中国循环杂志, 2015, 30(11): 1125–1127.
M Y, QIN F Z, LI B. The role of hypoxia induced factor in cardiac reconstruction and heart failure[J]. Chin Circul J, 2015, 30(11): 1125–1127. DOI:10.3969/j.issn.1000-3614.2015.11.022.DOU |
| [18] | FLORCZYK U, CZAUDERNA S, STACHURSKA A, et al. Opposite effects of HIF-1α and HIF-2α on the regulation of IL-8 expression in endothelial cells[J]. Free Radic Biol Med, 2011, 51(10): 1882–1892. DOI:10.1016/j.freeradbiomed.2011.08.023 |
| [19] | HOLMQUIST-MENGELBIER L, FREDLUND E, LÖFSTEDT T, et al. Recruitment of HIF-1alpha and HIF-2alpha to common target genes is differentially regulated in neuroblastoma: HIF-2alpha promotes an aggressive phenotype[J]. Cancer Cell, 2006, 10(5): 413–423. DOI:10.1016/j.ccr.2006.08.026 |



