乳腺癌(breast cancer)是最常见的恶性肿瘤之一。近年来,它一直是世界各地女性死亡的第二大原因[1]。2015年我国妇女罹患乳腺癌的患者超过400多万,其中死亡280万[2]。MDA-MB-231细胞系属雌激素、孕激素、生长因子受体均阴性的三阴性乳腺癌细胞系(triple negative breast cancer, TNBC)[3]。三阴性乳腺癌预后差,患者生存率低[4]。目前,乳腺癌的标准治疗方法包括手术、放化疗、内分泌治疗、靶向治疗等,然而,这些传统的治疗方法副作用大,给患者带来很大的痛苦[5]。
自噬(autophagy)是一种维持细胞内稳态的重要机制,负责清除细胞内的长寿蛋白、错误折叠蛋白等,并运送到溶酶体降解,为细胞适应各种刺激等提供必要的能量。近年来,对自噬的深入研究表明,自噬在癌细胞中具有双重作用(既有促进作用,又有抑制作用)。一方面,它可为肿瘤细胞的再生提供能量;另一方面,功能性自噬可阻止细胞坏死和炎症,导致基因不稳定性[6]。尽管目前对自噬在肿瘤发生、发展中的作用还有不同的认识,但越来越多的研究表明自噬抑制剂可增强肿瘤治疗的效果,部分研究已进入临床试验阶段,如氯喹及其衍生物羟基氯喹[7-8]。但目前自噬抑制剂的种类和数量很少,同时由于常用的自噬抑制剂毒副作用太大,不能用于临床开发,因此从毒性较低的传统中草药中寻找新的低毒高效的自噬抑制剂具有重要的临床意义。
千金藤素(cepharanthine)是从传统中药千金藤中提取的异喹啉生物碱[9],临床主要用于白细胞减少症,未见其明显的毒副作用[10]。研究表明千金藤素对多种肿瘤细胞具有抗肿瘤活性和抗多药耐药的作用,与化疗药物联合作用,通过逆转多药耐药性,发挥化疗增效的作用,应用前景广泛[11-12]。但千金藤素对TNBC作用及其分子机制的研究较少,在前期研究中,我们发现千金藤素对三阴性乳腺癌MDA-MB-231细胞的自噬降解有明显的抑制作用,本实验旨在研究千金藤素抑制乳腺癌MDA-MB-231细胞自噬降解的机制,为将千金藤素开发为一新的自噬抑制剂提供实验依据。
1 材料与方法 1.1 材料MDA-MB-231细胞购自ATCC;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、Lipofectamine 3000转染试剂盒、青霉素、链霉素、LysoTracker DND 99 Red均购自美国Invitrogen公司;Western blot试剂购自Bio-Basic公司;EGFP-LC3 plasmid购自上海吉凯公司;tfLC3购自Addgene;质粒提取试剂盒End-free Plasmid Mini Kit购自Omega公司;p62、LAMP1、LAMP2抗体均购自Cell Signaling公司;GAPDH抗体购自碧云天公司;Beclin1与LC3B抗体、二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)、雷帕霉素(Rapamycin)均购自Sigma-Aldrich公司;千金藤素对照品购自成都曼斯特生物科技有限公司;巴弗洛霉素A1(Bafilomycin A1)购自Cayman公司。
1.2 方法 1.2.1 细胞株与细胞培养MDA-MB-231细胞用DMEM完全培养基(含10%胎牛血清、青霉素1×105 U/L、链霉素100 mg/L),在37 ℃、饱和湿度及5% CO2的恒温培养箱中培养,每2天传代。
1.2.2 质粒提取、转染及激光共聚焦观察带有质粒的大肠杆菌在含有相应抗性抗生素的液体LB培养基中,于37 ℃,300 r/min恒温箱中培养12~16 h。依照质粒提取试剂盒End-free Plasmid Mini Kit说明书提取质粒,长期可保存于-20 ℃。对数期生长的MDA-MB-231细胞铺于预先植入爬片的24孔板内,每孔1×104个细胞,常规培养24 h,依照Lipofectamine 3000转染试剂盒说明书转染质粒,转染24 h后更换新鲜DMEM培养基并加入药物处理24 h,PBS洗涤并用免疫染色固定液(碧云天)固定爬片,在激光共聚焦显微镜(Zeiss)下观察。
1.2.3 LysoTracker染色细胞给药处理后,-20 ℃冰箱取出LysoTracker Red(1 mmol/L)室温解冻,分取1 μL加入至13.33 mL已预热好的DMEM完全培养基中,混匀后加入至24孔板中,每孔1 mL,轻摇混匀后放入37 ℃培养箱孵育1 h,去除染色液,细胞固定后用激光共聚焦显微镜观察。
1.2.4 Western blot检测MDA-MB-231细胞处理后,提取全细胞蛋白(P0013蛋白提取试剂盒,碧云天)并测定蛋白浓度(BCA蛋白浓度测定试剂盒增强型,碧云天),蛋白液加入Loading buffer,96 ℃,金属浴10 min,保存于-80 ℃。经聚丙烯酰胺凝胶电泳(SDS-PAGE),电转3~4 h至PVDF膜,5%脱脂奶粉封闭1 h,于4 ℃摇床上孵育抗体过夜,TBST洗涤一抗,加入二抗于室温下孵育2 h,TBST洗涤后显影。
1.3 统计学分析共聚焦图像采用Image J统计处理,Western blot检测结果采用Quality One软件分析,计量数据以x±s表示,采用SPSS 19.0统计软件进行处理。两样本的组间比较采用t检验。检验水准:α=0.01。
2 结果 2.1 千金藤素对MDA-MB-231细胞自噬体数量的影响MDA-MB-231细胞经EGFP-LC3质粒转染后,千金藤素4 μmol/L作用24 h,激光共聚焦显微镜观察自噬体,并使用Image J软件统计自噬体数量。结果显示千金藤素组的EGFP-LC3荧光团数量较对照组明显增多,主要分布于细胞核周围(图 1)。千金藤素组每个细胞中的平均荧光团数量(30.40±6.42)与对照组(5.00±2.12)相比,差异有统计学意义(P<0.01)。
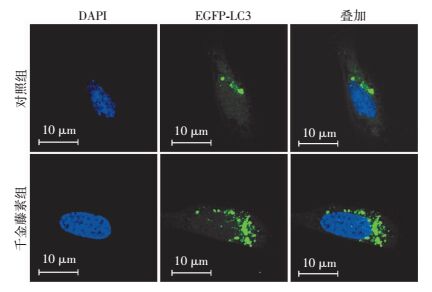
|
| 图 1 激光共聚焦显微镜观察EGFP-LC3荧光团数量变化 |
2.2 千金藤素对MDA-MB-231细胞自噬相关蛋白LC3B、p62、Beclin1表达的影响
千金藤素不同浓度(0、0.5、1、2、4 μmol/L)处理MDA-MB-231细胞24 h,或以千金藤素4 μmol/L浓度处理细胞不同时间(0、1、3、6、12、24 h),Western blot检测自噬相关蛋白LC3B、p62、Beclin1的表达。结果显示LC3B-Ⅱ、p62的表达均呈量效和时效增多,Beclin1的表达没有显著变化(图 2),说明千金藤素引起了MDA-MB-231细胞自噬底物、自噬体聚集。
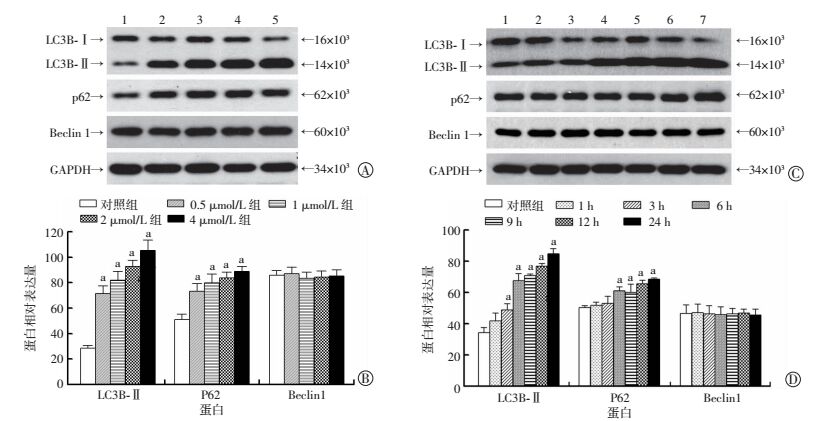
|
| A:Western blot检测不同浓度的千金藤素对MDA-MB-231细胞自噬相关蛋白表达的影响1:对照组;2:0.5 μmol/L组;3:1 μmol/L组;4:2 μmol/L组;5:4 μmol/L组;B:半定量统计分析结果a:P<0.01,与对照组比较;C:Western blot检测千金藤素处理不同时间对MDA-MB-231细胞自噬相关蛋白表达的影响1:对照组;2:1 h组;3:3 h组;4:6 h组;5:9 h组;6:12 h组;7:24 h组;D:半定量统计分析结果a:P<0.01,与对照组比较 图 2 千金藤素对MDA-MB-231细胞自噬相关蛋白表达的影响 |
2.3 千金藤素对MDA-MB-231细胞自噬的影响
细胞转染双色荧光质粒(tfLC3)后,可通过激光共聚焦显微镜观察自噬流的变化情况。当自噬流正常时(如Rapamycin处理后),将只能观察到红色荧光团;而当自噬过程被阻断在降解阶段时(如Bafilomycin A1处理后),将观察到大量黄色荧光团。MDA-MB-231细胞经千金藤素(4 μmol/L)、Bafilomycin A1(25 nmol/L)、Rapamycin(0.25 μmol/L)作用24 h后,激光共聚焦显微镜观察结果显示:千金藤素和与Bafilomycin A1作用类似,可观察到大量黄色荧光团,说明千金藤素阻断了自噬体的降解过程(图 3)。

|
| 图 3 激光共聚焦显微镜观察tfLC3转染后自噬流的变化 |
为进一步明确千金藤素阻断自噬降解的作用,将千金藤素(4 μmol/L)分别与Bafilomycin A1(25 nmol/L)、Rapamycin(0.25 μmol/L)联合作用于MDA-MB-231细胞24 h,Western blot检测结果显示,与Bafilomycin A1组相比,联用千金藤素后p62、LC3B-Ⅱ蛋白的表达并没有进一步增高;而与Rapamycin组相比,联用千金藤素后LC3B-Ⅱ蛋白的表达明显升高(P<0.01),同时Rapamycin导致的p62蛋白表达水平减少被逆转(图 4)。这进一步证实了千金藤素能够阻断自噬的降解。
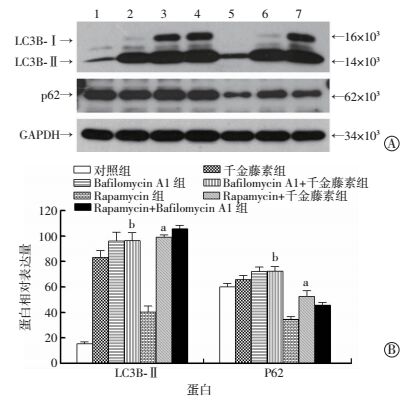
|
| A:Western blot检测结果1:对照组;2:千金藤素组;3:Bafilomycin A1组;4:Bafilomycin A1+千金藤素组;5:Rapamycin组;6:Rapamycin+千金藤素组;7:Rapamycin+Bafilomycin A1组;B:半定量分析结果a:P<0.01,与Rapamycin组比较 图 4 千金藤素联用Bafilomycin A1、Rapamycin对MDA-MB-231细胞自噬相关蛋白表达的影响 |
2.4 千金藤素对溶酶体酸性pH环境以及相关膜蛋白表达的影响
溶酶体酸性pH环境破坏,溶酶体数量下降,自噬体与溶酶体融合受阻等原因均可导致自噬降解过程受阻,自噬体堆积。为明确千金藤素阻断自噬降解的具体机制,我们首先采用LysoTracker染色实验考察溶酶体酸性环境是否被破坏。LysoTracker是一种趋酸性染料,可与酸性溶酶体结合染色,当溶酶体酸性环境被破坏时(如Bafilomycin A1处理后),LysoTracker几乎不能将溶酶体染色。结果显示LysoTracker能对千金藤素处理后的细胞正常染色(图 5),说明千金藤素并不影响溶酶体的酸性pH环境。其次我们采用Western blot检测了千金藤素对溶酶体标志蛋白LAMP1、LAMP2表达水平的影响。MDA-MB-231细胞经不同浓度千金藤素作用24 h后,Western blot检测结果显示千金藤素不但没降低LAMP1、LAMP2蛋白的表达水平,反而增高了其表达水平(P<0.05,图 6)。以上结果说明千金藤素不是通过影响溶酶体酸性pH环境或减少溶酶体数量的方式阻断自噬降解。
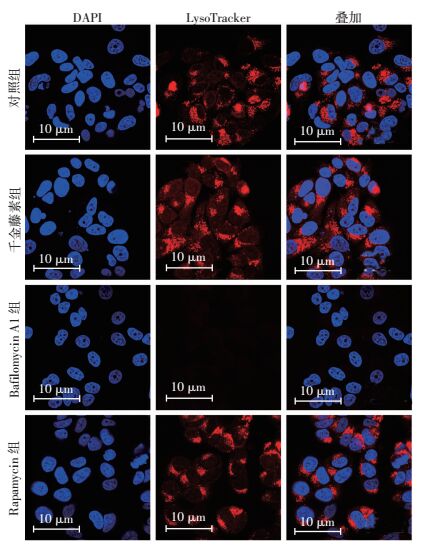
|
| 图 5 激光共聚焦显微镜观察LysoTracker对溶酶体的染色变化 |

|
| A:Western blot检测结果1:对照组;2:0.5 μmol/L组;3:1 μmol/L组;4:2 μmol/L组;5:4 μmol/L组;B:半定量统计分析结果a:P<0.01,与对照组比较 图 6 千金藤素对溶酶体相关膜蛋白表达的影响 |
2.5 千金藤素对自噬体与溶酶体融合的影响
为进一步确定千金藤素阻断自噬降解的原因,我们考察了千金藤素对自噬体与溶酶体融合的影响。千金藤素(4 μmol/L)、Bafilomycin A1 (25 nmol/L)和Rapamycin (0.25 μmol/L)分别作用于共转染了mRFP-LC3和mGFP-LAMP1质粒的MDA-MB-231细胞24 h后,激光共聚焦显微镜观察mRFP-LC3与mGFP-LAMP1的共定位。结果显示千金藤素与Bafilomycin A1相似,mRFP-LC3和mGFP-LAMP1的共定位极少,而Rapamycin组两者有大量的共定位(图 7)。以上说明千金藤素是通过抑制自噬体与溶酶体的融合从而阻断自噬降解。
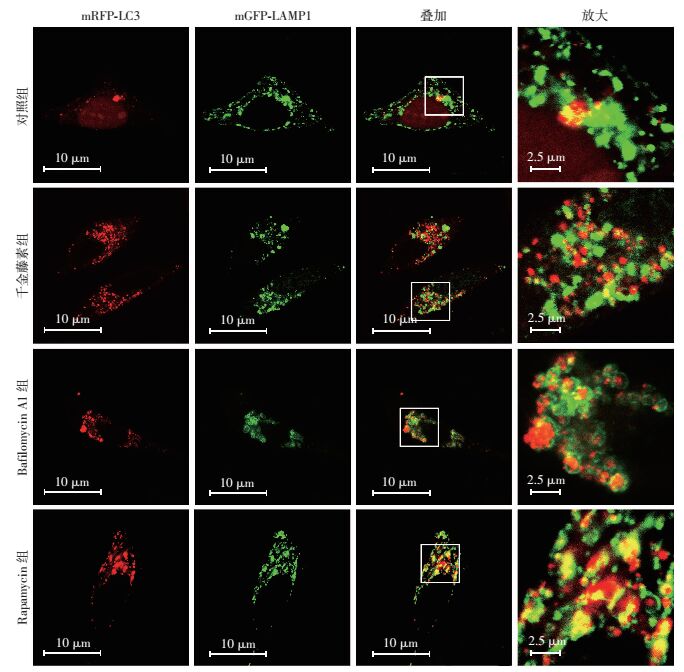
|
| 图 7 激光共聚焦显微镜观察mRFP-LC3和mGFP-LAMP1的共定位 |
3 讨论
三阴性乳腺癌的治疗是医学界的难题之一,目前有效的治疗方法很少。自噬是细胞维持稳态的重要过程,主要包括成核、延长、成熟、融合等,这一连续的过程又被形象地称为自噬流,但是过度的自噬或自噬性应激可以诱导细胞死亡[13]。目前的肿瘤治疗策略中,自噬抑制剂联合化疗药物的协同治疗方案在临床上已取得部分显著的效果,但进入临床实验阶段的自噬抑制剂现主要有氯喹及其衍生物羟基氯喹(hydroxych-loroquine,HCQ)[14]。自噬抑制剂的作用靶位主要分为①抑制自噬囊泡成核阶段:3-methyladenine (3-MA)、Wortmannin、LY294002、Spautin-1、SAR405等;②抑制自噬空泡转运过程:紫杉醇(paclitaxel),长春新碱(vincristine)等[3];③抑制自噬降解阶段:Bafilomycin A1、Chloroquine、HCQ、ROC325、Lys05等[15]。有研究表明作用于降解阶段的自噬抑制剂与化疗药物协同作用比作用于起始阶段的显著[16]。因此,开发作用于自噬降解阶段的抑制剂,对自噬抑制剂的临床开发应用具有重要意义。
千金藤素为中药千金藤中最受关注的生物碱,其具有调节免疫应答[17]、抗心律失常[18]、抑制肿瘤细胞浸润和转移、逆转肿瘤细胞多药耐药性[19]等作用。其抗肿瘤作用机制可能与升高活性氧水平、损伤线粒体而诱导细胞凋亡[20],或抑制NF-κB[21]等有关。文献[22]报道千金藤素引起宫颈癌细胞自噬体增多,但未深入研究其机制。本实验通过Western blot、激光共聚焦显微镜技术研究表明千金藤素对三阴性乳腺癌细胞MDA-MB-231的自噬有影响,可引起自噬体的增多,进一步转染tfLC3以及与Bafilomycin A1、Rapamycin的联用比较,均证实千金藤素与自噬抑制剂Bafilomycin A1作用相似,具有阻断自噬流的作用。LysoTracker染色结果以及检测溶酶体相关膜蛋白的表达,证实千金藤素不影响溶酶体的功能和数量。千金藤素影响了自噬体(mRFP-LC3)和溶酶体(mGFP-LAMP1)的共定位,说明千金藤素通过干扰自噬体与溶酶体的融合而阻断自噬降解。本研究证实千金藤素引起自噬体增多的主要原因是抑制了自噬体与溶酶体的融合而导致自噬体聚集,但自噬体与溶酶体融合的过程比较复杂,影响溶酶体的pH环境,扰乱微观蛋白的功能,抑制溶酶体内水解酶的活性以及干扰参与自噬体与溶酶体融合的蛋白复合物(如Rabs、HOPS、SNAREs等[23-24]),均可影响自噬体与溶酶体的融合而导致自噬体聚集。千金藤素作为一种生物碱,其干扰溶酶体与自噬体结合的机制可能与其影响了参与融合的蛋白复合物的活性有关,具体的分子机制还有待深入研究。
| [1] | YEDJOU C, IZEVBIGIE E, TCHOUNWOU P. Preclinical assessment of vernonia amygdalina leaf extracts as DNA damaging Anti-cancer agent in the management of breast cancer[J]. Int J Environ Res Public Health, 2008, 5(5): 337–341. DOI:10.3390/ijerph5050337 |
| [2] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] |
周静, 李国兵, 郑怡, 等. 莲心碱对乳腺癌细胞MDA-MB-231自噬功能的影[J].
第三军医大学学报, 2015, 37(7): 629–633.
ZHOU J, LI G B, ZHENG Y, et al. Liensinine inhibits autophagy in breast cancer MDA-MB-231 cells[J]. J Third Mil Med Univ, 2015, 37(7): 629–633. DOI:10.16016/j.1000-5404.201411115 |
| [4] | BAUER K R, BROWN M, CRESS R D, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype[J]. Cancer, 2007, 109(9): 1721–1728. DOI:10.1002/cncr.22618 |
| [5] | DESANTIS C E, LIN C C, MARIOTTO A B, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014, 64(4): 252–271. DOI:10.3322/caac.21235 |
| [6] | JANKU F, MCCONKEY D J, HONG D S, et al. Autophagy as a target for anticancer therapy[J]. Nat Rev Clin Oncol, 2011, 8(9): 528–539. DOI:10.1038/nrclinonc.2011.71 |
| [7] | LIANG D H, CHOI D S, ENSOR J E, et al. The autophagy inhibitor chloroquine targets cancer stem cells in triple negative breast cancer by inducing mitochondrial damage and impairing DNA break repair[J]. Cancer Lett, 2016, 376(2): 249–258. DOI:10.1016/j.canlet.2016.04.002 |
| [8] | VALSECCHI M E, KIMMEY G, BIR A, et al. Role of carboplatin in the treatment of triple negative early-stage breast cancer[J]. Rev Recent Clin Trials, 2015, 10(2): 101–110. DOI:10.2174/1574887110666150624101343 |
| [9] |
李兴. 千金藤属植物地不容的生药学及化学成分研究[D]. 重庆: 西南大学, 2009.
LI X. Study on the chemical constituents and pharmacognosy of stephania epigaea[D]. Chongqing: Southwest University, 2009. |
| [10] |
陆一安. 千金藤素防治抗癌药物引起的白细胞减少症的临床使用经验[J].
国外医学参考资料:药学分册, 1976(5): 296–297.
LU Y A. Cepharanthine prevention of leukopenia induced by anticancer drugs in clinical experience[J]. Foreign Med Sci: Pharmaceut Sci, 1976(5): 296–297. DOI:10.13220/j.cnki.jipr.1976.05.013 |
| [11] | PAZYAR N, JAMSHYDIAN N. Cepharanthine: a therapeutic potential candidate for psoriasis[J]. J Altern Complement Med, 2012, 18(7): 639–640. DOI:10.1089/acm.2012.0314 |
| [12] |
彭有梅, 王宁, 王亚峰, 等. 盐酸千金藤碱逆转K562/ADR细胞多药耐药性及其机制[J].
药学学报, 2012, 47(5): 594–599.
PENG Y M, WANG N, WANG Y F, et al. Correlation between reversing effect of cepharanthine hydrochloride on multidrug resistance and P-glycoprotein expression and function of K562/ADR cells[J]. Acta Pharm Sin, 2012, 47(5): 594–599. DOI:10.16438/j.0513-4870.2012.05.015 |
| [13] | GANLEY I G, LAM DU H, WANG J, et al. ULK1.ATG13.FIP200 complex mediates mTOR signaling and is essential for autophagy[J]. J Biol Chem, 2009, 284(18): 12297–12305. DOI:10.1074/jbc.M900573200 |
| [14] | ROSENFELD M R, YE X, SUPKO J G, et al. A phase Ⅰ/Ⅱ trial of hydroxychloroquine in conjunction with radiation therapy and concurrent and adjuvant temozolomide in patients with newly diagnosed glioblastoma multiforme[J]. Autophagy, 2014, 10(8): 1359–1368. DOI:10.4161/auto.28984 |
| [15] | CYNTHIA I, CHUDE, RAVI K. Targeting autophagy in cancer: update on clinical trials and novel inhibitors[J]. Int J Mol Sci, 2017, 18(6): 1279. DOI:10.3390/ijms18061279 |
| [16] | KREUZALER P, WATSON C J. Killing a cancer: what are the alternatives[J]. Nat Rev Cancer, 2012, 12(6): 411–424. DOI:10.1038/nrc3264 |
| [17] | HUANG H, HU G, WANG C, et al. Cepharanthine, an alkaloid from stephania cepharantha hayata, inhibits the inflammatory response in the RAW264.7 cell and mouse models[J]. Inflammation, 2014, 37(1): 235–246. DOI:10.1007/s10753-013-9734-8 |
| [18] |
苏彦宏, 李慧兰. 左旋千金藤定碱抗心律失常作用的研究[J].
昆明医学院学报, 2009, 30(10): 23–25.
SU Y H, LI H L. Anti-Arrhythmic effects of L-stepholidine[J]. J Kunming Med Univ, 2009, 30(10): 23–25. DOI:10.3969/j.issn.1003-4706.2009.10.006 |
| [19] | ROGOSNITZKY M, DANKS R. Therapeutic potential of the biscoclaurine alkaloid, cepharanthine, for a range of clinical conditions[J]. Pharmacol Rep, 2011, 63(2): 337–347. DOI:10.1016/S1734-1140(11)70500-X |
| [20] | HUA P, SUN M, ZHANG G, et al. Cepharanthine induces apoptosis through reactive oxygen species and mitochondrial dysfunction in human non-small-cell lung cancer cells[J]. Biochem Biophys Res Commun, 2015, 460(2): 136–142. DOI:10.1016/j.bbrc.2015.02.131 |
| [21] | SEUBWAI W, VAETEEWOOTTACHARN K, HIYOSHI M, et al. Cepharanthine exerts antitumor activity on cholangiocarcinoma by inhibiting NF-kappaB[J]. Cancer Sci, 2010, 101(7): 1590–1595. DOI:10.1111/j.1349-7006.2010.01572.x |
| [22] | LAW B Y, MOK S W, CHAN W K, et al. Hernandezine, a novel AMPK activator induces autophagic cell death in drug-resistant cancers[J]. Oncotarget, 2016, 7(7): 8090–8104. DOI:10.18632/oncotarget.6980 |
| [23] | REGGIORI F, UNGERMANN C. Autophagosome maturation and fusion[J]. J Mol Biol, 2017, 429(4): 486–496. DOI:10.1016/j.jmb.2017.01.002 |
| [24] | NAKAMURA S, YOSHIMORI T. New insights into autophagosome-lysosome fusion[J]. J Cell Sci, 2017, 130(7): 1209–1216. DOI:10.1242/jcs.196352 |



