契伦科夫光学成像(Cerenkov luminescence imaging,CLI)是一种新兴的以放射性核素为造影剂进行光学成像的新方法[1-4],在肿瘤成像[5]、术中导航[6]、淋巴示踪[7]及内窥成像[8]等方面得到了广泛应用并成为了研究热点。与临床正电子发射型计算机断层显像(positron emission computed tomography,PET)相比,自发式的CLI光学成像在信噪比、成像速度、经济成本等方面具有优势[9];与传统荧光光学成像方法相比,CLI成像使用与PET成像相同的临床核素探针,克服了探针毒性的问题[10]。然而,CLI光学成像的信号强度弱、组织穿透性差的问题严重限制了其在临床中的应用范围[11-12]。且契伦科夫光(Cerenkov luminescence,CL)能量主要集中在蓝紫波段(200~500 nm),生物组织对该波段的吸收能力强,而高灵敏度电荷耦合元件(charge-coupled device,CCD)相机的探测范围却主要集中在500~700 nm波段,使得相机对CL光探测的效率受到了限制[13]。为了增强契伦科夫光信号强度并改善其穿透性,2010年DOTHAGER等[14]用斯托克斯位移量子点(Qtracker 705)与18F-FDG进行混合, 出现了荧光光谱较吸收光谱红移且信号强度明显增加的现象,他将这种新的成像方式命名为契伦科夫能量转移成像(cerenkov radiation energy transfer imaging, CRETI);2013年THOREK等[15]通过使用纳米粒子实现契伦科夫光的生物特异性荧光转换激活成像,在增强CL信号的基础上还能对荧光探针所表达的信息进行定量,并将其命名为契伦科夫光二次诱导激发成像(secondary cerenkov induced fluorescence imaging, SCIFI)。CRETI与SCIFI均是运用了荧光激发效应作为成像原理来增强CL信号,但是目前常见的荧光激发材料以无机纳米颗粒为主,对人体具有潜在毒性,难以直接应用到临床实践中[16-17]。
故需要探索一种新的无毒荧光材料在保留CLI高信噪比及探针无毒优势的前提下实现对CLI信号的增强。四环素作为一种医用抗生素,吸收峰及发射峰分别为393 nm及530 nm,具有可靠的荧光性质,临床曾使用四环素洗胃液法、耳血四环素荧光实验进行胃癌普查[18-19]。荧光素钠也是临床常用的荧光造影剂,吸收峰及发射峰分别为487 nm及517 nm,经激发后能发出极强的黄绿色光,主要应用在眼底血管造影和激光共聚焦显微内镜检查中[20-22]。异硫氰酸荧光素是目前应用最广泛的荧光素之一,吸收峰及发射峰分别为495 nm及520 nm,已成功应用于人体的卵巢癌术中导航实验[23]。这3种荧光材料吸收峰(393、487、495 nm)均处于CL信号较强波段(200~500 nm),发射峰(530、517、520 nm)正好处于CCD相机敏感的范围(500~700 nm)。18F-FDG作为放射性标记的葡萄糖的结构类似物,在体内具有与葡萄糖相似的代谢途径,通过在高糖代谢的肿瘤部位聚集来区分良、恶性病灶,是临床最常用的核素探针[24]。因此,本研究将四环素、荧光素钠、异硫氰酸荧光素分别与18F-FDG组合使用,通过体外实验观察这3种荧光材料对契伦科夫光信号的增强作用,并选用体外实验效果最好的荧光材料在荷瘤鼠体内对其增强契伦科夫光的效果进行观察。
1 材料与方法 1.1 实验材料四环素(tetracycline,≥99.0%)购于上海研生生化试剂有限公司。荧光素钠(fluorescein disodium)购于武警总医院药剂科。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)购自Invitrogen公司。放射性核素18F-FDG由解放军总医院PET中心制备并提供。BALB/c裸鼠购自北京维通利华实验动物技术有限公司。4T1小鼠乳腺癌细胞系购自军事医学科学院。
1.2 四环素实验在96孔板中的10个孔中各自加入100 μL活度为100 μCi的18F-FDG,在其中9个孔中分别加入100 μL由生理盐水稀释至不同浓度的四环素溶液,使混合溶液的四环素最终浓度为100、50、10、5、1、0.5、0.1、0.05、0.01 mmol/L,另1个孔加入100 μL的生理盐水。此外于邻近的1个孔内加入200 μL浓度为100 mmol/L的四环素溶液。使用IVIS Spectrum进行成像,曝光时间50 s。选择每孔实际大小为ROI的大小进行信号强度分析。实验重复3次。
1.3 FITC实验在96孔板的9个孔中各加入100 μL活度为100 μCi的18F-FDG,在其中8个孔板中加入100 μL由DMSO稀释至不同浓度的FITC溶液,使混合溶液的FITC最终浓度为5、4、3、2.5、1.5、1、0.5、0.25 mmol/L,另1个孔加入100 μL的DMSO。此外于邻近的1个孔内加入200 μL浓度为5 mmol/L的FITC溶液。使用IVIS Spectrum进行成像,曝光时间50 s。选择每孔实际大小为ROI的大小进行信号强度分析。实验重复3次。
1.4 荧光素钠实验在96孔板中的9个孔中各自加入100 μL活度为100 μCi的18F-FDG,在其中8个孔板中加入100 μL由生理盐水稀释至不同浓度的荧光素钠溶液,使最终浓度依次为100、50、10、5、2、1、0.2、0.1 mmol/L,另1个孔加入100 μL生理盐水,此外于邻近的1个孔内加入200 μL浓度为100 mmol/L的荧光素钠溶液。使用IVIS Spectrum进行成像,曝光时间50 s。选择每孔实际大小为ROI的大小进行信号强度分析。上述实验重复3次。根据结果对荧光强度最强的板孔和单纯18F-FDG的板孔进行不同滤光片下的成像,成像条件同前,在500~840 nm范围内,以20 nm的滤光片间隔进行成像,根据ROI计算不同滤光片下的信号强度,得出两孔的光谱分离数据。
1.5 动物实验根据体外实验结果,选取对契伦科夫光信号有增强效果的FITC及荧光素钠进行在体实验。取6只5周龄大小的BALB/c雌鼠(体质量18~20 g),皮下种植6×106 4T1小鼠乳腺癌细胞,构建皮下肿瘤模型。1周后将500 μCi的18F-FDG通过尾静脉分别注入2只荷瘤鼠体内,45 min后使用IVIS Spectrum分别进行CLI成像,曝光时间5 min。CLI成像结束后将其中1只荷瘤鼠尾静脉注射30 mmol/L的荧光素钠100 μL,5 min后再进行同样参数的CLI激发荧光素钠成像。最后进行荧光素钠的激发荧光成像,曝光时间0.1 s。另1只荷瘤鼠尾静脉注射15 mmol/L的FITC 100 μL,5 min后进行同样参数的CLI激发FITC成像。最后进行FITC的激发荧光成像,曝光时间0.1 s。上述实验在重复3次,根据实际肿瘤大小,对CLI及CLI激发荧光材料的成像结果进行ROI信号强度的分析。动物实验全部遵守解放军总医院动物管理和保护条例。
1.6 统计学分析采用SPSS 17.0统计软件进行数据处理,数据以x±s表示。两组间比较采用配对样本t检验。检验水准:α=0.05。
2 结果 2.1 18F-FDG激发四环素体外成像固定18F-FDG活度为100 μCi,对不同浓度的四环素进行激发成像,从成像结果可以发现不同浓度的四环素溶液对18F-FDG的光强没有发生明显变化,以每孔大小勾画ROI进行统计分析,ROI计数结果再次验证,见图 1。
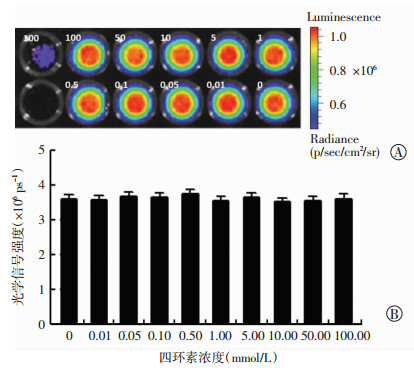
|
| A:固定18F-FDG与不同浓度的四环素组合进行成像,最左上方的孔只含有100 mmol/L的四环素,其余孔均含有100 μCi的18F-FDG;B:对成像结果进行ROI分析 图 1 不同浓度四环素溶液对光强的影响 |
2.2 18F-FDG激发FITC体外成像
固定18F-FDG活度为100 μCi,对不同浓度FITC进行成像,可以发现FITC与18F-FDG混合后荧光信号强度高于单纯的18F-FDG,而单纯的未与18F-FDG混合的FITC没有被激发,没有荧光光子产生。对每孔进行ROI定量时可以发现,当FITC浓度为1 mmol/L时,信号强度最强,约为纯18F-FDG信号强度的3.2倍,见图 2B。

|
| A:固定18F-FDG对不同浓度的FITC进行成像,最左上的板孔只含有5 mmol/L的FITC,不含18F-FDG,其余孔均含有100 μCi的18F-FDG;B:以每个孔板实际大小进行ROI分析 图 2 不同浓度FITC对光强的影响 |
2.3 18F-FDG激发荧光素钠体外成像
固定18F-FDG活度为100 μCi,对不同浓度荧光素钠进行激发成像,成像结果显示,荧光素钠与18F-FDG混合物产生的光信号强度高于纯18F-FDG产生的光信号;而未与18F-FDG混合的纯荧光素钠由于没有激发源,没有产生荧光光子。当荧光素钠浓度为2 mmol/L时,光学信号强度最强,见图 3A。以每孔实际大小勾画ROI后进行光强的定量分析,发现荧光素钠浓度为2 mmol/L时对CLI光信号的增强效果最显著,增强后的信号强度约为纯18F-FDG信号强度的5倍左右,见图 3B。对荧光素钠(2 mmol/L)和18F-FDG混合物产生的光信号进行光谱分离成像,发现荧光素钠能够将18F-FDG产生的光信号的发射峰红移至540 nm,且信号强度较单独18F-FDG的光信号明显增强。

|
| A:固定18F-FDG与对不同浓度的荧光素钠进行成像,最左上的孔只含100 mmol/L的荧光素钠,不含18F-FDG,其余孔均含有100 μCi的18F-FDG;B:以每个孔实际大小进行ROI分析;C:对荧光素钠为2 mmol/L的板孔及单纯18F-FDG的孔进行500~820 nm范围的光谱分析 图 3 不同浓度荧光素钠对光强的影响 |
2.4 18F-FDG激发FITC在体成像
对荷瘤鼠尾静脉注射18F-FDG后进行CLI成像,可以发现肿瘤部位、膀胱及颈部均有较强的CL信号,肿瘤周围信号背景比并不明显,见图 4A。注射FITC后,在相同成像条件下的CLI激发成像可以显著增强肿瘤部位的信号强度,与周围组织的信号背景比明显增强,见图 4B。FITC的激发荧光成像结果显示:FITC在体内均匀分布,并无分布特异性,见图 4C。CLI成像和CLI激发FITC成像的定量分析结果显示:注射FITC后肿瘤部位信号强度相比注射前提高2倍,信号强度差异有统计学意义(P < 0.05,图 4D)。
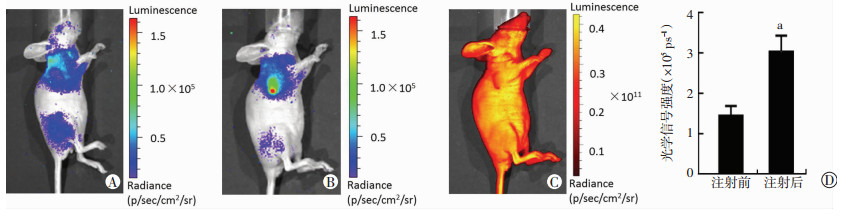
|
| A:对荷瘤鼠尾静脉注射500 μCi的18F-FDG后进行CLI成像;B:尾静脉注射100 μL的15 mmol/L的FITC后再次进行相同成像条件的CLI成像;C:对荷瘤鼠进行荧光成像;D:对注射FITC前后肿瘤部位信号强度进行定量分析a:P < 0.05,与注射前比较 图 4 FITC增强契伦科夫光信号的在体实验 |
2.5 18F-FDG激发荧光素钠在体成像
注射18F-FDG后CLI成像结果显示荷瘤鼠肿瘤部位具有较高的CL信号强度,但是肿瘤周围信号背景比并不明显,见图 5A。注射荧光素钠后,在相同成像条件下的CLI激发成像可以显著增强肿瘤部位的信号强度,与周围组织对比明显,见图 5B。荧光素钠的激发荧光成像结果显示:荧光素钠在体内均匀分布,并无分布特异性,见图 5C。CLI成像和CLI激发荧光素钠成像的定量分析结果显示:注射荧光素钠后肿瘤部位信号强度相比注射前提高3.9倍,信号强度差异有统计学意义(P < 0.01,图 5D)。

|
| A:对荷瘤鼠尾静脉注射500 μCi的18F-FDG后进行CLI成像;B:尾静脉注射100 μL的30 mmol/L的荧光素钠后再次进行相同成像条件的CLI成像;C:对荷瘤鼠进行荧光成像;D:对注射荧光素钠前后肿瘤部位信号强度进行定量分析a:P < 0.01,与注射前比较 图 5 荧光素钠增强契伦科夫光信号的在体实验 |
3 讨论
CLI作为一种新型的光学成像方法,使用了临床核医学成像所用的放射性核素,不仅具有荧光光学成像所没有的高信噪比及探针无毒优势,还实现了同一种造影剂的多模式成像,具有极大的临床转化价值。但是CLI光信号强度低,组织穿透性差,且能量主要集中在200~500 nm的蓝紫光波段范围内,严重限制CLI成像在临床应用中的推广。如何改善CLI信号的强度和组织穿透力成为亟待解决的问题。虽然CRETI及SCIFI可以增强放射性核素的光学信号强度,但受限于其毒性仍无法达到临床应用效果。使用无毒荧光材料提高放射性核素光学信号强度,减少放射性核素用量仍然是扩展契伦科夫光应用范围,使其进一步向临床转化的关键。本研究使用3种无毒的荧光材料作为媒介来增强CL信号强度,其中荧光素钠及FITC均通过激发荧光效应实现了CL的信号增强,在保证无毒的前提下有效地改善了CLI成像效果。
四环素作为一种微溶于水的亲癌荧光化合物,曾在20世纪80年代用于大规模人群的胃癌筛查[19]。然而当四环素为溶液状态时,实验结果显示随着四环素溶液浓度的改变,光强未出现明显变化。因为大部分有机荧光材料均含有共轭双键,而共轭双键的多少决定了该荧光材料的荧光效率及量子产量。四环素每个分子中只含有5个共轭双键,数量远小于目前常用的有机荧光染料。而契伦科夫光本身信号强度弱,在四环素低量子产率的背景下很难对其进行有效的二次激发,这就导致了不同浓度的四环素溶液均未对CL光强产生影响。
荧光素钠也是一种临床常用的荧光造影剂,主要应用在眼底血管造影,经紫外灯照射可发出极强的黄绿色光[20]。实验结果显示出荧光素钠可以显著增强光信号强度,最大强度可以提高5倍左右,并且能将紫外波段为主的CL光红移至540 nm附近,在增加信号强度的基础上还提高了穿透深度,实现了一种无毒荧光材料显著增强契伦科夫光信号的方法。当荧光素钠浓度为2 mmol/L时增强CL信号效果最佳,故本研究在进行荷瘤鼠实验时尾静脉注射30 mmol/L的荧光素钠溶液0.1 mL,按荷瘤鼠血液1.5 mL计算[25],能使荷瘤鼠血液中荧光素钠的浓度达到2.0 mmol/L。通过注射前后成像结果对比发现,荧光素钠能使肿瘤部位信号强度提高3.9倍。荧光素钠等荧光素静脉使用后在体内是均匀分布的,并无肿瘤靶向性,但是18F-FDG由于糖代谢作用在肿瘤区域汇聚,其产生的契伦科夫光能被荧光素进行信号增强。因此,相比于周围组织,肿瘤部位的信噪比显著增强。在将来的临床应用中18F-FDG与荧光素混合可以降低契伦科夫成像时核素使用剂量。
与荧光素钠相似,FITC也是一种应用广泛的荧光材料,因其具有价格低廉的特点而应用于生物标记领域,如标记蛋白、脂多糖、亲和素等。早在2011年VAN DAM等[23]就将叶酸连接在FITC上,构建了靶向叶酸受体的荧光探针,并成功在人体中进行了术中导航,证实了FITC的良好荧光特性及安全性。体外实验发现FITC与放射性核素混合后,可以增强光学信号强度,最大可以提高3倍的信号强度。与荧光素钠相似,在荷瘤鼠实验时尾静脉注射15 mmol/L的FITC溶液0.1 mL,能使肿瘤部位信号强度增加2倍。虽然FITC增强效果不如荧光素钠,但是FITC便于进行靶向修饰,使其具有肿瘤特异性,以此来增加肿瘤部位荧光染料的聚集,在增强契伦科夫光学信号的基础上还能对肿瘤部位该荧光探针汇聚情况进行定量,获得更多成像信息。
荧光素钠为临床可用的造影剂,而FITC也被应用于临床的荧光术中导航实验,这些荧光材料均可直接应用于人体。而现有的增强契伦科夫光信号的媒介多为具有潜在毒性的纳米颗粒,限制了该项技术的临床应用。无毒荧光材料与18F-FDG组合使用可提高CL信号强度,具有很好的临床转化潜力。但是这些荧光材料与18F-FDG是相互分离的探针,荧光材料在没有靶向修饰的情况下在血液中是均匀分布的,无法在肿瘤部位实现有效地聚集。如何能将这些荧光染料进一步修饰,实现这些无毒荧光材料肿瘤部位的靶向分布,降低放射性核素的用量,有待进一步研究。
| [1] | THOREK D L, ROBERTSON R, BACCHUS W A, et al. Cerenkov imaging -a new modality for molecular imaging[J]. Am J Nucl Med Mol Imaging, 2012, 2(2): 163–173. |
| [2] | XU Y, LIU H, CHENG Z. Harnessing the power of radio-nuclides for optical imaging: Cerenkov luminescence imaging[J]. J Nucl Med, 2011, 52(12): 2009–2018. DOI:10.2967/jnumed.111.092965 |
| [3] | XU Y, CHANG E, LIU H, et al. Proof-of-concept study of monitoring cancer drug therapy with cerenkov luminescence imaging[J]. J Nucl Med, 2012, 53(2): 312–317. DOI:10.2967/jnumed.111.094623 |
| [4] |
马晓伟, 杨卫东, 汪静. 切伦科夫光学成像研究进展[J].
中华核医学与分子影像杂志, 2012, 32(1): 72–74.
MA X W, YANG W D, WANG J. Progress in cerenkov luminescence imaging[J]. Chin J Nucl Med Mol Imaging, 2012, 32(1): 72–74. DOI:10.3760/cma.j.issn.2095-2848.2012.01.024 |
| [5] | THOREK D L, DAS S, GRIMM J. Molecular imaging using nanoparticle quenchers of Cerenkov luminescence[J]. Small, 2014, 10(18): 3729–3734. DOI:10.1002/smll.201400733 |
| [6] | GROOTENDORST M R, CARIATI M, PINDER S E, et al. Intraoperative assessment of tumor resection margins in breast-conserving surgery using 18F-FDG cerenkov luminescence imaging: a first-in-human feasibility study[J]. J Nucl Med, 2017, 58(6): 891–898. DOI:10.2967/jnumed.116.181032 |
| [7] | LEE S B, YOON G, LEE S W, et al. Combined positron emission tomography and cerenkov luminescence imaging of sentinel lymph nodes using PEGylated radionuclide-embedded gold nanoparticles[J]. Small, 2016, 12(35): 4894–4901. DOI:10.1002/smll.201601721 |
| [8] | HU H, CAO X, KANG F, et al. Feasibility study of novel endoscopic cerenkov luminescence imaging system in detecting and quantifying gastrointestinal disease: first human results[J]. European Radiology, 2015, 25(6): 1814–1822. DOI:10.1007/s00330-014-3574-2 |
| [9] | HU Z, QU Y, WANG K, et al. In vivo nanoparticle-mediated radiopharmaceutical-excited fluorescence molecular imaging[J]. Nature Communications, 2015, 6: 7560. DOI:10.1038/ncomms8560 |
| [10] | BOSCHI F, CALDERAN L, D'AMBROSIO D, et al. In vivo 18F-FDG tumour uptake measurements in small animals using cerenkov radiation[J]. Eur J Nucl Med Mol Imaging, 2011, 38(1): 120–127. DOI:10.1007/s00259-010-1630-y |
| [11] | THOREK D L, RIEDL C C, GRIMM J. Clinical cerenkov luminescence imaging of 18F-FDG[J]. J Nucl Med, 2014, 55(1): 95–98. DOI:10.2967/jnumed.113.127266 |
| [12] | CHIN P T, WELLING M M, MESKERS S C, et al. Optical imaging as an expansion of nuclear medicine: cerenkov-based luminescence vs fluorescence-based luminescence[J]. Eur J Nucl Med Mol Imaging, 2013, 40(8): 1283–1291. DOI:10.1007/s00259-013-2408-9 |
| [13] |
何耘, 屈亚威, 宋天明, 等. 荧光素钠在切伦科夫能量转移中的应用[J].
中华核医学与分子影像杂志, 2015, 35(1): 59–62.
HE Y, QU Y W, SONG T M, et al. Application of fluorescein sodium on cerenkov radiation energy transfer[J]. Chin J Nucl Med Mol Imaging, 2015, 35(1): 59–62. DOI:10.3760/cma.j.issn.2095-2848.2015.01.014 |
| [14] | DOTHAGER R S, GOIFFON R J, JACKSON E, et al. Cerenkov radiation energy transfer (CRET) imaging: a novel method for optical imaging of PET isotopes in biological systems[J]. PLoS ONE, 2010, 5(10): e13300. DOI:10.1371/journal.pone.0013300 |
| [15] | THOREK D L, OGIRALA A, BEATTIE B J, et al. Quantitative imaging of disease signatures through radioactive decay signal conversion[J]. Nat Med, 2013, 19(10): 1345–1350. DOI:10.1038/nm.3323 |
| [16] | SHAFFER T M, PRATT E C, GRIMM J. Utilizing the power of cerenkov light with nanotechnology[J]. Nat Nanotechnol, 2017, 12(2): 106–117. DOI:10.1038/nnano.2016.301 |
| [17] | MA X, KANG F, XU F, et al. Enhancement of cerenkov luminescence imaging by dual excitation of Er3+, Yb3+-doped rare-earth microparticles[J]. PLoS ONE, 2013, 8(10): e77926. DOI:10.1371/journal.pone.0077926 |
| [18] |
玄光善, 孙红梅, 吴效楠, 等. 荧光光谱法研究四环素和牛血清蛋白的荧光猝灭和增敏作用[J].
光谱实验室, 2006, 23(6): 1318–1322.
XUAN G S, SHUN H M, WU X N, et al. The fluorescence quenching and sensitizing interaction between tetracycline and bovine serum albumin by fluorescence spectroscopy[J]. Chin J Spectrosc Lab, 2006, 23(6): 1318–1322. DOI:10.3969/j.issn.1004-8138.2006.06.051 |
| [19] |
聂松. 四环素亲癌现象研究及耳血四环素荧光实验在胃癌普查中的应用[J].
北京医学, 1979, 1(2): 102–105, 130.
NIE S. The study of tetracycline affinity for cancer tissue and application of gastric cancer mass screening by tetracycline test with ear-puncture blood[J]. Beijing Med J, 1979, 1(2): 102–105, 130. DOI:10.15932/j.0253-9713.1979.02.015 |
| [20] | GUDURU A, MARTZ T G, WATERS A, et al. Oxygen saturation of retinal vessels in all stages of diabetic retinopathy and correlation to ultra-wide field fluorescein angiography[J]. Invest Ophthalmol Vis Sci, 2016, 57(13): 5278–5284. DOI:10.1167/iovs.16-20190 |
| [21] | ZHANG Y L, BAI L, LI Z, et al. A lower dose of fluorescein sodium is more suitable for confocal laser endomicroscopy: a feasibility study[J]. Gastrointest Endosc, 2016, 84(6): 917–923. DOI:10.1016/j.gie.2016.05.011 |
| [22] |
连喜军, 鲁晓翔, 刘勤生, 等. 荧光素钠法测定β-葡聚糖含量的研究[J].
食品研究与开发, 2006, 27(10): 116–119.
LIAN X J, LU X X, LIU Q S, et al. The study on determination of Β-GLucan by fluorimetry with sodium fluorescein[J]. Food Res Dev, 2006, 27(10): 116–119. DOI:10.3969/j.issn.1005-6521.2006.10.039 |
| [23] | VAN DAM G M, THEMELIS G, CRANE L M, et al. Intraoperative tumor-specific fluorescence imaging in ovarian cancer by folate receptor-α targeting: first in-human results[J]. Nat Med, 2011, 17(10): 1315–1319. DOI:10.1038/nm.2472 |
| [24] | CONTI P S, LILIEN D L, HAWLEY K, et al. PET and 18F-FDG in oncology: a clinical update[J]. Nucl Med Biol, 1996, 23(6): 717–735. DOI:10.1016/0969-8051(96)00074-1 |
| [25] |
何诚. 实验动物学[M]. 北京: 中国农业大学出版社, 2005: 67-81.
HE C. Laboratory animal science[M]. Beijing: China Agricultural University Press, 2005: 67-81. |



