铁离子是细胞生存、代谢所必需的微量元素,它在DNA合成、红细胞生成、线粒体的生物合成、能量代谢及氧化呼吸链中都起着非常重要的作用。铁离子主要储存在细胞内的铁蛋白和铁池中。细胞内铁浓度主要受铁调素调控,铁调素在肝脏快速合成,如果血清铁过量,肝脏快速合成大量铁调素,并通过降解铁转运蛋白(ferroportin,FPN)防止细胞内铁向血清中转移。而细胞内铁过载,就通过FNP释放,以防止铁离子浓度过高,对细胞产生毒性作用[1]。
有氧呼吸的细胞都能产生ROS,其主要生成部位包括线粒体、内质网、质膜以及细胞质[2]。ROS是一类有氧代谢的产物的总称,主要包括超氧化物、过氧化氢、单线态氧、臭氧、次卤酸和有机过氧化物,这些氧化物灭活受非抗氧化酶类物质和抗氧化酶调节[3]。生理情况下,ROS可以调节一类蛋白质的表达,如张力蛋白同源的磷酸酯酶(PTEN)、表皮生长因子受体(EGFR)、蛋白激酶及组蛋白去乙酰化酶等[4-7]。巨噬细胞通过产生ROS杀灭吞噬的病原体而发挥灭菌活性[8]。
巨噬细胞按照免疫学分型可分为经典激活型(M1)和替代激活型(M2)。M1型巨噬细胞主要表现出促进炎症及肿瘤抑制效应,M2型巨噬细胞则是抑制炎症,促进肿瘤发展的效应[9]。另外,巨噬细胞在机体铁代谢中也起重要作用。巨噬细胞通过吞噬衰老红细胞及其他受体、离子通道获取铁,如FPN、TfR、CD91、DMT-1、CD163等。同时,一些研究已证实,M1型巨噬细胞是一种铁隔离型细胞,它将铁储存于细胞质内,同时高表达DMT-1、CD91、铁调素、铁蛋白及血浆铜蓝蛋白,而低表达TfR、FPN[10]。另外,也有一些研究显示铁离子能够促巨噬细胞M1型极化[11-12]。但是,铁离子是如何促进巨噬细胞极化尚无明确的定论。
目前,有研究显示肿瘤相关蛋白53(tumor associated protein 53,p53)在巨噬细胞的极化中起调节作用[13], 其高表达能够促进巨噬细胞向M1型极化,然而乙酰化p53在巨噬细胞极化方面的作用还未得到明确的研究。本研究通过观察巨噬细胞在铁过载的情况下p53乙酰化的水平,发现ROS过量产生,促进p53乙酰化,最终促进巨噬细胞M1极化。
1 材料与方法 1.1 材料及主要试剂小鼠巨噬细胞系RAW 264.7细胞,小鼠肝癌细胞系H22细胞均为本实验室冻存;胎牛血清、胰酶、DMEM高糖细胞培养液均购自HyClone公司(美国);柠檬酸铁购自Sigma-Aldrich公司(美国);还原性谷胱甘肽购自重庆药友制药公司(中国);p300/CBP抑制剂购自Abcam公司(美国);ROS检测试剂盒、超氧化物阴离子荧光探针购自碧云天公司(中国);p53、乙酰化p53、CD86和CD206单克隆抗体购自Cell Signaling Technology公司(美国);IL-1β、IL-10、TGF-β和TNF-α单克隆抗体购自GeneTex公司(美国);Fitc标记的CD86、APC标记的CD206单克隆抗体购自Thermo Fisher Scientific公司(美国);TRNzol总RNA提取试剂、反转录试剂盒及荧光定量PCR试剂盒购于TaKaRa公司(日本),PCR引物均购自上海生工公司(中国)。
1.2 方法 1.2.1 细胞培养RAW细胞和H22细胞接种于含10%胎牛血清,1%青霉素-链霉素双抗的DMEM培养基,并培养于37 ℃、5%二氧化碳的饱和湿度、恒定温度培养箱。
1.2.2 铁剂、GSH及p300/CBP抑制剂配制精确称取2.5 mg柠檬酸铁,溶于1 mL超纯水中,并用0.2 μm过滤器过滤,避免细菌污染,即用即配,避免长时间放置,溶液呈酸性。该浓度铁剂按文献报道[10]确定,避免浓度过高对细胞产生毒性,6孔板中的细胞每次加入1.8 mL新鲜培养基和0.2 mL新鲜配制的铁剂。GSH 0.6 g溶于6 mL培养基,加入1.8 mL含有GSH的培养基到6孔板,再加入0.2 mL铁剂处理。p300/CBP 1 mg溶于89.8 mL DMSO中(25 mmol/L),加入抑制剂与培养基的比例为1:1 000~3:1 000,巨噬细胞用p300/CBP抑制剂预处理50~60 min,随后添加铁剂。
1.2.3 BALB/c裸鼠皮下肝癌模型的建立及皮下瘤组织免疫荧光实验取8只6~8周龄BALB/c裸鼠,随机分为2组:铁剂处理组和对照组,处理组尾静脉注射200 μL无菌柠檬酸铁溶液(25 g/L),对照组裸鼠注射200 μL PBS溶液。连续注射3 d,第4天将H22细胞和RAW巨噬细胞以4:1比例混匀注入裸鼠皮下。每3天测量1次皮下瘤体积,肿瘤体积计算方法:肿瘤体积计算公式=长径×(宽度2)/2。第21天处死裸鼠,完整取下皮下瘤,称量并用于免疫荧光实验。免疫荧光步骤如下,取下皮下瘤组织,液氮保存;连续冰冻切片厚度3~5 mm;丙酮4 ℃固定10 min;5%山羊血清室温封闭15 min;每张片子加入50~100 μL CD86和F4/80单克隆抗体(1:50浓度稀释);4 ℃过夜孵育;PBS清洗3次×5 min;滴加对应的荧光二抗(1:50浓度稀释),避光室温孵育1 h;PBS清洗3次× 5 min;滴加DAPI孵育5 min;PBS清洗3次×5 min;抗荧光淬灭剂封片,于荧光显微镜下观察及采图。
1.2.4 Western blot实验RAW巨噬细胞经铁离子刺激不同时间后,提取细胞总蛋白,蛋白经BCA法测定浓度,测定后取200 μL蛋白样品与50 μL上样缓冲液混匀,100 ℃× 10 min变性蛋白。按30 mg/孔上样进行电泳、转膜。所得条带经5% BSA封闭60 min;分别加入GAPDH抗体(1:5 000浓度稀释)及p53、乙酰化p53、IL-10、IL-1β、TNF-α、TGF-β抗体(均为1:1 000浓度稀释),4 ℃过夜孵育;PBST清洗3遍×5 min;分别加入对应的二抗(1:1 000浓度稀释)37 ℃孵育1 h;PBST清洗3遍× 5 min;ECL化学发光显影。
1.2.5 qRT-PCR实验使用TRIzol试剂(Invitrogen公司,美国)提取RAW细胞内的总RNA,按产品说明书步骤进行;所得RNA通过分光光度计检测浓度;使用TaKaRa反转录试剂盒(日本)和T100 PCR仪(Bio-Rad, 美国)进行反转录,按产品说明书步骤进行;反转录后所得cDNA使用SYBR®-Green(TaKaRa公司,日本)和荧光定量PCR检测系统(Bio-Rad,美国)进行qRT-PCR检测,按说明书步骤进行。qRT-PCR检测核酸表达,以GAPDH为内参。相关引物信息见表 1。
| 引物名称 | 引物序列(5′→3′) | 产物大小(bp) |
| CD206 | 上游GGGACTCTGGATTGGACTCA 下游CCAGGCTCTGATGATGGACT |
114 |
| Arg-1 | 上游TTTAGGGTTACGGCCGGTG 下游TTTGAGAAAGGCGCTCCGAT |
130 |
| TNF-α | 上游GGATCTCAAAGACAACCAAC 下游ACAGAGCAATGACTCCAAAG |
347 |
| iNOS | 上游CTGCAGCACTTGGATCAGGAACCTG 下游GGAGTAGCCTGTGTGCACCTGGAA |
310 |
| p53 | 上游GAGGATTCACAGTCGGATA 下游ATCATCTGGAGGAAGAAGTT |
87 |
| GAPDH | 上游CACCCACTCCTCCACCTTTG 下游CCACCACCCTGTTGCTGTAG |
220 |
1.2.6 流式细胞实验
种植于6孔板的RAW巨噬细胞经铁剂(Iron)、GSH(Iron+GSH)及对照(Control)处理后,用0.25%胰酶消化细胞,计数细胞,约1×106,离心后移除上清液,用3%多聚甲醛固定细胞5 min,离心后移除上清液;0.3%Triton X-100通透5 min,加入FITC-CD86抗体(0.125 mg/管)和APC-CD206抗体(0.2 mg/管),抗体使用200 μL PBS配置,冰上孵育30 min,离心去上清液,PBS清洗3次,进行流式细胞实验分析。
1.2.7 ROS检测定性方法:RAW巨噬细胞种植于6孔板中,经过不同处理后,PBS清洗3次,加入2 mL无血清培养基,再加入2 μL DCFH-DA(2, 7-Dichlorodi-hydrofluorescein)探针,37 ℃孵育30 min,然后用无血清培养基清洗3次,于荧光显微镜下观察。定量方法:RAW巨噬细胞种植于96孔板,按上述比例及方法装载探针,将酶标仪设置488 nm激发波长,525 nm发射波长进行读数。皮下瘤组织内活性氧测定方法:取新鲜皮下瘤组织冰冻切片,滴加超氧化物阴离子荧光探针(dihydroethidium,DHE),均匀覆盖肿瘤组织切片,浓度为0.5~5 μmol/L,37 ℃孵育30 min,PBS清洗3次,使用DAPI染核(室温孵育10 min),PBS清洗3次,抗荧光淬灭剂封片,于显微镜下观察;氧化后的DHE受激发后呈红色荧光,定位于细胞核内。
1.3 统计学分析采用SPSS 17.0统计软件分析数据,数据以x±s表示,进行正态性、方差齐性检验,两样本均数比较采用独立样本t检验。采用GraphPad Prism 5软件制图。
2 结果 2.1 铁离子促巨噬细胞内ROS表达,抑制ROS减弱极化效应使用过滤后的柠檬酸铁溶液(2.5 mg/mL)、柠檬酸铁溶液+GSH(0.1 g/mL)和PBS(对照组)刺激RAW 264.7细胞2 h,使用DCFH-DA来检测细胞内ROS产生的水平,图 1A中荧光强度表示ROS产生的水平,可见铁离子刺激后ROS大量产生,同时,GSH能够减少ROS;图 1B为酶标仪检测结果,与荧光显微镜观察结果相似(P < 0.05)。图 1C~E分别验证了铁离子促M1型巨噬细胞标记物高表达,说明铁离子明显促巨噬细胞向M1型极化,同时在GSH组中,铁离子促极化效应有减弱。说明GSH可能通过抑制ROS,减弱了铁离子的促极化效应。
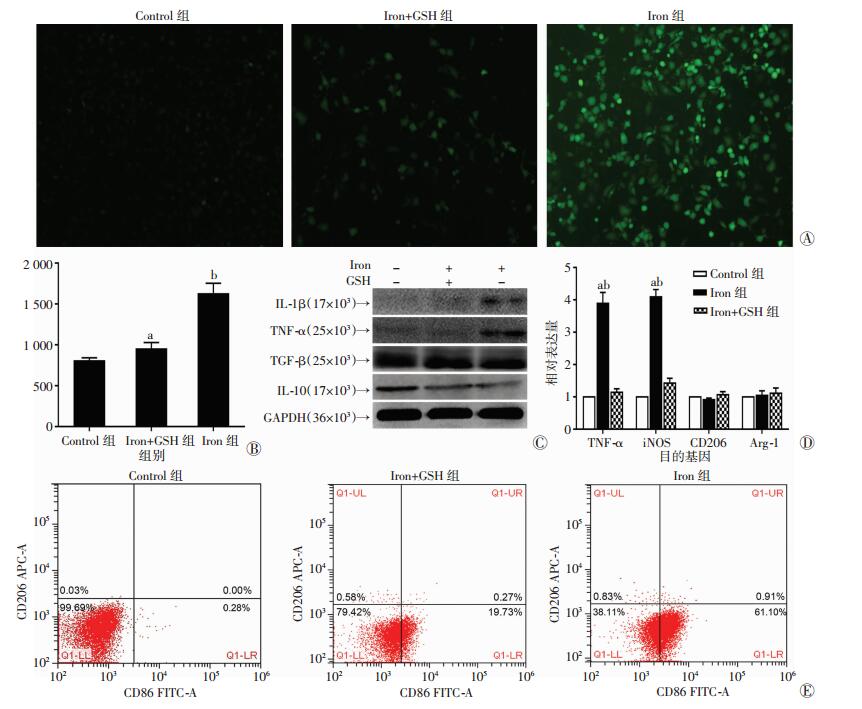
|
| A:DCFH-DA探针检测细胞内活性氧水平(×200);B:酶标仪检测细胞内活性氧水平a:P < 0.05,b:P < 0.01,与Control组比较;C:Western blot检测巨噬细胞内M1极化标记物IL-1β、TNF-α和M2极化标记物TGF-β、IL-10蛋白表达;D:qRT-PCR检测巨噬细胞内M1极化标记物TNF-α、iNOS和M2极化标记物CD206、Arg-1 RNA表达a:P < 0.01,与Control组比较;b:P < 0.01,与Iron+GSH组比较;E:流式细胞仪检测巨噬细胞内M1极化标记物CD86和M2极化标记物CD206蛋白表达 图 1 铁离子促巨噬细胞内ROS表达,抑制ROS减弱极化效应 |
2.2 ROS产生诱导P53的表达
p53蛋白随着铁剂处理时间的延长,表达逐渐增加(图 2A、B)。同时,巨噬细胞在接受GSH和铁剂共同刺激的情况下,p53表达明显低于仅使用铁剂刺激的细胞(图 2C、D)。说明抑制ROS能够下调p53蛋白的表达并抑制M1型极化,表明p53可能参与了ROS诱导巨噬细胞向M1型极化的过程。
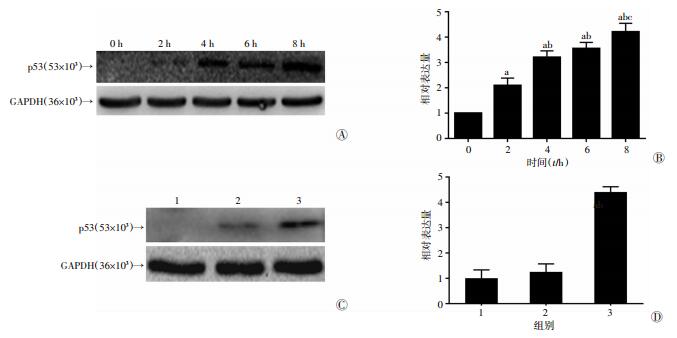
|
| A:Western blot检测铁剂刺激后不同时间巨噬细胞内p53蛋白的表达;B:qRT-PCR检测铁剂刺激不同时间后巨噬细胞内p53 RNA的表达a:P < 0.01,与0 h比较;b:P < 0.01,与2 h比较;c:P < 0.01,与4 h比较;C:Western blot检测巨噬细胞内p53蛋白的表达1:Control组;2:Iron+GSH组;3:Iron组;D:qRT-PCR检测巨噬细胞内p53 RNA的表达1:Control组;2:Iron+GSH组;3:Iron组;a:P < 0.01,与Control组比较;b:P < 0.01,与Iron+GSH组比较 图 2 ROS诱导p53蛋白表达 |
野生型p53并非是p53的活化形式,正常情况下,p53蛋白通过泛素化迅速降解,所以细胞内含量并不高,只是在肿瘤细胞中,突变型的p53蛋白能够大量累积。因此,我们设想,在参与巨噬细胞极化的过程中,p53可能存在某种激活形式。
2.3 ROS诱导p53乙酰化,抑制p53乙酰化逆转铁离子的促M1型极化效应随后的实验结果显示:乙酰化p53和p53一样,随着铁剂刺激的时间延长而增加。所以,将乙酰化p53和p53的比值进行分析,结果显示:经过铁剂刺激后的巨噬细胞,其乙酰化p53和p53的比值明显增大(P < 0.01),说明铁剂刺激后,巨噬细胞内乙酰化p53表达增加(图 3A、B)。为了验证乙酰化p53参与了ROS诱发的M1型极化,使用p300/CBP抑制剂来抑制p53的乙酰化,Western blot检测发现,p300/CBP抑制剂能够明显抑制p53的乙酰化,但并不影响p53的表达,而GSH则同时抑制p53表达和乙酰化(图 3C、D)。随后,再通过Western blot、qRT-PCR检测巨噬细胞极化的标记物,发现p300/CBP抑制剂和GSH都能够抑制铁剂刺激引起的M1型极化(图 3E、F)。这些结果说明ROS可能通过乙酰化p53来调控铁剂诱导的M1型极化。
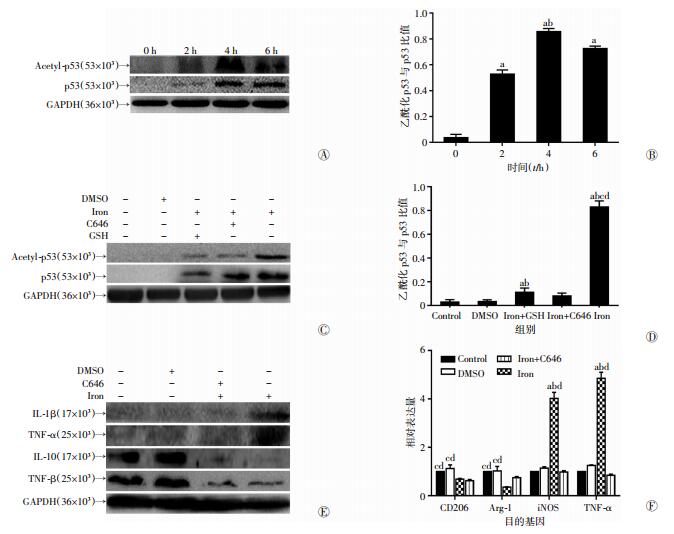
|
| A、B:分别为Western blot检测、分析巨噬细胞受铁刺激后p53乙酰化与刺激时间的关系a:P < 0.01,与0 h比较;b:P < 0.05,与2 h比较;C、D:分别为Western blot检测、分析GSH和p300/CBP抑制剂与铁剂共同刺激巨噬细胞后乙酰化p53表达的改变a:P < 0.05,与Control比较;b:P < 0.05,与DMSO组比较;c:P < 0.01,与Iron+GSH组比较;d:P < 0.01,与Iron+C646组比较;E、F:qRT-PCR、Western blot检测p300/CBP抑制剂对巨噬细胞极化的抑制效应a:P < 0.01,与Control组比较;b:P < 0.01,与DMSO组比较;c:P < 0.05,与Iron组比较;d:P < 0.05,与Iron+C646组比较 图 3 ROS通过乙酰化p53调节巨噬细胞M1型极化 |
2.4 铁剂诱导裸鼠皮下瘤内巨噬细胞向M1型极化
由于M1型巨噬细胞具有很强的抗肿瘤效应,因此,本研究通过尾静脉注射的方式提高裸鼠体内的铁含量,然后进行裸鼠皮下成瘤实验(图 4A)。结果显示接受铁剂处理后的裸鼠皮下瘤体积和质量均小于对照组(P < 0.05,图 4B、C)。

|
| A:裸鼠模型及肿瘤大体形态观察;B:肿瘤体积差异统计(n=8, x±s)a:P < 0.01,与Control组比较;C:肿瘤质量差异统计(n=8, x±s)a:P < 0.01,与Control组比较;D:皮下瘤组织冰冻切片,通过免疫组织荧光观察肿瘤内巨噬细胞极化指标(×400),F4/86(红光)为巨噬细胞标记物,CD86(绿光)为M1型巨噬细胞标记物,DAPI(蓝光)为细胞核染色;E:氧化性DHE(红光)定位于细胞核内,DAPI为细胞核(蓝光)(×400) 图 4 铁剂诱导裸鼠皮下瘤内巨噬细胞向M1型极化 |
采用组织免疫荧光染色观察皮下瘤组织内CD86和F4/80蛋白的表达,结果显示两组裸鼠皮下瘤内F4/80标记的巨噬细胞量差异不大,但铁剂处理组皮下瘤组织内较多表达CD86,明显高于对照组(图 4D)。CD86是M1型巨噬细胞标记物,说明铁剂处理组裸鼠皮下瘤内巨噬细胞明显向M1型极化,而较多的文献已经证实,肿瘤内的巨噬细胞(tumor-associated-macrophage, TAM)主要呈M2型极化。因此,这些结果说明铁剂能够明显改变巨噬细胞的极化状态,促进其M1型极化,随后M1型极化的巨噬细胞抑制了H22肿瘤细胞的生长。同时,本研究通过超氧化物阴离子荧光探针(DHE)检测了肿瘤组织内的活性氧水平(图 4E),通过观察定位于核内的红色荧光数量,发现经铁剂处理后的小鼠皮下瘤内具有更高水平的活性氧物质,提示铁剂可能通过提高巨噬细胞ROS水平,促进了巨噬细胞的极化。
3 讨论肝脏及网状内皮窦系统内的巨噬细胞在铁代谢中起非常关键的作用,二者既是机体铁储存系统,也是机体铁代谢的调节系统[13-14]。铁离子浓度的变化可以改变巨噬细胞的极化状态,但是具体机制还未得到深入研究。本研究观察到细胞内铁过载能促进巨噬细胞内ROS水平升高,该现象可能通过Fenton反应实现,即Fe2+ + H2O2→Fe3+ + OH-+OH。在ROS大量产生的同时,也观察到巨噬细胞明显的向M1型极化;随后,本研究使用还原型谷胱甘肽降低细胞内ROS的水平,减少ROS后,巨噬细胞M1型极化也减少,提示铁离子通过诱导ROS的产生,促进了巨噬细胞M1型极化。
大量产生的ROS因其强氧化性能够损伤细胞DNA、细胞膜等结构,而p53蛋白在DNA修复中起着重要的作用[15],同时也有一些研究表明p53蛋白参与了巨噬细胞极化形式的调节[16-17],因此,我们推测p53蛋白可能参与了ROS诱导巨噬细胞向M1型极化的过程,在随后的实验中,通过Western blot,qRT-PCR检测了p53蛋白的表达。发现p53表达随铁剂刺激时间延长而增加,同时抑制ROS后,铁剂不再促p53增加,这一结果说明铁剂可能通过诱导ROS产生,刺激p53表达,从而加强M1型极化。
在研究中,我们也发现乙酰化p53和p53表达趋势相同,即随铁剂刺激时间延长表达逐渐增加。通过分析乙酰化p53和p53的比值,发现铁剂刺激后,该比值上升,说明在p53表达增加的基础上,乙酰化p53增加更明显,同时,抑制ROS后,乙酰化p53也降低。p53的乙酰化主要受p300和CBP乙酰化转移酶的调节[18-19],为了验证乙酰化p53参与了巨噬细胞极化的过程,我们通过p300/CBP乙酰化转移酶抑制剂,抑制p53的乙酰化酶(p300和CBP乙酰化转移酶)。结果显示,抑制p300/CBP转移酶后,p53乙酰化明显减少而总p53减少不明显,同时,巨噬细胞M1型极化也减弱。这些结果说明,乙酰化p53也参与了经铁刺激后的巨噬细胞M1型极化。
综上所述,铁离子诱导巨噬细胞内ROS产生,ROS产生后,通过某种效应,促进了p53的乙酰化,最终促进巨噬细胞向M1型极化。但是ROS是通过何种效应促进p53乙酰化最终引起巨噬细胞M1极化,还需要更深入的研究。
目前,针对铁剂对巨噬细胞极化方向的研究还较少,但大多数研究[11-12]显示巨噬细胞铁过载后,向促炎型巨噬细胞极化,该过程可能是巨噬细胞杀灭病原体的机制之一,巨噬细胞通过隔离细菌生长所需的铁离子,从而达到抑制细菌生长的作用。但是,铁负载是通过何种机制引起巨噬细胞极化,还未得到明确的研究。本研究显示铁剂通过诱导ROS产生,并增强p53的乙酰化,促进了巨噬细胞M1型极化,该过程可能与p53乙酰化转移酶(p300/CBP)活性增高有关,本研究探讨了乙酰化p53在巨噬细胞极化中的作用。这项研究可能为肿瘤的免疫治疗提供了潜在的方法,即靶向提高肿瘤相关巨噬细胞内铁离子含量,促进巨噬细胞向M1型极化,从而抑制肿瘤生长的效应。但是在增加巨噬细胞铁离子含量的过程中,难免会导致机体铁或其他细胞内铁过载,而引起一系列的副反应,如内皮细胞、肝细胞氧化应激、损伤或者坏死,甚至肝脏、肾脏受损等[20-23]。所以,如何靶向提高巨噬细胞内的铁含量(如与新型材料结合等方法)还需要更加深入的研究。
| [1] | DEV S, BABITT J L. Overview of iron metabolism in health and disease[J]. Hemodial Int, 2017, 21(Suppl 1): S6–S20. DOI:10.1111/hdi.12542 |
| [2] | ANDREYEV A Y, KUSHNAREVA Y E, MURPHY A N, et al. Mitochondrial ROS metabolism: 10 years later[J]. Biochemistry Mosc, 2015, 80(5): 517–531. DOI:10.1134/S0006297915050028 |
| [3] | FRANSEN M, NORDGREN M, WANG B, et al. Role of peroxisomes in ROS/RNS-metabolism: implications for human disease[J]. Biochim Biophys Acta, 2012, 1822(9): 1363–1373. DOI:10.1016/j.bbadis.2011.12.001 |
| [4] | AHIR M, BHATTACHARYA S, KARMAKAR S, et al. Tailored-CuO-nanowire decorated with folic acid mediated coupling of the mitochondrial-ROS generation and miR425-PTEN axis in furnishing potent anti-cancer activity in human triple negative breast carcinoma cells[J]. Biomaterials, 2016, 76: 115–132. DOI:10.1016/j.biomaterials.2015.10.044 |
| [5] | XU Z, ZHAO Y, ZHONG P, et al. EGFR inhibition attenuates diabetic nephropathy through decreasing ROS and endoplasmic reticulum stress[J]. Oncotarget, 2017, 8(20): 32655–32667. DOI:10.18632/oncotarget.15948 |
| [6] | MACKAY C E, SHAIFTA Y, SNETKOV V V, et al. ROS-dependent activation of RhoA/Rho-kinase in pulmonary artery: Role of Src-family kinases and ARHGEF1[J]. Free Radic Biol Med, 2017, 110: 316–331. DOI:10.1016/j.freeradbiomed.2017.06.022 |
| [7] | BAI J, LEI Y, AN G L, et al. Down-regulation of deacetylase HDAC6 inhibits the melanoma cell line A375.S2 growth through ROS-dependent mitochondrial pathway[J]. PLoS ONE, 2015, 10(3): e0121247. DOI:10.1371/journal.pone.0121247 |
| [8] | KIM J H, LEE J, BAE S J, et al. NADPH oxidase 4 is required for the generation of macrophage migration inhibitory factor and host defense against Toxoplasma gondii infection[J]. Sci Rep, 2017, 7(1): 6361. DOI:10.1038/s41598-017-06610-4 |
| [9] | MURRAY P J, ALLEN J E, BISWAS S K, et al. Macrophage activation and polarization: nomenclature and experimental guidelines[J]. Immunity, 2014, 41(1): 14–20. DOI:10.1016/j.immuni.2014.06.008 |
| [10] | ZANGANEH S, HUTTER G, SPITLER R, et al. Iron oxide nanoparticles inhibit tumour growth by inducing pro-inflammatory macrophage polarization in tumour tissues[J]. Nat Nanotechnol, 2016, 11(11): 986–994. DOI:10.1038/nnano.2016.168 |
| [11] | GAN Z S, WANG Q Q, LI J H, et al. Iron reduces M1 macrophage polarization in RAW264.7 macrophages associated with inhibition of STAT1[J]. Mediators Inflamm, 2017, 2017: 8570818. DOI:10.1155/2017/8570818 |
| [12] | JUNG M, MERTENS C, BRÜNE B. Macrophage iron homeostasis and polarization in the context of cancer[J]. Immunobiology, 2015, 220(2): 295–304. DOI:10.1016/j.imbio.2014.09.011 |
| [13] | VON D A, ADAMSON J W. Iron metabolism in man[J]. JPEN J Parenter Enteral Nutr, 2013, 37(5): 599–606. DOI:10.1177/0148607112459648 |
| [14] | ANDERSON E R, SHAH Y M. Iron homeostasis in the liver[J]. Compr Physiol, 2013, 3(1): 315–330. DOI:10.1002/cphy.c120016 |
| [15] | BARAN K, YANG M, DILLON C P, et al. The proline rich domain of p53 is dispensable for MGMT-dependent DNA repair and cell survival following alkylation damage[J]. Cell Death Differ, 2017, 24(11): 1925–1936. DOI:10.1038/cdd.2017.116 |
| [16] | LI L, NG DS, MAH W C, et al. A unique role for p53 in the regulation of M2 macrophage polarization[J]. Cell Death Differ, 2015, 22(7): 1081–1093. DOI:10.1038/cdd.2014.212 |
| [17] | LOWE J M, MENENDEZ D, BUSHEL P R, et al. p53 and NF-κB coregulate proinflammatory gene responses in human macrophages[J]. Cancer Res, 2014, 74(8): 2182–2192. DOI:10.1158/0008-5472.CAN-13-1070 |
| [18] | ZHENG S, KOH X Y, GOH H C, et al. Inhibiting p53 acetylation reduces cancer chemotoxicity[J]. Cancer Res, 2017, 77(16): 4342–4354. DOI:10.1158/0008-5472.CAN-17-0424 |
| [19] | RADA M, VASILEVA E, LEZINA L, et al. Human EHMT2/G9a activates p53 through methylation-independent mechanism[J]. Oncogene, 2017, 36(7): 922–932. DOI:10.1038/onc.2016.258 |
| [20] | SOUTH P K, LEVANDER O A, SMITH A D. Effects of dietary iron overload on glutathione peroxidase knockout mice[J]. Biol Trace Elem Res, 2002, 88(1): 79–85. DOI:10.1385/BTER:88:1:79 |
| [21] | PILO F, ANGELUCCI E. A storm in the niche: Iron, oxidative stress and haemopoiesis[J]. Blood Rev, 2017. DOI:10.1016/j.blre.2017.08.005 |
| [22] | SHAW J, CHAKRABORTY A, NAG A, et al. Intracellular iron overload leading to DNA damage of lymphocytes and immune dysfunction in thalassemia major patients[J]. Eur J Haematol, 2017, 99(5): 399–408. DOI:10.1111/ejh.12936 |
| [23] | PARK C Y, CHUNG J, KOO K O, et al. Hepatic iron storage is related to body adiposity and hepatic inflammation[J]. Nutr Metab (Lond), 2017, 14: 14. DOI:10.1186/s12986-017-0169-3 |



