非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种肝脏脂质蓄积性疾病,主要表现为单纯的肝脏脂肪变性或非酒精性脂肪性肝炎,随疾病进展有可能发展为肝硬化,甚至肝细胞癌。研究发现富含甘油三酯(triglycerides,TG)脂质核心的脂滴异常蓄积是导致NAFLD发生的重要机制[1]。围脂滴蛋白(perilipins)家族是脂滴表面含量最多且特点明确的蛋白,其生理功能是促进中性脂质存储于脂滴。动物和细胞研究发现,该家族中PLIN2是人和啮齿类动物肝细胞中的主要脂滴蛋白[2],参与调控脂质代谢,可作为治疗和预防NAFLD的潜在靶点[2]。然而,PLIN2调节脂滴代谢的机制尚未明确。
研究表明,白藜芦醇(resveratrol,RSV)具有抗炎、降脂等作用[3-5],可以通过激活蛋白激酶A(protein kinase,PKA)相关信号通路,诱导自噬,从而减轻肝脂肪变性[6]。除调控自噬以外,RSV对于NAFLD发生、发展的其他因素(如脂滴脂解等)是否也具有改善作用还有待进一步研究。本研究将利用脂肪变性HepG2细胞[7-8],应用PKA抑制剂(protein kinase inhibitor,PKI)和PLIN2 siRNA转染处理,探究RSV对肝细胞脂滴脂解的影响以及PKA和PLIN2在其中的作用。
1 材料与方法 1.1 细胞及其来源人肝癌细胞株(HepG2)购于美国ATCC细胞库。
1.2 主要试剂DMEM高糖培养基、DMEM高糖培养基(无酚红)、胎牛血清以及胰蛋白酶购自美国HyClone公司,谷氨酰胺(GlutaMAXTM Supplement)购自美国Gibco公司,RSV(纯度≥99%,HPLC级)、棕榈酸、游离甘油检测试剂、甘油标准品均购自美国Sigma公司,TG检测试剂盒购自中国南京建成生物工程所,引物由中国生工生物工程(上海)股份有限公司设计并合成,RNA提取试剂、逆转录试剂盒及定量PCR试剂盒购自中国宝生物工程有限公司,PKA活性检测试剂盒购自美国ArborAssays公司,β-actin抗体购自中国北京中杉金桥公司,围脂滴蛋白PLIN2抗体购自英国Abcam公司,PVDF膜购自美国Merck Millipore公司。
1.3 细胞培养与实验分组使用含10%胎牛血清和GlutaMAXTM的DMEM高糖培养基培养HepG2细胞,融合度达70%~80%时进行传代。前期研究及预实验发现采用0.2 mmo/L及以上浓度棕榈酸(palmitic acid, PA)[6]处理HepG2细胞后,细胞活力呈剂量依赖性下降,并且细胞内甘油三酯水平、脂滴数量及大小与对照组比较呈剂量依赖性升高(P<0.05),故本实验均采用0.2 mmol/L的PA处理HepG2细胞24 h,建立脂肪变性细胞模型。模型建立后,吸弃原培养基后加入含有不同浓度RSV的新鲜培养基再继续干预24 h。实验分为对照组、PA组、PA+RSV 10 μmol/L组、PA+RSV 20 μmol/L组、PA+RSV 40 μmol/L组、PA+RSV 80 μmol/L组。
1.4 油红O染色按分组接种好的细胞,用4%多聚甲醛固定,37 ℃油红染色30 min,苏木精复染核。于倒置显微镜下观察细胞内脂滴形成情况。
1.5 免疫荧光染色细胞爬片干预后,使用4%多聚甲醛固定,之后使用羊血清液室温封闭,一抗4 ℃孵育过夜,第2天进行二抗孵育以及DAPI复染核,最后使用防荧光淬灭封片液封片,在荧光显微镜下观察围脂滴蛋白的情况。
1.6 细胞TG含量测定按分组将HepG2细胞按1.5×105/孔接种于6孔板中,药物干预后,收集细胞,按照说明书采用GPO-PAP酶法进行细胞TG的检测。
1.7 Western blot检测蛋白表达将各组的细胞收集提取总蛋白,使用12%的聚丙烯酰胺凝胶进行电泳,湿法转印蛋白至PVDF膜。室温封闭2 h,一抗(1:1 000)4 ℃孵育过夜,于第2天二抗(1:5 000)室温孵育1 h,并使用VILBER FUSION FX7成像系统曝光,Gel-Pro_analyzer分析条带灰度值。
1.8 Real-time qPCR检测mRNA表达按4×104/孔接种细胞到24孔板,药物干预后,收集细胞,使用TRIzol裂解细胞;加入三氯甲烷分离RNA,使用异丙醇、75%乙醇分离RNA;使用TaKaRa反转录和PCR试剂进行RT-PCR,步骤按照说明书进行。mRNA的表达使用△△Ct法计算。
1.9 抑制PLIN2表达或者抑制PKA活性对RSV效应的影响PA处理细胞24 h后,使用Lipofectamine 2000脂质体转染PLIN2 siRNA或者PKI过表达质粒[PLIN2 siRNA购自美国Santa Cruz公司,PKI过表达质粒由中国生工生物工程(上海)股份有限公司合成]6 h,更换新鲜培养基后加入实验浓度的药物干预24 h,检测各组培养液游离甘油含量。实验分为对照组、PA组、PA+RSV 40 μmol/L组(PA+RSV组)、PKI(或PLIN2 siRNA)组、PA+PKI(或PLIN2 siRNA)组、PA+RSV 40 μmol/L+PKI(或PLIN2 siRNA)组(PA+RSV+PKI组或PA+RSV+PLIN2 siRNA组)。
1.10 统计学分析所有实验重复3次,数据采用Excel录入,计量资料用x±s表示,应用GraghPad 5.0软件进行统计绘图,SPSS 22.0进行统计学分析,多组间使用单因素方差分析,使用Tukey's Multiple Comparison Test进行多重比较,转染前后效应间比较使用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 RSV改善HepG2细胞脂肪变性 2.1.1 RSV减轻脂肪变性HepG2细胞脂滴的蓄积PA处理HepG2细胞24 h后,脂滴变得更大、更多;不同浓度RSV干预后,细胞内脂滴蓄积程度随RSV浓度的升高而降低(图 1)。
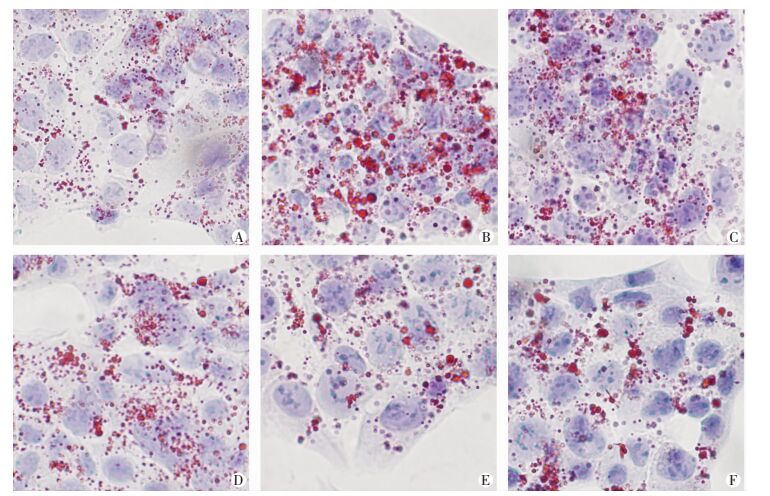
|
| A:对照组;B:PA组;C:PA+RSV 10 μmol/L组;D:PA+RSV 20 μmol/L组;E:PA+RSV 40 μmol/L组;F:PA+RSV 80 μmol/L组 图 1 油红O染色观察脂肪变性HepG2细胞脂滴的蓄积程度(LM ×400) |
2.1.2 RSV降低脂肪变性HepG2细胞内的TG含量
PA处理细胞24 h建模成功后,HepG2细胞内TG含量显著增加(P<0.05),不同浓度(0、10、20、40、80 μmol/L)的RSV干预后,40、80 μmol/L RSV干预可以显著降低脂肪变性的HepG2细胞内TG含量(P<0.05,图 2)。因此,后续RSV干预浓度选择40 μmol/L。
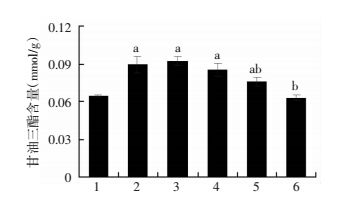
|
| 1:对照组;2:PA组;3:PA+RSV 10 μmol/L组;4:PA+RSV 20 μmol/L组;5:PA+RSV 40 μmol/L组;6:PA+RSV 80 μmol/L组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较 图 2 GPO-PAP酶法检测HepG2细胞内的TG含量 |
2.2 RSV促进脂肪变性HepG2细胞的脂滴脂解
PA处理24 h建模后,不同浓度RSV干预后,培养液中的游离甘油含量呈剂量依赖性升高,表明细胞内游离甘油的生成并向细胞外的分泌显著增加(图 3)。
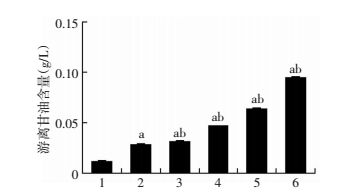
|
| 1:对照组;2:PA组;3:PA+RSV 10 μmol/L组;4:PA+RSV 20 μmol/L组;5:PA+RSV 40 μmol/L组;6:PA+RSV 80 μmol/L组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较 图 3 偶联酶反应法检测HepG2细胞培养液中的游离甘油含量 |
2.3 RSV上调脂肪变性肝细胞PLIN2 mRNA和蛋白表达
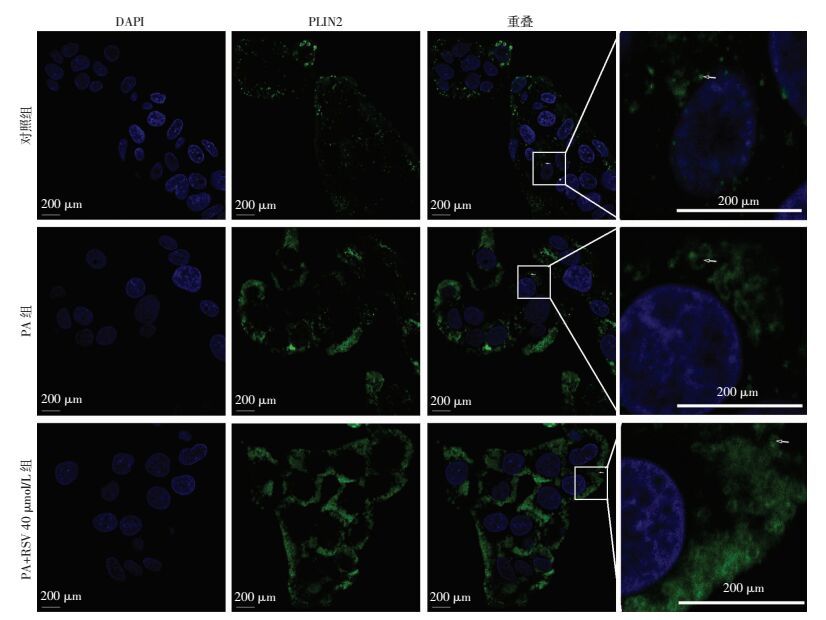
PA处理24 h后,然后用RSV干预24 h。PA处理后,脂肪变性HepG2细胞内PLIN2 mRNA和蛋白表达有所增加;40 μmol/L RSV干预后可以显著促进PLIN2在mRNA和蛋白的表达(P<0.05,图 4)。免疫荧光检测结果显示,PA处理后,PLIN2表达增加,有大脂滴形成(箭头示);40 μmol/L RSV干预后,PLIN2表达较PA单独处理组显著增加,且存在有大量小脂滴(箭头示),PLIN2围绕小脂滴分布(图 5)。
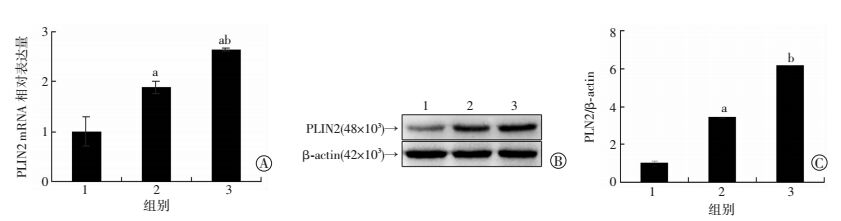
|
|
1:对照组;2:PA组;3:PA+RSV 40 μmol/L组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较 A:Real-time qPCR检测HepG2细胞内PLIN2 mRNA的表达;B:Western blot检测HepG2细胞内PLIN2蛋白的表达;C:β-actin校正后PLIN2蛋白的相对表达 图 4 RSV干预后脂肪变性HepG2细胞内PLIN2表达 |
|
| 右侧图为对应位置的局部放大↑:脂滴 图 5 免疫荧光染色检测细胞HepG2细胞内PLIN2蛋白的表达 |
2.4 RSV上调脂肪变性HepG2细胞PKA活性
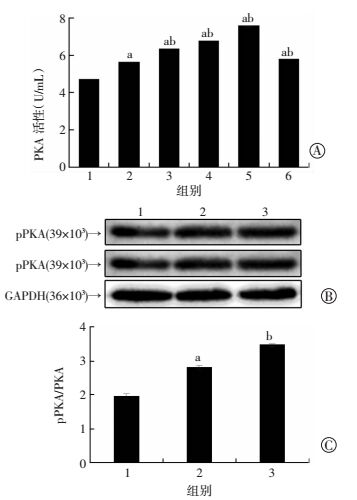
脂肪变性的HepG2细胞PKA活性明显增加,RSV干预后,其活化作用较PA组显著增强(P<0.05),并且呈浓度依赖效应(图 6A),与PKA的磷酸化水平的增加一致(图 6B、C)。上述结果说明,RSV通过PKA的磷酸化上调HepG2细胞的PKA活性。
|
| A:ELISA检测HepG2细胞内PKA的活性1:对照组;2:PA组;3:PA+RSV 10 μmol/L组;4:PA+RSV 20 μmol/L组;5:PA+RSV 40 μmol/L组;6:PA+RSV 80 μmol/L组;B:Western blot检测HepG2细胞内pPKA和PKA蛋白的表达1:对照组;2:PA组;3:PA+RSV 40 μmol/L组;C:通过PKA校正后pPKA蛋白的相对表达1:对照组;2:PA组;3:PA+RSV 40 μmol/L组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较 图 6 RSV对脂肪变性HepG2细胞PKA活性的影响 |
2.5 抑制PLIN2可以减弱RSV促进脂肪变性HepG2细胞脂解的作用
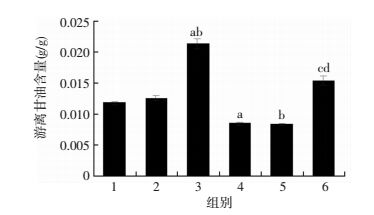
与PA组比较,PA+PLIN2 siRNA组细胞培养液游离甘油含量显著降低(P<0.05),抑制PLIN2表达后可以削弱脂肪变性的HepG2细胞基础状态的脂解作用。在转染PLIN2 siRNA后,PA+RSV+PLIN2 siRNA组的培养液游离甘油含量相比PA+PLIN2 siRNA组显著增高(P<0.05),相比PA+RSV组明显下降(P<0.05,图 7)。以上结果表明在RSV处理脂肪变性的HepG2细胞后,RSV仍能促进脂解的发生,但是这种促进作用明显减弱。
|
| 1:对照组;2:PA组;3:PA+RSV组;4:PLIN2 siRNA组;5:PA+PLIN2 siRNA组;6:PA+RSV+PLIN2 siRNA组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较;c:P<0.05,与PA+RSV组比较;d:P<0.05,与PA+PLIN2 siRNA组比较 图 7 偶联酶反应法检测抑制PLIN2表达后HepG2细胞培养液中的游离甘油含量 |
2.6 抑制PKA活性可以减弱RSV促进脂肪变性HepG2细胞PLIN2表达和脂解的作用
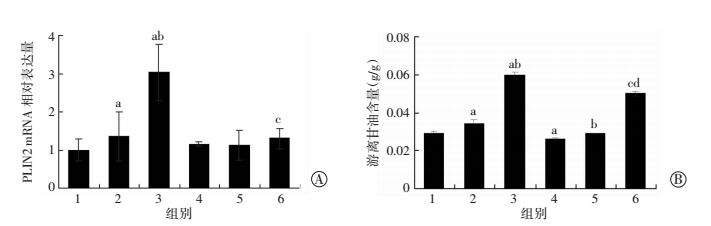
PA+RSV+PKI组与PA+RSV组比较PLIN2 mRNA相对表达量显著下降(P<0.05),表明抑制PKA活性后PLIN2 mRNA表达明显下降。
转染PKI后,与对照组比较,PKI组细胞培养液游离甘油含量显著下降,PA+PKI组与PA组比较、PA+RSV+PKI组与PA+RSV组比较,培养液游离甘油含量均明显下降(P<0.05,图 8)。结果表明应用PKA活性抑制剂PKI过表达质粒干预后,PKA活性明显抑制,而脂解作用减弱,并且RSV对于脂解的促进作用也同样减弱。
|
|
1:对照组;2:PA组;3:PA+RSV组;4:PKI组;5:PA+PKI组;6:PA+RSV+PKI组a:P<0.05,与对照组比较;b:P<0.05,与PA组比较;c:P<0.05,与PA+RSV组比较;d:P<0.05,与PA+PKI组比较 A:使用Real-time qPCR检测HepG2细胞内PLIN2 mRNA的表达;B:偶联酶反应法检测抑制PKA活性后HepG2细胞培养液中游离甘油含量 图 8 抑制PKA活性后RSV促进PLIN2 mRNA表达和脂解的作用减弱 |
3 讨论
脂解是脂滴中的TG通过脂肪酶水解生成游离甘油和游离脂肪酸,并分泌到细胞外的过程[9]。本研究发现,RSV处理后的脂肪变性肝细胞内的TG显著减少,而细胞外的游离甘油明显增多,结果表明RSV可以促进脂肪变性肝细胞的脂滴脂解过程。目前国内外学者对于RSV影响脂解的研究主要以脂肪细胞为主。LASA等[10]研究发现,RSV能通过上调脂肪细胞中脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)显著促进脂滴脂解。其他学者研究也发现RSV可以促进脂肪细胞、纤维细胞等细胞的脂解[11-13]。此外,对于促进肝脏脂解,仅有个别研究报道使用药物(如吡格列酮)可以通过增强ATGL和激素敏感性脂肪酶(hormone sensitive lipase,HSL)表达发挥此作用[14]。因此,本研究发现RSV可以通过改善肝细胞脂解,从而发挥改善NAFLD的作用。
RSV促进脂肪变性肝细胞的脂解作用与其促进PKA磷酸化进而增强其活性以及上调PLIN2表达有关。大多数研究已证实,RSV具有促进PKA磷酸化,增强其活性的作用[15-16]。本研究发现降低PLIN2表达可以明显削弱RSV促进脂肪变性肝细胞脂解的作用。而抑制PKA活性后,RSV上调PLIN2表达和促进脂解的作用均明显减弱。以上结果表明,RSV通过增加PKA活性发挥其促进脂解的作用依赖于PLIN2的mRNA和蛋白表达水平的增加。PLIN2在几乎所有组织中有表达,是啮齿类动物和人类的肝脏中表达量最多的围脂滴蛋白[17]。PLIN2的表达水平与细胞质TG水平呈正相关,与肝脏组织等非脂肪组织的脂质蓄积有关,但是其调控脂质代谢的作用机制尚不明确。研究表明,PLIN2基因敲减后可以降低小鼠血清和肝脏TG水平,改善脂肪肝[18]。也有研究发现PLIN2在脂肪细胞或者NAFLD等脂肪蓄积性相关疾病中表达升高[17, 19]。本研究也发现,PA处理导致的肝细胞脂质蓄积且伴随PLIN2表达的增高。然而,我们对RSV促进肝细胞脂解机制的研究发现,RSV促进脂肪变性肝细胞的脂解作用依赖于PLIN2表达的增高,而不是PLIN2的降低。使用免疫荧光技术可以发现,PLIN2更多地存在于小脂滴表面[20],尤其是在未成熟脂滴中。JIN等[21]研究发现褪黑素处理的猪卵母细胞可以生成更小的脂滴,并且与脂解相关蛋白(ATGL、CGI-58、HSL、PLIN2)的基因表达明显上升。本研究也发现,RSV处理脂肪变性肝细胞后,细胞内存在更多小脂滴(免疫荧光结果中显示为小空泡)并被PLIN2包绕,可能是RSV促进脂解,导致脂滴变得更多、更小的缘故。我们推测PLIN2增高在肝细胞中促进脂解与在脂肪细胞中促进脂质蓄积的作用不一致的原因与PLIN2的组织特异性、蛋白质构型的变化、翻译后修饰(PLIN2的磷酸化[22-23])、细胞内分布定位以及与脂肪酶[24]等蛋白质相互作用有关。PLIN2在肝细胞脂解或NAFLD发生、发展中的作用机制还有待进一步研究。
总之,RSV作为食物中常见的一种植物化学物,通过活化PKA进而上调NAFLD治疗的新靶点PLIN2的表达,继而增强脂解,从而可能改善NAFLD。本研究结果还为PLIN2在NAFLD的脂滴代谢中的调控机制提供了新证据,表明了PLIN2表达上调在改善NAFLD中也可能发挥积极的作用。然而,RSV通过PKA或PLIN2和脂肪酶之间的关系,以及PLIN2参与脂解的具体机制还需要在以后进行深入研究。此外,以上研究结果还需要在原代肝细胞以及动物实验中进一步验证。
| [1] | GOH V, SILVER D. The lipid droplet as a potential therapeutic target in NAFLD[J]. Semi Liver Dis, 2013, 33(4): 312–320. DOI:10.1055/s-0033-1358521 |
| [2] | LIBBY A E, BALES E, ORLICKY D J, et al. Perilipin-2 deletion impairs hepatic lipid accumulation by interfering with sterol regulatory element-binding protein (SREBP) activation and altering the hepatic lipidome[J]. J Biol Chem, 2016, 291(46): 24231–24246. DOI:10.1074/jbc.M116.759795 |
| [3] | CHEN S, ZHAO X, RAN L, et al. Resveratrol improves insulin resistance, glucose and lipid metabolism in patients with non-alcoholic fatty liver disease: a randomized controlled trial[J]. Dig Liver Dis, 2015, 47(3): 226–232. DOI:10.1016/j.dld.2014.11.015 |
| [4] | ZHOU X, CHEN M, ZENG X, et al. Resveratrol regulates mitochondrial reactive oxygen species homeostasis through Sirt3 signaling pathway in human vascular endothelial cells[J]. Cell Death Dis, 2014, 5: e1576. DOI:10.1038/cddis.2014.530 |
| [5] | LIU C, LIAO J Z, LI P Y. Traditional Chinese herbal extracts inducing autophagy as a novel approach in therapy of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2017, 23(11): 1964–1973. DOI:10.3748/wjg.v23.i11.1964 |
| [6] | ZHANG Y, CHEN M L, ZHOU Y, et al. Resveratrol improves hepatic steatosis by inducing autophagy through the cAMP signaling pathway[J]. Mol Nutr Food Res, 2015, 59(8): 1443–1457. DOI:10.1002/mnfr.201500016 |
| [7] | ZHANG Z C, LIU Y, XIAO L L, et al. Upregulation of miR-125b by estrogen protects against non-alcoholic fatty liver in female mice[J]. J Hepatol, 2015, 63(6): 1466–1475. DOI:10.1016/j.jhep.2015.07.037 |
| [8] | SINHA R A, FARAH B L, SINGH B K, et al. Caffeine stimulates hepatic lipid metabolism by the autophagy-lysosomal pathway in mice[J]. Hepatology, 2014, 59(4): 1366–1380. DOI:10.1002/hep.26667 |
| [9] | ZECHNER R, MADEO F, KRATKY D. Cytosolic lipolysis and lipophagy: two sides of the same coin[J]. Nat Rev Mol Cell Biol, 2017. DOI:10.1038/nrm.2017.76 |
| [10] | LASA A, SCHWEIGER M, KOTZBECK P, et al. Resveratrol regulates lipolysis via adipose triglyceride lipase[J]. J Nutr Biochem, 2012, 23(4): 379–384. DOI:10.1016/j.jnutbio.2010.12.014 |
| [11] | LONDOS C, BRASAEMLE D L, SCHULTZ C J, et al. On the control of lipolysis in adipocytes[J]. Ann N Y Acad Sci, 1999, 892: 155–168. DOI:10.1111/j.1749-6632.1999.tb07794.x |
| [12] | SZKUDELSKA K, NOGOWSKI L, SZKUDELSKI T. Resveratrol, a naturally occurring diphenolic compound, affects lipogenesis, lipolysis and the antilipolytic action of insulin in isolated rat adipocytes[J]. J Steroid Biochem Mol Biol, 2009, 113(1-2): 17/24. DOI:10.1016/j.jsbmb.2008.11.001 |
| [13] | RAYALAM S, DELLA-FERA M A, BAILE C A. Synergism between resveratrol and other phytochemicals: implications for obesity and osteoporosis[J]. Mol Nutr Food Res, 2011, 55(8): 1177–1185. DOI:10.1002/mnfr.201000616 |
| [14] | HSIAO P J, CHIOU H C, JIANG H J, et al. Pioglitazone enhances cytosolic lipolysis, β-oxidation and autophagy to ameliorate hepatic steatosis[J]. Sci Rep, 2017, 7(1): 9030. DOI:10.1038/s41598-017-09702-3 |
| [15] | BLUMENSTEIN I, KESERü B, WOLTER F, et al. The chemopreventive agent resveratrol stimulates cyclic AMP-dependent chloride secretion in vitro[J]. Clin Cancer Res, 2005, 11(15): 5651–5656. DOI:10.1158/1078-0432.CCR-04-2674 |
| [16] | ANDREWS C S, MATSUYAMA S, LEE B C, et al. Resveratrol suppresses NTHi-induced inflammation via up-regulation of the negative regulator MyD88 short[J]. Sci Rep, 2016, 6: 34445. DOI:10.1038/srep34445 |
| [17] | CARR R M, AHIMA R S. Pathophysiology of lipid droplet proteins in liver diseases[J]. Exp Cell Res, 2016, 340(2): 187–192. DOI:10.1016/j.yexcr.2015.10.021 |
| [18] | CONTE M, FRANCESCHI C, SANDRI M, et al. Perilipin 2 and age-related metabolic diseases: a new perspective[J]. Trends Endocrinol Metab, 2016, 27(12): 893–903. DOI:10.1016/j.tem.2016.09.001 |
| [19] | OKUMURA T. Role of lipid droplet proteins in liver steatosis[J]. J Physiol Biochem, 2011, 67(4): 629–636. DOI:10.1007/s13105-011-0110-6 |
| [20] | BI J, XIANG Y, CHEN H, et al. Opposite and redundant roles of the two Drosophila perilipins in lipid mobilization[J]. J Cell Sci, 2012, 125(Pt 15): 3568–3577. DOI:10.1242/jcs.101329 |
| [21] | JIN J X, LEE S, Taweechaipaisankul A, et al. Melatonin regulates lipid metabolism in porcine oocytes[J]. J Pineal Res, 2017, 62(2): e12388. DOI:10.1111/jpi.12388 |
| [22] | KAUSHIK S, CUERVO A M. AMPK-dependent phosphorylation of lipid droplet protein PLIN2 triggers its degradation by CMA[J]. Autophagy, 2016, 12(2): 432–438. DOI:10.1080/15548627.2015.1124226 |
| [23] | KAUSHIK S, CUERVO A M. Degradation of lipid droplet-associated proteins by chaperone-mediated autophagy facilitates lipolysis[J]. Nat Cell Biol, 2015, 17(6): 759–770. DOI:10.1038/ncb3166 |
| [24] | MACPHERSON R E, PETERS S J. Piecing together the puzzle of perilipin proteins and skeletal muscle lipolysis[J]. Physiol appl, nutr metab, 2015, 40(7): 641–651. DOI:10.1139/apnm-2014-0485 |



