GUO Gang, E-mail: guogang7001@163.com
幽门螺杆菌(Helicobacter pylori, H.pylori)是感染定植于人胃黏膜的革兰阴性微需氧菌,已被明确是引起慢性胃炎、消化性溃疡的致病菌[1-2],并与胃癌的发生、发展密切相关,1994年世界卫生组织已将其列为Ⅰ类致癌因子[3]。研究表明,H.pylori感染所诱导的胃部微环境免疫抑制发挥了抑制宿主免疫清除细菌效应,进而促进了H.pylori感染相关胃病进展[4]。
肾上腺髓质素(adrenomedullin, ADM)是一个由52个氨基酸组成的生物活性肽,由KITAMURA等[5]在1993年从嗜铬细胞瘤中分离出来。ADM具有多种生物学功能,包括调节血压、抗微生物、抑制炎症等[6]。目前研究表明ADM在胃肠道的分布广泛,提示其可能作为一个肠道激素调节胃肠道的生理和病理[7-9]。
文献[10]报道,在体外H.pylori的感染可以引起胃上皮细胞ADM在mRNA水平表达升高。但ADM在H.pylori感染中升高的调控通路及其功能尚不清楚。本研究旨在明确ADM在H.pylori感染中的表达变化,探索H.pylori诱导ADM上调的调控通路并初步探讨其功能作用,为探明H.pylori感染致病机制及相关胃炎及胃癌的防治提供新的思路。
1 材料与方法 1.1 细胞和细菌来源、培养细菌及其培养条件:野生型(wild type, WT) H.pylori 11637(NCTC, cagA positive)以及相同菌株背景的cagA毒力因子敲除株(△cagA, H.pylori 11637 background)和H.pylori 26695在-80 ℃中长期保存,H.pylori细菌培养使用Skirrow血平板(含1.5%琼脂粉、5%兔全血、0.5%葡萄糖);液体培养使用Skirrow液体培养基(含10%小牛血清、0.5%葡萄糖),培养条件为37 ℃、5%O2、10%CO2[11]。
细胞:单个核细胞来源于健康成人志愿者;AGS、HGC-27胃上皮细胞系(美国ATCC)。
1.2 主要试剂肾上腺髓质素购买于Sigma Aldrich公司,Anti-ADM antibody购买于Abcam公司,ADM抗体(C-20)购买于Santa Cruz公司,辣根酶标记兔抗山羊IgG(H+L)二抗、辣根酶标记山羊抗兔IgG(H+L)二抗、辣根酶标记山羊抗小鼠IgG(H+L)二抗购买于北京中杉金桥公司,定量PCR试剂盒购买于TOYOBO公司,逆转录试剂盒购买于TaKaRa公司,ECL显色液、蛋白提取液购买于Thermo Scientific公司,Wortmannin购买于Millipore公司,Human CD3 antibody APC-cy7购买于Biolegend公司,CFSE购买于BD bioscience公司,Human IFN-γ antibody PE-cy7购买于Ebioscience公司。
1.3 方法 1.3.1 H.pylori感染小鼠选取6~8周雌性C57小鼠180只(北京华阜康),按照随机数字表分成3组(n=60),分别用WT H.pylori 11637和△cagA H.pylori菌液连续灌胃5次,每半天1次,共2天半。未感染组用无菌PBS代替菌液。灌胃后每周每组随机处死小鼠5只,取胃组织提取RNA和制作石蜡切片。
1.3.2 H.pylori刺激胃上皮细胞提前1 d将AGS或HGC-27细胞铺于无菌培养平板,待细胞充分贴壁,更换为不含青链霉素的培养基。用无菌PBS将H.pylori从培养基上洗脱,测量600 nm处光密度。按照相应的感染复数(MOI,细菌:细胞数量)(0、20、50、100、200)加入到每孔细胞培养基中。置于37 ℃、5% CO2的孵箱中培养相应的时间(6、12、24 h),收集细胞和细胞培养上清待后续处理。
1.3.3 信号通路抑制实验将AGS或HGC-27细胞铺于无菌12孔板或6孔板,待细胞充分贴壁,PBS清洗细胞3次,信号通路阻断剂Wortmannin(10 nmol/L)处理细胞2 h(1% FBS的F12或RPMI1640培养基,37 ℃,5%CO2)(同体积的DMSO作为对照),再进行WT H.pylori 11637与细胞共培养实验。
1.3.4 实时荧光定量PCR采用TRIzol法提取细胞和组织中的总RNA,实时荧光定量SYBR Green法检测H.pylori感染的AGS、HGC-27、小鼠胃组织中ADM表达,引物设计见表 1。抽提后的RNA经电泳检验RNA无降解,用Nanodrop one微量紫外可见分光光度计测定RNA浓度,根据浓度计算体积后取RNA 500 ng按照逆转录试剂盒步骤以10 μL体系进行逆转录。取cDNA在Real-time PCR仪上按照试剂说明以10 μL体系进行反应。设复孔取均值,每个样本每个指标重复3次。使用Bio-Rad CFX Manager、Excel和GraphPad Prism5等软件统计分析数据。
| 基因 | 引物 | 长度 |
| Human ADM | 上游5′-GGAAGAGGGAACTGCGGATGT-3′ 下游5′-GGCATCCGGACTGCTGTCT-3′ |
137 bp |
| Human GAPDH | 上游5′-ACCCAGAAGACTGTGGATGG-3′ 下游5′-CAGTGAGCTTCCCGTTCAG-3′ |
139 bp |
| Mouse ADM | 上游5′-TTCGCAGTTCCGAAAGAAGT-3′ 下游5′-CCAGTTGTGTTCTGCTCGTC-3′ |
153 bp |
| Mouse β-actin | 上游5′-CCACACCCGCCACCAGTTCG-3′ 下游5′-CCCATTCCCACCATCACACC-3′ |
165 bp |
1.3.5 蛋白印迹
收集细胞培养上清用蛋白超滤离心管浓缩10倍或使用RAPI裂解法提取细胞培养总蛋白,BCA法测定总蛋白浓度,以每条泳道20 μg蛋白上样,用12%十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,利用湿法电转将蛋白转印至PVDF膜。PBST洗膜,5% BSA室温封闭1 h,加入一抗(GAPDH抗体1 :2 000稀释、ADM antibody 1 :1 000稀释、p-AKT antibody 1 :1 000稀释、AKT antibody 1 :1 000稀释)4 ℃过夜,加入辣根过氧化物酶标记的二抗(1 :10 000)室温孵育1 h,ELC发光检测蛋白表达量。用ImageLab软件记录和分析成像结果。
1.3.6 免疫组织化学染色H.pylori灌胃感染3周的小鼠胃组织标本用中性甲醛固定,石蜡包埋后切片,经二甲苯和梯度乙醇脱蜡水化,在柠檬酸盐修复液中微波加热煮沸12 min修复抗原,3%过氧化氢溶液浸泡30 min,0.5% Triton X-100室温通透15 min,1% BSA 37 ℃封闭30 min后,加入一抗(ADM抗体Santa Cruz)1 :100(PBS代替一抗作为阴性对照),在湿盒中4 ℃过夜。PBS清洗,滴加二抗(辣根酶标记兔抗山羊IgG)37 ℃孵育1 h,清洗后滴加二氨基联苯胺(DAB)显色,苏木精染核,透明、脱水、封片。用显微镜(Nikon ECLIPSE 80i)采集并分析图像。
1.3.7 流式细胞术检测取正常人新鲜血与无菌PBS,按照1 :1稀释,取15 mL加入到装有15 mL淋巴细胞分离液的离心管中,离心机加减速调为0,20 ℃,2 000 r/min,离心20 min,吸取中间白膜层即为外周血单个核细胞(peripheral blood mononuclear cell,PBMC),PBS清洗重悬,利用人CD3细胞分离磁珠(Miltenyi-Biotec),按照说明书分选CD3+T淋巴细胞,用CFSE染色标记。以2×105个细胞加入预包被1 μg/mL CD3抗体及2 μg/mL CD28抗体的96孔板中,以终浓度为0、10、50、100 nmol/L加入重组人ADM,放置于37 ℃、5%CO2的孵箱中培养4 d。收集细胞,加入Human CD3 antibody APC-cy7抗体4 ℃染色30 min后,通透,再用Human IFNγ antibody PE-cy7染细胞内因子,离心弃上清,PBS重悬,用流式仪检测并分析[12]。
1.4 统计学处理采用SPSS 19.0软件进行统计分析,计量数据用x±s表示,用t检验比较组间差异,用Friedman检验比较T细胞增殖率总体分布间的差异,计数资料用百分比表示,检验水准α=0.05。
2 结果 2.1 H.pylori诱导胃上皮细胞ADM表达升高相对于未感染组,H.pylori (包括WT H.pylori 11637菌株和H.pylori 26695菌株)能在感染后12 h和24 h,在转录水平显著诱导胃上皮细胞AGS和HGC-27 ADM的表达增高(P < 0.05,图 1)。H.pylori也能依赖感染时间(6、12、24 h)诱导AGS细胞ADM表达显著升高(P < 0.05,图 2)。H.pylori还能依赖感染剂量在转录水平和翻译水平显著诱导AGS细胞ADM表达增加(P < 0.05,图 3)。结果表明,H.pylori能够显著诱导胃上皮细胞ADM表达升高。
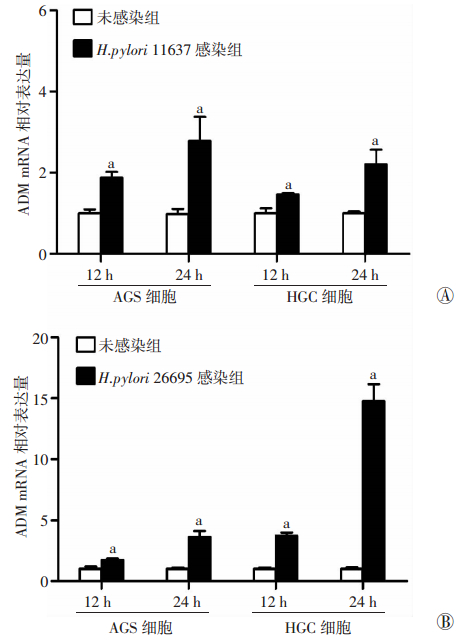
|
| a:P < 0.05,与未感染组比较 图 1 H.pylori 11637菌株(A)和H.pylori 26695菌株(B)感染胃上皮细胞AGS和HGC-27后ADM mRNA表达的变化 |
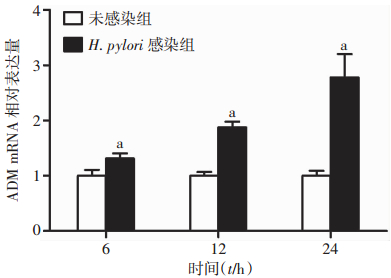
|
| a:P < 0.05,与未感染组比较 图 2 H.pylori感染不同时间AGS细胞ADM mRNA表达变化 |
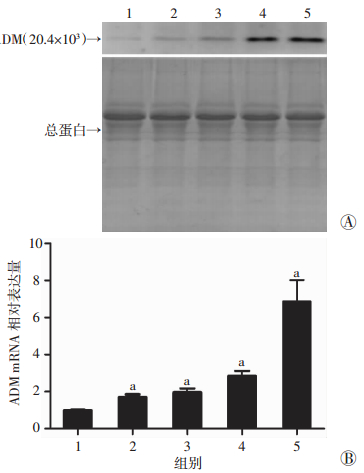
|
| A:蛋白表达;B:定量分析结果 1:未感染组;2:H.pylori感染MOI=20;3:H.pylori感染MOI=50;4:H.pylori感染MOI=100;5:H.pylori感染MOI=200;a:P < 0.05, 与未感染组比较 图 3 H.pylori不同感染剂量下AGS细胞ADM mRNA和蛋白表达的变化 |
2.2 H.pylori依赖毒力因子cagA诱导ADM表达增高
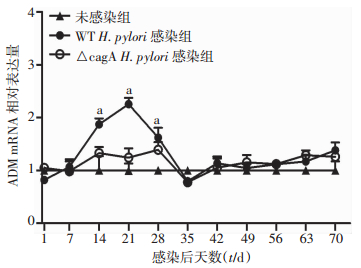
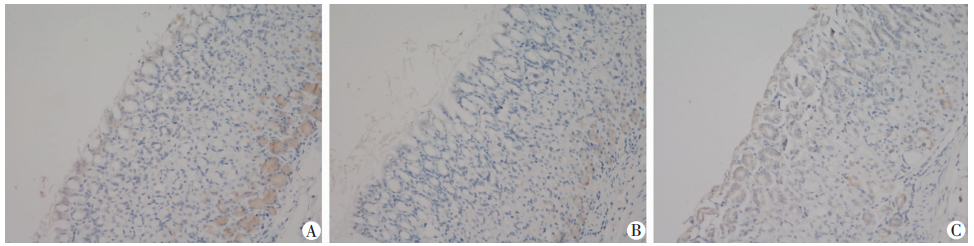
相对于未感染组,WT H.pylori 11637菌株(MOI= 100)感染后能使胃上皮细胞AGS和HGC-27在转录水平ADM表达升高2~3倍(P < 0.05),而△cagA H.pylori感染组则只升高1.0~1.5倍(P < 0.05),有明显回落。蛋白表达水平趋势与转录水平相同(图 4)。在小鼠体内转录水平,ADM表达呈现WT H.pylori 11637菌株感染组在2~4周时有明显升高(1.5~2.5倍),而△cagA H.pylori感染组略有升高(1.2~1.25倍),较WT H.pylori 11637菌株感染组有所回落,其他周数与未感染组区别不明显。免疫组化染色感染第3周的小鼠胃组织显示,ADM高表达于黏膜基底层,且WT H.pylori 11637菌株感染组表达较高(图 5、6)。结果表明,在体内和体外水平,H.pylori均能使ADM在转录和翻译水平表达升高,并且H.pylori毒力因子cagA参与了此调控过程。
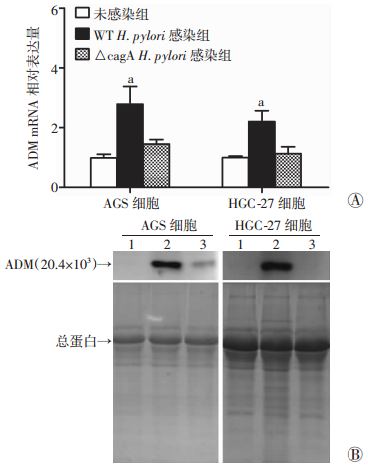
|
| A:mRNA表达水平;B:蛋白表达 1:未感染组;2:WT H.pylori感染组;3:△cagA H.pylori感染组;a:P < 0.05, 与未感染组和△cagA H.pylori感染组比较 图 4 WT H.pylori 11637菌株感染后胃上皮细胞AGS、HGC-27中ADM mRNA和蛋白表达水平变化 |
|
| a:P < 0.05, 分别与未感染组和△cagA H.pylori感染组比较 图 5 感染不同菌株后ADM mRNA不同时间的表达变化 |
|
| A:WT H.pylori感染组;B:△cagA H.pylori感染组;C:未感染组 图 6 免疫组化染色观察不同菌株感染3周小鼠胃组织ADM表达 (×200) |
2.3 H.pylori通过激活PI3K/AKT信号通路,诱导胃上皮细胞ADM表达上调
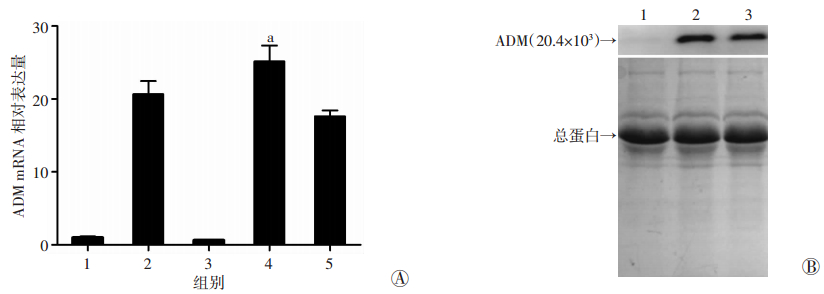
H.pylori 11637能够显著诱导AGS细胞内磷酸化AKT的增加,且H.pylori刺激后细胞培养上清中ADM表达升高,而PI3K信号通路抑制剂(Wortmannin)预处理后,再与H.pylori共培养(MOI=100),则胞内磷酸化AKT降低,同时上清中ADM表达回落(图 7、8);转录水平和翻译水平变化一致,Wortmannin预处理后,ADM表达回落(图 8)。结果表明,H.pylori感染过程能够激活胃上皮细胞PI3K/AKT信号通路,诱导ADM表达上调。

|
| 1:未感染组;2:H.pylori感染组;3:Wortmannin预处理后H.pylori感染组 图 7 Western blot检测H.pylori感染及用Wortmannin预处理后胃上皮细胞AKT蛋白表达的变化 |
|
| A:各组细胞mRNA表达 1:未感染组;2:H.pylori感染组;3:DMSO预处理后未感染组;4:DMSO预处理后H.pylori感染组;5:Wortmannin预处理后H.pylori感染组;B:各组蛋白表达 1:未感染组;2:DMSO预处理后H.pylori感染组;3:Wortmannin预处理后H.pylori感染组;a:P < 0.05, 与Wortmannin预处理后H.pylori感染组比较 图 8 H.pylori感染及用Wortmannin预处理后胃上皮细胞中ADM mRNA和蛋白表达的变化 |
2.4 ADM发挥促进CD3+ T淋巴细胞增殖的功能
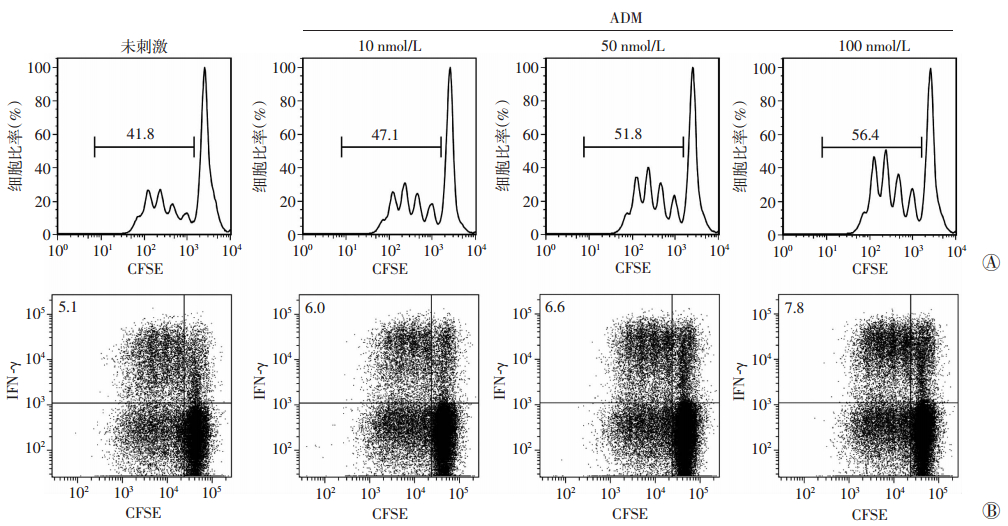
H.pylori感染过程中,宿主T淋巴细胞免疫对细菌的清除及抵抗感染发挥重要作用。因此,我们在体外分选CD3+ T淋巴细胞,检测加入不同浓度的ADM后CD3+ T细胞的增殖情况。流式细胞术检测结果显示,随着ADM浓度的增加,CD3+ T淋巴细胞增殖逐渐增加,并且呈现浓度依赖性增加(P < 0.05),同时IFN-γ表达也逐渐增加,呈浓度依赖性增加(P < 0.05,图 9、10)。
|
| A:T淋巴细胞;B:IFN-γ+T淋巴细胞 图 9 各组T淋巴细胞流式细胞术检测结果 |
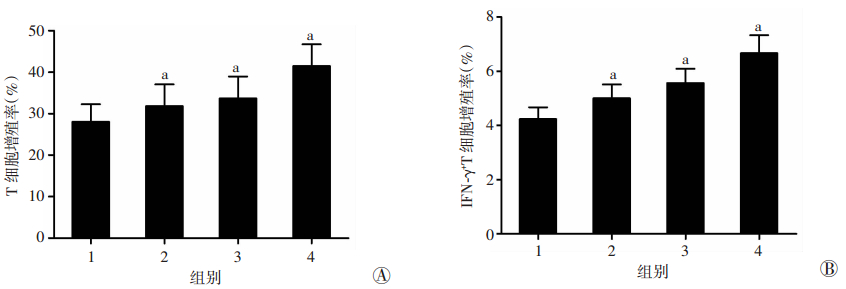
|
| A:T淋巴细胞;B:IFN-γ+T淋巴细胞 1:未刺激组;2:ADM 10 nmol/L刺激组;3:ADM 50 nmol/L刺激组;4:ADM 100 nmol/L刺激组;a:P < 0.05, 与未刺激组比较 图 10 ADM刺激前后CD3+ T淋巴细胞和IFN-γ+T淋巴细胞增殖率的比较 |
3 讨论
H.pylori已在全球造成超过50%的人口感染,是一个世界性问题,且在中国H.pylori的感染率较高。H.pylori感染引起的慢性胃炎和胃溃疡等疾病是胃癌的重要危险因素。胃肠道黏膜是人体固有免疫防线的重要组成部分。H.pylori的致病机制复杂,一方面H.pylori可附着在胃黏膜上,并通过毒力因子对胃黏膜直接损伤,进而促进胃黏膜炎症及免疫反应。另一方面,在H.pylori慢性感染过程中,胃上皮细胞与H.pylori直接接触,产生多种趋化因子及细胞因子,参与构成了炎症性的胃部微环境[4, 13]。ADM是在H.pylori感染过程中表达升高的众多蛋白之一,我们的研究首先验证了文献报道的结果:在体外H.pylori感染过程中,ADM在转录水平表达增加,在此基础上我们又从体内和体外两个方面,证明了H.pylori感染过程中,ADM在转录和翻译水平均明显上调。
目前的研究认为ADM的表达升高与多种因素相关,例如炎症因子IL-1β、TNF-α和免疫原LPS等刺激均能使ADM表达升高[6]。同时文献[14]报道,在ADM的启动子区域,有激活蛋白-2(activator protein-2, AP-2)、环磷酸腺苷调节增强子元件(cyclic adenosine monophosphate-regulated enhancer element)以及核因子-κβ(nuclear factor-κβ, NF-κβ)的结合位点。我们在研究中发现,在H.pylori的感染过程中,敲除毒力因子cagA后,胃内ADM表达降低,揭示了毒力因子cagA参与ADM表达的调控过程。另一方面我们又发现了H.pylori通过PI3K/AKT信号通路调控ADM的表达,阐明了H.pylori诱导胃内ADM表达升高的一种分子机制。但在H.pylori的感染中cagA具体通过何种方式参与ADM的表达调控有待进一步深入研究。
ADM在胃肠道内分布广泛,特别是在胃上皮细胞和神经胶质细胞中,能够发挥多种生理功能。现有研究已经证明ADM在胃肠道内具有多种调节作用,例如抑制胃酸分泌和排空,直接抗菌作用,调节肠内糖转运,调节结肠内水和离子转运,调节结肠和小肠运动,提高内皮屏障功能,稳定循环功能等[15-17],但对于在H.pylori感染相关胃炎中尚少见报道。我们的研究发现H.pylori诱导ADM表达升高,而上调的ADM可以促进CD3+ T淋巴细胞的增殖和IFN-γ的表达。这个结果提示,ADM在机体免疫调节、炎症的发生发展中发挥了重要作用。有文献报道,作为一种免疫逃逸机制,H.pylori可诱导Treg增加引起免疫抑制,促进H.pylori定植,而我们的研究发现,作为一种保护机制,机体在H.pylori感染前期可能通过升高ADM的表达发挥免疫清除作用,从而抑制胃肠道黏膜H.pylori的定植产生。同时我们在研究中还发现ADM可以对巨噬细胞产生一定影响,因此我们猜测ADM可能通过影响免疫细胞增殖和分化、改变胃部炎症环境或抑制H.pylori的定植从而对H.pylori相关胃炎产生一定影响。但此假设还需要进一步的实验进行验证。
我们研究了ADM对CD3+ T淋巴细胞的作用,但ADM对各类T细胞亚群发挥了怎样的作用,ADM对T细胞是如何发挥作用的,以及在体内H.pylori感染过程中,ADM发挥了怎样的效应,这些问题都有待进一步深入研究。综上所述,我们发现H.pylori能够通过PI3K/AKT信号通路调节ADM表达升高,ADM升高后能够促进CD3+ T淋巴细胞的增殖和IFN-γ的表达,从而发挥免疫调节功能,本研究为H.pylori感染相关胃炎的防治提供了理论支撑和新思路。
| [1] | MARSHALL B J, WARREN J R. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration[J]. Lancet, 1984, 1(8390): 1311–1315. |
| [2] | REZKITHA Y A, MIFTAHUSSURUR M, NUSI I A, et al. An East-Asian-type cagA Helicobacter pylori infected patient with clinical manifestation of gastric ulcer[J]. Acta Med Indones, 2016, 48(4): 307–313. |
| [3] | PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74–108. DOI:10.3322/canjclin.55.2.74 |
| [4] | KANDULSKI A, SELGRAD M, MALFERTHEINER P. Helicobacter pylori infection: a clinical overview[J]. Dig Liver Dis, 2008, 40(8): 619–626. DOI:10.1016/j.dld.2008.02.026 |
| [5] | KITAMURA K, KANGAWA K, KAWAMOTO M, et al. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma[J]. Biochem Biophys Res Commun, 1993, 192(2): 553–560. DOI:10.1016/j.bbrc.2012.08.022 |
| [6] | MARTINEZ-HERRERO S, MARTINEZ A. Adrenomedullin regulates intestinal physiology and pathophysiology[J]. Domest Anim Endocrinol, 2016, 56(Suppl): S66-S83. DOI: 10.1016/j.domaniend.2016.02.004. |
| [7] | MARUTSUKA K, HATAKEYAMA K, SATO Y, et al. Immunohistological localization and possible functions of adrenomedullin[J]. Hypertens Res, 2003, 26(Suppl): S33–S40. DOI:10.1291/hypres.26.S33 |
| [8] | GROSCHL M, WENDLER O, TOPF H G, et al. Significance of salivary adrenomedullin in the maintenance of oral health: stimulation of oral cell proliferation and antibacterial properties[J]. Regul Pept, 2009, 154(1/3): 16–22. DOI:10.1016/j.regpep.2008.12.007 |
| [9] | FUKUDA K, TSUKADA H, OYA M, et al. Adrenomedullin promotes epithelial restitution of rat and human gastric mucosa in vitro[J]. Peptides, 1999, 20(1): 127–132. DOI:10.1016/S0196-9781(98)00146-6 |
| [10] | ALLAKER R P, KAPAS S. Adrenomedullin expression by gastric epithelial cells in response to infection[J]. Clin Diagn Lab Immunol, 2003, 10(4): 546–551. |
| [11] | ZHUANG Y, SHI Y, LIU X F, et al. Helicobacter pylori-infected macrophages induce Th17 cell differentiation[J]. Immunobiology, 2011, 216(1/2): 200–207. DOI:10.1016/j.imbio.2010.05.005 |
| [12] | WANG T T, ZHAO Y L, PENG L S, et al. Tumour-activated neutrophils in gastric cancer foster immune suppression and disease progression through GM-CSF-PD-L1 pathway[J]. Gut, 2017, 66: 1900–1911. DOI:10.1136/gutjnl-2016-313075 |
| [13] |
胡素侠, 张荣波, 杨立新, 等. 幽门螺杆菌基因多态性及其致病机制研究进展[J].
齐齐哈尔医学院学报, 2013, 34(23): 3520–3522.
HU S X, ZHANG R B, YANG L X. Research progress on genetic polym orphism and pathogenesis of Helicobacter Pylori[J]. J Qiqihar Med Coll, 2013, 34(23): 3520–3522. |
| [14] | HINSON J P, KAPAS S, SMITH D M. Adrenomedullin, a multifunctional regulatory peptide[J]. Endocr Rev, 2000, 21(2): 138–167. DOI:10.1210/edrv.21.2.0396 |
| [15] | HIRSCH A B, MCCUEN R W, ARIMURA A, et al. Adrenomedullin stimulates somatostatin and thus inhibits histamine and acid secretion in the fundus of the stomach[J]. Regul Pept, 2003, 110(3): 189–195. DOI:10.1016/S0167-0115(02)00208-2 |
| [16] | WIESNER J, VILCINSKAS A. Antimicrobial peptides: the ancient arm of the human immune system[J]. Virulence, 2010, 1(5): 440–464. DOI:10.4161/viru.1.5.12983 |
| [17] | KRAVTSOV G M, HWANG I S, TANG F. The inhibitory effect of adrenomedullin in the rat ileum: cross-talk with beta3-adrenoceptor in the serotonin-induced muscle contraction[J]. J Pharmacol Exp Ther, 2004, 308(1): 241–248. DOI:10.1124/jpet.103.057612 |



