2. 400016重庆,重庆医科大学附属第一医院:实验研究中心
2. Experiments Research Center, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
暴力攻击行为危害社会安危,备受全球关注。当攻击行为对其他生物、物体或社会造成严重侵犯时则被视为病理性攻击,通常是在心理、社会或生物因素造成的精神病理状态下产生[1],如脑损伤、癫痫、阿尔茨海默病、酒精滥用、精神分裂症、注意力缺陷多动障碍、品行障碍、反社会性人格障碍、创伤后应激障碍、间歇性暴发障碍及抑郁症等精神疾病都可表现出病理性的攻击[2]。目前认为,与攻击行为相关脑区包括前额叶皮层、海马、下丘脑、杏仁体等,以上任何一个脑区结构或功能异常都会增加攻击或暴力行为发生的风险[3]。
已经证实的与攻击行为相关的化学物质包括五羟色胺(serotonin, 5-HT)、多巴胺(dopamine)、一氧化氮(NO)、加压素(vasopressin)、催产素(oxytocin)等[4-6]。5-HT与攻击行为最为密切,众多研究指出五羟色胺1A受体(serotonin 1A receptor, 5-HT1AR)是攻击行为发生的关键受体[7-9]。突触后致密物-95(postsynaptic density-95, PSD-95)信号通路,即为N-甲基-D-天冬氨酸受体/突触后致密蛋白95/神经元型一氧化氮合酶(NMDAR/PSD-95/nNOS)结构体信号通路,由于NMDA受体活化nNOS需要支架蛋白PSD-95的介导,且此介导作用为特异性通路,因此国内外均有研究和学者将NMDAR/PSD-95/nNOS复合体介导的信号通路称为PSD-95信号通路。PSD-95信号通路是调控神经元功能的重要信号途径, 与神经突触可塑性密切相关,是调控神经元功能的重要信号途径,参与脑缺血、氧化应激等过程,其下游物质nNOS也与攻击行为的发生密切相关[10-11]。PSD-95信号通路在病理性攻击行为中的参与机制尚未有清晰研究。病理性攻击行为发生的两个重要因素即包括五羟色胺分泌紊乱及HPA轴活性异常[12],本研究以病理性攻击大鼠模型为基础,探索PSD-95信号通路参与并介导5-HT1A受体激动剂对病理性攻击大鼠攻击行为改善作用的调控机制,为进一步研究病例性攻击行为发生及发展提供动物实验依据。
1 材料与方法 1.1 实验动物和分组出生后21 d雄性SD大鼠共24只,体质量50~70 g,购于重庆医科大学实验动物中心(SPF级)。通过早年多重慢性应激构建病理性攻击大鼠模型,将大鼠按照抽签法分为4组,分别给予5-HT1A受体激动剂(8-OH-DPAT)、PSD-95阻断剂(ZL006)、8-OH-DPAT+ ZL006及生理盐水(NaCl)。本研究获得重庆医科大学附属第一医院生物医学伦理委员会批准(2014-02-27),研究方案符合医学伦理原则和赫尔辛基宣言的各项要求。
1.2 药物与试剂5-HT1A受体激动剂(8-OH-DPAT)购于美国Sigma公司,PSD-95阻断剂(ZL006)购于MCE有限公司,5-HT1A受体抗体购于北京博奥森公司,PSD-95抗体购于美国Santa Cruz公司,糖皮质激素抗体购于万类生物科技有限公司。大鼠血清糖皮质激素ELISA试剂盒购于上海江莱生物有限公司。记录行为学摄像机为日本索尼公司产品。
1.3 构建大鼠病理性攻击模型模型构建方法为本课题组前期研究发现,利用早年多重慢性应激手段构建病理性攻击大鼠模型[13]。建模手段主要包括:①早年孤养:断奶后21 d开始进行孤养,共持续5周,给予正常条件的食物、饮水、温度、湿度。②昼夜颠倒:自21 d起给予模型大鼠昼夜颠倒(每日8:00~20:00遮光,20:00~次日8:00光照),共持续5周。③去奖赏挫败:孤养2周后每天给予2%蔗糖水,从第3周起则改为每次攻击实验前给予1%蔗糖水。④预计惹刺激及居住入侵实验:孤养第3周起,每天将入侵鼠放入居住鼠笼内,用铁丝网隔开,预激惹居住鼠5 min,随即撤去铁丝网,开始10 min的居住-入侵实验。每日1次,共持续3周。
1.4 药物干预建模成功后,分别给予4组大鼠以下干预,A组:8-OH-DPAT,B组:8-OH-DPAT+ZL006,C组:ZL006,D组:NaCl。5-HT1A受体激动剂(8-OH-DPAT)按照0.5 mg/kg每天腹腔给药。PSD-95阻断剂(ZL006)按照1 mg/kg剂量每3天腹腔给药,NaCl按2 mL/只腹腔注射。每次于18:00进行注射,且在8-OH-DPAT注射结束后10 min再注射ZL006。给药共持续2周,干预后对各组大鼠再次进行居住-入侵实验。
1.5 行为学检测实验过程中共需进行3次行为学测试,分别于给药前,给药1周后及给药2周后。利用居住-入侵实验测试大鼠的攻击行为。将居住鼠的笼子搬至黑暗环境中,并用摄像机记录放入入侵鼠后10 min的大鼠行为。实验结束后,由2名经过一致性培训的实验人员对行为学视频进行评估和记录,并取平均值进行统计。大鼠攻击行为表现为:①攻击总次数(撕咬+攀压+击打);②攻击行为持续时间;③攻击性追逐行为;④攻击性理毛。
一般认为与对照组相比有以下行为之一可视为动物病理性攻击行为[14-15]:①第1次攻击潜伏期显著缩短;②攻击/威胁比例显著升高;③对要害部位(头、腹部和喉部)进行攻击;④对手屈服后继续攻击。
1.6 血清及脑组织标本采集给药前及给药1周后的行为学测试结束后,将大鼠置于乙醚罐中进行麻醉,迅速用毛细血管取眼眶后静脉血于1 mL EP管中,4 ℃离心,取上清液,存于-80 ℃冰箱保存。给药2周后行为学测试结束,给予居住鼠以10%水合氯醛(0.3 mL/100 g)进行腹腔注射麻醉,2~3 min后,迅速利用毛细管取大鼠眼眶后静脉血于1 mL EP管中,取血后加高浓度二氧化碳使大鼠窒息后断头,参考《大鼠脑立体定位图谱》分离并取出大鼠前额叶皮质、海马、下丘脑,生理盐水冲洗后,-80 ℃保存。
1.7 Western blot检测脑区5-HT1AR、PSD-95、糖皮质激素受体(glucocorticoid receptor, GR)蛋白表达水平将脑组织进行裂解、匀浆后取上清液。蛋白定量后进行聚丙烯酰胺凝胶恒压(60~120 V)电泳,恒流250 mA电转膜后封闭PVDF膜2 h(5%脱脂奶粉)后予5-HT1AR(1 :500)、PSD-95(1 :500)及GR(1 :500)抗体孵育,4 ℃过夜。分别予以山羊抗小鼠、抗兔二抗37 ℃烤箱1 h,TBST洗膜3次后用凝胶成像系统显影并分析结果。
1.8 ELISA测定大鼠血清糖皮质激素浓度将保存在-80 ℃的大鼠血清放置室温,充分震荡,按照ELISA试剂盒说明书测大鼠血清糖皮质激素浓度。
1.9 统计学方法所有实验结果采用SPSS 20.0统计软件进行统计分析。对连续性定量资料进行正态性检验,符合正态分布资料采用均值和标准差描述其分布,多组间比较采用单因素方差分析,各组不同时间点结果采用重复测量的方差分析。检验水准α=0.05。
2 结果 2.1 给药前、给药1周后及给药2周后病理性攻击行为变化给药前,各组之间攻击总次数、攻击持续时间、屈服后攻击次数、攻击潜伏期及攻击要害部位次数差异无统计学意义(P>0.05)。8-OH-DPAT组给药1周后攻击总数、攻击持续时间、攻击要害部位次数均有明显下降(P < 0.05),且2周后持续下降(P < 0.05)。8-OH-DPAT+ZL006组同时给药1周后,攻击总数、攻击持续时间、攻击要害部位次数明显下降(P < 0.05),但2周后攻击水平与给药1周后差异无统计学意义(P>0.05)。ZL006组与NaCl组在给药1周及2周后攻击总数、攻击持续时间和攻击要害部位次数差异均无统计学意义(P>0.05,图 1)。
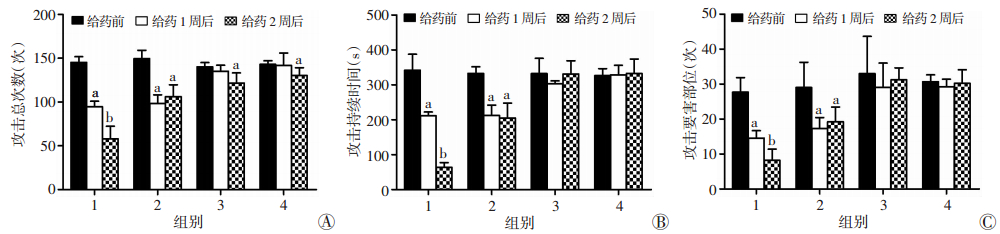
|
| A:攻击总次数;B:攻击持续时间;C:攻击要害比;1: 8-OH-DPAT组;2: 8-OH-DPAT+ZL006组;3: ZL006组;4:NaCl组;a:P < 0.05,与给药前比较;b:P < 0.05,与给药1周后比较 图 1 给药前后不同时段各组大鼠攻击水平变化 |
2.2 各组大鼠不同脑区PSD-95、GR、5-HT1AR表达 2.2.1 前额叶皮层PSD-95、GR、5-HT1AR表达
Western blot检测结果显示8-OH-DPAT组前额叶皮层PSD-95表达高于其余3组(P < 0.05)。4组大鼠前额叶皮层GR表达较弱,且各组间表达差异无统计学意义(P>0.05)。8-OH-DPAT组和8-OH-DPAT+ZL006组前额叶皮层5-HT1AR表达高于其余两组(P < 0.05,图 2)。
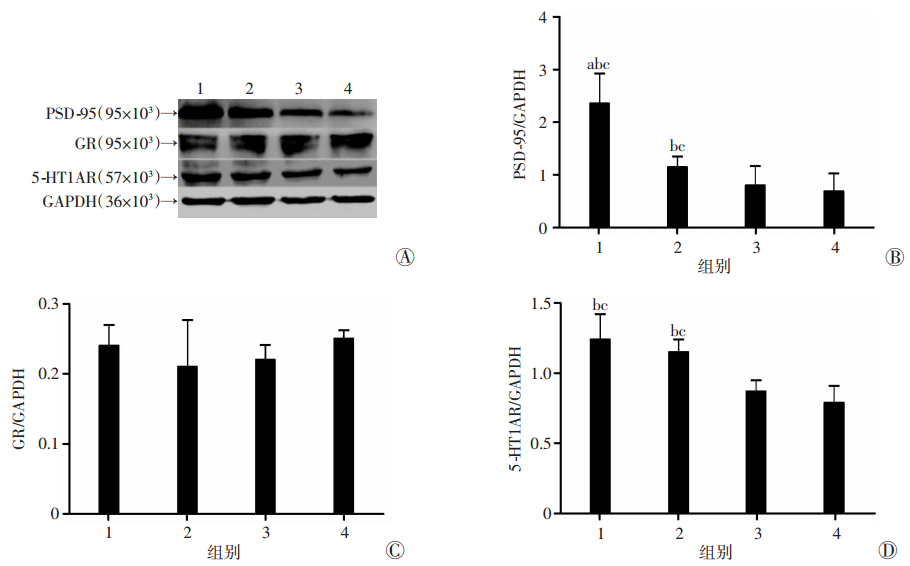
|
| A:各组大鼠前额叶PSD-95、GR、5-HT1AR蛋白表达结果;B~D:PSD-95、GR、5-HT1AR蛋白相对表达量; 1:8-OH-DPAT组;2:8-OH-DPAT+ZL006组;3:ZL006组;4:NaCl组;a:P < 0.05,与8-OH-DPAT+ZL006组比较;b:P < 0.05,与ZL006组比较;c:P < 0.05,与NaCl组比较 图 2 Western blot检测各组大鼠前额叶PSD-95、GR、5-HT1AR表达 |
2.2.2 海马PSD-95、GR、5-HT1AR表达
Western blot检测结果显示8-OH-DPAT组大鼠海马PSD-95表达高于其余3组(P < 0.05),且该区GR表达低于其余3组(P < 0.05)。8-OH-DPAT组和8-OH-DPAT+ ZL006组海马区5-HT1AR表达高于其余两组(P < 0.05,图 3)。
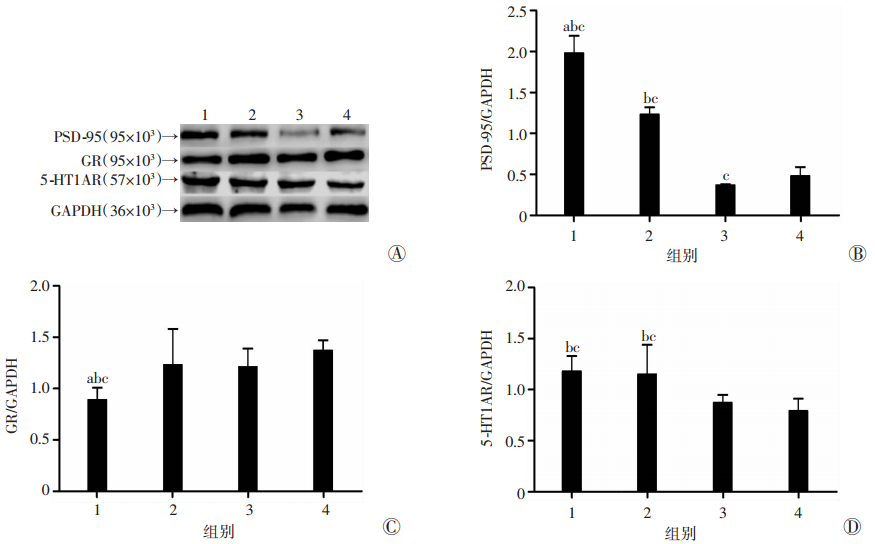
|
| A:各组大鼠海马PSD-95、GR、5-HT1AR蛋白表达结果;B~D:PSD-95、GR、5-HT1AR蛋白相对表达量;1:8-OH-DPAT组;2:8-OH-DPAT+ZL006组;3:ZL006组;4:NaCl组 a:P < 0.05,与8-OH-DPAT+ZL006组比较;b:P < 0.05,与ZL006组比较;c:P < 0.05,与NaCl组比较 图 3 Western blot检测各组大鼠海马PSD-95、GR、5-HT1AR表达 |
2.2.3 各组大鼠下丘脑PSD-95、GR、5-HT1AR表达
Western blot检测结果显示4组大鼠下丘脑PSD-95、5-HT1AR表达差异无统计学意义(P>0.05),且在该脑区没有清晰检测到GR表达(图 4)。
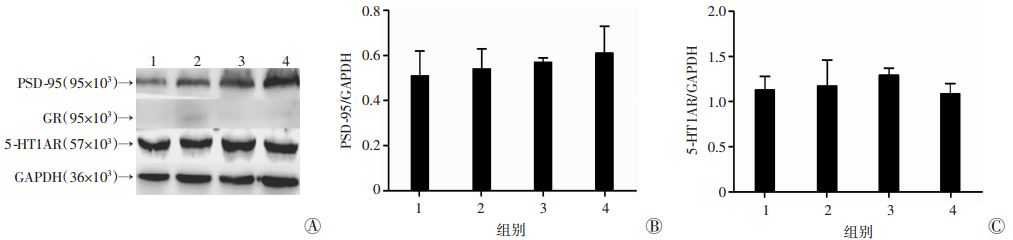
|
| A:各组大鼠海马PSD-95、5-HT1AR蛋白表达结果;B~C:PSD-95、GR、5-HT1AR蛋白相对表达量;1:8-OH-DPAT组;2:8-OH-DPAT+ZL006组;3:ZL006组;4:NaCl组 图 4 Western blot检测各组大鼠下丘脑PSD-95、GR、5-HT1AR表达 |
2.3 大鼠血清糖皮质激素ELISA检测结果
给药前各组大鼠血清糖皮质激素浓度差异无统计学意义(P>0.05)。8-OH-DPAT组大鼠血清糖皮质激素浓度在给药后有明显上升(P < 0.05),而其余3组给药前后血清糖皮质激素水平无明显变化(P>0.05,表 1)。
| 组别 | 给药前 | 给药1周后 | 给药2周后 |
| 8-OH-DPAT组 | 8.72±3.34 | 16.33±6.71a | 19.21±4.05ab |
| 8-OH-DPAT+ZL006组 | 9.31±2.18 | 10.29±3.11 | 10.00±1.41 |
| ZL006组 | 7.99±1.31 | 8.21±3.62 | 6.74±1.67 |
| NaCl组 | 8.14±2.05 | 8.88±7.13 | 6.83±2.47 |
| a:P < 0.05, 与给药前比较;b:P < 0.05,与给药1周后比较 | |||
3 讨论
本实验直接选取课题组前期已构建成功的病理性攻击大鼠模型,该模型信效度已得到有效验证。利用早年多重慢性应激所致的病理性攻击大鼠,攻击行为有别于大鼠普通攻击行为,主要表现为潜伏期短、攻击次数多、易攻击要害部位且忽视对手屈服信号。与HALLER等[14]将大鼠肾上腺切除所构建的低唤起型攻击大鼠模型表现类似,除攻击水平远高于普通大鼠外,二者血清糖皮质激素水平均低于普通大鼠。
本实验结果显示,8-OH-DPAT组攻击总次数、攻击持续时间及攻击要害比NaCl组降低,说明本研究中使用该剂量的5-HT1A受体激动剂(8-OH-DPAT)能够有效降低病理性攻击行为。大量研究证明,选择性5-HT1A受体激动剂8-OH-DPAT可减少不同造模方式下,如社会隔离、预激惹刺激等产生的攻击行为[16-17]。但也有研究表明,选择性5-HT1AR激动剂8-OH-DPAT可增加产后雌性大鼠的攻击行为[18]。这些矛盾的结果可能与不同剂量的5-HT1A受体激动剂作用的不同位置有关。本课题组利用早年多重慢性应激所构建病理性攻击模型8-OH-DPAT,发现海马区和前额叶区5-HT1AR表达增加,而下丘脑区5-HT1AR表达则无明显差异。MORI等[19]研究发现,食欲肽基因敲除鼠前额叶、杏仁体、中缝背核等脑区5-HT1AR表达极低,给予8-OH-DPAT后,可观察到前额叶区5-HT1AR表达增加。DABROWSKA等[20]通过5-HT1AR的生物化学及分子模型研究发现8-OH-DPAT为强有力的5-HT1AR分子激活剂。研究表明,直接给予脑区注射8-OH-DPAT,并未观测到边缘脑区5-HT1AR表达有变化[21-22]。考虑原因为各研究采用不同的应激方式且研究对象不同,故结果有差异。课题组利用早年慢性多重应激,导致脑区大部分5-HT1AR脱抑制,5-HT1AR处于休眠状态,无法正常工作或表达,故在本模型中可以观察到,使用8-OH-DPAT后,前额叶和海马区5-HT1AR表达增加。
本研究发现,伴随5-HT1A受体表达增加,海马区GR表达降低,大鼠血清糖皮质激素浓度上升,与PILAR-CUÉLLAR等[23]的研究结果类似,局部激活大鼠海马区5-HT1AR,海马区5-HT1AR过表达,即出现血清糖皮质激素水平升高,盐皮质激素受体/糖皮质激素受体比降低,提示海马区GR表达降低。5-HT1A受体与HPA轴的相互作用已得到众多研究证实。STAMPER等[24]也发现激活大鼠背内侧下丘脑5-HT1A受体能够抑制大鼠HPA轴活性。给予单一应激下的大鼠每日腹腔注射5-HT1A受体拮抗剂(WAY-100635)能够防止海马GR的过度表达,对HPA轴起到保护作用[25]。ERDELJAN等[26]研究发现,外源和内源性的糖皮质激素及血清素均能够影响海马区GR表达,给予大鼠注射血清素,可上调海马区GR表达,进而导致HPA轴功能紊乱。由于GR集中表达在海马,其余脑区尤其下丘脑仅少量或无分布[27]。大鼠在青春期时接受早年慢性多重应激早期可导致糖皮质激素水平升高,损害海马神经元,HPA轴呈脱抑制状态。在此状态下,海马区GR作为调控HPA轴的高位中枢,对HPA轴具有负反馈抑制作用,长期慢性应激,导致HPA轴功能失调,造成血清糖皮质激素水平降低[28-29]。海马区是重要的认知功能脑区,损伤后对应激反应异常,可表现过度反应,是攻击行为发生的重要脑区。
本研究还发现,联合使用8-OH-DPAT和ZL006后,8-OH-DPAT对病理性攻击行为的改善和大鼠血清糖皮质激素的上调作用均未表现出来。攻击行为在联合用药的1周后不再降低,且血清糖皮质激素水平无明显上升,8-OH-DPAT+ZL006组大鼠海马区GR表达与NaCl组也无明显差异。在动物实验中初步证实了8-OH-DPAT对病理性攻击行为的调控作用是由PSD-95信号通路介导的。首先,通过8-OH-DPAT组、8-OH-DPAT+ZL006组Western blot检测结果可见前额叶及海马区PSD-95表达均高于其余两组,可以判断随着5-HT1AR表达增加,PSD-95表达增加。MOGHA[30]在其研究中证明5-HT1A受体激动剂(8-OH-OPAT)可通过激活ERK磷酸化而使PSD-95的表达增加、棘突生长及突触形成。课题组前期研究结果也发现,利用早年慢性多重应激所构建的病理性攻击大鼠攻击行为的发生与前额叶皮层、海马及下丘脑区发生了神经突触可塑性损伤有关,其中病理性攻击组下丘脑及海马区PSD-95表达低于正常大鼠,且给予8-OH-DPAT后PSD-95表达上升[31-33]。其次,8-OH-DPAT组未使用PSD-95阻断剂,可以观察到海马区GR表达降低,而联合使用阻断剂后,未观察到海马区GR的变化,血清糖皮质激素水平也无回升,提示PSD-95信号通路对HPA轴可能存在一定的调控作用。DUNN等[34]在大鼠胰腺细胞实验中发现PSD-95信号通路能够直接调控细胞膜表面促肾上腺皮质激素释放受体-1(CRFR1)及GR的定位及表达,验证了PSD-95信号通路可调控HPA轴活性的假设。PSD-95信号通路参与大脑缺血、缺氧保护机制已得到众多研究肯定,其参与大鼠应激、调节抑郁及焦虑情绪也均被初步证实。本实验中采用ZL006作为PSD-95信号通路阻断剂,可阻断NMDAR/PSD-95/nNOS复合物中的下游信号PSD-95/nNOS的偶联,与nNOS的β-finger结构结合,阻断PSD-95与nNOS相互作用,且对nNOS与PSD-95表达无明显影响[35]。在本研究中也发现ZL006组与NaCl组相比,各脑区PSD-95表达无明显差异。
综上所述,本研究在动物在体实验中验证5-HT1A受体激动剂8-OH-DPAT能够改善早年慢性应激所致的病理性攻击大鼠攻击行为,能够提升其血清糖皮质激素水平,维持HPA轴稳定性,且上述作用是由海马区PSD-95信号通路介导的。前额叶、下丘脑、海马均为攻击相关的重要脑区,而在本实验中,我们仅发现前额叶及海马区PSD-95信号通路可承接5-HT1AR信号,且海马区GR受到PSD-95信号通路的进一步调控,血清糖皮质激素水平也随之变化,考虑原因可能是不同脑区GR分布量的差异。同时本研究也间接证明了PSD-95信号通路参与病理性攻击行为的发生、发展,为其治疗和预测提供了可能的新的作用靶点。由此我们提出假设,在慢性多重应激早期,适当给予神经稳定制剂,保护神经可塑性功能稳定,防止PSD-95信号通路表达异常,对HPA轴有一定的保护作用,能够降低病理性攻击行为发生的可能。本研究仍存在不足,例如缺乏离体细胞实验结果作为支持,PSD-95信号通路作为5-HT1AR与HPA轴的可能连接通路,其具体的调控机制还有待进一步研究。
| [1] |
唐平. 病理性攻击行为的心理基础及其哲学本质[J].
医学与哲学, 2004, 25(11): 65–67.
TANG P. Pathological aggressive behavior's mental base and its philosophical essence[J]. Med Philos, 2004, 25(11): 65–67. |
| [2] | HALLER J, KRUK M R. Normal and abnormal aggression: human disorders and novel laboratory models[J]. Neurosci Biobehav Rev, 2006, 30(3): 292–303. DOI:10.1016/j.neubiorev.2005.01.005 |
| [3] | DAVIDSON R J, PUTNAM K M, LARSON C L. Dysfunction in the neural circuitry of emotion regulation—a possible prelude to violence[J]. Science, 2000, 289(5479): 591–594. DOI:10.1126/science.289.5479.591 |
| [4] | LESCH K P, MERSCHDORF U. Impulsivity, aggression, and serotonin: a molecular psychobiological perspective[J]. Behavi Sci Law, 2000, 18(5): 581–604. DOI:10.1002/1099-0798(200010)18:5<581::aid-bsl411>3.0.co;2-l |
| [5] | STOHN J P, MARTINEZ M E, ZAFER M, et al. Increased aggression and lack of maternal behavior in Dio3-deficient mice are associated with abnormalities in oxytocin and vasopressin systems[J]. Genes Brain Behav, 2017. DOI:10.1111/gbb.12400 |
| [6] | STEVENSON P A, RILLICH J. Adding up the odds-Nitric oxide signaling underlies the decision to flee and post-conflict depression of aggression[J]. Sci Adv, 2015, 1(2): e1500060–e1500060. DOI:10.1126/sciadv.1500060 |
| [7] | DE BOER S F, KOOLHAAS J M. 5-HT1A and 5-HT1B receptor agonists and aggression: a pharmacological challenge of the serotonin deficiency hypothesis[J]. Eur J Pharmacol, 2005, 526(1/3): 125–139. DOI:10.1016/j.ejphar.2005.09.065 |
| [8] | ŁUKASIEWICZ S, BŁASIAK E, SZAFRAN-PILCH K, et al. Dopamine D2 and serotonin 5-HT1A receptor interaction in the context of the effects of antipsychotics-in vitro studies[J]. J Neurochem, 2016, 137(4): 549–560. DOI:10.1111/jnc.13582 |
| [9] | HEYDARI A, DAVOUDI S. The effect of sertraline and 8-OH-DPAT on the PTZ_induced seizure threshold: Role of the nitrergic system[J]. Seizure, 2017, 45: 119–124. DOI:10.1016/j.seizure.2016.12.005 |
| [10] | DOUCET M V, LEVINE H, DEV K K, et al. Small-molecule inhibitors at the PSD-95/nNOS interface have antidepressant-like properties in mice[J]. Neuropsychopharmacology, 2013, 38(8): 1575–1584. DOI:10.1038/npp.2013.57 |
| [11] | SREJIC L R, HUTCHISON W D, AARTS M M. Uncoupling PSD-95 interactions leads to rapid recovery of cortical function after focal stroke[J]. J Cereb Blood Flow Metab, 2013, 33(12): 1937–1943. DOI:10.1038/jcbfm.2013.153 |
| [12] | HALLER J, HALÁSZ J, MIKICS E, et al. Chronic glucocorticoid deficiency-induced abnormal aggression, autonomic hypoarousal, and social deficit in rats[J]. J Neuroendocrinol, 2004, 16(6): 550–557. DOI:10.1111/j.1365-2826.2004.01201.x |
| [13] |
屈远. 病理性攻击大鼠模型构建及效果评估[D]. 重庆: 重庆医科大学, 2012.
QU Y. Establish and effect evaluation of pathological aggression animal model[D]. Chongqing: Chongqing Medical University, 2012. |
| [14] | HALLER J, HORVÁTH Z, BAKOS N. The effect of buspirone on normal and hypoarousal-driven abnormal aggression in rats[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2007, 31(1): 27–31. DOI:10.1016/j.pnpbp.2006.05.022 |
| [15] |
屈远, 雷莉, 秦光成, 等. 青春期病理性攻击动物模型的初步构建[J].
中华行为医学与脑科学杂志, 2011, 20(7): 630–632.
QU Y, LEI L, QIN G C, et al. Preliminary establish of the puberty pathological aggression animal model[J]. Chin J Behavioral Med Brain Sci, 2011, 20(7): 630–632. DOI:10.3760/cma.j.issn.1674-6554.2011.07.019 |
| [16] | BIBANCOS T, JARDIM D L, ANEAS I, et al. Social isolation and expression of serotonergic neurotransmission-related genes in several brain areas of male mice[J]. Genes Brain Behav, 2007, 6(6): 529–539. DOI:10.1111/j.1601-183X.2006.00280.x |
| [17] | FONE K C, PORKESS M V. Behavioural and neurochemical effects of post-weaning social isolation in rodents-relevance to developmental neuropsychiatric disorders[J]. Neurosci Biobehav Rev, 2008, 32(6): 1087–1102. DOI:10.1016/j.neubiorev.2008.03.003 |
| [18] | TAKAHASHI A, NAGAYASU K, NISHITANI N, et al. Control of intermale aggression by medial prefrontal cortex activation in the mouse[J]. PLoS ONE, 2014, 9(4): e94657. DOI:10.1371/journal.pone.0094657 |
| [19] | MORI T, UZAWA N, IWASE Y, et al. Narcolepsy-like sleep disturbance in orexin knockout mice are normalized by the 5-HT1A receptor agonist 8-OH-DPAT[J]. Psychopharmacology (Berl), 2016, 233(12): 2343–2353. DOI:10.1007/s00213-016-4282-1 |
| [20] | DABROWSKA J, BRYLINSKI M. Stereoselectivity of 8-OH-DPAT toward the serotonin 5-HT1A receptor: biochemical and molecular modeling study[J]. Biochem Pharmacol, 2006, 72(4): 498–511. DOI:10.1016/j.bcp.2006.05.008 |
| [21] | STEIN D J, MICZEK K A, LUCION A B, et al. Aggression-reducing effects of F15599, a novel selective 5-HT1A receptor agonist, after microinjection into the ventral orbital prefrontal cortex, but not in infralimbic cortex in male mice[J]. Psychopharmacology (Berl), 2013, 230(3): 375–387. DOI:10.1007/s00213-013-3164-z |
| [22] | BESNARD S, MASSÉ F, VERDAGUER M, et al. Time-and dose-related effects of three 5-HT receptor ligands on the genioglossus activity in anesthetized and conscious rats[J]. Schlaf Atmung, 2007, 11(4): 275–284. DOI:10.1007/s11325-007-0107-0 |
| [23] | PILAR-CUÉLLAR F, VIDAL R, DÍAZ Á, et al. Enhanced stress response in 5-HT1AR overexpressing mice: altered HPA function and hippocampal long-term potentiation[J]. ACS Chem Neurosci, 2017, 8(11): 2393–2401. DOI:10.1021/acschemneuro.7b00156 |
| [24] | STAMPER C E, HASSELL J E, KAPITZ A J, et al. Activation of 5-HT1A receptors in the rat dorsomedial hypothalamus inhibits stress-induced activation of the hypothalamic-pituitary-adrenal axis[J]. Stress, 2017, 20(2): 223–230. DOI:10.1080/10253890.2017.1301426 |
| [25] | WANG H T, HAN F, SHI Y X. Activity of the 5-HT1A receptor is involved in the alteration of glucocorticoid receptor in hippocampus and corticotropin-releasing factor in hypothalamus in SPS rats[J]. Int J Mol Med, 2009, 24(2): 227–231. |
| [26] | ERDELJAN P, ANDREWS M H, MACDONALD J F, et al. Glucocorticoids and serotonin alter glucocorticoid receptor mRNA levels in fetal guinea-pig hippocampal neurons, in vitro[J]. Reprod Fertil Dev, 2005, 17(7): 743–749. DOI:10.1071/RD05043 |
| [27] | ANACKER C, CATTANEO A, MUSAELYAN K, et al. Role for the kinase SGK1 in stress, depression, and glucocorticoid effects on hippocampal neurogenesis[J]. Proc Natl Acad Sci USA, 2013, 110(21): 8708–8713. DOI:10.1073/pnas.1300886110 |
| [28] | SHARVIT A, SEGAL M, KEHAT O, et al. Differential modulation of synaptic plasticity and local circuit activity in the dentate gyrus and CA1 regions of the rat hippocampus by corticosterone[J]. Stress, 2015, 18(3): 319–327. DOI:10.3109/10253890.2015.1023789 |
| [29] | KUNⅡSHI H, ICHISAKA S, MATSUDA S, et al. Chronic inactivation of the orbitofrontal cortex increases anxiety-like behavior and impulsive aggression, but decreases depression-like behavior in rats[J]. Front Behav Neurosci, 2016, 10: 250. DOI:10.3389/fnbeh.2016.00250 |
| [30] | MOGHA A, GUARIGLIA S R, DEBATA P R, et al. Serotonin 1A receptor-mediated signaling through ERK and PKCα is essential for normal synaptogenesis in neonatal mouse hippocampus[J]. Trans Psych, 2012, 2(1): e66. DOI:10.1038/tp.2011.58 |
| [31] |
雷莉, 张艳, 胡华, 等. 早年慢性应激对青春期大鼠攻击行为及下丘脑腹内侧核和前额皮质脑源性神经营养因子表达的影响[J].
第三军医大学学报, 2013, 35(3): 233–236.
LEI L, ZHANG Y, HU H, et al. Effect of early chronic life stress on aggressive behavior and expression of brain-derived neurotrophic factor in hypothalamus and prefrontal cortex in puberty rats[J]. J Thrid Mil Med Univ, 2013, 35(3): 233–236. |
| [32] |
张艳. 早年慢性应激后青春期攻击大鼠认知功能及海马神经可塑性改变[D]. 重庆: 重庆医科大学, 2014.
ZHANG Y. Changes of cognitive function and hippocampal plasticity in adolescent rats with chronic stress after puberty[D]. Chongqing: Chongqing Medical University, 2014. |
| [33] |
张艳, 雷莉, 胡华, 等. 早年慢性应激对青春期病理性攻击大鼠空间学习记忆及海马脑源性神经营养因子、5-羟色胺的影响[J].
第二军医大学学报, 2013, 34(10): 1065–1069.
ZHANG Y, LEI L, HU H, et al. Effect of early life chronic stress on spatial learning and memory and hippocampus brain-derived neurotrophic factor and 5-HT in puberty pathological aggression rats[J]. J Second Mil Med Univ, 2013, 34(10): 1065–1069. DOI:10.3724/SP.J.1008.2013.01065 |
| [34] | DUNN H A, CHAHAL H S, CAETANO F A, et al. PSD-95 regulates CRFR1 localization, trafficking and β-arrestin2 recruitment[J]. Cell Signal, 2016, 28(5): 531–540. DOI:10.1016/j.cellsig.2016.02.013 |
| [35] |
刘成全, 颜天华, 陈荣, 等. NMDAR/PSD-95/nNOS复合物在神经病理性疼痛中的研究进展[J].
药学与临床研究, 2015, 23(2): 168–171.
LIU C Q, YAN T H, CHEN R, et al. Research progress of nmdar/psd-95/nnos complex in neuropathic pain[J]. Pharm Clin Res, 2015, 23(2): 168–171. |



