2. 510010 广州,广州军区广州总医院心脏外科
2. Department of Cardiovascular Surgery, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou, Guangdong Province, 510010, China
主动脉夹层作为心脏外科领域最为复杂的疾病之一,因其发病位置的特殊以及手术方式的局限,一直以来有着较高的病死率。有研究显示未行手术干预的A型主动脉夹层患者住院死亡率为58%,而进行手术的患者住院死亡率仍高达9%~32.5%[1]。急性肾功能损伤(acute kidney injury,AKI)作为Ⅰ型主动脉夹层手术后较为常见的并发症,发生率为18%~55%,远高于心脏外科其他手术的并发症,并且夹层手术后,有2%~8%的患者需要行肾脏代替治疗(renal replacement therapy,RRT)[2-3]。夹层术后肾功能损伤的高发生率以及其带来的不良预后让许多夹层患者命运趋向终结,也让外科医师辛苦数小时完成的高难度手术成果付之一炬。因此,RRT的及时合理应用在全弓置换术后康复中有着举足轻重的作用。本研究通过回顾本中心主动脉夹层行全弓置换患者数据,分析术前、术中RRT患者的各项资料,试图发现其相关危险因素,对术后RRT做出及时预测,在肾功能进一步恶化前采取有效的治疗方法。
1 资料与方法 1.1 临床资料回顾性分析广州军区广州总医院心脏外科中心2007年3月至2017年3月诊断为Ⅰ型主动脉夹层并行全弓置换患者258例,术后采用在2007年由Acute Kidney Injury Network(AKIN)制定的分级标准,诊断术后AKI患者123例,其中因肾功能损伤严重需行RRT者46例,此46例均为初次行RRT,将此46例纳入RRT组,剩余未行RRT者212例纳入非RRT组。
1.2 方法 1.2.1 手术方式258例患者麻醉方式无差异,且均行全弓置换以及象鼻支架腔内植入术,术中采用中低温、双侧低流量脑灌注。肝素化后,经右腋动脉、左颈总动脉、股动脉插入动脉泵管,经右房插入双极静脉管,经右上肺静脉插入左心引流管,行体外循环。优先吻合四分叉人工血管与左颈总动脉,撤除原左颈总动脉泵管,阻闭升主动脉,以HTK心肌停跳液由主动脉根部冷灌停跳,待体温降至26~28 ℃时阻闭无名动脉、左锁骨下动脉,停止股动脉循环,开始双侧低流量脑灌注。于无名动脉开口远端离断主动脉弓,置入象鼻支架,开口与主动脉壁吻合。取人工血管行升主动脉重建,远端与主动脉弓吻合,恢复股动脉流量。此时,在心脏跳动下分别行分叉血管与无名动脉、左锁骨下动脉吻合。
1.2.2 术后监护术后进入监护室,予呼吸机辅助呼吸及心电监测,有创血压及中心静脉压监测。符合以下任意标准即开始行RRT[4]:①持续6 h无尿;②严重少尿(持续12 h尿量<200 mL);③高钾血症(血钾>6.5 mmol/L);④严重的代谢性酸中毒(pH<7.2);⑤容量过负荷(肺水肿或利尿药物对其无效);⑥严重的氮质血症(尿素氮>30 mmol/L或血清肌酐>300 μmol/L);⑦发生尿毒症的临床并发症。由监护医师在股静脉或颈内静脉留置三腔血滤管,连续RRT过程中置换液为我院提供,抗凝采用低分子肝素泵入,维持ACT值<180 s,当连续3 d血清肌酐值低于正常值2倍或持续3 d尿量均>500 mL时,可在留置管道的情况下为患者撤除血液滤过设备。
1.3 观察指标各项术前资料以及术中资料:手术时间;体外循环时间;低流量脑灌注时间;术中温度;主动脉阻闭时间;术中红细胞输注量。
1.4 统计学分析计量资料数据采用x±s表示,SPSS 19.0统计软件进行统计处理,组间比较采用t检验,计数资料采用χ2检验,必要时采用Fisher确切概率检验,单因素分析结果有统计学意义的指标纳入Logistic回归分析。ROC曲线评判所得危险因素的检验效能,计算曲线下面积(area under the curve,AUC)及95%可信区间, 检验水准α=0.05。
2 结果 2.1 两组患者术前资料及住院死亡情况258例患者年龄(47.78±8.80)岁,男性215例,女性43例,术后住院死亡34例,死于术后低心排3例,术后多器官功能衰竭19例,感染性休克12例,其中RRT组死亡12例,死亡率占RRT组的26.1%。在RRT组与非RRT组术前资料对比中,术前脓毒血症(15.2% vs 3.8%),术前双侧肾动脉累及(17.4% vs 4.7%)以及术前血清肌酐水平相比较差异有统计学意义(P < 0.05)。而其他数据比较未见明显差异,见表 1。
| 组别 | n | 年龄 (岁,x±s) |
男/女 (例) |
BMI (kg/m2,x±s) |
高血压 [例(%)] |
糖尿病 [例(%)] |
急诊手术 [例(%)] |
吸烟 [例(%)] |
双侧肾动脉 累及[例(%)] |
脓毒血症 [例(%)] |
射血分数 (%,x±s) |
血清肌酐 (μmol/L,x±s) |
| RRT组 | 46 | 49.13±8.25 | 39/7 | 25.67±2.87 | 26(56.5) | 2(4.3) | 9(19.6) | 22(47.8) | 8(17.4) | 7(15.2) | 62.30±6.75 | 146.72±38.89 |
| 非RRT组 | 212 | 47.48±8.92 | 176/36 | 24.92±2.96 | 114(53.8) | 8(3.8) | 25(11.8) | 108(50.9) | 10(4.7) | 8(3.8) | 61.83±6.19 | 125.79±35.92 |
| 统计值 | 1.152 | 0.085 | 1.555 | 0.115 | 0.000 | 1.996 | 0.147 | 7.505 | 7.071 | 0.468 | 3.528 | |
| P | 0.250 | 0.771 | 0.121 | 0.734 | 1.000 | 0.158 | 0.701 | 0.006 | 0.008 | 0.640 | <0.001 |
2.2 两组患者术中资料对比
两组患者术中资料比较中,RRT组在手术时间、体外循环时间以及术中红细胞输注量上均要高于非RRT组,且差异有统计学意义(P < 0.05),而在低温低流量时间,主动脉阻闭时间及温度上均未见明显差异,见表 2。
| 组别 | n | 手术时间 (min,x±s) |
体外循环时间 (min,xx±s) |
低流量脑灌注时间 (min,x±s) |
主动脉阻闭时间 (min,x±s) |
术中最低温度 (℃,x±s) |
术中红细胞输注>10 U [例(%)] |
| RRT组 | 46 | 445.17±25.04 | 250.60±31.80 | 32.54±7.57 | 129.04±19.96 | 25.39±0.88 | 23(50) |
| 非RRT组 | 212 | 423.52±28.20 | 230.05±28.58 | 29.05±13.89 | 123.41±20.77 | 25.47±0.89 | 54(25.5) |
| 统计值 | 4.811 | 4.332 | 1.648 | 1.679 | 0.554 | 10.861 | |
| P | <0.001 | <0.001 | 0.101 | 0.094 | 0.580 | 0.001 |
2.3 多因素Logistic回归分析结果
将表 1、2单因素分析中存在统计学意义的指标纳入Logistic回归分析,发现术前肌酐水平高、手术时间延长以及术中红细胞输注>10 U是术后RRT的独立危险因素,而术前双侧肾动脉累及、术前脓毒血症、体外循环时间在多因素分析中未见明显差异,见表 3。
| 危险因素 | OR | 95%CI | P |
| 血清肌酐 | 1.018 | 1.008~1.027 | <0.001 |
| 手术时间 | 1.034 | 1.005~1.064 | 0.020 |
| 术中红细胞输注量>10 Ua | 3.426 | 1.573~7.458 | 0.002 |
| a:术中红细胞输注量赋值:1=红细胞输注量≥10 U,0=红细胞输注量<10 U;除术中红细胞输注量外其余为连续变量 | |||
2.4 危险因素预测效能分析
经过ROC曲线分析得出,血清肌酐在预测术后RRT曲线下面积(AUC)为0.675,95%CI为0.586~ 0.765,P < 0.001,当界值在143 μmol/L时,灵敏度为60.9%,特异性为75%;术中红细胞输注量>10 U AUC为0.623,95%CI为0.530~0.716,P=0.009;手术时间AUC为0.728,95%CI为0.648~0.809,P < 0.001,当界值在441 min时,灵敏度为65.2%,特异性为74.1%。3项危险因素综合AUC为0.839,95%CI为0.786~0.892,P < 0.001,见图 1。
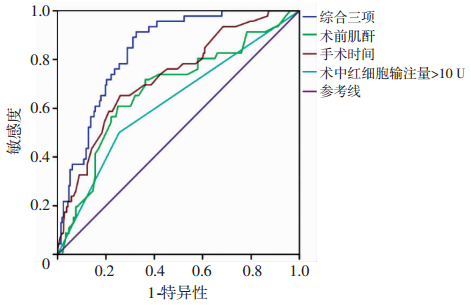
|
| 图 1 危险因素预测ROC曲线 |
3 讨论
在夹层术后,出现AKI患者的1年内死亡率是未发生AKI患者的2.55倍[5]。我中心全弓置换手术采用右腋动脉、左颈总动脉、股动脉泵管,中低温双侧脑灌注手段,维持直肠温度在26~28 ℃。有研究显示,相较于深低温及浅低温,中低温在提供充分脑保护的同时,对于肾功能的影响最小[6]。术后AKI的发生率为47.7%,且术后RRT比例也达17.8%,要高于其他临床中心的结果(11%)[7],可能因为本研究单分析全弓置换手术的患者。而ROH等[7]研究中则以所有A型夹层手术患者为研究对象,包括了全弓、半弓等一系列手术方式。经RRT治疗后各种原因死亡患者12例,死亡率为26%,故明确术后RRT的危险因素对高危患者做出及时的治疗也变得尤为重要。
有研究证实[8],体外循环时间>180 min是术后并发AKI的高危因素,其可能原因是长时间的体外循环过程中,肾脏无法维持最佳的灌注压力,肾脏缺血导致邻近肾小管坏死而进一步加重了炎性反应。本研究发现虽然体外循环时间在RRT组中显著长于非RRT组,但在Logistic回归中未能作为独立危险因素存在。手术时间的增加与术中红细胞输注量>10 U被证实为独立的危险因素。在VERMEULEN等[9]的研究中发现,存储红细胞的细胞膜薄弱,进入机体后很容易破裂分解为铁与游离血红蛋白,造成肾脏微循环功能受损。而手术时间延长很大程度上取决于体外循环时间及术后止血时间,全弓置换手术技术难度大、吻合口多、术后止血困难是延长手术时间的重要原因。手术时间延长导致了凝血机制紊乱,增加了输血量,也增加了术后RRT的风险。QIU等[10]认为通过简化手术方式节省了手术时间,并且减少因为吻合口过多而增加的输血风险,有效降低了术后并发AKI的可能。
术前脓毒血症及双侧肾动脉累及在较多文献中被证实和术后AKI密不可分[11-12],本研究中结果显示两组相比,RRT组脓毒血症患者占比达15.2%,而非RRT组中仅占3.8%,RRT组中有17.4%患者CTA显示双侧肾动脉累及,非RRT组中则有4.7%,其可能原因在于术前双侧肾动脉累及激活了肾素-血管紧张素-醛固酮系统,引起收缩压升高,导致了假腔的持续扩张,肾脏血流进一步减少。年龄、肥胖、高血压等因素均在相关研究中被证实与术后AKI相关[13-15],本研究因样本较少,两组患者中高血压患病率相当(56.5% vs 53.8%),且多为60岁以下中等体态患者,故未证实其与术后RRT的相关性。
血清肌酐作为反映肾脏功能最为直观的指标,在RRT组中要明显高于非RRT组。肾脏功能在经历过低温、低流量体外循环的打击之后,炎性反应加重并缺血再灌注损伤造成血清肌酐进行性升高。许多相关研究证实,术前即存在肾功能损伤的患者中术后肾功能进一步恶化及需要RRT的患者比例极高。ENGLBERGER等[15]认为,术前血清肌酐>1.2 mg/dL与术后AKI有关,相比肌酐,肾小球滤过率预测更为准确,当界值为60 mL/(min·1.73m-2),灵敏度和特异度均很高[16]。本研究中虽未测得肾小球滤过率,但考虑AKIN、RIFLE、KDIGO等标准都是基于肌酐变化来定义AKI严重程度,同时肌酐在预测RRT上也展现了较好的特异性。AUC为0.675,95%CI为0.586~0.765,当界值在143 μmol/L时,灵敏度为60.9%,特异性为75%,而综合得出的3项危险因素,AUC可达0.839,95%CI为0.786~0.892。对于术后并发AKI的患者,是否早期RRT仍然争议较大。本研究得出:术前肌酐高水平、手术时间延长、术中红细胞输注量>10 U均为术后RRT的独立危险因素。将此3项纳入开始RRT的考量范围,明确在术前、术中即存在高危因素的患者,术后肾功能损伤未达AKIN-3级时尽早行RRT是否可以改善此类患者的预后及提高生存率,等待更多的随机对照研究明确。
全弓置换术后并发肾功能损伤及需要肾脏替代治疗发生率高,严重影响了患者的预后,明确术前肌酐高水平、手术时间延长、输血量增加是术后肾脏替代治疗的高危因素,可以为术后AKI患者的治疗提供参考意见。
| [1] | GEIRSSON A, SZETO W Y, POCHETTINO A, et al. Significance of malperfusion syndromes prior to contemporary surgical repair for acute type a dissection:outcomes and need for additional revascularizations[J]. Eur J Cardiothorac Surg, 2007, 32(2): 255–262. DOI:10.1016/j.ejcts.2007.04.012 |
| [2] | KUITUNEN A, VENTO A, SUOJARANTA-YLINEN R, et al. Acute renal failure after cardiac surgery:evaluation of the RIFLE classification[J]. Ann Thorac Surg, 2006, 81(2): 542–546. DOI:10.1016/j.athoracsur.2005.07.047 |
| [3] | KOWALIK M M, LANGO R, KLAJBOR K, et al. Incidence-and mortality-related risk factors of acute kidney injury requiring hemofiltration treatment in patients undergoing cardiac surgery: a single-center 6-year experience[J]. J Cardiothorac Vasc Anesth, 2011, 25(4): 619–624. DOI:10.1053/j.jvca.2010.12.011 |
| [4] | BELLOMO R, KELLUM J A, RONCO C. Acute kidney injury[J]. Lancet, 2012, 380(9843): 756–766. DOI:10.1016/S0140-6736(11)61454-2 |
| [5] | TSAI H S, TSAI F C, CHEN Y C, et al. Impact of acute kidney injury on one-year survival after surgery for aortic dissection[J]. Ann Thorac Surg, 2012, 94(5): 1407–1412. DOI:10.1016/j.athoracsur.2012.05.104 |
| [6] | URBANSKI P P, LENOS A, BOUGIOUKAKIS P, et al. Mild-to-moderate hypothermia in aortic arch surgery using circulatory arrest: a change of paradigm?[J]. Eur J Cardiothorac Surg, 2012, 41(1): 185–191. DOI:10.1016/j.ejcts.2011.03.060 |
| [7] | ROH G U, LEE J W, NAM S B, et al. Incidence and risk factors of acute kidney injury after thoracic aortic surgery for acute dissection[J]. Ann Thorac Surg, 2012, 94(3): 766–771. DOI:10.1016/j.athoracsur.2012.04.057 |
| [8] | SANSONE F, MORGANTE A, CERESA F, et al. Prognostic implications of acute renal failure after surgery for type A acute aortic dissection[J]. Aorta (Stamford), 2015, 3(3): 91–97. DOI:10.12945/j.aorta.2015.14.022 |
| [9] | VERMEULEN W I, HANSSEN S J, BUURMAN W A, et al. Cardiovascular surgery and organ damage: time to reconsider the role of hemolysis[J]. J Thorac Cardiovasc Surg, 2011, 142(1): 1–11. DOI:10.1016/j.jtcvs.2011.02.012 |
| [10] | QIU Z, CHEN L, CAO H, et al. Analysis of risk factors for acute kidney injury after ascending aortic replacement combined with open placement of triple-branched stent graft in type A aortic dissection: a new technique versus the traditional method in a single Chinese center[J]. Med Sci Monit, 2015, 21: 674–680. DOI:10.12659/MSM.892492 |
| [11] | WANG X, REN H M, HU C Y, et al. Predictors and in-hospital outcomes of preoperative acute kidney injury in patients with type A acute aortic dissection[J]. J Geriatr Cardiol, 2016, 13(8): 679–684. DOI:10.11909/j.issn.1671-5411.2016.08.006 |
| [12] | KO T, HIGASHITANI M, SATO A, et al. Impact of acute kidney injury on early to long-term outcomes in patients who underwent surgery for type A acute aortic dissection[J]. Am J Cardiol, 2015, 116(3): 463–468. DOI:10.1016/j.amjcard.2015.04.043 |
| [13] | DI MARCO L, PACINI D, LEONE A, et al. Long-term outcome after acute type A aortic dissection: does an age limit still exist?[J]. J Cardiovasc Surg (Torino), 2014, 55(3): 359–365. |
| [14] | ZHAO H, PAN X, GONG Z, et al. Risk factors for acute kidney injury in overweight patients with acute type A aortic dissection:a retrospective study[J]. J Thorac Dis, 2015, 7(8): 1385–1390. DOI:10.3978/j.issn.2072-1439.2015.07.19 |
| [15] | ENGLBERGER L, SURI R M, GREASON K L, et al. Deep hypothermic circulatory arrest is not a risk factor for acute kidney injury in thoracic aortic surgery[J]. J Thorac Cardiovasc Surg, 2011, 141(2): 552–558. DOI:10.1016/j.jtcvs.2010.02.045 |
| [16] | IMASAKA K, TAYAMA E, TOMITA Y. Preoperative renal function and surgical outcomes in patients with acute type A aortic dissectiondagger[J]. Interact Cardiovasc Thorac Surg, 2015, 20(4): 470–476. DOI:10.1093/icvts/ivu430 |



