肥胖或超重将诱导糖尿病、心血管疾病、肿瘤等高死亡率的机体代谢性疾病[1]。肥胖最早流行于发达国家,但随着物质生活水平的提高,人们饮食及生活方式的改变,发展中国家肥胖发病率亦逐年增高,受累人群逐步的年轻化,现已成为全球性的医学和社会问题[2]。营养物质的过度摄入且消耗减少是导致肥胖的重要原因。能量的摄入过程主要包括消化的营养物质(葡萄糖、脂肪酸、氨基酸等)在小肠的吸收,以及吸收后的营养物质通过肠系膜循环转运至肝脏及脂肪组织进行物质的代谢。因此,探究营养物质吸收转运过程的调控机制及其药理学的干预,将会有效地限制高糖及体脂的储存,从而达到降低血糖及体质量的目的。
吸收后的营养物质需进入肠系膜血管内转运到肝脏进行物质代谢,小肠系膜血管系统对营养物质的转运过程发挥重要的调节作用。与大动脉(如胸、腹主动脉)等容量血管不同,肠系膜微细动脉属于阻力血管范畴,其血管平滑肌的舒缩可明显改变血管管径,对肠系膜的血流量具有明显控制作用。当肠系膜微细动脉收缩时,血管内阻力增大,肠系膜血流量减少,最终限制营养物质的转运;反之当血管舒张时,肠系膜血流量增加,营养物质的转运亦增加[3]。肠系膜微细动脉作为阻力血管一个较好的模型而被广泛应用于血管生理及病理的研究,故研究肠系膜微细动脉平滑肌的调节机制意义重大。
已有研究表明,肠系膜微细动脉平滑肌的功能受钾通道调节[3]。其中电压依赖性钾通道(voltage-dependent K+,Kv)表达于肠系膜动脉,在营养物质转运过程中发挥重要作用[4]。Kv超家族主要包括12个亚家族(Kv1~Kv12),Kv1是该家族中最大的亚家族,包括Kv1.1~Kv1.8八个成员[5],其中Kv1.1和Kv1.3在肠系膜微细动脉中均有表达[3, 6],但其对动脉平滑肌的调节作用及机制不是十分清楚。因此,本研究选用小鼠肠系膜微细动脉作为阻力血管的模型,应用丹麦DMT520A离体微血管张力测定系统记录其张力变化,通过广谱Kv通道阻断剂4-AP,以及选择性Kv1.1和Kv1.3通道阻断剂TEA,PAP-1进行实验,探究Kv通道及其亚型对离体小鼠肠系膜微细血管的调节作用及其机制,旨在发现调控能量转运药物研发的新靶点。
1 材料与方法 1.1 材料 1.1.1 设备丹麦DMT520A双通道微血管张力测定仪(DMT),Powerlab数据采集分析系统和LabChart8软件进行数据的采集和记录(AD Instruments公司)。
1.1.2 实验试剂Krebs-Henseleit液成分(mmol/L):NaCl:118、KCl:4.7、MgSO4:1.2、KH2PO4:1.2、NaHCO3:25、CaCl2:2、Glucose:10。0 mmol/L Ca2+ Krebs-Henseleit液成分(mmol/L):NaCl:118、KCl:4.7、MgSO4:1.2、KH2PO4:1.2、NaHCO3:25、EGTA:0.5,Glucose:10。4-氨基吡啶(4-Aminopyridine,4-AP),四乙基氯化铵(Tetraethylam-monium,TEA),EGTA均购于Sigma公司,PAP-1购于MCE公司,去甲肾上腺素(Norepinephrine,NE)购于远大医药有限公司,NaCl、KCl等无机试剂均为国产分析纯。4-AP、PAP-1溶于DMSO,EGTA溶于1 mol/L NaHCO3,TEA溶于去离子水,实验结果表明,实验中所用DMSO的浓度对肠系膜血管张力测定无影响。
1.1.3 实验动物清洁级健康C57BL/6小鼠,雄性,6~8周龄,体质量20~25 g,购自陆军军医大学第二附属医院实验动物中心,自由饮水和摄食。
1.2 实验方法 1.2.1 小鼠肠系膜动脉制备C57BL/6小鼠脱颈处死后迅速取出带系膜肠管,浸入预冷的K-H液中,解剖显微镜下小心清除血管周围脂肪和结缔组织,分离肠系膜动脉2级分支,剪取长度为1.5~2 mm的动脉环。转移血管至含5 mL K-H液的浴槽中,悬挂于两段钨丝线中(直径0.04 mm),其中钨丝线的一边连接张力换能器,另一边连接血管微调装置,保持浴槽温度在37 ℃,持续通入95% O2+5% CO2的混合气,维持pH值在7.4左右。血管环在K-H液中平衡30 min后标准化,经过标准化的血管环,其张力相当于100 mmHg下血管直径0.9倍的张力。血管环在该张力下孵育30 min,每隔15 min更换一次K-H液。用KCl(1×10-1 mol/L)预收缩,待收缩张力稳定后洗脱,此过程重复3次,以激发血管环的最大收缩活性。
1.2.2 血管收缩的量效曲线 1.2.2.1 观察钾通道阻断剂对静息状态血管的作用待血管标准化平衡后,在恒温组织浴槽中从低浓度到高浓度累积加入4-AP、PAP-1、TEA,记录血管在不同浓度药物作用下的血管张力。
1.2.2.2 观察钾通道阻断剂对NE诱导的血管收缩曲线的作用待血管标准化平衡后,在恒温组织浴槽中从低浓度到高浓度累积加入NE,绘制对照组血管收缩的量效曲线。随后用K-H液洗脱上述药物,此过程重复3次,待血管再次平衡后,加入钾通道阻断剂,30 min后,再次从低浓度到高浓度累积加入NE,绘制实验组NE诱导血管收缩的量效曲线。
1.2.3 血管舒张的量效曲线 1.2.3.1 钾通道阻断剂对KCl预收缩血管环的作用用KCl(1×10-1 mol/L)预收缩血管,待血管收缩平稳后,以累积浓度法加入钾通道阻断剂4-AP、PAP-1、TEA,绘制血管舒张的量效曲线。
1.2.3.2 钾通道阻断剂对NE预收缩血管环的作用用NE(5×10-6 mol/L)预收缩血管,待血管收缩平稳后,以累积浓度法加入钾通道阻断剂4-AP、PAP-1、TEA,绘制血管舒张的量效曲线。
1.2.4 NE在0 mmol/L Ca2+液以及2 mmol/L Ca2+液中的收缩曲线血管在K-H液中标准化后平衡30 min,将K-H液换成0 mmol/L Ca2+ K-H液,待血管再次平稳后,向浴槽中加入NE(5×10-6 mol/L),记录血管张力的变化,随后加入CaCl2(2×10-3 mol/L),待张力平稳后再次记录血管的收缩值。随后用K-H液洗脱上述药物,此过程重复3次。加阻断剂组为:血管在K-H液中稳定10 min后,将K-H液换成0 mmol/L Ca2+K-H液,随后加入钾离子通道阻断剂,10 min后加入NE,记录血管张力的变化,随后加入CaCl2,再次记录血管的张力变化。
1.3 统计学分析采用GraphPad Prism 6.0统计软件进行实验数据的分析和图片的绘制,所有数据以x±s表示。最大舒张率Rmax计算方法如下:(最大收缩张力-加药后张力)/(最大收缩张力-静息张力)×100%。收缩百分比计算方法为:(加药后张力-静息张力)/(最大收缩张力-静息张力)×100%。曲线下面积(AUC)计算方法为使用GraphPad软件Analyze中Area under curve计算所得。每组实验血管例数n≥5。两配对样本间比较采用配对t检验,两组间比较采用t检验。检验水准α=0.05。
2 结果 2.1 4-AP对小鼠肠系膜微细动脉的作用 2.1.1 4-AP对静息状态下小鼠肠系膜微细动脉的作用小鼠肠系膜动脉标准化后平稳30 min,累积加入不同浓度4-AP(6×10-3、8×10-3、10×10-3 mol/L),观察到血管发生了明显的收缩反应(n=5,图 1A),其中最大收缩张力为(8.82±0.68)mN。

|
|
A:4-AP对静息状态下小鼠肠系膜微细动脉的收缩曲线; B:4-AP对KCl预收缩小鼠肠系膜微细动脉的收缩曲线; C:4-AP对NE预收缩小鼠肠系膜微细动脉的舒张曲线 图 1 Kv通道阻断剂4-AP对小鼠肠系膜微细动脉的作用 |
2.1.2 4-AP对KCl预收缩的小鼠肠系膜微细动脉的作用
累积浓度的4-AP(0.5×10-3~4×10-3 mol/L),使KCl预收缩的内皮完整的血管进一步发生收缩反应(n=5,图 1B),当加入最大浓度4×10-3 mol/L的4-AP时血管未进一步的收缩,说明此时已达最大收缩张力。
2.1.3 4-AP对NE预收缩小鼠肠系膜微细动脉的作用小鼠完整内皮肠系膜动脉用NE预收缩,约3 min后收缩平稳,累积加入不同浓度4-AP(0.5×10-3~4×10-3 mol/L)。结果显示:4-AP能浓度依赖性舒张NE预收缩的血管(n=5,图 1C),Rmax为(86.63±4.91)%,pEC50为(2.02±0.18)。
2.2 4-AP对NE诱导小鼠肠系膜微细动脉收缩曲线的抑制作用小鼠肠系膜动脉环标准化后平稳30 min,进行对照组实验,获得NE收缩血管的量效曲线(图 2A),随后洗脱以上药物,加入4-AP(2×10-3 mol/L),获得4-AP组NE收缩血管的量效曲线(图 2B)。结果显示:4-AP可使NE量效曲线向右下方移动(图 2C,n= 10),加入0.9×10-6 mol/L NE时血管的收缩百分比从对照组的(90.20±0.96)%降至(49.05±8.84)%(P < 0.01),曲线下面积(AUC)从对照组的(20.24±0.69)降至(6.99±1.49)(P < 0.01),NE的pEC50对照组为(0.63±0.03),4-AP组为(0.74±0.03)(P < 0.01)。

|
| A:对照组NE收缩曲线;B:4-AP(2×10-3 mol/L)作用30 min后NE的收缩曲线;C:对照组与4-AP组的NE收缩百分比S形曲线(n=10);a:P < 0.01,与4-AP组比较 图 2 Kv通道阻断剂4-AP可抑制NE诱导的血管收缩 |
2.3 4-AP抑制NE诱导细胞内钙释放所致的动脉收缩,不影响外钙内流所致的收缩
肠系膜动脉环标准化后平稳30 min,观察NE(5×10-6 mol/L)在0 mmol/L Ca2+液及2 mmol/L Ca2+中收缩张力的变化,4-AP组为:洗脱上述药物后加入4-AP(4×10-3 mol/L),再次记录NE在0 mmol/L Ca2+液及2 mmol/L Ca2+中收缩张力的变化。结果显示:对照组在0 mmol/L Ca2+ K-H液中加入NE后,血管产生明显收缩反应,最大收缩张力为(3.45±0.24)mN,而加入4-AP组,血管未发生收缩反应(P < 0.01,图 3);对照组在2 mmol/L Ca2+液中加入NE后血管的最大收缩张力为(7.26±0.69)mN,4-AP组为(7.30±0.61)mN(n=6,P>0.05,图 3)。洗脱前后未影响血管的收缩活性,并且在洗脱后的反应中,血管的收缩活性较洗脱前稍有增加。以上结果表明:4-AP明显抑制NE诱导的细胞内钙释放,未影响细胞外钙内流所致的动脉收缩。
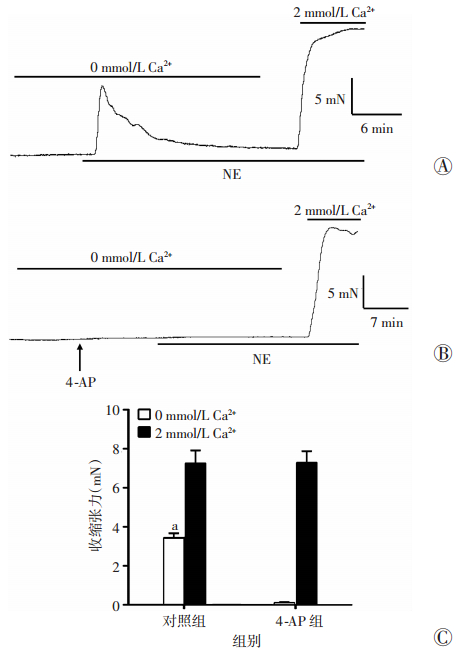
|
| A:对照组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线;B:4-AP(4×10-3 mol/L)组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线;C:对照组与4-AP组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线统计(n=6);a:P < 0.01,与4-AP组比较 图 3 Kv通道阻断剂4-AP可抑制NE诱导的细胞内钙释放,不影响外钙内流 |
2.4 PAP-1对小鼠肠系膜微细动脉的作用 2.4.1 PAP-1对静息状态下小鼠肠系膜微细动脉的作用
小鼠肠系膜动脉环标准化后平稳30 min,累积加入不同浓度PAP-1(8×10-6,10×10-6,20×10-6 mol/L),血管未发生收缩反应。为了证明血管此时的活性状态,随后加入NE(5×10-6 mol/L),血管产生收缩反应(n=5,图 4A)。以上结果表明PAP-1即使在高浓度下也不能使静息状态下的血管环发生收缩反应。
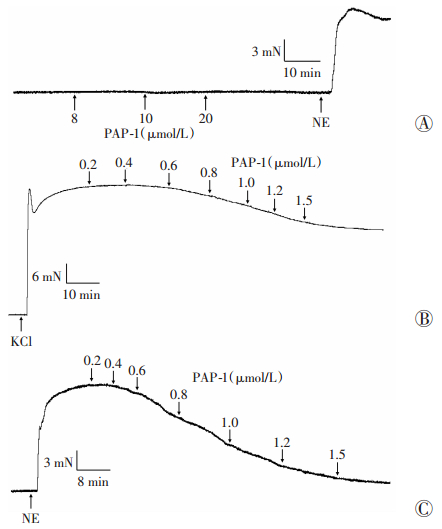
|
|
A:PAP-1对静息状态下小鼠肠系膜微细动脉的收缩曲线; B:PAP-1对KCl预收缩的小鼠肠系膜微细动脉的舒张曲线; C:PAP-1对NE预收缩小鼠肠系膜微细动脉的舒张曲线 图 4 Kv1.3通道选择性阻断剂PAP-1对小鼠肠系膜微细动脉的作用 |
2.4.2 PAP-1对KCl预收缩的小鼠肠系膜微细动脉的作用
小鼠完整内皮肠系膜动脉用KCl预收缩,约3 min后收缩平稳,累积加入不同浓度PAP-1(0.2× 10-6~1.5×10-6 mol/L)。结果显示:PAP-1可使KCl预收缩内皮完整的血管发生舒张反应(n=5),最大舒张率Rmax为(31.06±2.81)%,pEC50为(1.49±0.79),见图 4B。
2.4.3 PAP-1对NE预收缩小鼠肠系膜微细动脉的作用小鼠完整内皮肠系膜动脉用NE预收缩,约3 min后收缩平稳,累积加入不同浓度PAP-1(0.2×10-6~1.5×10-6 mol/L)。结果显示:PAP-1能浓度依赖性舒张NE预收缩的血管(n=6),最大舒张率Rmax为(89.69±1.51)%,pEC50为(0.71±0.03),见图 4C。
2.5 PAP-1对NE诱导小鼠肠系膜微细动脉收缩曲线的抑制作用小鼠肠系膜动脉环标准化后平稳30 min,进行对照组实验,获得NE收缩血管的量效曲线(图 5A),随后洗脱以上药物,加入PAP-1(3×10-6 mol/L),获得PAP-1组NE收缩血管的量效曲线(图 5B)。结果显示:PAP-1同样可使NE量效曲线向右下方移动(n=10,图 5C),加入0.9 ×10-6 mol/L NE时血管的收缩百分比从对照组的(95.73±1.05)%降至(38.21±9.63)%(P < 0.01),曲线下面积(AUC)从对照组的(26.60±1.92)降至(9.25±2.87)(P < 0.01),NE的pEC50对照组为(0.61±0.03),加PAP-1组为(0.74±0.08)。
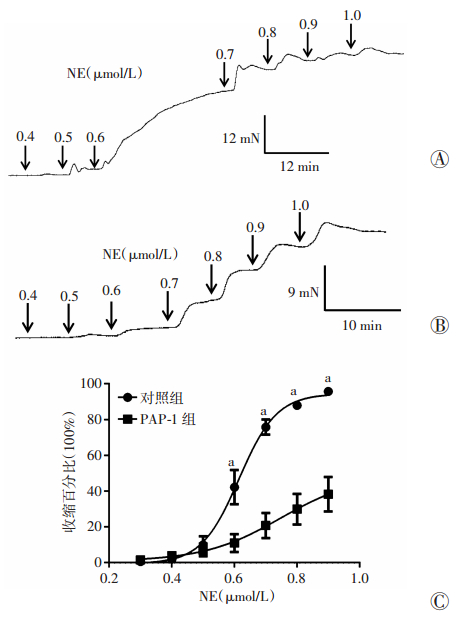
|
| A:对照组NE收缩曲线;B:PAP-1(3×10-6 mol/L)作用30 min后NE的收缩曲线;C:对照组与PAP-1组的NE收缩百分比S形曲线(n=10);a:P < 0.01,与PAP-1组比较 图 5 Kv1.3通道选择性阻断剂PAP-1对NE诱导的血管收缩的影响 |
2.6 PAP-1同时抑制NE诱导细胞内钙释放和外钙内流所致的动脉收缩
肠系膜动脉环标准化后平稳30 min,观察NE(5×10-6 mol/L)在0 mmol/L Ca2+液及2 mmol/L Ca2+中收缩张力的变化,PAP-1组为:洗脱上述药物后加入PAP-1(10×10-6 mol/L),再次记录NE在0 mmol/L Ca2+液及2 mmol/L Ca2+中收缩张力的变化。结果显示:对照组中在0 mmol/L Ca2+K-H液中加入NE后,血管产生明显的收缩反应,最大收缩张力为(4.28±0.53)mN,而加入PAP-1组,血管亦发生了收缩反应,最大收缩力为(2.75±0.49)mN,与对照组相比张力被明显抑制(P < 0.05);对照组在2 mmol/L Ca2+液中加入NE后血管的最大收缩张力为(7.08±0.58)mN,实验组为(5.90±0.80)mN(n=6,P < 0.05,图 6)。以上结果表明:PAP-1不仅抑制NE诱导的细胞内钙释放,同时也抑制了外钙内流所致的动脉收缩。

|
| A:对照组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线;B:PAP-1 (10×10-6 mol/L)组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线;C:对照组与PAP-1组NE在0 mmol/L Ca2+及2 mmol/L Ca2+液中的收缩曲线统计(n=6);a:P < 0.05,与PAP-1组比较 图 6 Kv1.3通道选择性阻断剂PAP-1可抑制NE诱导的细胞内钙释放和外钙内流 |
2.7 TEA对小鼠肠系膜微细动脉的作用 2.7.1 TEA对静息状态下小鼠肠系膜微细动脉的作用
肠系膜动脉环标准化后平稳30 min,累积加入不同浓度TEA(5×10-3,10×10-3,20×10-3 mol/L),观察到:TEA可使血管发生明显的收缩反应,最大收缩张力为(3.03±0.88)mN(图 7A)。但在0 mmol/L Ca2+ K-H液,则未观察到血管发生收缩反应。为证明血管此时的活性状态,随后将浴槽内液体换为K-H液加入NE(5×10-6 mol/L)后,血管发生明显收缩反应(n=5,图 7B)。以上结果表明:TEA收缩静息状态的肠系膜动脉与促进细胞外钙内流有关。
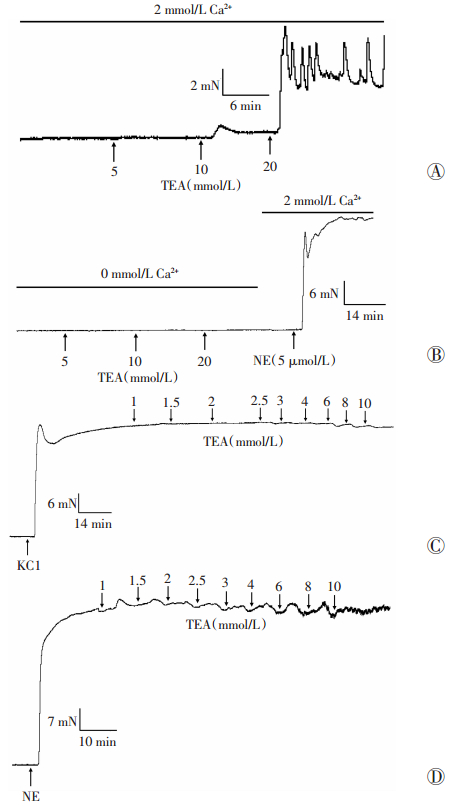
|
| A:K-H液中TEA对静息状态下小鼠肠系膜微细动脉的收缩曲线;B:0 mmol/L Ca2+ K-H液中TEA未使静息状态下小鼠肠系膜微细动脉发生收缩反应;C:TEA对KCl预收缩的小鼠肠系膜微细动脉的作用曲线;D:TEA对NE预收缩小鼠肠系膜微细动脉的作用曲线 图 7 Kv1.1通道选择性阻断剂TEA对小鼠肠系膜微细动脉的作用 |
2.7.2 TEA对KCl预收缩小鼠肠系膜微细动脉的作用
小鼠肠系膜动脉环用KCl预收缩,约3 min后收缩平稳,累积加入不同浓度TEA(1×10-3~10×10-3 mol/L),发现TEA未使KCl预收缩的动脉环产生明显作用(n=6,图 7C)。
2.7.3 TEA对NE预收缩小鼠肠系膜微细动脉的作用小鼠肠系膜动脉环用NE预收缩,约3 min后收缩平稳,累积加入不同浓度TEA(1×10-3~10×10-3 mol/L),发现TEA同样未使NE预收缩的血管环发生舒张反应(n=5,图 7D)。
3 讨论血管平滑肌细胞内钙离子的浓度及其精细调控是维持血管正常舒缩反应的关键。正常静息状态下,细胞内处于一种钙稳态状态,即胞质内游离Ca2+浓度约为胞外Ca2+浓度的1/10 000,故细胞对胞质内Ca2+浓度的增加异常敏感,以致于胞内Ca2+成为触发许多生理反应的重要信号[7]。由于血管平滑肌细胞内钙离子的浓度与血管收缩强度之间存在较好的相关性,后者往往可作为前者的间接测定指标。我们的研究发现:4-AP和TEA均可收缩静息状态的小鼠肠系膜微细动脉,提示阻断Kv及Kv1.1通道后可使细胞内Ca2+浓度增加;PAP-1未能影响静息状态的血管,说明Kv1.3通道未能对血管发挥收缩调节作用。
细胞外高钾可收缩肠系膜动脉[8]。具体机制如下:静息状态下,由于血管平滑肌细胞膜上Na+-K+泵的活动,细胞内的钾离子浓度达到细胞外液的30倍,使钾离子由胞内向胞外流动,产生细胞膜内较负的静息电位(或极化状态)。当增加胞外钾离子浓度时,胞内钾离子的外流受到限制,使细胞膜发生去极化,从而激活血管平滑肌上的VDCC,导致外钙内流和最终的血管收缩[3, 9]。本研究发现,Kv通道阻断剂4-AP可收缩静息状态的肠系膜微细动脉,并可使KCl预收缩的血管进一步发生收缩反应。提示4-AP阻断Kv通道,可使细胞膜发生去极化激活VDCC,最终导致外钙内流使血管发生收缩反应。表明总的Kv通道在维持细胞膜电位上发挥重要作用。Kv1.1通道选择性阻断剂TEA也可收缩静息状态的血管,但未能使KCl预收缩的血管发生进一步的张力增加,说明Kv1.1通道在维持细胞膜电位上亦发挥作用。但作为Kv通道的一个亚型,其单独发挥的作用不及总的Kv通道。Kv1.3通道选择性阻断剂PAP-1不能引起静息状态的血管收缩,并使KCl预收缩的血管发生舒张反应,提示Kv1.3的功能活动可能不影响血管平滑肌细胞的静息膜电位。
NE作为另一种强有力的血管收缩药物,已广泛应用于临床和基础研究,其作用机制同样是增加胞质内Ca2+浓度,但与高钾收缩血管的机制不同。具体如下:NE主要通过激活细胞膜上的α肾上腺素受体。该受体作为G蛋白偶联受体超家族的一员,一方面可活化Gq激活磷脂酶C(PLC),水解磷脂酰肌醇4,5-双磷酸(PIP2)产生二酰甘油(DAG)和三磷酸肌醇(IP3),后者与肌浆网上IP3R结合引起肌浆网内钙释放[10]。另一方面其可通过Gs激活腺苷酸环化酶(AC),进而水解三磷酸腺苷(ATP)生成环-磷酸腺苷(cAMP)。cAMP作为第二信使分子激活下游的蛋白激酶A(PKA),活化蛋白质的磷酸化过程,从而使细胞膜上的钙通道从非活性状态转为活性状态,最终导致胞外钙离子内流[11]。我们的实验结果显示,4-AP可使NE预收缩的小鼠肠系膜微细动脉产生明显舒张作用,提示阻断Kv通道可以抑制NE诱导的细胞内Ca2+浓度增加。为了进一步探究细胞内Ca2+的来源,我们在0 mmol/L Ca2+及2 mmol/L Ca2+ K-H液中开展实验。结果显示,阻断Kv通道后主要抑制了NE诱导的细胞内钙释放,而未影响外钙内流所致的收缩。我们发现Kv1.3通道选择性阻断剂PAP-1,同样可使NE预收缩的动脉发生舒张作用。但进一步的实验发现PAP-1不仅抑制NE诱导的细胞内钙释放,同时还抑制外钙内流所致的动脉收缩。而Kv1.1通道选择性阻断剂TEA对NE预收缩的血管不产生作用,提示Kv1.1通道的功能活动可能不影响血管平滑肌细胞内已增加的Ca2+浓度。
肠系膜循环系统的主要功能之一是将已吸收入血的营养物质(葡萄糖、脂肪酸、氨基酸等)转运至肝脏及脂肪组织进行甘油三酯的合成,后者作为人体内含量最多的脂类,其增高与许多临床疾病密切相关[12]。肠系膜微细动脉属于阻力血管的一种,其舒张可增加肠系膜血流量进而增加营养物质的转运,从而在肝脏和脂肪组织合成更多的甘油三酯,最终使体质量增加。反之,其收缩可达到降低体质量的目的。我们的实验结果显示,Kv通道可调节小鼠肠系膜动脉的舒缩反应,但不同的通道亚型对小鼠肠系膜微细血管的调节作用及其机制明显不同。Kv1.3通道亚型对小鼠肠系膜微细动脉主要发挥舒张调节作用,阻断该通道后不影响静息状态的血管活性,但可同时抑制血管平滑肌细胞内钙的释放及外钙内流,而使已收缩的血管发生舒张反应。提示阻断Kv1.3通道亚型可能会增加肠系膜循环的血流量,进而增加营养物质的转运。而Kv1.1通道亚型对小鼠肠系膜微细动脉主要发挥收缩调节作用,阻断该通道后可促进血管平滑肌细胞外钙的内流而收缩静息状态的血管,但对预收缩的动脉无明显作用。提示阻断Kv1.1通道亚型可能会减少肠系膜循环血流量,进而限制营养物质的转运,达到降低血糖及体质量的目的,故Kv1.1通道有望成为抗肥胖及高血糖新的潜在靶点。
| [1] | MASSETTI G M, DIETZ W H, RICHARDSON L C. Excessive weight gain, obesity, and cancer: opportunities for clinical intervention[J]. JAMA, 2017, 318(20): 1975–1976. DOI:10.1001/jama.2017.15519 |
| [2] | FARRAG N S, CHESKIN L J, FARAG M K. A systematic review of childhood obesity in the Middle East and North Africa (MENA) region: Health impact and management[J]. Adv Pediatr Res, 2017, 4(6): 1–13. DOI:10.12715/apr.2017.4.6 |
| [3] | MCDANIEL S S, PLATOSHYN O, YU Y, et al. Anorexic effect of K+ channel blockade in mesenteric arterial smooth muscle and intestinal epithelial cells[J]. J Appl Physiol(1985), 2001, 91(5): 2322–2333. |
| [4] | COX R H, FROMME S. Functional expression profile of voltage-gated K(+) channel subunits in rat small mesenteric arteries[J]. Cell Biochem Biophys, 2016, 74(2): 263–276. DOI:10.1007/s12013-015-0715-4 |
| [5] | ZHAO W, CHEN Y. Progress in research of KV1. 1 and KV1. 3 channels as therapeutic targets[J]. Curr Top Med Chem, 2016, 16(16): 1877–1885. DOI:10.2174/1568026616666160315142920 |
| [6] | PLANE F, JOHNSON R, KERR P, et al. Heteromultimeric Kv1 channels contribute to myogenic control of arterial diameter[J]. Circ Res, 2005, 96(2): 216–224. DOI:10.1161/01.RES.0000154070.06421.25 |
| [7] | GARLAND C J, BAGHER P, POWELL C, et al. Voltage-dependent Ca2+ entry into smooth muscle during contraction promotes endothelium-mediated feedback vasodilation in arterioles[J]. Sci Signal, 2017, 10(486): 1–14. DOI:10.1126/scisignal.aal3806 |
| [8] | JACKSON W F. Potassium channels in regulation of vascular smooth muscle contraction and growth[J]. Adv Pharmacol, 2017, 78: 89–144. DOI:10.1016/bs.apha.2016.07.001 |
| [9] | SALOMONSSON M, BRASEN J C, SORENSEN C M. Role of renal vascular potassium channels in physiology and pathophysiology[J]. Acta Physiol (Oxf), 2017, 221(1): 14–31. DOI:10.1111/apha.12882 |
| [10] | ECKERT R E, KARSTEN A J, UTZ J, et al. Regulation of renal artery smooth muscle tone by alpha1-adrenoceptors: role of voltage-gated calcium channels and intracellular calcium stores[J]. Urol Res, 2000, 28(2): 122–127. DOI:10.1007/s002400050149 |
| [11] | KARAKI H, OZAKI H, HORI M, et al. Calcium movements, distribution, and functions in smooth muscle[J]. Pharmacol Rev, 1997, 49(2): 157–230. |
| [12] | AHMAD S, MORA S, FRANKS P W, et al. Adiposity and genetic factors in relation to triglycerides and triglyceride-rich lipoproteins in the women's genome health study[J]. Clin Chem, 2017, 63(11): 1–11. DOI:10.1373/clinchem.2017.280545 |



