2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院妇产科
2. Department of Obstetrics and Gynecology, First Affiliated Hospital, Army Medical Universtity (Third Military Medical University), Chongqing, 400038, China
压力性尿失禁(stress urinary incontinence,SUI)是女性常见病,其患病率随年龄增长而增高,严重影响女性生活质量[1]。SUI的关键机制是膀胱颈支撑功能障碍与尿道固有括约肌缺陷(intrinsic sphincter deficiency,ISD),而ISD主要由尿道周围平滑肌细胞(smooth muscle cells,SMCs)病变或凋亡所致[2]。目前SUI的治疗方法众多,但均未从本质上恢复尿道括约肌的功能。近年来,成体干细胞的移植已成为再生医学的重要手段,为SUI的治疗提供了新的策略[3]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, bMSCs)作为重要的成体干细胞之一,因其具取材方便、增殖快速、可自体移植及修饰后能表达特定外源目的基因等特性[4],将其用作种子细胞用于细胞及基因治疗的研究已愈来愈受关注。
bMSCs具有向成骨细胞、心肌细胞及SMCs等多种成体细胞分化的潜能,该分化潜能受转录因子随机抑制或激活、微环境诱导及信号转导通路等多因素调控[5]。Notch通路作为重要的信号转导通路之一在其调控中发挥着重要作用[6]。Deltex-1基因参与神经的形成与B细胞的发育,亦同细胞的分化密切相关[7]。Deltex-1含有的DomainⅠ结构域可在胞内与Notch信号的胞内区结合,以调节Notch信号的表达,因此,Deltex-1是Notch通路重要的重要调控因子[8],但Deltex-1与bMSCs的关系,以及Deltex-1在bMSCs向其他细胞,尤其向SMCs分化中的作用尚不清楚。
本实验首先分离、培养与鉴定大鼠bMSCs,将前期构建的pAd/Deltex-1腺病毒载体[9]感染bMSCs,采用CCK-8(cell count kit-8)法检测感染的bMSCs的增殖情况并绘制其增殖曲线。然后将经感染的bMSCs与SMCs共培养,采用免疫荧光细胞化学、RT-PCR及Western blot分别检测其bMSCs中SMCs标志物平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SM-MHC)的表达变化,探讨Deltex-1在bMSCs向SMCs分化中的作用,以期为进一步运用经修饰的bMSCs治疗女性SUI奠定基础。
1 材料与方法 1.1 材料自行构建的pAd/Deltex-1腺病毒载体[9]。胎牛血清购自美国Sigma公司。DMEM培养基、0.25%胰酶购自美国HyClone公司。CCK-8(cell counting kit-8)试剂盒购自日本DOjinDO公司; SM-MHC单克隆抗体购自美国Abcam公司。辣根过氧化物酶标记的Western blot二抗羊抗鼠IgG、cy3标记羊抗鼠免疫荧光二抗、DAPI及抗荧光淬灭封片剂购自碧云天生物技术研究所。引物设计与合成由上海捷瑞公司完成。Maker DL2000、RT-PCR试剂盒购自TaKaRa公司。琼脂糖凝胶、TAE购自北京天根公司。PVDF膜购自美国Bio-Rad公司。SuperSignalTM west femto maximum sensitivity substarte购自美国Thermo公司。大鼠SMCs株购自ATCC细胞库。
SPF级SD大鼠15只,购自第三军医大学实验动物中心,体质量170~190 g,雄性不拘,生产许可证号是SCXK(渝)2012-0003,用于bMSCs分离、培养与鉴定。
1.2 方法 1.2.1 bMSCs的分离、培养及鉴定大鼠bMSCs的分离培养参照前期工作[9]进行。bMSCs的鉴定采用流式细胞仪检测,具体如下,取第3代bMSCs制成细胞悬液,并计数,确保每组细胞样本不少于1×105个。在细胞样本中分别加入CD44、CD45与CD90抗体,37 ℃避光孵育约1.5 h,以不加抗体的细胞样本作对照。PBS再次重悬各待测细胞,流式细胞仪分别检测不同抗体标记的细胞样本的百分率,具体按各抗体说明书进行。实验至少重复3次。
1.2.2 CCK-8法检测细胞增殖将第3代bMSCs种植于96孔板中(约3 000个细胞/150μL/孔),用感染复数(multiplicity of infection, MOI)为100的pAd/Deltex-1病毒进行感染。分别以未感染及经空病毒感染的bMSCs为对照,单纯培养液作空白对照。分别于感染后24、48、72 h及96 h取出一96孔板,每孔替换新鲜培养基,并加入CCK-8检测夜(12 μL/孔),继续培养3.5 h后,轻微振荡混匀,用酶标仪检测其光密度值[D(450)],以该值为Y轴,培养时间为X轴绘制各细胞增殖曲线。实验重复至少3次。
1.2.3 免疫荧光细胞化学检测SMCs标志物SM-MHC的表达将种植于盖玻片上经携带Deltex-1基因的腺病毒感染24 h的第3代bMSCs爬片与常规培养24 h的SMCs于6孔板中共培养,确保两种细胞直接接触。分别以未感染及经空病毒感染与SMCs共培养的bMSCs爬片细胞为阳性对照,经Deltex-1病毒感染不与SMCs共培养的bMSCs作阴性对照,单纯培养的bMSCs、SMCs分别作正常对照。共培养48 h后收集各细胞进行免疫荧光细胞化学染色,分别检测其SMCs标志物SM-MHC的表达(SM-MHC是SMCs的标志性蛋白,未经诱导的bMSCs并不表达,其表达阳性表明被感染bMSCs已向SMCs分化),采用激光共聚焦显微镜观测并拍照。
1.2.4 RT-PCR检测SM-MHC的mRNA水平分别设计SM-MHC基因(BC166736.1)与β-actin基因(NM_031144.3)检测引物,SM-MHC基因的上游引物:5′-AGGGCGATGAGGTGGTTGTA-3′, 下游引物:5′-CC-GAGTAGGTGTAGATGAGGC-3′,产物:195 bp; β-actin基因(内参照)的上游引物:5′-TTGTCCCTGTATGCC-TCTG-3′, 下游引物:5′-AGGAAGGAAGGCTGGAAG-3′,产物:383 bp。收集上述(1.2.3)各组细胞,分别提取其总RNA并予以定量检测。采用反转录(RT)试剂盒将RNA反转录为cDNA,RT反应条件:30 ℃ 10 min、42 ℃ 30 min、99 ℃ 5 min、5 ℃ 5 min,1个循环。PCR检测按其试剂盒说明进行,每一反应体系含cDNA 1.5 μL,反应条件:94 ℃ 1 min、94 ℃ 30 s、85 ℃ 5 s、58.6 ℃ 1 min、72 ℃ 5 min,28个循环。反应结束后,取反应液10 μL行凝胶电泳,以确认PCR产物。实验重复至少3次。
1.2.5 Western blot检测SM-MHC、Notch-1蛋白表达收集上述(1.2.3)各组细胞,分别提取其总蛋白质。蛋白定量后经SDS-PAGE分离各蛋白,并转移到PVDF膜上。分别放入含SM-MHC鼠单克隆抗体(1 :600稀释)与Notch-1兔多克隆抗体(1 :200稀释)的5%脱脂奶粉封闭液中,4 ℃过夜孵育,分别加入辣根过氧化物酶标记的羊抗鼠IgG(1 :1 200稀释)与羊抗兔IgG(1 :700稀释),室温孵育1.5 h,增强化学发光显色,以β-actin为内参照。实验重复至少3次。
1.3 统计学分析计量资料采用x±s表示,两组之间比较采用两样本t检验,多组样本之间采用单因素方差分析进行检验。P < 0.05表示有差异具有统计学意义。
2 结果 2.1 bMSCs的分离、培养与鉴定倒置显微镜下可见,初次培养1~7 d的bMSCs呈散在克隆生长,细胞有圆形及不规则形,大部分呈纺锤形、长梭形。培养5~8 d后, 挑取生长良好的单克隆细胞(第1代)培养。经传代的单克隆bMSCs(第2代),增殖良好,待生长至80% ~90%培养面时行再次传代,再次传代培养的bMSCs(第3代)形态较均一,以长梭形为主,分布较均匀(图 1),细胞分裂增殖旺盛,增殖速度明显较原代bMSCs快,4~6 d可传代培养。

|
| 图 1 倒置显微镜下传代扩增的第3代bMSCs |
流式细胞仪(FCM)检测显示,第2或3代bMSCs稳定表达CD44、CD90(中胚层来源细胞的表型标志),其阳性率分别为98.400%与82.900%,不表达或微弱表达造血细胞的表型标志CD45,其阳性率为0.943%(图 2)。
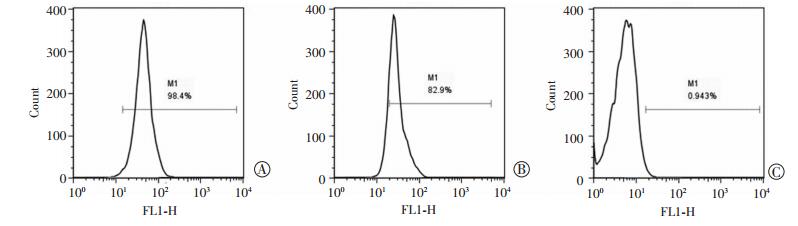
|
| A:CD44;B:CD90;C:CD45 图 2 流式细胞仪检测bMSCs的CD44、CD90及CD45的阳性率 |
2.2 Deltex-1对bMSCs增殖的影响
CCK-8检测表明,经Deltex-1病毒感染的bMSCs的增殖慢于未经感染或经空病毒感染的bMSCs,48 h开始更加明显(P < 0.05,P < 0.01,图 3)。
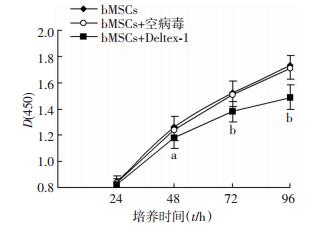
|
| a:P < 0.05,b:P < 0.01,与未经感染或经空病毒感染的bMSCs比较 图 3 CCK-8检测Deltex-1病毒感染对bMSCs增殖的影响 |
2.3 Deltex-1促进bMSCs向SMCs分化
SM-MHC是SMCs的功能性标志物,未经诱导的bMSCs并不表达,其阳性染色表明被感染bMSCs已向SMCs分化。bMSCs经携带Deltex-1基因的腺病毒感染24 h后,与SMCs共培养48 h,采用免疫荧光细胞化学染色,激光共聚焦显微镜观测显示(图 4),单独培养的bMSCs与只经Deltex-1病毒感染的bMSCs不表达SMCs标志物SM-MHC,未感染或经空病毒感染与SMCs共培养的bMSCs低表达表达SM-MHC。而经Deltex-1病毒感染与SMCs共培养的bMSCs及单独培养的SMCs显著表达SM-MHC。该结果提示,Deltex-1可在蛋白水平促进bMSCs向SMCs分化。

|
| 图 4 各组bMSCs的SM-MHC表达的免疫荧光细胞化学检测 |
2.4 Deltex-1促进bMSCs向SMCs分化
RT-PCR结果表明:单独培养的bMSCs与只经Deltex-1病毒感染的bMSCs不表达SMCs标志物SM-MHC,未感染或经空病毒感染与SMCs共培养的bMSCs微弱表达SM-MHC。而经Deltex-1病毒感染与SMCs共培养的bMSCs及单独培养的SMCs明显表达SM-MHC(图 5)。该结果提示,Deltex-1可在mRNA水平促进bMSCs向SMCs分化。
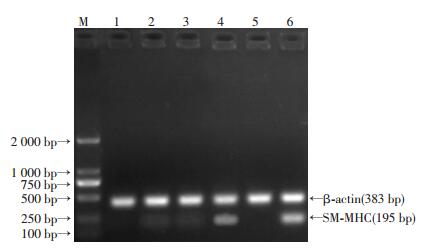
|
| M:DNA Marker (DL 2 000); 1:未经感染的bMSCs; 2:未经感染与SMCs共培养的bMSCs; 3:经空病毒感染与SMCs共培养的bMSCs; 4:经Deltex-1病毒感染与SMCs共培养的bMSCs; 5:经Deltex-1病毒感染的bMSCs; 6:单纯培养的SMCs 图 5 RT-PCR检测各组bMSCs SM-MHC的mRNA表达 |
Western blot检测显示:在相对分子质量22.7×104处,未经感染的bMSCs与只经Deltex-1病毒感染的bMSCs不表达SMCs标志物SM-MHC,未感染或经空病毒感染与SMCs共培养的bMSCs较弱表达SM-MHC,而经Deltex-1病毒感染与SMCs共培养的bMSCs及单独培养的SMCs明显表达SM-MHC(图 6)。在相对分子质量4.0×104处,未经感染的bMSCs显著表达Notch通路相关因子Notch-1,未经感染与SMCs共培养的bMSCs、经Deltex-1病毒感染的bMSCs较弱表达Notch-1,而经Deltex-1病毒感染与SMCs共培养的bMSCs明显低表达Notch-1,其程度依次为,未经感染的bMSCs>未经感染与SMCs共培养的bMSCs>经Deltex-1病毒感染的bMSCs>经Deltex-1病毒感染与SMCs共培养的bMSCs(图 7)。这些结果提示,Deltex-1可在蛋白水平促进bMSCs向SMCs分化,其机制可能是通过阻遏Notch通路而抑制bMSCs的增殖来实现的。
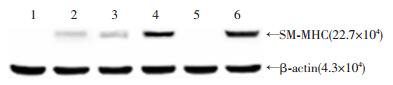
|
| 1:未经感染的bMSCs; 2:未经感染与SMCs共培养的bMSCs; 3:经空病毒感染与SMCs共培养的bMSCs; 4:经Deltex-1病毒感染与SMCs共培养的bMSCs; 5:经Deltex-1病毒感染的bMSCs; 6:单纯培养的SMCs 图 6 Western blot检测各组bMSCs的SM-MHC的蛋白表达 |

|
| 1:未经感染与SMCs共培养的bMSCs; 2:经Deltex-1病毒感染与SMCs共培养的bMSCs; 3:经Deltex-1病毒感染的bMSCs; 4:未经感染的bMSCs 图 7 Western blot检测各组bMSCs Notch-1的蛋白表达 |
3 讨论
括约肌功能障碍是SUI的主要原因,现有的治疗手段不能从本质上恢复括约肌功能。鉴于运用干细胞移植修复肌肉损伤、加强肌肉收缩功能的研究[10-11],人们对ISD的干细胞移植治疗寄予厚望。然而,迄今为止,该疗法并未获得预期疗效,究其原因主要与干细胞体内诱导分化的研究仍有不少关键问题尚未解决相关。其中最为重要的是移植后,干细胞在其所处微环境中的增殖、分化及其机制等仍不清楚。
bMSCs具有自我更新和多向分化的潜能,能在不同微环境中分化为其环境所需要的细胞,研究bMSCs向SMCs的增殖、分化潜能,对治疗包括SUI在内的多种疾病具有重要的临床意义[12]。bMSCs的分化潜能受转录因子随机抑制或激活、微环境诱导及信号转导通路等多因素的调控[5],其中,Notch信号转导通路是调控干细胞包括bMSCs增殖、分化的重要通路之一,它可通过表达配体与相邻细胞间的相互作用转导信号,从而决定多种细胞的“命运”[13]。当Notch与其相应的配体结合后可导致ADAM蛋白酶裂解Notch的细胞外结构域,通过蛋白活化γ分泌酶(γ-secretase),从而裂解Notch的胞内段(the Intracellular Domain of Notch,ICN),ICN转移至细胞核内,与转录抑制因子CSI结合成转录活化因子,激活HES等基因的表达,最终影响细胞的增殖、分化与凋亡。Deltex家族作为Notch的配体与细胞的发育、生长及分化密切相关,它包含Deltex-1、Deltex-2、Deltex-3与Deltex-4成员,其中,Deltex-1是Notch信号通路的下游分子,在蛋白结构上高度保守,含有DomainⅠ, DomainⅡ和Domain Ⅲ结构域,其中,DomainⅠ是Deltex-1蛋白的最必需成分,可在胞内与Notch信号的胞内区上的ANK重复结构相结合,以调节Notch信号的表达[14],是Notch通路的重要调控因子[8]。早有研究发现,SMCs与bMSCs接触培养可诱导后者分化为SMCs[15]。进一步研究证实bMSCs向SMCs分化的过程受Notch通路的调控[16]。然而,Deltex-1作为Notch通路的重要调控因子,其在该过程中的作用尚不清楚。
为了探讨Deltex-1对干细胞的增殖及其向SMCs分化的影响,本研究首先分离、培养大鼠bMSCs并予鉴定,结果证实,所获得的bMSCs具有干细胞的形态与表面标志特性,可用于后续实验。然后将Deltex-1病毒感染bMSCs,用CCK-8法检测了Deltex-1对bMSCs增殖的影响,结果发现,过表达Deltex-1的bMSCs,其增殖明显下降。进一步将过表达Deltex-1的bMSCs与SMCs共培养后,采用免疫荧光细胞化学、RT-PCR及Western blot技术检测了Deltex-1对bMSCs向SMCs分化的影响,虽然mRNA水平检测结果的2、3泳道(图 5)与蛋白水平的结果稍显不一,但属情理之中,因mRNA水平与蛋白水平表达本身就存在不一致性,再者,这里的电泳时间相对较长,致使本应稍强表达的2、3泳道变成了非常微弱的表达。总体而言,这些结果显示,单独培养或经Deltex-1病毒感染的bMSCs不表达SMCs标志物SM-MHC,未感染或感染空病毒与SMCs共培养的bMSCs微弱表达SM-MHC,而经Deltex-1病毒感染与SMCs共培养的bMSCs明显表达SM-MHC,这些结果提示,bMSCs必须在与SMCs共培养的条件下才能向SMCs分化,这与文献[16]报道一致,同时Deltex-1过表达明显促进bMSCs向SMCs分化。
大量文献报道,Notch通路可促进多种干细胞的维持及增殖[17],并可调控其多向分化潜能[18]。近来研究发现,Deltex-1可通过直接结合Notch胞内段诱导Notch受体的泛素化和降解,从而抑制Notch通路[14]。本实验还发现过表达Deltex-1与SMCs共培养的bMSCs,其Notch-1表达明显下调,该结果提示,Deltex-1可能是通过阻遏Notch通路而抑制bMSCs增殖,并促进其分化潜能的,当其与SMCs共培养时,微环境的改变可诱导bMSCs向SMCs分化。
综上,本实验证实了Deltex-1对bMSCs向SMCs分化的促进作用,为进一步利用其治疗SUI奠定了实验基础,但其具体的分子机制尚需进一步的研究。
| [1] | AGARWAL A, ERYUZLU L N, CARTWRIGHT R, et al. What is the mostbothersome lower urinary tract symptom?Individual-and population-level perspectives for both men and women[J]. Eur Urol, 2014, 65(6): 1211–1217. DOI:10.1016/j.eururo.2014.01.019 |
| [2] | YIOU R, HOGREL J Y, LOCHE C M, et al. Periurethral skeletal myofibre implantation in patients with urinary incontinence and intrinsic sphincter deficiency: a phase I clinical trial[J]. BJU Int, 2013, 111(7): 1105–1116. DOI:10.1111/j.1464-410X.2012.11682.x |
| [3] | WILLIAMS J K, DEAN A, BADLANI G, et al. Regenerative Medicine Therapies for Stress Urinary Incontinence[J]. J Urol, 2016, 196(6): 1619–1626. DOI:10.1016/j.juro.2016.05.136 |
| [4] | SHI B, LONG X, ZHAO R, et al. Featured Article: Transplantation of mesenchymal stem cells carrying the human receptor activity-modifying protein 1 gene improves cardiac function and inhibits neointimal proliferation in the carotid angioplasty and myocardial infarction rabbit model[J]. Exp Biol Med, 2014, 239(3): 356–365. DOI:10.1177/1535370213517619 |
| [5] | YUAN J, HUANG G, XIAO Z, et al. Overexpression of β-NGF promotes differentiation of bone marrow mesenchymal stem cells into neurons through regulation of AKT and MAPK pathway[J]. Mol Cell Biochem, 2013, 383(1/2): 201–211. DOI:10.1007/s11010-013-1768-6 |
| [6] | CAO J, WEI Y, LIAN J, et al. Notch signaling pathway promotes osteogenic differentiation of mesenchymal stem cells by enhancing BMP9/Smad signaling[J]. Int J Mol Med, 2017, 40(2): 378–388. DOI:10.3892/ijmm.2017.3037 |
| [7] | CHENG Y C, HUANG Y C, YEH T H, et al. Deltex1 is inhibited by the Notch-Hairy/E(Spl) signaling pathway and induces neuronal and glial differentiation[J]. Neural Dev, 2015, 10: 28. DOI:10.1186/s13064-015-0055-5 |
| [8] | ZHANG P, YANG Y, NOLO R, et al. Regulation of NOTCH signaling by reciprocal inhibition of HES1 and Deltex 1 and its role in osteosarcoma invasiveness[J]. Oncogene, 2010, 29(20): 2916–2926. DOI:10.1038/onc.2010.62 |
| [9] |
王荥, 王延洲, 徐惠成. deltex-1腺病毒载体的构建及其在大鼠bMSCs中的表达[J].
第三军医大学学报, 2011, 33(15): 1555–1558.
Wang Y, Wang Y Z, Xu H C. Expression of deltex-1 in rat bone marrow mesenchymal stem cells by adenovirus vector[J]. J Third Mil Med Univ, 2011, 33(15): 1555–1558. |
| [10] | YANG D Y, SHEU M L, SU H L, et al. Dual regeneration of muscle and nerve by intravenous administration of human amniotic fluid-derived mesenchymal stem cells regulated by stromal cell-derived factor-1alpha in a sciatic nerve injury model[J]. J Neurosurg, 2012, 116(6): 1357–1367. DOI:10.3171/2012.2.JNS111360 |
| [11] | GURRIAR N-RODR GUEZ U, SANTOS-ZAS I, GONZ LEZ-S NCHEZ J, et al. Action of obestatin in skeletal muscle repair: stem cell expansion, muscle growth, and microenvironment remodeling[J]. Mol Ther, 2015, 23(6): 1003–1021. DOI:10.1038/mt.2015.40 |
| [12] | WANG Z, WEN Y, LI Y H, et al. Smooth muscle precursor cells derived from human pluripotent stem cells for treatment of stress urinary incontinence[J]. Stem Cells Dev, 2016, 25(6): 453–461. DOI:10.1089/scd.2015.0343 |
| [13] | CAO J, WEI Y, LIAN J, et al. Notch signaling pathway promotes osteogenic differentiation of mesenchymal stem cells by enhancing BMP9/Smad signaling[J]. Int J Mol Med, 2017, 40(2): 378–388. DOI:10.3892/ijmm.2017.3037 |
| [14] | HSIAO H W, LIU W H, WANG C J, et al. Deltexl is a target of the transcription factor NFAT that promotes T cell anergy[J]. Immunity, 2009, 31(1): 72–83. DOI:10.1016/j.immuni.2009.04.017 |
| [15] | FOX V, GOKHALE P J, WALSH J R, et al. Cell-cell signaling through NOTCH regulates human embryonic stem cell proliferation[J]. Stem cells, 2008, 26(3): 715–723. DOI:10.1634/stemcells.2007-0368 |
| [16] | LIN C H, LILLY B. Endothelial cells direct mesenchymal stem cells toward a smooth muscle cell fate[J]. Stem Cells Dev, 2014, 23(21): 2581–2590. DOI:10.1089/scd.2014.0163 |
| [17] | CIRIA M, GARC A N A, ONTORIA-OVIEDO I, et al. Mesenchymal Stem Cell Migration and Proliferation Are Mediated by Hypoxia-Inducible Factor-1alpha Upstream of Notch and SUMO Pathways[J]. Stem Cells Dev, 2017, 26(13): 973–985. DOI:10.1089/scd.2016.0331 |
| [18] | SANCHO R, CREMONA C A, Behrens A. Stem cell and progenitor fate in the mammalian intestine: Notch and lateral inhibition in homeostasis and disease[J]. EMBO Rep, 2015, 16(5): 571–581. DOI:10.15252/embr.201540188 |



