霍奇金淋巴瘤是来源于淋巴系统的恶性肿瘤,是目前治愈率较高的恶性肿瘤,采用化疗或化疗联合局部放疗可以使约80%的经典型霍奇金淋巴瘤(classical Hodgkin lymphoma, CHL)患者取得病情的长期缓解甚至治愈[1]。近几年来,ABVD(表柔吡星+达卡巴嗪+长春新碱+博来霉素)、Standford V(阿霉素、长春碱、氮芥、依托泊苷、长春新碱、博来霉素和强的松)、递增剂量BEACOPP(环磷酰胺+长春新碱+依托泊苷+表柔吡星+甲基卞肼+博来霉素+泼尼松)等方案已在临床治疗CHL中取得了较好的效果。但仍有10%的Ⅰ~Ⅱ期良好病变,30%的Ⅰ~Ⅱ期不良病变及Ⅲ~Ⅳ期病变的CHL经标准一线方案治疗后不能达完全缓解(complete response, CR),或CR后出现复发[2]。目前对于复发、难治性霍奇金淋巴瘤(relapsed and/or refractory classical Hodgkin lymphoma, RR-CHL)的治疗仍是临床治疗中的一个巨大挑战[3]。前期研究表明,尝试大剂量解救化疗后序贯自体造血干细胞移植(autologous hematopoietic stem cell transp-lantation, ASCT),可成为RR-CHL的治疗选择,ASCT对RR-CHL的治疗上取得了进一步的效果[4]。我中心在2000-2013年,对部分RR-CHL患者实施了解救化疗后序贯ASCT,现对其疗效、安全性等报告如下。
1 资料与方法 1.1 病例资料收集我中心2000-2013年经组织病理活检诊断为CHL的住院患者。部分患者为治疗缓解后在原部位或(和)新部位出现病灶,经重新取组织病理活检,排除继发的第2肿瘤,确定为原有CHL复发。2009年后开始引入了Deauville标准[5-6]评价疗效。根据此标准,3~4疗程ABVD方案化疗后行正电子发射计算机断层显像(positron emission tomography, PET)检查,对于Deauville评分4或5的患者,一部分患者给予受累野放疗,一部分患者给予二线方案治疗后,再行PET检查评判,对于PET仍未转阴的患者确定为难治性病例。RR-CHL病例共计97例,其中52例患者接受了ASCT;而其余45例患者拒绝接受ASCT治疗,未行移植而继续采用化疗或化疗联合放疗治疗。所有患者均对病情有充分的知情,并签署了相关的医疗知情文书。本研究经中国注册临床试验伦理审查委员会批准,注册号为ChiCTR-ONC-16009027。
接受ASCT的52例患者中,男性35例,女性17例,中位年龄29(8~63) 岁,其中≥40岁的有10例;按WHO对CHL病理亚型分类,其中富含淋巴细胞型(lymphocyte-rich, LRCHL)8例,结节硬化型(nodular sclerosis, NSCHL)19例,混合细胞型(mixed cell ularity, MCCHL)23例,少淋巴细胞型(lymphocyte-depletion, LDCHL)2例;完善PET或胸腹部CT、骨髓形态学及骨髓活检、肝肾功能、心功能、β2微球蛋白、血乳酸脱氢酶(lactate dehydrogenase, LDH)等检查,Ann Arbor分期在Ⅰ~Ⅱ期的有19例,Ⅲ~Ⅳ期有33例;有24例患者伴有B症状;国际预后评分(international prognostic score, IPS)≥3分的有31例;LDH高于正常值的有19例;病变部位为巨大肿块的有9例;伴有结外浸润的有16例;淋巴结受累≥3处的有21例;有8例患者出现骨髓侵犯;伴红细胞沉降率(erythrocyte sedimentation rate, ESR)≥50 mm/h有18例;伴有高血压、冠心病、糖尿病、COPD等慢性基础疾病的患者有18例;体力状况评分(eastern cooperative oncology group, ECOG)评分≥3分的17例。
未行自体造血干细胞移植的45例患者中,男性32例,女性13例,中位年龄34(4~69) 岁,其中≥40岁的有20例;LRCHL 6例,NSCHL 15例,MCCHL 12例,LDCHL 2例;分期在Ⅰ~Ⅱ期的有12例,Ⅲ~Ⅳ期有33例;有17例患者伴有B症状;IPS≥3分的有23例;LDH高于正常值的有18例;病变部位为巨大肿块的有7例;伴有结外浸润的有8例;淋巴结受累≥3处的有10例;有3例患者出现骨髓侵犯;伴ESR≥50 mm/h有17例;伴有慢性基础疾病的患者有10例;ECOG评分≥3分的21例。44例患者平均给予了7.8(4~14) 个疗程的化疗,有32例患者在治疗期间使用二线化疗方案,有13例患者未使用。
1.2 造血干细胞移植前治疗接受ASCT的52例患者移植前给予4~11个疗程的化疗。有32例患者在治疗期间对ABVD方案治疗效果较差,使用了NCCN霍奇金淋巴瘤治疗指南推荐的二线化疗方案,如DHAP、ESHAP、GVD、ICE、MINE等方案。有20例患者未使用二线治疗方案。经中大剂量的解救化疗后,移植前复查增强CT或PET检查,评判疗效达CR的有16例,部分缓解(partial response, PR)的有27例,未缓解或病情进展的有9例。其中8例发生骨髓侵犯的患者,干细胞动员前复查骨髓形态学及骨髓活检、流式MRD检测,均未发现淋巴瘤细胞。
1.3 造血干细胞动员52例患者均采用MOED(米托蒽醌:6 mg/m2×3 d;长春地辛:1.4 mg/m2×1 d;依托泊苷:100 mg/m2×3 d;地塞米松:10~15 mg×5 d)方案动员。当白细胞降至最低点后开始回升时(WBC>1×109/L)给予重组人粒细胞刺激因子(G-CSF) 5~10 μg/kg/d动员干细胞,动员4天后开始采集外周血造血干细胞。最低采集目标为2×106个CD34+细胞/kg。
1.4 预处理方案及植入评判指标本研究自体造血干细胞移植预处理方案均采用CEAC(洛莫司汀:200 mg/m2×1d;环磷酰胺:1 g/m2×4 d;阿糖胞苷:1~2 g/m2×4 d;依托泊苷:100 mg/m2× 4 d)。预处理结束24 h后回输自体外周血造血干细胞。以连续3次血常规外周血中性粒细胞>0.5×109/L,未输注血小板情况下,血小板>20×109/L为造血功能重建。
1.5 ASCT主要并发症的防治我中心对ASCT并发症的防治方面已建立了较为系统的方案,中心其他的ASCT临床研究并发症的防治也取得了较好的成果[7]。移植前1周开始予氟康唑胶囊、复方磺胺甲噁唑片(SMZco)、诺氟沙星胶囊三联口服肠道清洁及预防感染,静脉丙种球蛋白0.4 g/kg每周输注1次。移植后如出现发热,寻找感染灶,予广谱抗生素抗感染治疗;如出现(或疑似)真菌感染,给予广谱抗真菌药物治疗。自预处理开始予阿昔洛韦预防巨细胞病毒感染,一旦监测到CMV-DNA拷贝数增高和(或)出现CMV感染相关临床症状时, 予以更昔洛韦或膦甲酸钠抗病毒治疗。给予低分子肝素钙、前列地尔预防肝静脉闭塞病(VOD)。移植过程中给予水化、碱化尿液,使每日尿量>2 000 mL, 尿pH值维持在7左右,保护肾功能和预防出血性膀胱炎。骨髓抑制期给予成分血输注,及移植期间常规给予肝脏、心脏功能的保护,以及适当静脉营养等对症支持治疗。
1.6 ASCT后的治疗移植组其中20例患者分别为病初有巨大肿块、移植前原有肿块增大或病情进展出现新肿块,移植后给予受累野的放疗。有33例患者移植后接受了1~5个疗程减低剂量的化疗,以清除残留病及预防复发。
本研究ASCT治疗组1例患者移植1年后复发,给予brentuximab vedotin解救治疗1个疗程后,经PET检查评判疗效为CR,因其寻找合适的供体时间较长,未能找到HLA全相合的供者,序贯再予12个疗程brentuximab vedotin治疗后,行父供子HLA 5/10相合造血干细胞移植,目前移植后21个月,定期复查PET评判为CR,无病存活。
1.7 统计学方法采用IBM SPSS Statistics 23.0软件进行统计分析。计量资料以x± s或者M(上下四分位数)表示;两组间基线资料及并发症情况比较采用χ2检验、Fisher精确概率法、独立样本t检验或Mann-Whitney U检验;采用Kaplan-Meier方法进行生存分析,Logrank方法得到组间比较的P值;采用COX逐步回归分析方法进行预后影响因素分析,进入标准设置为0.05,排除标准设置为0.1,逐步回归方法采用Forward wald法;检验水准:α=0.05。
2 结果 2.1 研究对象一般资料比较本研究97例患者的基线资料如性别、CHL的病理类型、分期、IPS评分、ECOG评分、LDH增高程度、ESR增高程度、淋巴结受累范围、是否有B症状、是否合并慢性病、是否伴有巨大包块、是否使用二线化疗方案、是否有结外浸润、是否有骨髓侵犯均无统计学差异(P>0.05),详见表 1。
| 组别 | n | 性别 | 年龄 | 病理类型 | 分期 | B症状 | 伴有慢性病 | 二线方案 | LDH值 | 巨大包块 | 结外浸润 | 淋巴结受累 | 骨髓侵犯 | IPS评分 | ECOG评分 | ESR值 | |||||||||||||||||||||||||||||||
| 男 | 女 | < 40岁 | >40岁 | LRCHL | NSCHL | LRCHL | LDCHL | Ⅰ~Ⅱ | Ⅲ~Ⅳ | 有 | 无 | 有 | 无 | 使用 | 未用 | 正常范围 | 高于正常 | 有 | 无 | 有 | 无 | ≥3处 | <3处 | 有 | 无 | <3 | ≥3 | 0~2 | ≥3 | ≥50 mm/h | <50 mm/h | ||||||||||||||||
| ASCT组 | 52 | 35 | 17 | 42 | 10 | 8 | 19 | 23 | 2 | 19 | 33 | 24 | 28 | 18 | 34 | 32 | 20 | 33 | 19 | 9 | 43 | 16 | 36 | 21 | 31 | 8 | 44 | 21 | 31 | 35 | 17 | 18 | 34 | ||||||||||||||
| 未移植组 | 45 | 32 | 13 | 25 | 20 | 16 | 15 | 12 | 2 | 12 | 33 | 17 | 28 | 10 | 35 | 32 | 13 | 27 | 18 | 7 | 38 | 8 | 37 | 10 | 35 | 3 | 42 | 22 | 23 | 24 | 21 | 17 | 28 | ||||||||||||||
| 统计量 | 0.163 | 7.179 | 6.160 | 1.081 | 0.694 | 0.405 | 0.985 | 0.123 | 0.054 | 2.187 | 3.66 | 1.824 | 0.707 | 1.977 | 0.105 | ||||||||||||||||||||||||||||||||
| P | 0.686 | 0.007 | 0.093 | 0.298 | 0.405 | 0.179 | 0.321 | 0.726 | 0.817 | 0.139 | 0.056 | 0.177 | 0.4 | 0.16 | 0.746 | ||||||||||||||||||||||||||||||||
2.2 移植组造血干细胞采集数量及造血重建时间
ASCT组的52例患者采集物中外周血单个核细胞数:(8.21±2.57)×108/kg,CD34+细胞数:(7.71±5.76)×106/kg。所有患者自体移植后造血功能均得到重建, 中性粒细胞>0.5×109/L的中位时间11(移植后7~14) d,血小板恢复至20×109/L的中位时间12(移植后8~22) d。
2.3 两组患者发生并发症的比较两组患者相比较,ASCT组出现Ⅳ级骨髓抑制、消化道反应及粒细胞缺乏伴发热的发生率明显高于未移植组(P < 0.05),但两组患者出现感染及出血症状的发生率差异无统计学意义(P>0.05)。ASCT组患者没有因出现并发症而中断治疗;未移植组治疗过程中出现1例心脏不良事件及1例肺纤维化而中断治疗,分别在12个月后与8个月后出现本病复发。未移植组治疗期间出现1例消化道大出血,经积极抢救后存活。远期出现第2肿瘤的发生率ASCT组有3.84%,其中1例患者在ASCT治疗5年后出现急性髓系白血病,1例ASCT治疗2年后出现非霍奇金淋巴瘤。未移植组第2肿瘤发生率为4.44%, 1例患者治疗结束9年后出现弥漫大B细胞淋巴瘤,1例治疗9年3个月后出现肺腺癌。并发症的发生情况详见表 2。
| 组别 | n | 消化道反应 | 口腔溃疡 | 肺部感染 | 败血症 | 病毒感染 | 肛周感染 | 粒缺伴发热 | 肝功损害 | 第二肿瘤 | Ⅳ级骨髓抑制 | 发生感染 | 有出血症状 | |
| ASCT组 | 52 | 51(98.07) | 9(17.30) | 2(3.84) | 5(9.61) | 2(3.84) | 3(5.76) | 12(23.07) | 2(3.84) | 2(4.44) | 52(100.00) | 12(23.07) | 13(25.00) | |
| 未移植组 | 45 | 34(75.55)a | 12(26.66) | 4(8.88) | 4(8.88) | 6(13.33) | 2(4.44) | 2(4.44)a | 2(4.44) | 2(4.44) | 28(62.22)a | 14(31.11) | 11(24.44) | |
| a: P < 0.01,与ASCT组比较 | ||||||||||||||
2.4 两组患者临床疗效比较
移植组患者从移植后,未移植组患者从第4个疗程化疗结束后,观察两组患者无进展生存率(progression-free survival, PFS)及总生存率(overall survival, OS)时间。随访至2016年12月,中位随访56 (12~158) 个月,ASCT组疾病复发及进展10例,中位生存时间及中位复发时间未得到;死亡6例,病死率11.5%,未出现移植相关死亡病例;3年PFS为(78.6± 6.20)%, OS为(85.9±5.5)%。未移植组疾病复发27例,中位生存时间:114.00(51.55~176.45) 个月,中位复发时间:36.00(12.179~59.821) 个月,死亡21例,病死率46.6%;3年PFS为(43.1±7.60)%, OS为(54.1±8.1)%。ASCT组OS及PFS均明显优于未移植组(P < 0.05)。两组患者生存分析见图 1。
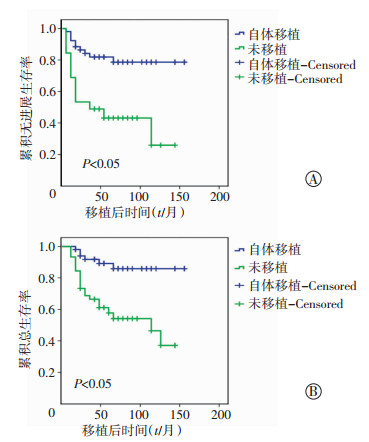
|
| 图 1 RR-CHL两组患者的无进展生存曲线(A)和总生存曲线(B)分析 |
本研究中ASCT前均给予疗效评判,早期部分患者行增强CT检查评判疗效,我中心从2009年开始引入PET检查评估治疗缓解状态。在ASCT组中,16例患者移植前PET检查阴性评判为CR,另外36例患者PET有阳性结果评判疗效未达CR。PET阴性的患者3年OS为100%,PFS为100%;PET有阳性结果的患者3年OS为(78.9±8.0)%,PFS为(68.6±8.6)%。其两部分患者的生存分析见图 2。从生存分析来看,移植前PET阴性评判为CR的患者,其PFS明显优于PET有阳性结果的患者(P=0.021),而对于OS差异无统计学意义(P=0.077)。
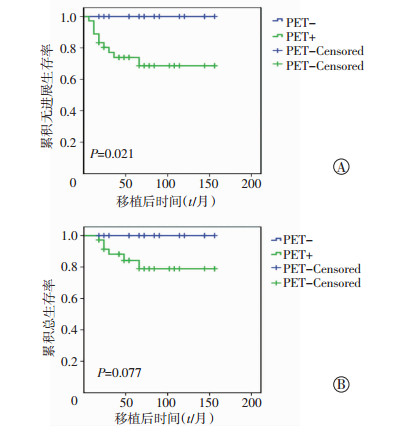
|
| 图 2 移植前PET检查两种结果的患者无进展生存曲线(A)和总生存曲线(B)分析 |
2.5 两组患者预后分析
对97例RR-CHL患者采用COX逐步回归分析方法,对本研究的预后因素进行分析。我们发现性别、年龄、CHL的病理类型、分期、合并B症状、合并慢性病、有巨大包块、有结外浸润、二线化疗方案治疗、ESR增高、ECOG评分这些预后因素在OS和PFS差异无统计学意义(P>0.05)。通过COX回归分析结果显示:未采用ASCT(P < 0.001)、LDH值高于正常(P=0.014)、有骨髓侵犯(P=0.001) 是影响PFS的危险因素;而未采用ASCT(P < 0.001)、IPS评分≥3分(P=0.014)、LDH值高于正常(P=0.020)、有骨髓侵犯(P=0.026) 是影响OS的危险因素。结果见表 3、4。
| 自变量 | P | EXP(B) | 95%CI | |
| 未采用ASCT | 0.000 | 4.401 | 2.082~ | 9.306 |
| LDH值高于正常 | 0.014 | 2.283 | 1.181~ | 4.415 |
| 有骨髓侵犯 | 0.001 | 3.858 | 1.690~ | 8.806 |
| 自变量 | P | EXP(B) | 95%CI | |
| 未采用ASCT | 0.000 | 6.804 | 2.558~ | 18.095 |
| IPS评分≥3分 | 0.014 | 3.083 | 1.259~ | 7.551 |
| LDH值高于正常 | 0.020 | 2.555 | 1.158~ | 5.636 |
| 有骨髓侵犯 | 0.026 | 3.268 | 1.156~ | 9.240 |
3 讨论
近几十年来,随着CHL治愈率的明显提高,临床试验仍将重点放在如何提高晚期患者、复发难治性患者的治愈率上。ASCT技术已发展数十年,仍不断完善及改进。早期国外研究报道,早期预后不良患者和进展期患者进行ASCT后,疗效并没有比常规化疗更具优势[8]。但近期国外的临床研究却发现,同单独采用传统化疗相比,采用ASCT治疗RR-CHL患者的EFS和PFS显著提高,但OS差异率无统计学意义[9-11]。国内万文丽等[12]研究报道,对15例初治CHL患者进行ASCT后, 其3年OS达92.9%。我中心接受ASCT治疗的52例患者,其3年OS、PFS均明显优于未移植的常规治疗组。本研究发现,ASCT治疗RR-CHL的效果优于常规化疗,即使淋巴瘤侵犯到骨髓,挽救性化疗后序贯ASCT也会进一步挽救患者。在对本研究的预后分析中,未采用ASCT也是影响OS及PFS的危险因素。
对于预处理方案的选择目前尚无指南推荐,也缺乏前瞻性随机试验比较各个方案的优劣后得出1个最优方案。较多的中心使用卡莫司汀+依托泊苷+阿糖胞苷+马法兰(BEAM)、环磷酰胺+卡莫司汀+依托泊苷(CBV)或环磷酰胺+卡莫司汀+依托泊苷+顺铂(CBVP)方案[10, 13-14]。2013年美国Nebraska研究组[15]对225例行ASCT的RR-CHL进行回顾性分析,使用了BEAM或CBV作为预处理方案,研究认为除预处理方案外,也与造血干细胞有效的支持及移植前较好的解救治疗相关。我中心在BEAM、CBV两方案上结合、改良,使用了CEAC预处理方案,所有病例均造血重建,未出现移植相关死亡。与常规治疗组相比较,除了Ⅳ级骨髓抑制、粒缺伴发热及消化道反应增高(P < 0.05) 外,其余并发症差异无统计学意义,这与预处理方案中化疗药物剂量明显增高有关,而感染及出血症状的发生率与常规治疗组差异无统计学意义。在我中心另1项双次自体造血干细胞移植治疗T淋巴母细胞淋巴瘤的临床研究中[7],首次移植也选用CEAC方案预处理,同样提示该方案比较安全且有效。
目前治疗中期的PET检查结果对评估ASCT患者预后起了重要的作用。近期1项前瞻性研究中[16],中期PET检查结果可很好地预测Ⅰ~Ⅱ期不良病变及Ⅲ~Ⅳ期病变患者的治疗成败。在CHL近期的研究表明,解救化疗之后行PET检查对ASCT有重要的预后价值[17],EFS在ASCT前PET阳性的患者为31%,而PET阴性的为75%;研究证实,与PET阳性患者相比,PET阴性患者PFS明显延长。在MOSKOWITZ等[18]研究中,中期疗效评估PET转阴的患者接受ASCT,而PET阳性的患者则给予二线方案化疗4个周期,无疾病进展时再行ASCT;中位随访51个月,中期评判PET阴性的患者较PET阳性患者的EFS明显延长(分别为80%和28.6%)。从本研究的生存分析来看,移植前PET阴性评判为CR的患者,其PFS明显优于未达PET有阳性结果的患者。那么对于RR-CHL患者,在ASCT之前,解救治疗使患者达到PET阴性的状态有利于患者的长期生存。
对于ASCT后疾病进展和复发的患者,目前尚无标准治疗方案,可尝试brentuximab vedotin解救治疗后,行异基因造血干细胞移植(allo-HSCT)。本组1例患者ASCT治疗1年后复发,给予brentuximab vedotin解救治疗后,行单倍体相合造血干细胞移植,无病存活至今,但此药的治疗花费非常高。Brentuximab vedotin是一种CD30靶向抗体-药物偶联物,已有研究证实对复发或难治性CD30阳性的淋巴瘤有效[19]。根据1项Ⅱ期多中心临床试验[20]结果,FDA批准brentuximab vedotin可用于ASCT失败的HL患者, 及至少已行两种化疗方案且不适合接受ASCT的患者的治疗。在我国还没有brentuximab vedotin上市,且治疗费用十分昂贵,那么对未曾治愈的CHL患者,ASCT是我们推荐的优选的治疗方案。
2017 NCCN霍奇金淋巴瘤指南[21]指出:ASCT可作为RR-CHL患者的最佳治疗方案,建议移植后给予brentuximab vedotin维持治疗1年。本研究发现相较于常规化放疗,自体造血干细胞移植在治疗RR-CHL的疗效较好,可以提高这些患者的OS及PFS,预处理CEAC方案相对毒性小、并发症未明显增多、耐受性较好。自体造血干细胞移植治疗RR-CHL值得在临床进一步推广应用。
| [1] | ARMITAGE J O. Early-stage hodgkin's iymphoma[J]. N Engl J Med, 2010, 363(7): 653–662. DOI:10.1056/NEJMra1003733 |
| [2] | LAZARUS H M, ROWLINGS P A, ZHANG M J, et al. Autotransplants for hodgkin's disease in patients never achieving remission: a report from the autologous blood and marrow transplant registry[J]. J Clin Oncol, 1999, 17(2): 534–545. DOI:10.1200/JCO.1999.17.2.534 |
| [3] | KURUVILLA J, KEATING A, CRUMP M. How I treat relapsed and refractory Hodgkin lymphoma[J]. Blood, 2011, 117(16): 4208–4217. DOI:10.1182/blood-2010-09-288373 |
| [4] | SUREDA A, PEREIRA M I, DREGER P, et al. The role of hematopoietic stem cell transplantation in the treatment of relapsed/refractory Hodgkin's lymphoma[J]. Curr Opin Oncol, 2012, 24(6): 727–732. DOI:10.1097/CCO.0b013e328359557e |
| [5] | MEIGNAN M, GALLAMINI A, HAIOUN C, et al. Report on the second International workshop on interim positron emission tomography in lymphoma held in menton, france, 8-9 april 2010[J]. Leuk Lymphoma, 2010, 51(12): 2171–2180. DOI:10.3109/10428194.2010.529208 |
| [6] | MEIGNAN M, GALLAMINI A, ITTI E, et al. Report on the third international workshop on interim positron emission tomography in lymphoma held in menton, france, 26-27 september 2011 and menton 2011 consensus[J]. Leuk Lymphoma, 2012, 53(10): 1876–1881. DOI:10.3109/10428194.2012.677535 |
| [7] |
李佳丽, 刘耀, 文钦, 等. 双次自体造血干细胞移植治疗T淋巴母细胞淋巴瘤21例的临床疗效观察[J].
第三军医大学学报, 2016, 38(12): 1350–1355.
LI J L, LIU Y, WEN Q, et al. Double autologous peripheral blood stem cells transplant for 21 patients with lymphoblastic lymphoma[J]. J Third Mil Med Univ, 2016, 38(12): 1350–1355. DOI:10.16016/j.1000-5404.201601148 |
| [8] | CARELLA A M, BELLEI M, BRICE P, et al. High-dose therapy and autologous stem cell transplantation versus conventional therapy for patients with advanced Hodgkin's lymphoma responding to front-line therapy: long-term results[J]. Haematologica, 2009, 94(1): 146–148. DOI:10.3324/haematol.13484 |
| [9] | LINCH D C, WINFIELD D, GOLDSTONE A H, et al. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin's disease: results of a BNLI randomised trial[J]. Lancet, 1993, 341(8852): 1051–1054. DOI:10.1016/0140-6736(93)92411-l |
| [10] | SCHMITZ N, PFISTNER B, SEXTRO M, et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive hodgkin's disease: a randomised trial[J]. Lancet, 2002, 359: 2065–2071. DOI:10.1016/S0140-6736(02)08938-9 |
| [11] | RANCEA M, MONSEF I, VON TRESCKOW B, et al. High-dose chemotherapy followed by autologous stem cell transplantation for patients with relapsed/refractory Hodgkin lymphoma[J]. Cochrane Database Syst Rev, 2013, 6: D9411. DOI:10.1002/14651858.CD009411.pub2 |
| [12] |
万文丽, 田磊, 克晓燕, 等. 62例霍奇金淋巴瘤患者临床特征与预后分析[J].
中华血液学杂志, 2013, 34(7): 618–621.
WAN W L, TIAN L, KE X Y, et al. Clinical characteristics and prognostic factors of 62 cases with Hodgkin lymphoma[J]. Chin J Hema, 2013, 34(7): 618–621. DOI:10.3760/cma.j.issn.0253-2727.2013.07.013 |
| [13] | DI IANNI M, BALLANTI S, IODICE G, et al. High-dose thiotepa, etoposide and carboplatin as conditioning regimen for autologous stem cell transplantation in patients with high-risk hodgkin's lymphoma[J]. Hematology, 2012, 17(1): 23–27. DOI:10.1179/102453312X13221316477534 |
| [14] | REECE D E, NEVILL T J, SAYEGH A, et al. Regimen-related toxicity and non-relapse mortality with high-dose cyclophosphamide, carmustine (BCNU) and etoposide (VP16-213) (CBV) and CBV plus cisplatin (CBVP) followed by autologous stem cell transplantation in patients with hodgkin's disease[J]. Bone Marrow Transplant, 1999, 23(11): 1131–1138. DOI:10.1038/sj.bmt.1701790 |
| [15] | WILLIAM B M, LOBERIZA F R Jr, WHALEN V, et al. Impact of conditioning regimen on outcome of 2-year disease-free survivors of autologous stem cell transplantation for Hodgkin lymphoma[J]. Clin Lymphoma Myeloma Leuk, 2013, 13(4): 417–423. DOI:10.1016/j.clml.2013.03.009 |
| [16] | CERCI J J, PRACCHIA L F, LINARDI C C, et al. 18F-FDG PET after 2 cycles of ABVD predicts event-free survival in early and advanced Hodgkin lymphoma[J]. J Nucl Med, 2010, 51(9): 1337–1343. DOI:10.2967/jnumed.109.073197 |
| [17] | MOSKOWITZ A J, YAHALOM J, KEWALRAMANI T, et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma[J]. Blood, 2010, 116(23): 4934–4937. DOI:10.1182/blood-2010-05-282756 |
| [18] | MOSKOWITZ C H, MATASAR M J, ZELENETZ A D, et al. Normalization of pre-ASCT, FDG-PET imaging with second-line, non-cross-resistant, chemotherapy programs improves event-free survival in patients with Hodgkin lymphoma[J]. Blood, 2011, 119(7): 1665–1670. DOI:10.1182/blood-2011-10-388058 |
| [19] | YOUNES A, BARTLETT N L, LEONARD J P, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas[J]. N Engl J Med, 2010, 363(19): 1812–1821. DOI:10.1056/NEJMoa1002965 |
| [20] | YOUNES A, GOPAL A K, Smith S E, et al. Results of a pivotal phase Ⅱ study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma[J]. J Clin Oncol, 2012, 30(18): 2183–2189. DOI:10.1200/JCO.2011.38.0410 |
| [21] | National Comprehensive Cancer Network v1.2017 guideline on Hodgkin lymphoma[G/OL][2017-3-1]. |



