苯并[a]芘(BaP)是一种重要的环境有机污染物,其健康危害一直为人们所关注,既往研究表明雄性生殖系统是BaP损害作用的靶器官之一[1-2]。BaP在机体内的代谢活化产物7,8-二羟-9,10-环氧化苯并[a]芘(benzo[a]pyrene-7, 8-diol-9, 10-epoxide, BPDE)可与DNA形成加合物,造成遗传物质损伤,因此,既往有关BaP雄性生殖毒性的机制研究主要集中于生殖细胞的DNA损伤[3]。近来研究显示:BaP可以提高细胞内的活性氧(reactive oxygen species, ROS)水平[4]。ROS是线粒体凋亡重要的诱导因子,过度产生的ROS可以增加线粒体内膜通透性,降低线粒体膜电位,Cyt C自线粒体释放至细胞质,导致线粒体途径的细胞凋亡。已有研究证实:BPDE可诱导人肺癌细胞中发生Bax上调、Cyt C释放等线粒体凋亡相关分子改变[5]。这些结果提示BaP的生殖毒性机制可能与线粒体通路的细胞凋亡有关。
褪黑素(melatonin)是哺乳动物和人类松果体产生的一种神经内分泌激素。近年来,研究发现褪黑素在延缓衰老、催眠、抗肿瘤、抗心血管疾病及免疫等方面具有广泛的生物学作用[6]。抗氧化是褪黑素发挥其功能的一种重要方式。研究显示褪黑素是一种高效的自由基清除剂[7],最近的报道证实,其能够减轻神经细胞氧化应激损伤和线粒体凋亡[8],提示褪黑素可能对BPDE导致的生殖细胞损伤也具有一定的保护作用。因此,本研究建立小鼠精原细胞GC-1体外染毒模型,研究BPDE诱导GC-1细胞凋亡的作用及机制,进一步探索褪黑素对BPDE诱导GC-1细胞凋亡的影响。
1 材料与方法 1.1 材料 1.1.1 细胞株小鼠睾丸精原细胞(GC-1)购自美国ATCC细胞库。
1.1.2 试剂BPDE购自美国Midwest公司;DMEM高糖培养基、胎牛血清购自美国Gibco公司;蛋白提取试剂盒、BCA蛋白检测试剂盒、SDS-PAGE凝胶配制试剂盒、线粒体膜电位检测试剂盒(JC-1)购自碧云天生物技术公司;细胞色素C(Cyt C)、Cleaved-caspase-3、Cleaved-caspase-9抗体购自美国CST公司;Actin抗体、HRP标记的山羊抗兔及抗小鼠二抗均购自碧云天生物技术公司;PVDF膜、ECL发光液购自美国Millipore公司;Annexin V/PI凋亡检测试剂盒购自美国BD公司;褪黑素、2′, 7′-二氯荧光黄双乙酸盐(2, 7-dichlorofluorescin diacetate, DCFH-DA)荧光探针购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养与处理GC-1细胞用含10%胎牛血清的DMEM高糖培养基,在CO2浓度为5%、温度为37 ℃的细胞培养箱中培养。细胞于对数生长期时消化、接种,24 h后,更换含有BPDE的培养基处理24 h,BPDE终浓度分别为100、150、200 nmol/L,溶剂DMSO作为对照。为观察褪黑素对BPDE作用效应的影响,采用1 μmol/L的褪黑素预处理细胞2 h,再采用200 nmol/L BPDE处理24 h。
1.2.2 流式细胞仪检测细胞凋亡按照1.2.1方法接种和培养细胞,BPDE处理24 h后收集细胞,采用PBS清洗2次,按照试剂盒说明书进行处理:加入结合液悬浮细胞,再依次加入Annexin V-FITC染色液和PI染液, 室温避光孵育15 min,C6流式细胞仪(美国BD公司)检测凋亡细胞数量。
1.2.3 线粒体膜电位(ΔΨ)检测按照1.2.1方法接种和培养细胞,BPDE处理24 h后收集细胞,采用0.5 mL新鲜培养基重新悬浮细胞。按试剂盒说明书配制JC-1染色工作液,每个样本加入0.5 mL染色液,37 ℃孵育20 min。JC-1染色缓冲液洗涤细胞2次,加入0.5 mL缓冲液重新悬浮细胞,分装于96孔板中。采用酶标仪检测JC-1单体和聚合物的荧光强度,JC-1聚合物对单体荧光强度的比值为细胞内线粒体膜电位(ΔΨ)的数值,结果表示为相对于对照组的百分数。
1.2.4 细胞内ROS水平分析DCFH-DA进入细胞后可被酯酶水解成DCFH,进而被细胞内的ROS氧化生成有荧光的DCF。本研究采用流式细胞仪检测GC-1细胞内的DCF荧光强度,评估ROS水平。按照1.2.1方法培养和接种细胞,BPDE处理24 h后,收集细胞,弃旧培养基,使用1 mL含10 μmol/L DCFH-DA的无血清培养基悬浮细胞,37 ℃避光孵育30 min。无血清培养基洗涤细胞2次,最后重新悬浮在0.5 mL的无血清培养基中。流式细胞仪FL-1通道分析绿色荧光强度,结果表示为相对于对照组的百分数。
1.2.5 Western blot检测按照1.2.1方法接种和培养细胞,BPDE处理24 h后,根据蛋白提取试剂盒说明书提取各组总蛋白和细胞质蛋白。采用BCA法检测蛋白浓度后,加入5×Loading Buffer煮沸蛋白样本5 min,-80 ℃保存备用。配制12%的分离胶,SDS聚丙烯酰胺凝胶电泳条件为80 V电泳直至结束。转膜条件为恒压100 V,120 min。PVDF膜经5%的脱脂奶粉室温封闭1 h后,加入一抗Actin、Cleaved Caspase-3/9和Cyt C抗体(稀释比均为1 :1 000),4 ℃过夜。TBST清洗,每次5 min;室温孵育稀释比为1 :2 000的相应二抗1 h,再次采用TBST清洗3次后,滴加ECL化学发光液,Fusion FX凝胶成像系统显像。采用Image J软件分析条带灰度值,用目的蛋白/内参蛋白的比值代表相对表达量,结果表示为与对照组的百分比。
1.3 统计学分析实验数据表示为x±s, 采用SPSS 15.0统计软件,采用单因素方差分析比较各组之间的差异。以P < 0.05为差异有统计学意义。
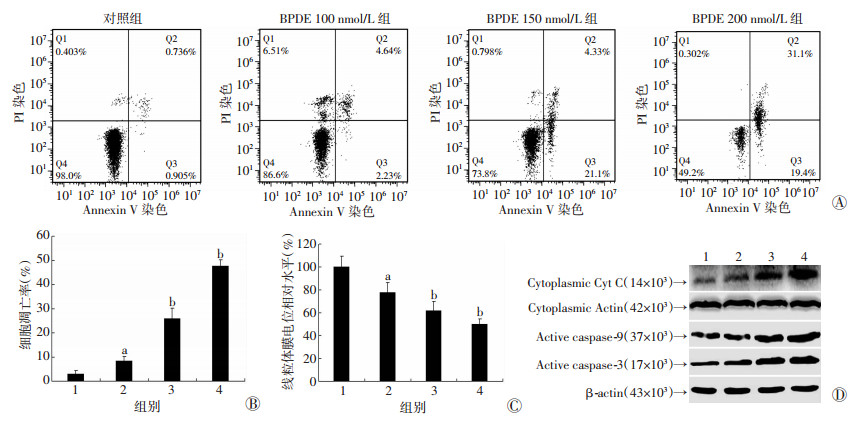
2 结果 2.1 BPDE诱导GC-1细胞线粒体途径的凋亡AnnexinV/PI染色结果显示:与对照组比较,100、150、200 nmol/L BPDE处理24 h均可显著提高Annexin V+细胞比例,细胞凋亡率随着BPDE浓度增加而升高(图 1A、B)。JC-1染色发现:BPDE处理GC-1细胞后可诱导线粒体膜电位显著降低,且存在剂量依赖性(图 1C)。Western blot检测发现:细胞质Cyt C蛋白表达随BPDE处理浓度的增加而升高,提示BPDE可促进线粒体Cyt C的释放。细胞总蛋白中caspase-9和caspase-3活化水平明显增加,提示BPDE处理可诱导caspase-9/3通路的活化(图 1D)。上述结果表明线粒体通路参与了BPDE诱导的GC-1细胞凋亡。
|
|
1:对照组;2:BPDE 100 nmol/L组;3:BPDE 150 nmol/L组;4:BPDE 200 nmol/L组;a:P < 0.05,b:P < 0.01,与对照组比较 A:Annexin V/PI染色及流式细胞仪检测细胞凋亡;B:细胞凋亡率分析;C:JC-1染色检测细胞线粒体膜电位改变;D:Western blot检测细胞质Cyt C以及细胞中caspase 9/3活性形式蛋白的表达 图 1 BPDE诱导GC-1细胞线粒体通路的凋亡 |
2.2 褪黑素减少BPDE诱导的GC-1细胞凋亡
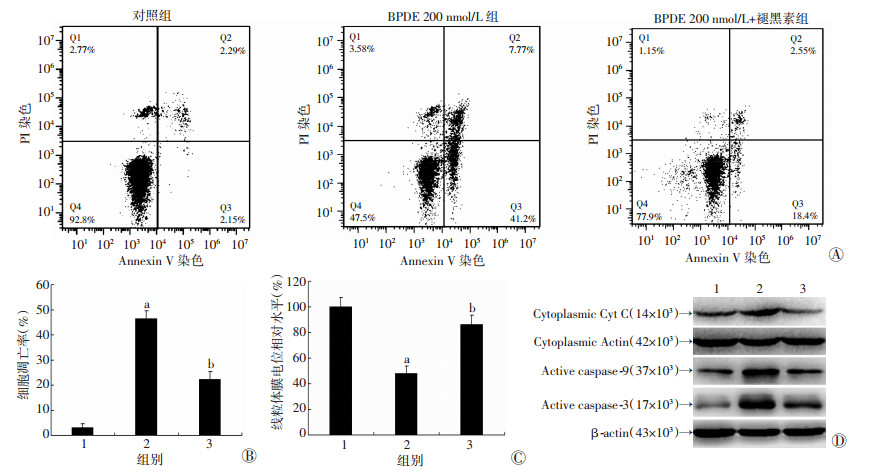
为观察褪黑素对BPDE诱导的细胞凋亡的影响,采用1 μmol/L褪黑素预处理细胞2 h后,再进行BPDE染毒。细胞凋亡检测结果显示:与BPDE 200 nmol/L组比较,褪黑素预处理后BPDE染毒组的细胞凋亡率出现显著降低(P<0.01,图 2A、B)。此外,褪黑素预处理可以明显抑制BPDE诱导的GC-1细胞线粒体膜电位下降(图 2C),降低细胞质内升高的Cyt C水平,同时降低caspase-3和caspase-9的表达(图 2D)。上述结果提示褪黑素能有效抑制BPDE引起的GC-1细胞线粒体通路的凋亡。
|
|
1:对照组;2:BPDE 200 nmol/L组;3:BPDE 200 nmol/L+褪黑素组;a:P < 0.01,与对照组比较;b:P < 0.05,与BPDE单独处理组比较 A:Annexin V/PI染色及流式细胞仪检测细胞凋亡;B:细胞凋亡率分析;C:JC-1染色检测细胞线粒体膜电位改变;D:Western blot检测细胞质Cyt C以及细胞中caspase 9/3活性形式蛋白的表达 图 2 褪黑素对BPDE诱导的GC-1细胞凋亡的影响 |
2.3 褪黑素降低BPDE诱导的GC-1细胞ROS水平
采用DCFH-DA探针结合流式细胞仪分析的方法检测GC-1细胞内的ROS水平,结果显示:BPDE处理后,GC-1细胞内DCF荧光强度明显增加。随着BPDE处理剂量增加,ROS水平显著升高,存在剂量-效应关系(图 3A、B)。而与BPDE 200 nmol/L组比较,褪黑素预处理后,再进行BPDE染毒,细胞内ROS水平的升高出现显著抑制(图 3C)。上述结果提示BPDE可以引起GC-1细胞的氧化应激,而褪黑素则可以有效减轻BPDE诱导的ROS水平升高。

|
|
a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,与BPDE 200 nmol/L组比较 A:DCFH-DA染色及流式细胞仪检测ROS水平;B:BPDE处理后细胞ROS水平的改变1:对照组;2:BPDE 100 nmol/L组;3:BPDE 150 nmol/L组;4:BPDE 200 nmol/L组;C:褪黑素预处理后细胞ROS水平的改变1:对照组;2:褪黑素组;3:BPDE 200 nmol/L组;4:BPDE 200 nmol/L+褪黑素组 图 3 褪黑素对BPDE诱导的GC-1细胞ROS水平的影响 |
2.4 褪黑素激活Nrf-2/ARE抗氧化通路
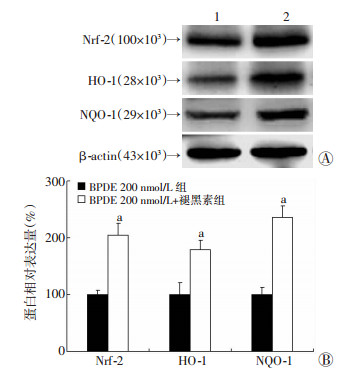
核因子E2相关因子(nuclear factor erythroid-2 related factor 2,Nrf-2)是细胞内最重要的抗氧化分子之一,它与抗氧化反应元件(antioxidant response element,ARE)结合,激活内源性抗氧化基因如HO-1/NQO-1等,对抗活性氧的损伤。Western blot检测结果显示:与BPDE 200 nmol/L组相比较,褪黑素预处理能显著增加细胞内Nrf-2及其转录调控的下游基因HO-1和NQO-1的蛋白表达(图 4),这些结果表明褪黑素降低BPDE诱导的GC-1细胞ROS水平可能与激活Nrf-2/ARE抗氧化通路有关。
|
| A:Western blot检测Nrf-2、HO-1、NQO-1蛋白表达1:BPDE 200 nmol/L组;2:BPDE 200 nmol/L+褪黑素组;B:半定量分析a:P < 0.05,与BPDE 200 nmol/L组比较 图 4 Western blot检测褪黑素对GC-1细胞内Nrf-2/ARE抗氧化通路的影响 |
3 讨论
研究显示:过去数十年间精液质量在世界范围内都呈明显的下降趋势[9-10]。由于男性生殖健康面临的严峻形势,WHO将其列入21世纪危害人类健康的一个重大问题。探讨男性生殖健康危险因素和生殖损害预防策略成为生命科学的一个重要命题。越来越多的证据证实男性生殖健康与环境污染物暴露密切相关[11]。BaP是一种重要的多环芳烃类化合物,广泛存在于职业和生活环境中,也是大气细颗粒物PM2.5中附着的重要有机成分。研究表明男(雄)性生殖系统是多环芳烃作用的重要靶器官,因此,研究BaP男性生殖损伤的机制及其防护具有重要意义。
BPDE是BaP在机体内代谢生成的活性产物之一,具有亲电子性,可以与核DNA的亲核基团发生不可逆的共价结合,形成大分子加合物,造成遗传物质的损伤。因此,生殖细胞的DNA损伤既往成为BaP生殖损伤的主要研究方向。此外,有研究显示BaP能引起大鼠睾丸细胞氧化应激[2],BPDE能诱导人支气管上皮细胞(16HBE)内ROS水平增高[12],提示氧化应激相关的损伤可能也是BaP生殖损害的作用机制。线粒体是细胞内ROS产生的主要场所,同时也是ROS作用的主要靶点。研究发现线粒体途径的凋亡是ROS造成线粒体损伤最重要的一种形式,而目前尚未发现BaP或BPDE对生精细胞线粒体凋亡的研究。本研究通过精原细胞GC-1染毒模型,证实了BPDE可以引起生精细胞线粒体膜电位的降低,线粒体Cyt C释放至细胞质,并造成了caspase-9/3的激活。这些结果说明BPDE可诱导精原细胞发生线粒体途径的凋亡,也提示除了引起遗传物质损伤以外,诱导精原细胞线粒体途径的凋亡可能也是BPDE雄性生殖毒性的机制之一。
人和哺乳动物松果体分泌的褪黑素在许多生理功能中发挥重要作用,并且是一种有效的自由基清除剂[13-14]。已有研究显示褪黑素能通过抗氧化作用保护BaP引起的大鼠肝、肾及脑的损伤[15],但是褪黑素是否对BaP的生殖损伤产生影响仍然是未知的。本研究中,褪黑素预处理能逆转BPDE诱导的GC-1细胞线粒体膜电位的降低,抑制Cyt C的释放以及caspase-9/3的激活,最终使BPDE诱导的线粒体途径的精原细胞凋亡得到显著降低。进一步检测GC-1细胞内的ROS水平,发现与线粒体凋亡通路激活一致,BPDE可以剂量依赖性地增加细胞内的ROS水平,而褪黑素预处理则明显抑制了BPDE诱导的ROS水平的增加。上述研究结果提示BPDE诱导的线粒体途径细胞凋亡与其引起的GC-1细胞氧化应激损伤相关,同时也表明抗氧化剂褪黑素可能通过抑制细胞内的ROS升高而减少BPDE引起的精原细胞凋亡性损伤。Nrf-2是细胞内最重要的抗氧化因子之一,因可以激活大量的内源性抗氧化基因如HO-1、NQO-1等,故能有效对抗氧化压力[16]。已有研究显示褪黑素能够激活Nrf-2/ARE抗氧化通路,对抗药物或紫外线引起的损伤,提示褪黑素激活的Nrf-2抗氧化反应是其发挥保护性作用的机制之一[17-18]。本研究结果表明褪黑素能够激活GC-1细胞内的Nrf-2/ARE抗氧化通路,其可能是褪黑素对抗BPDE诱导的氧化应激及细胞损伤的内在机制。事实上,已经有许多研究显示褪黑素在一定程度上抵抗重金属如镉和镍、紫外线及药物等对机体和细胞的损害[19]。也有研究证实褪黑素可以减弱镉诱导的小鼠睾丸生殖细胞凋亡,可能与抗氧化作用有关[20]。这些证据提示这种机体自身分泌的吲哚类激素不仅在调节诸多生理性功能过程中发挥重要作用,在环境污染物健康损害中也发挥一定的保护性作用。
本研究证实精原细胞线粒体途径的凋亡是BaP致雄性生殖损伤的机制之一,并且观察到褪黑素能有效减少BPDE引起的线粒体途径的精原细胞凋亡,其机制可能与激活Nrf-2/ARE抗氧化通路、降低精原细胞ROS水平有关。上述研究对于更全面地阐释BaP雄性生殖毒性的分子机制及提出保护性的干预措施提供了实验线索。本研究仅为细胞水平的实验研究,由于机体内的调节机制复杂,关于BaP的雄性生殖毒性还需要大样本的人群研究资料以及进一步的动物实验验证。在今后的研究中,一方面进行更深入的BaP雄性生殖毒性及褪黑素保护作用的机制研究,另一方面还需要依托人群调查,研究BaP暴露水平与精子损伤的相关性。
| [1] | CONTI G O, CALOGERO A E, GIACONE F, et al. B(a)P adduct levels and fertility: A cross-sectional study in a Sicilian population[J]. Mol Med Rep, 2017, 15(5): 3398–3404. DOI:10.3892/mmr.2017.6396 |
| [2] | ARAFA H M, ALY H A, ABD-ELLAH M F, et al. Hesperidin attenuates benzo[alpha] pyrene-induced testicular toxicity in rats via regulation of oxidant/antioxidant balance[J]. Toxicol Ind Health, 2009, 25(6): 417–427. DOI:10.1177/0748233709106624 |
| [3] | O'BRIEN J M, BEAL M A, YAUK C L, et al. Benzo(a)pyrene is mutagenic in mouse spermatogonial stem cells and dividing spermatogonia[J]. Toxicol Sci, 2016, 152(2): 363–371. DOI:10.1093/toxsci/kfw088 |
| [4] | RANJIT S, MIDDE N M, SINHA N, et al. Effect of polyaryl hydrocarbons on cytotoxicity in monocytic cells: potential role of cytochromes P450 and oxidative stress pathways[J]. PLoS ONE, 2016, 11(9): e0163827. DOI:10.1371/journal.pone.0163827 |
| [5] | XIAO H, RAWAL M, HAHM E R, et al. Benzo[J]. Cell Cycle, 2007, 6(22): 2826–2834. DOI:10.4161/cc.6.22.4891 |
| [6] |
张天宝, 侯鹏高. 褪黑素生理活性及其作用机制的研究进展[J].
齐齐哈尔医学院学报, 2015, 36(11): 1671–1673.
ZHANG T B, HOU G P. Progress on physiological activities of melatonin and its mechanisms[J]. J Qiqihar Med Coll, 2015, 36(11): 1671–1673. |
| [7] | SUZEN S. Melatonin and synthetic analogs as antioxidants[J]. Curr Drug Deliv, 2013, 10(1): 71–75. DOI:10.2174/1567201811310010013 |
| [8] | WASEEM M, SAHU U, SALMAN M, et al. Melatonin pre-treatment mitigates SHSY-5Y cells against oxaliplatin induced mitochondrial stress and apoptotic cell death[J]. PLoS ONE, 2017, 12(7): e0180953. DOI:10.1371/journal.pone.0180953 |
| [9] | CARLSEN E, GIWERCMAN A, KEIDING N, et al. Evidence for decreasing quality of semen during past 50 years[J]. BMJ, 1992, 305(6854): 609–613. DOI:10.1136/bmj.305.6854.609 |
| [10] |
张树成, 王弘毅, 王介东. 1981~1996年我国有生育力男性精液质量的变化分析[J].
生殖与避孕, 1999, 19(1): 27–33.
ZHANG S C, WANG H Y, WANG J D. Analysis of change in sperm quality of Chinese fertile men during 1981-1996[J]. Reprod Contracep, 1999, 19(1): 27–33. |
| [11] | BARAZANI Y, KATZ B F, NAGLER H M, et al. Lifestyle, environment, and male reproductive health[J]. Urol Clin North Am, 2014, 41(1): 55–66. DOI:10.1016/j.ucl.2013.08.017 |
| [12] | SANG H, ZHANG L, LI J. Anti-benzopyrene-7, 8-diol-9, 10-epoxide induces apoptosis via mitochondrial pathway in human bronchiolar epithelium cells independent of the mitochondria permeability transition pore[J]. Food Chem Toxicol, 2012, 50(7): 2417–2423. DOI:10.1016/j.fct.2012.04.041 |
| [13] | LI Y, LI S, ZHOU Y, et al. Melatonin for the prevention and treatment of cancer[J]. Oncotarget, 2017, 8(24): 39896–39921. DOI:10.18632/oncotarget.16379 |
| [14] | XIE Z, CHEN F, LI W A, et al. A review of sleep disorders and melatonin[J]. Neurol Res, 2017, 39(6): 559–565. DOI:10.1080/01616412.2017.1315864 |
| [15] | MURAWSKA-CIAŁOWICZ E, JETHON Z, MAGDALAN J, et al. Effects of melatonin on lipid peroxidation and antioxidative enzyme activities in the liver, kidneys and brain of rats administered with benzo(a)pyrene[J]. Exp Toxicol Pathol, 2011, 63(1/2): 97–103. DOI:10.1016/j.etp.2009.10.002 |
| [16] | MA Q. Role of nrf2 in oxidative stress and toxicity[J]. Annu Rev Pharmacol Toxicol, 2013, 53: 401–426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [17] | CHEN L Y, RENN T Y, LIAO W C, et al. Melatonin successfully rescues hippocampal bioenergetics and improves cognitive function following drug intoxication by promoting Nrf2-ARE signaling activity[J]. J Pineal Res, 2017, 63(2): e12417. DOI:10.1111/jpi.12417 |
| [18] | JANJETOVIC Z, JARRETT S, LEE E, et al. Melatonin and its metabolites protect human melanocytes against UVB-induced damage: Involvement of NRF2-mediated pathways[J]. Sci Rep, 2017, 7(1): 1274. DOI:10.1038/s41598-017-01305-2 |
| [19] | CAO Z, FANG Y, LU Y, et al. Melatonin alleviates cadmium-induced liver injury by inhibiting the TXNIP-NLRP3 inflammasome[J]. J Pineal Res, 2017, 62(3): e12389. DOI:10.1111/jpi.12389 |
| [20] | JI Y L, WANG H, MENG C, et al. Melatonin alleviates cadmium-induced cellular stress and germ cell apoptosis in testes[J]. J Pineal Res, 2012, 52(1): 71–79. DOI:10.1111/j.1600-079X.2011.00921.x |



