2. 400037 重庆,第三军医大学新桥医院神经内科
2. Department of Neurology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
脑出血(intracerebral hemorrhage,ICH)在所有脑血管疾病中占20%~30%,是我国居民首要的致死因素[1]。ICH具有高发生率、高致残率和高死亡率的特点,然而目前仍然缺乏有效的治疗手段。有关ICH后的神经功能恢复主要涉及神经发生、血管生成以及突触的可塑性等[2]。其中海马神经发生在脑出血后神经功能恢复中发挥着极其重要的作用,通过神经发生产生的新生神经元可以迁移到脑损伤区域,有效改善神经功能缺损[3]。而海马神经发生的过程主要包括神经干细胞(neural stem cells,NSCs)的增殖、分化以及迁移,这一过程受到Notch1信号的调控。研究表明,通过促进海马的神经发生可以有效地促进ICH后的神经功能恢复[4]。然而,为了维持海马神经发生的持续性,则需要NSCs通过自身增殖来维持NSCs的库容。其中,NSCs通过水平分裂,即左右分开可以有效地维持和扩增NSCs的库容,而NSCs的垂直分裂方式,即上下分开则对NSCs库容存在消耗作用[5]。那么,是否可以通过调控NSCs的分裂方式来维持NSCs的库容,促进脑出血后海马神经发生的持续性,进而改善神经功能缺损?本研究通过建立小鼠自体血脑出血模型,观察脑出血对海马NSCs分裂方式以及Notch1表达的影响,进一步通过调控Notch1信号,观察对海马NSCs分裂方式以及后期神经功能恢复的影响。
1 材料与方法 1.1 主要材料与试剂BCA试剂(碧云天,P0012S)、BrdU粉剂(Sigma,B5002)、BrdU抗体(BD pharmingen,555627)、DCX抗体(Santa,sc-8066)、β-actin抗体(Boster,BM0627)、Notch1抗体(Abcam,ab8925)、Notch1活化剂(Millipore,491002)等。
1.2 实验动物C57BL/6小鼠购自第三军医大学实验动物中心,6~8周龄,体质量18~22 g,全部为雄性,自由进食,分笼饲养。所有的动物实验按照实验动物管理及保护的有关规定进行。
1.3 实验分组与小鼠脑出血模型的建立实验总共分为Sham组(n=10)、ICH组(n=10)、ICH+Vehicle组(n=15)、ICH+Notch1活化剂组(n=15)。参考文献[6]报道的小鼠自体血脑出血模型建立的方法,简述如下:用80 mg/kg剂量的戊巴比妥钠腹腔注射进行麻醉,用离体定位仪固定小鼠,从小鼠尾巴收集20 μL自体血,利用微量注射泵将其缓慢地注入小鼠颅内的尾状核中,其定位坐标为:以囟门为原点,向前0.8 mm, 再向左2 mm,并插入3.5 mm深。注射完成后10 min,缓慢拔出微量注射针,缝合皮肤。Sham组不注入自体血,其余过程一样。ICH+Notch1活化剂组在ICH模型建立成功后,侧脑室植入1个渗透微型泵,Notch1利用人工脑脊液配成10 μg/mL的浓度,按照0.5 μL/h速度持续泵注3 d。ICH+Vehicle组只泵入同剂量的人工脑积液。腹腔注射BrdU(50 mg/kg),每天1次,总共注射3 d,第4天取材。ICH+Vehicle组和ICH+Notch1活化剂组各5只在ICH 28 d进行行为学检测后再取材。
1.4 转轮实验ICH后28 d进行小鼠的运动功能检查,参考文献[7]报道的方法进行:将转轮的初速度调到10 r/min,将小鼠放到转轮上后,以0.2 r/s的加速度进行加速,记录3次掉下来的潜伏期。总共重复3次,求3次的平均值。
1.5 平衡木行走实验ICH 28 d后利用平衡木行走实验对小鼠的运动平衡功能进行检测,参考文献[7]报道的方法进行:将小鼠置于6 mm、120 mm长的木质平衡木上,平衡木悬高300 mm,让小鼠由一侧向另外一侧行走,记录小鼠60步内右侧双腿滑落的次数。
1.6 免疫荧光与免疫组化利用0.01 mol/L PBS漂洗脑片,加入50%甲酰胺反应60 min(60 ℃),漂洗,加入2 mol/L HCl反应15 min(37 ℃),漂洗,加入一抗(mouse anti-BrdU),4 ℃反应12 h,漂洗,加入荧光二抗(Cy3 anti-mouse),37 ℃反应2 h,染DAPI,漂洗,贴片,待干燥后封片。BrdU阳性细胞采用体视学的方法进行统计[8],切片厚度25 μm,每间隔10张切片染1张切片,总共取9张切片,阳性细胞的总和乘以10,即得到整个海马的BrdU阳性细胞数。另外,当海马颗粒下区的2个BrdU阳性细胞呈现水平紧密排列时,称为水平分裂。同理,当海马颗粒下区的2个BrdU阳性细胞呈现垂直紧密排列时,称为垂直分裂[8]。
利用0.01 mol/L PBS漂洗脑片,加入0.3% H2O2反应30 min(37 ℃),漂洗,加入一抗(goat anti-DCX),4 ℃反应12 h,漂洗,加入生物素二抗(anti-goat),漂洗,再加入SABC,37 ℃反应1 h,漂洗,DAB显色。
1.7 Western blot检测利用RIPA裂解液裂解海马组织,并在冰上研磨碎,离心,利用BCA法检测蛋白浓度进行定量,配制SDS-PAGE凝胶,加样,进行电泳、转膜。用5%脱脂奶粉进行封闭3 h,漂洗后加入一抗,4 ℃反应12 h,漂洗,加入二抗,37 ℃反应2 h,漂洗,利用Bio-Rad ChemiDoc MP成像系统进行显影成像,并利用Image J软件进行灰度值分析,以β-actin为内参进行比对分析。
1.8 统计学分析每个实验重复3次,采用SPSS 20.0统计软件,计量资料以x±s表示,2组之间BrdU阳性细胞数以及Notch1蛋白表达的比较采用独立样本t检验,3组之间的DCX阳性细胞数、转轮实验的潜伏期和平衡木行走实验时腿的滑落次数的比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 ICH对小鼠海马NSCs水平分裂的比例以及Notch1表达的影响免疫荧光观察结果显示,小鼠ICH后,整个海马齿回颗粒下区(subgrannular zone,SGZ)BrdU阳性细胞数量明显增多[(1 079±92)vs(1 507±115),P<0.01, 图 1A],同时发现,ICH后,小鼠SGZ中NSCs水平分裂的比例明显降低[(0.70±0.08)vs(0.46±0.11),P<0.01, 图 1B]。而通过Western blot检测发现,ICH后小鼠海马中的Notch1表达明显降低[(0.37±0.01)vs(0.28±0.01),P<0.05, 图 1C]。

|
| A:Sham组和ICH组小鼠第3天时整个海马中BrdU标记的阳性细胞情况;B:垂直分裂和水平分裂;C:Western blot检测Sham组和ICH组小鼠海马Notch1表达的情况1:Sham组;2:ICH组 图 1 ICH对NSCs的增殖方式以及海马Notch1表达的影响 |
2.2 促进Notch1的表达对ICH后小鼠海马NSCs水平分裂比例的影响
与ICH+Vehicle组比较,当利用Notch1活化剂处理后,能够促进ICH后小鼠海马Notch1蛋白的表达,并且能够使小鼠SGZ中NSCs的BrdU阳性细胞数量进一步增多[(1 586±87)vs(1 875±109), P<0.05]。同时ICH+Notch1活化剂组小鼠SGZ中NSCs水平分裂的比例明显增高[(0.46±0.08)vs(0.69±0.05),P<0.05, 图 2]。

|
| A:ICH+Vehicle组小鼠海马中BrdU标记的阳性细胞情况;B:ICH+Notch1组小鼠海马中BrdU标记的阳性细胞情况 图 2 Notch1对ICH后小鼠海马NSCs增殖的影响(免疫荧光) |
2.3 促进Notch1的表达对ICH后小鼠的远期运动功能恢复以及神经发生的影响
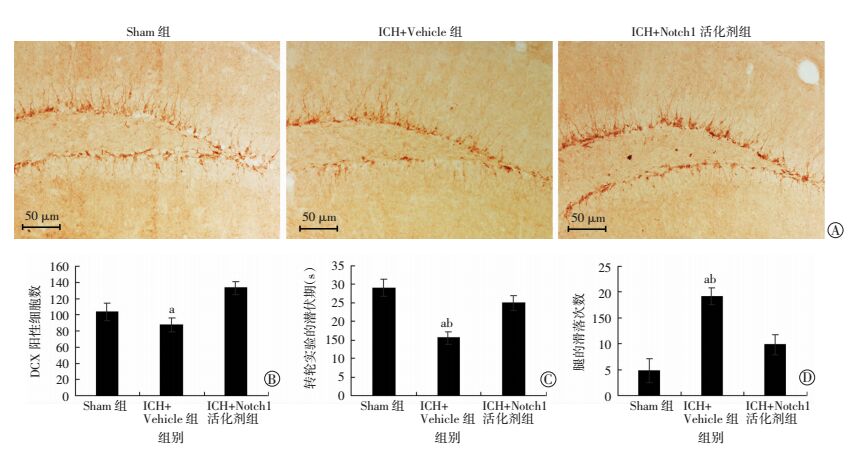
ICH 28 d后,通过免疫组化染色发现,Notch1活化剂能够有效地促进ICH后小鼠海马的神经发生(P<0.01, 图 3A、B)。同时,通过转轮实验检测小鼠的运动功能发现,Notch1活化剂能够有效改善ICH后小鼠的运动功能(P<0.01, 图 3C、D)。
|
| A:小鼠海马DCX免疫组化染色(SABC);B:DCX阳性细胞数;C:转轮实验的潜伏期;D:平衡木行走实验时腿的滑落次数a:P<0.01,与ICH+Notch1活化剂组比较;b:P<0.01,与Sham组比较 图 3 Notch1对小鼠ICH 28 d后海马神经发生以及运动功能的影响 |
3 讨论
本研究发现ICH能够导致小鼠海马中NSCs水平分裂的比例明显降低,同时伴随着Notch1信号的下调。而活化ICH小鼠Notch1信号后,可以有效地增加小鼠海马中NSCs水平分裂的比例,并且能够改善ICH小鼠的远期运动功能和神经发生。本研究结果提示,Notch1在ICH导致小鼠海马中NSCs分裂方式改变中发挥着重要的作用,通过调控Notch1信号可为改善ICH后神经功能恢复提供靶点。
目前,ICH后的神经发生得到了越来越多的重视。研究表明,通过促进ICH后的神经发生可以有效地改善ICH小鼠的神经功能[4]。而对于成年小鼠,神经发生主要存在于小鼠的海马颗粒下区和室管膜下区,其过程主要包括NSCs的增殖、分化与迁移等。其中,NSCs的分裂方式决定着NSCs的命运。当NSCs水平分裂时,可以有效地维持NSCs的库容;而当NSCs垂直分裂时,会使NSCs分化,进而耗竭NSCs的库容[9]。因此NSCs两种分裂方式的平衡对于NSCs的库容以及神经发生的持续性至关重要。
Notch1信号通路是一条调控神经干细胞增殖与分化的经典信号通路,Notch1主要表达在胚胎期和成年期小鼠大脑的海马区和室管膜区[10]。研究提示,当活化Notch1信号后,可以有效地促进小鼠海马NSCs的增殖。而当Notch1信号被外界因素干预受到抑制后,海马中的NSCs数量明显会降低[11]。随着针对Notch1对NSCs调控作用的研究深入,近期发现Notch1主要是通过调控NSCs的分裂方式来决定NSCs的命运。当Notch1活化时,NSCs水平分裂的比例明显增高,进而促进NSCs数量的维持和扩增[12]。正常生理条件下,Notch1维持在一个相对稳定的表达水平,进而维持NSCs的数量。而在病理条件下(比如衰老、脑缺血),会导致Notch1的表达水平发生变化,进而影响NSCs的数量和海马神经发生[13-14]。本研究发现ICH会导致小鼠海马中Notch1的表达明显降低,进而导致NSCs水平分裂的比例减少,最终影响了远期的神经发生。这样进一步证实了Notch1对于海马NSCs的调控作用,提示Notch1可作为调控海马神经发生异常相关疾病的靶点。
研究显示,当脑损伤发生后,通过促进海马的神经发生,进而增加新生神经元的数量,能够有效改善脑损伤导致的神经功能缺损[15-16]。这也在本研究中得到了进一步的证实,我们通过活化ICH小鼠海马中的Notch1信号,促进了NSCs的增殖和远期神经发生,并且改善了远期ICH小鼠的运动功能。前期有研究采用转轮实验和平衡木实验检测发现ICH小鼠一侧运动功能会发生障碍,进而导致平衡功能障碍[4]。本研究也发现ICH小鼠在转轮实验和平衡木实验中表现出异常,而通过活化ICH小鼠海马中的Notch1信号后,可以有效地改善ICH小鼠的运动功能障碍。另外,有研究也发现通过NSCs移植,能够有效地改善缺血性脑损伤患者的神经功能恢复[17]。这也进一步提示通过调控海马NSCs的增殖与神经发生,可为治疗脑损伤相关疾病提供方向。
综上所述,本研究从NSCs分裂方式的角度探讨ICH后Notch1对小鼠海马远期神经发生和神经功能恢复的影响,发现了ICH会导致小鼠海马Notch1表达的下调,并伴随NSCs水平分裂比例的明显降低。活化Notch1信号可以有效提高ICH小鼠海马NSCs水平分裂的比例,并且能够促进远期的海马神经发生与神经功能恢复。但ICH到底如何影响Notch1信号以及Notch1信号如何调控NSCs的分裂方式,有待进一步研究。
| [1] | ZHOU M, WANG H, ZHU J, et al. Cause-specific mortality for 240 causes in China during 1990-2013: a systematic subnational analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2016, 387(10015): 251–272. DOI:10.1016/S0140-6736(15)00551-6 |
| [2] | MOSKOWITZ M A, LO E H, Iadecola C. The science of stroke: mechanisms in search of treatments[J]. Neuron, 2010, 67(2): 181–198. DOI:10.1016/j.neuron.2010.07.002 |
| [3] | LEI C, WU B, CAO T, et al. Activation of the high-mobility group box 1 protein-receptor for advanced glycation end-products signaling pathway in rats during neurogenesis after intracerebral hemorrhage[J]. Stroke, 2014, 46(2): 500–506. DOI:10.1161/strokeaha.114.006825 |
| [4] | ZHAO Y, WEI Z Z, ZHANG J Y, et al. GSK-3β inhibition induced neuroprotection, regeneration, and functional recovery after intracerebral hemorrhagic stroke[J]. Cell Transplant, 2017, 26(3): 395–407. DOI:10.3727/096368916X694364 |
| [5] | NOCTOR S C, MARTÍNEZ-CERDEÑO V, KRIEGSTEIN A R. Distinct behaviors of neural stem and progenitor cells underlie cortical neurogenesis[J]. J Comp Neurol, 2008, 508(1): 28–44. DOI:10.1002/cne.21669 |
| [6] | WANG Y C, ZHOU Y, FANG H, et al. Toll-like receptor 2/4 heterodimer mediates inflammatory injury in intracerebral hemorrhage[J]. Ann Neurol, 2014, 75(6): 876–889. DOI:10.1002/ana.24159 |
| [7] | FENN A M, GENSEL J C, HUANG Y, et al. Immune activation promotes depression 1 month after diffuse brain injury: a role for primed microglia[J]. Biol Psychiatry, 2014, 76(7): 575–584. DOI:10.1016/j.biopsych.2013.10.014 |
| [8] | LIU L, ZHANG Q, CAI Y, et al. Resveratrol counteracts lipopolysaccharide-induced depressive-like behaviors via enhanced hippocampal neurogenesis[J]. Oncotarget, 2016, 7(35): 56045–56059. DOI:10.18632/oncotarget.11178 |
| [9] | SLATER J L, LANDMAN KA, HUGHES B D, et al. Cell lineage tree models of neurogenesis[J]. J Theor Biol, 2009, 256(2): 164–179. DOI:10.1016/j.jtbi.2008.09.034 |
| [10] | ARTAVANIS-TSAKONAS S, RAND M D, LAKE R J. Notch signaling: cell fate control and signal integration in development[J]. Science, 1999, 284(5415): 770–776. DOI:10.1126/science.284.5415.770 |
| [11] | ZHANG K, ZHAO T, HUANG X, et al. Notch1 mediates postnatal neurogenesis in hippocampus enhanced by intermittent hypoxia[J]. Neurobiol Dis, 2014, 64: 66–78. DOI:10.1016/j.nbd.2013.12.010 |
| [12] | NTELIOPOULOS G, GORDON M Y. Protein segregation between dividing hematopoietic progenitor cells in the determination of the symmetry/asymmetry of cell division[J]. Stem Cells Dev, 2012, 21(14): 2565–2580. DOI:10.1089/scd.2011.0467 |
| [13] | SUN F, MAO X, XIE L, et al. Notch1 signaling modulates neuronal progenitor activity in the subventricular zone in response to aging and focal ischemia[J]. Aging Cell, 2013, 12(6): 978–987. DOI:10.1111/acel.12134 |
| [14] | WANG S, YUAN Y, XIA W, et al. Neuronal apoptosis and synaptic density in the dentate gyrus of ischemic rats' response to chronic mild stress and the effects of Notch signaling[J]. PLoS ONE, 2012, 7(8): e42828. DOI:10.1371/journal.pone.0042828 |
| [15] | KIM K, PARK H W, MOON H E, et al. The effect of human umbilical cord blood-derived mesenchymal stem cells in a collagenase-induced intracerebral hemorrhage rat mondel[J]. Exp Neurobiol, 2015, 24(2): 146–155. DOI:10.5607/en.2015.24.2.146 |
| [16] | CHEN J, LEAK R K, YANG G Y. Perspective for stroke and brain injury research: mechanisms and potential therapeutic targets[J]. CNS Neurosci Ther, 2015, 21(4): 301–303. DOI:10.1111/cns.12392 |
| [17] | QIAO L Y, HUANG F J, ZHAO M, et al. A two-year follow-up study of cotransplantation with neural stem/progenitor cells and mesenchymal stromal cells in ischemic stroke patients[J]. Cell Transplant, 2014, 23(Suppl 1): S65–S72. DOI:10.3727/096368914X684961 |



