胃癌是全世界肿瘤相关疾病致死的第3大主因,也是中国男性最高发的肿瘤类型[1-2]。早期胃癌切除后,5年生存率可达95%以上[3],但进展期胃癌术后5年生存率不到30%[4],可见胃癌细胞侵袭转移是胃癌患者不良预后的主要原因之一。
人端粒酶逆转录酶(telomerase reverse transcriptase, hTERT)是端粒酶的催化亚基,催化端粒合成,对维持端粒长度、抵抗衰老具有重要作用;此外,hTERT还可以发挥非逆转录酶活性、抵抗细胞凋亡、促进DNA损伤修复及基因表达等作用[5-6]。hTERT在正常体细胞中基本不表达,但在多数肿瘤细胞中高表达,并与肿瘤细胞生物学行为密切相关;例如,在恶性胶质瘤细胞中,hTERT可促进细胞增殖,干扰hTERT表达可显著抑制肿瘤细胞增殖[7-8]。也有研究表明:在肝癌细胞中过表达hTERT促进其侵袭能力,在神经母细胞瘤中干扰hTERT显著抑制其侵袭能力[9-10]。课题组前期研究表明[11]:hTERT促进肿瘤侵袭转移与叉头盒蛋白(forkhead box M1,FOXM1)密切相关,然而hTERT影响FOXM1表达的具体机制不清楚。FOXM1是增殖相关转录因子,已被证实为一种原癌基因。FOXM1在胚胎及胎儿细胞中高表达,可维持其正常发育;在肿瘤细胞系中高表达, 促进肿瘤发生、增殖、侵袭、转移等[12];例如,在肝细胞癌中,FOXM1可通过促进细胞周期蛋白B1(cyclin B1)、细胞周期蛋白D1(cyclin D1)等促进肝癌细胞增殖[13-14],在急性白血病中,FOXM1也可以通过促进细胞周期进程进而促进白血病细胞增殖[15]。此外,FOXM1与肿瘤侵袭密切相关,可促进基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶-9(MMP-9)等蛋白表达,从而导致肿瘤的侵袭转移。体外研究证实:FOXM1通过促进MMP-2表达,进而促进恶性胶质瘤细胞侵袭能力[16];在结肠癌中,FOXM1也可能通过抑制MMP-9的表达进而抑制结肠癌细胞的侵袭转移[17]。
在肝癌、骨肉瘤等肿瘤细胞系中,hTERT可通过促进MMPs表达,促进肿瘤细胞侵袭[10, 18]。本课题组前期研究发现[11]:胃癌细胞系中hTERT可上调FOXM1进而促进胃癌细胞侵袭转移,但机制不明。那么,FOXM1作为MMPs的上游调控者,是否受到hTERT的调控,进而影响肿瘤细胞的生物学行为呢?目前关于hTERT与FOXM1的关系鲜见报道。本研究拟探讨FOXM1在hTERT促进胃癌细胞侵袭中的作用及hTERT调控FOXM1的分子机制,为靶向hTERT的胃癌防治提供新的策略。
1 材料与方法 1.1 主要试剂人胃癌细胞株SGC-7901由本实验室保存,高糖DMEM培养基(美国HyClone公司),胎牛血清(美国Gibco公司),抗人hTERT抗体(英国Abcam公司),抗人FOXM1抗体(美国Cellsignal公司),抗HA-Tag抗体(美国Proteintech公司),抗乙酰化赖氨酸抗体(美国PTM biolabs公司),山羊抗兔、山羊抗鼠二抗购自上海碧云天公司,双荧光素酶报告实验试剂盒购自美国Promega公司,LipofectamineTM3000转染试剂购自美国Thermo Fisher公司,BCA蛋白浓度测定试剂盒及RIPA裂解液购自上海碧云天公司,逆转录、PCR及免疫共沉淀(co-immunoprecipitation,Co-IP)试剂盒购自美国Thermo Scientific公司,Matrigel购自美国BD公司,细胞培养小室购自美国Millipore公司,实验中所使用的质粒及慢病毒均为本实验室所保存。
1.2 方法 1.2.1 细胞培养人胃癌细胞SGC-7901采用DMEM高糖(含10%胎牛血清)于37℃、5% CO2培养箱中培养。
1.2.2 提取细胞总蛋白将培养液吸出后,用预冷PBS将残留的培养基洗尽,弃PBS,在6孔板的每个孔中加入70 μL含蛋白酶抑制剂的蛋白裂解液;冰上裂解30 min,刮下并收集细胞,4 ℃,14 000 r/min,离心15 min;吸取上清即为总蛋白;BCA法测总蛋白浓度。
1.2.3 提取RNA取6孔板培养细胞,用预冷的PBS将残留的培养基洗尽,弃PBS;在6孔板的每个孔中加入1 mL TRIzol,吹打使细胞裂解,在冰上静置5 min;向上述裂解液中加入氯仿200 μL,剧烈震荡15 s,静置2 min;离心:4 ℃,14 000 r/min,8 min;取上清于无RNA酶EP管中,加入等量异丙醇,混匀;离心:4 ℃,14 000 r/min,20 min;弃上清,加入1 mL 75%酒精,离心:4 ℃,7 500 r/min,5 min;再次离心,小心吸尽残余酒精,晾干;加入20 μL DEPC水,溶解沉淀,混匀;测浓度。
1.2.4 逆转录配制如下反应体系:gDNA Eraser 1 μL,Eraser Buffer 2 μL,RNA 1 μg,RNase free dH2O补足10 μL(反应条件:42 ℃,2 min);向上述反应产物中加入如下体系:5×prime script buffer2 4 μL,primescript RT enyme mix 1 μL,RT primer mix 1 μL,RNase free dH2O 4 μL(反应条件:37 ℃、15 min,85 ℃、5 s);向反应产物cDNA中加入20 μL DEPC水,备用。
1.2.5 荧光定量PCR配制如下体系:2×SYBR Green Supermix 10 μL,cDNA 4 μL,上下游引物各0.4 μL,Rox 0.4 μL,超纯水4.8 μL,总体积20 μL(反应条件:95 ℃ 15 s,60 ℃ 30 s),40个循环,设置3个复孔,最后的数值用Prism 5进行作图和统计学分析。
1.2.6 Western blot检测RIPA裂解液提取细胞蛋白,BCA法测蛋白浓度,100 ℃、10 min使蛋白变性; 蛋白上样量为30 μg,以10%SDS-PAGE凝胶电泳分离; 湿转法转移蛋白至NC膜,5%脱脂奶粉封闭2 h,加入一抗4 ℃过夜(hTERT 1 :1 000,FOXM1 1 :1 000,GAPDH 1 :10 000),二抗室温孵育1 h(山羊抗鼠1 :5 000,山羊抗兔1 :10 000),ECL化学发光法显示结果。
1.2.7 免疫共沉淀检测使用Pierce免疫共沉淀试剂盒,首先将抗体固定于偶联树脂(15 μg),裂解细胞并用对照树脂预处理细胞裂解液,在4 ℃进行免疫共沉淀,SDS-PAGE分析样品。具体步骤参见说明书。
1.2.8 细胞转染使用LipofectamineTM 3000试剂进行细胞转染。分别配制如下体系(6孔板):①Opti-MEM 125 μL,LipofactamineTM 3000 3.6 μL;②Opti-MEM 125 μL,P3000TM 6 μL,DNA 3 μg,将①加入到②,混匀,室温静置15 min;待细胞贴壁约80%,弃原培养基,PBS洗2遍,Opti-MEM润洗1次,弃Opti-MEM,重新加入750 μL Opti-MEM,将上述配制好含质粒的转染试剂250 μL加入至6孔板,轻轻混匀,继续培养,6 h后更换含血清的培养基继续培养。
1.2.9 细胞慢病毒感染构建稳转细胞系将对数生长期的细胞按照1×105/L接种于24孔板中,于37 ℃、5%CO2条件培养过夜;待细胞贴壁约50% ~70%进行感染;用完全培养基将polybrene稀释至终浓度为5 μg/mL;从冰箱取出病毒载体,并迅速融化;弃原有培养基,每孔加入新的含有polybrene的培养基,加入病毒载体,混匀,继续培养;12 h后换液,继续培养;在荧光显微镜观察感染效率,而后继续传代培养;通过Western blot检测进行验证。
1.2.10 免疫荧光实验细胞爬片:将20 mm×20 mm的无菌细胞爬片置入12孔板中,取处于对数生长期的细胞接种于爬片上,细胞密度约50%。细胞固定、打孔、封闭:将细胞置于4%多聚甲醛固定20 min,PBS洗涤3×10 min/次,尔后0.5% Triton X-100于4 ℃打孔30 min,PBS洗3遍,每遍10 min。加入5% BSA,室温封闭30 min,PBS洗3遍,每遍10 min;一抗孵育:取出细胞爬片置于载玻片上,兔属抗人hTERT一抗抗体稀释比例为1 :100,适量滴加于细胞爬片上,4 ℃湿盒中过夜;取出爬片,PBS洗3遍,每遍15 min,加入Alexa Fluor579标记山羊抗兔二抗(稀释比例为1 :300), 37 ℃孵育1 h,PBS洗3遍,每遍15 min;鼠属抗人FOXM1一抗稀释比例为1 :100,Alexa Fluor 488标记山羊抗鼠二抗(稀释比例为1 :300);加入DAPI,室温孵育5 min,PBS洗3遍,每遍15 min。使用激光共聚焦观察488 nm和579 nm波长处显示的荧光并拍照。
1.2.11 Transwell检测准备小室:水化基质胶,用完全培养基:基质胶=5 :1配制,向小室内加入50 μL稀释的基质胶,于37 ℃培养箱静置30 min待其凝固;制备细胞悬液,无血清培养基稀释浓度为1×106/mL,加入100 μL细胞悬液于上室,下室加入含20%FBS培养基800 μL,常规培养36 h。细胞计数:用棉签轻轻擦掉上室中的基质胶及液体,PBS清洗2遍,晾干,4%多聚甲醛固定10 min,PBS清洗2遍,晾干,结晶紫染色15 min,PBS清洗4次,晾干,于倒置显微镜拍照,每个小室随机选择5个视野,计算均值。
1.2.12 双荧光素酶报告基因检测将细胞接种于24孔板,按上述1.2.8细胞转染方法转染质粒(体系为上述体系的1/4,pEGFP-N1-FOXM1及其对照质粒pEGFP-N1用量为800 ng,内参质粒pRL-TK为200 ng),24 h后收集、裂解细胞;将细胞用预冷PBS洗2遍,每孔加入1×Passive Lysis Buffer 100 μL,室温摇动裂解30 min,4 ℃,12 000 r/min离心,取30 μL上清,加入50 μL荧光素酶检测试剂后检测荧光素酶活性;将稀释为1×stop@Go试剂加入上述混合物,再次检测海肾报告基因活性,以荧光报告基因读数除以海肾报告基因读数,得比值。
1.3 统计学分析应用Prism 5统计软件,计量资料以x±s表示,两组间比较采用t检验。检验水准:α=0.05。
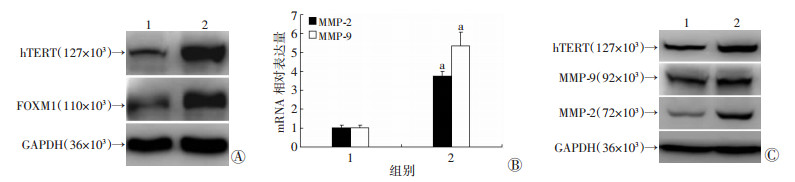
2 结果 2.1 hTERT促进FOXM1及其下游靶基因的表达构建稳定过表达hTERT的胃癌细胞株SGC-7901-hTERT,采用Western blot和qRT-PCR分别检测相关基因mRNA和蛋白的表达。过表达hTERT后,与对照组比较,FOXM1蛋白表达明显上调(图 1A),FOXM1下游靶基因MMP-2、MMP-9的mRNA(图 1B)及蛋白(图 1C)表达也明显上调。
|
|
1:对照组; 2:过表达hTERT组 A:Western blot检测FOXM1蛋白表达; B:qRT-PCR检测MMP-2、MMP-9 mRNA表达a:P < 01,与对照组比较; C:Western blot检测MMP-2、MMP-9蛋白表达 图 1 qRT-PCR和Western blot检测过表达hTERT后两组SGC-7901细胞FOXM1及其下游靶基因的表达 |
2.2 hTERT通过FOXM1促进胃癌细胞侵袭转移
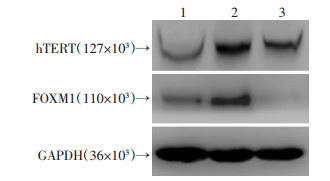
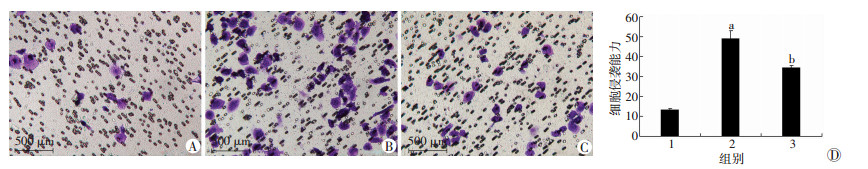
进一步在稳定过表达hTERT的胃癌细胞SGC-7901中转染FOXM1干扰质粒,采用Transwell侵袭实验检测细胞侵袭能力的变化(图 2、3)。过表达hTERT 后,与对照组比较,细胞侵袭能力明显增强(P < 01),在过表达hTERT细胞中干扰FOXM1后,可以部分逆转hTERT对胃癌细胞侵袭能力的影响(P < 01)。
|
| 1:对照组;2:过表达hTERT组;3:过表达hTERT后shFOXM1组 图 2 Western blot检测干扰FOXM1后hTERT和FOXM1蛋白的变化 |
|
| A~C:Transwell检测SGC7901细胞侵袭能力(结晶紫×20);A:对照组; B:过表达hTERT组; C:过表达hTERT后shFOXM1组;D:细胞侵袭能力分析1:对照组;2:过表达hTERT组;3:过表达hTERT后shFOXM1组; a:P < 01,与对照组比较;b :P < 01, 与过表达hTERT组比较 图 3 Transwell实验检测过表达hTERT并干扰FOXM1后各组SGC-7901细胞侵袭能力 |
2.3 hTERT通过上调FOXM1调节其下游基因表达
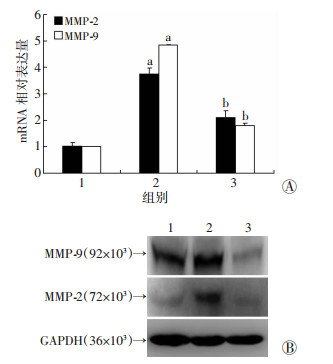
在稳定过表达hTERT的胃癌细胞SGC-7901中转染FOXM1干扰质粒,用qRT-PCR和Western blot检测FOXM1下游靶基因MMP-2、MMP-9的mRNA及蛋白表达。与对照组比较,过表达hTERT可显著促进上述基因的mRNA(图 4A)及蛋白(图 4B)表达,干扰FOXM1后可部分逆转这一效应。
|
|
1:对照组;2:过表达hTERT组;3:过表达hTERT后shFOXM1组 A:qRT-PCR检测MMP-2、MMP-9的mRNA表达a:P < 01,与对照组比较;b:P < 01,与过表达hTERT组比较; B:Western blot检测MMP-2、MMP-9蛋白表达 图 4 qRT-PCR和Western blot检测各组SGC-7901细胞FOXM1下游靶基因的mRNA及蛋白表达 |
2.4 hTERT不影响FOXM1的转录变化
采用qRT-PCR和双荧光素酶报告基因检测过表达hTERT后FOXM1 mRNA及启动子活性变化。结果发现:过表达hTERT没有影响FOXM1 mRNA表达(过表达hTERT组vs对照组: 1.23±0.15 vs 1.01±0.11,P>0.05)。双荧光素酶报告基因实验发现:hTERT也没有改变FOXM1启动子活性(过表达hTERT组vs对照组: 1.00±0.04 vs 1.00±0.00,P>0.05)。据此推测,hTERT有可能通过影响FOXM1的翻译后修饰,从而促进其蛋白表达。
2.5 hTERT促进FOXM1蛋白乙酰化用HA-FOXM1慢病毒稳定感染SGC-7901细胞后,进一步通过转染hTERT表达质粒,再检测hTERT对FOXM1蛋白乙酰化修饰的影响。免疫荧光实验发现hTERT和FOXM1存在细胞共定位(图 5)。免疫共沉淀实验发现hTERT过表达显著促进了FOXM1的蛋白乙酰化水平(图 6)。推测hTERT有可能通过募集某乙酰转移酶,与FOXM1蛋白形成三聚蛋白复合体,最终促进了FOXM1的乙酰化修饰及其蛋白稳定性。
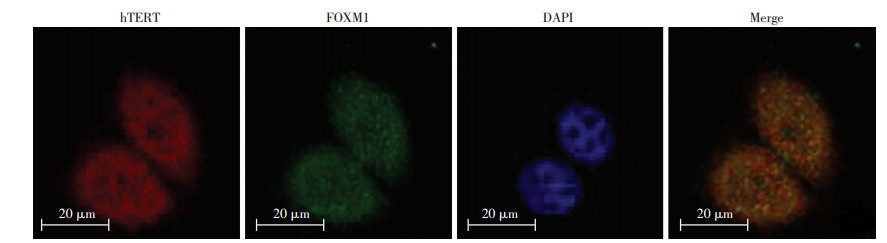
|
| 图 5 免疫荧光观察hTERT和FOXM1定位 |
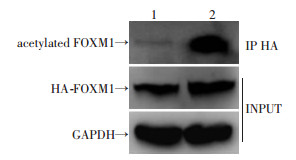
|
| 1:对照组;2:过表达hTERT组 图 6 免疫共沉淀检测FOXM1蛋白乙酰化水平 |
3 讨论
肿瘤细胞侵袭转移是患者不良预后的重要原因。本研究在胃癌细胞中稳定过表达hTERT,发现胃癌细胞侵袭能力明显增强,在此细胞株中干扰FOXM1后,可部分逆转这一效应。这一结果说明,hTERT可通过FOXM1促进胃癌细胞侵袭。进一步研究证实:过表达hTERT促进FOXM1蛋白表达,同时也上调了FOXM1下游靶基因MMP-2、MMP-9等基因的表达,干扰FOXM1后上述相关基因表达下调,说明hTERT通过调节FOXM1及其下游侵袭相关基因,进而影响了胃癌细胞的生物学行为。本研究探讨了hTERT调控FOXM1的机制,发现过表达hTERT以后,FOXM1乙酰化水平也随之上调;以上结果提示:hTERT有可能通过调控FOXM1蛋白乙酰化进而影响了胃癌细胞侵袭转移能力。
细胞外基质及其特化形成的基底膜,是实体肿瘤细胞发生远处转移首先要突破的一道“障碍”,其主要成分为糖胺聚糖、结构蛋白、纤连蛋白等。肿瘤细胞可以通过分泌多种蛋白酶,比如基质金属蛋白酶、组织蛋白酶、蛋白裂解酶、肝素酶等,分解这一“障碍”,进而促进其转移。其中研究得比较多且最重要的一类蛋白酶是基质金属蛋白酶;比如,MMP-9可分解基底膜的主要成分Ⅳ型胶原蛋白进而促进肿瘤细胞侵袭转移。hTERT促进肿瘤细胞侵袭的机制研究并不多,其机制也相当复杂。既往课题组研究表明:不表达hTERT的U2OS细胞中转染hTERT质粒可促进其侵袭,直接证实了hTERT可以促进肿瘤细胞侵袭能力[19]。也有研究表明[20]:hTERT可以通过早期生长反应因子-1(early growth response, EGR-1)促进组织蛋白酶-D的表达,进一步促进了肿瘤细胞的侵袭。本研究发现:在胃癌细胞中,hTERT可上调FOXM1的蛋白水平,进而促进MMP-2、MMP-9表达,并最终增强了胃癌细胞侵袭能力。
翻译后修饰(post-translational modification,PTM),是指蛋白质翻译中或翻译后的化学修饰。它可以发生在蛋白质的氨基酸侧链、蛋白质C末端或N末端,改变蛋白质的酶活性、亚细胞定位、相互作用、DNA结合能力及蛋白稳定性。本研究发现:hTERT可上调FOXM1的蛋白表达,但并不影响其启动子活性及转录,说明hTERT有可能通过翻译后修饰调控FOXM1。研究表明:FOXM1翻译后修饰主要有磷酸化、甲基化、乙酰化等[21-23]。FOXM1磷酸化可影响其亚细胞定位,甲基化可影响其转录活性;例如,STED可直接与FOXM1结合,并促进其甲基化,进而上调其对表皮生长因子的转录。LV等[23]的研究发现:乙酰基转移酶P300/CBP可促进FOXM1赖氨酸残基K63、K422、K440、K603、K614等位点乙酰化,进而促进FOXM1蛋白稳定性及转录活性。本研究发现:过表达hTERT以后,FOXM1乙酰化水平也随之增加。根据以上分析,hTERT很有可能是通过调节了FOXM1乙酰化,进而影响其蛋白稳定性及转录活性。通过生物信息学网站(网址:http://bioinfo.bjmu.edu.cn/huac/,http://bioinfo.ncu.edu.cn/inquiries_PLMLA.aspx,http://www.bioinfo.bio.cuhk.edu.hk/bpbphka.jsp)进一步研究发现:FOXM1赖氨酸残基K12、K63、K105、K144、K274、K282、K356、K443、K514、K515、K599、K603位点可能发生乙酰化,因此,本课题组后续将研究FOXM1的具体乙酰化位点。人源乙酰化酶有5个家族:P300/CBP家族、MYST蛋白复合物、GNAT家族、一般转录因子、核受体辅助因子,每一个家族又包含了多个不同的乙酰化酶;同时,去乙酰化酶有ClassⅠ、ClassⅡ、ClassⅢ、ClassⅣ 4类,其中Ⅰ、Ⅱ、Ⅳ类可以被曲古柳菌素(trichostatin A, TSA)所抑制,Ⅲ类可以被尼克酰胺(nicotinamide, NAM)所抑制。后续课题组将应用上述分子抑制剂及相关乙酰化酶的干扰策略,进一步阐明促进FOXM1乙酰化发生的关键酶,并探讨hTERT与该关键乙酰化酶的相互作用情况,从而揭示hTERT促进FOXM1乙酰化的具体分子机制。本课题研究的不足之处在于:在这一现象中是端粒酶逆转录活性还是非逆转录酶活性在发挥主要作用尚未阐明。本课题组拟构建端粒酶逆转录酶活性区突变细胞株,进一步证实hTERT在调控FOXM1中的分子机制。
综上所述,在胃癌细胞系中,hTERT可能通过上调FOXM1乙酰化、促进FOXM1蛋白表达,进而促进了胃癌细胞的侵袭能力。然而hTERT是如何引起FOXM1乙酰化改变有待后续实验进一步研究。本研究为靶向hTERT的防治胃癌侵袭转移策略提供了新依据。
| [1] | WHO. World Health Rankings:Stomach cancer [EB/OL]. [2017-08-22]. |
| [2] | ZHENG R, ZENG H, ZHANG S, et al. National estimates of cancer prevalence in China, 2011[J]. Cancer Lett, 2016, 370(1): 33–38. DOI:10.1016/j.canlet.2015.10.003 |
| [3] | ZHU L, QIN J, WANG J, et al. Early gastric cancer: current advances of endoscopic diagnosis and treatment[J]. Gastroenterol Res Pract, 2016, 2016: 9638041. DOI:10.1155/2016/9638041 |
| [4] | XU Y, HUA J, LI J, et al. Laparoscopic versus open gastrectomy for gastric cancer with serous invasion: long-term outcomes[J]. J Surg Res, 2017, 215: 190–195. DOI:10.1016/j.jss.2017.03.048 |
| [5] | QIN Y, GUO H, TANG B, et al. The non-reverse transcriptase activity of the human telomerase reverse transcriptase promotes tumor progression (review)[J]. Int J Oncol, 2014, 45(2): 525–531. DOI:10.3892/ijo.2014.2470 |
| [6] | ZHOU J, DING D, WANG M, et al. Telomerase reverse transcriptase in the regulation of gene expression[J]. BMB Rep, 2014, 47(1): 8–14. DOI:10.5483/bmbrep.2014.47.1.284 |
| [7] | KHATTAR E, KUMAR P, LIU C Y, et al. Telomerase reverse transcriptase promotes cancer cell proliferation by augmenting tRNA expression[J]. J Clin Invest, 2016, 126(10): 4045–4060. DOI:10.1172/JCI86042 |
| [8] | LIN G, CHEN T, ZOU J, et al. Quantum dots-siRNA nanoplexes for gene silencing in central nervous system tumor cells[J]. Front Pharmacol, 2017, 8: 182. DOI:10.3389/fphar.2017.00182 |
| [9] | CHAKRABARTI M, BANIK N L, RAY S K. Sequential hTERT knockdown and apigenin treatment inhibited invasion and proliferation and induced apoptosis in human malignant neuroblastoma SK-N-DZ and SK-N-BE2 cells[J]. J Mol Neurosci, 2013, 51(1): 187–198. DOI:10.1007/s12031-013-9975-x |
| [10] | CHEN P C, PENG J R, HUANG L, et al. Overexpression of human telomerase reverse transcriptase promotes the motility and invasiveness of HepG2 cells in vitro[J]. Oncol Rep, 2013, 30(3): 1157–1164. DOI:10.3892/or.2013.2563 |
| [11] | HU C, NI Z, LI B S, et al. hTERT promotes the invasion of gastric cancer cells by enhancing FOXO3a ubiquitination and subsequent ITGB1 upregulation[J]. Gut, 2017, 66(1): 31–42. DOI:10.1136/gutjnl-2015-309322 |
| [12] | WIERSTRA I. FOXM1 (Forkhead box M1) in tumorigenesis: overexpression in human cancer, implication in tumorigenesis, oncogenic functions, tumor-suppressive properties, and target of anticancer therapy[J]. Adv Cancer Res, 2013, 119: 191–419. DOI:10.1016/B978-0-12-407190-2.00016-2 |
| [13] | HU C, LIU D, ZHANG Y, et al. LXRα-mediated downregulation of FOXM1 suppresses the proliferation of hepatocellular carcinoma cells[J]. Oncogene, 2014, 33(22): 2888–2897. DOI:10.1038/onc.2013.250 |
| [14] | YU M, TANG Z, MENG F, et al. Elevated expression of FoxM1 promotes the tumor cell proliferation in hepatocellular carcinoma[J]. Tumour Biol, 2016, 37(1): 1289–1297. DOI:10.1007/s13277-015-3436-9 |
| [15] | NAKAMURA S, HIRANO I, OKINAKA K, et al. The FOXM1 transcriptional factor promotes the proliferation of leukemia cells through modulation of cell cycle progression in acute myeloid leukemia[J]. Carcinogenesis, 2010, 31(11): 2012–2021. DOI:10.1093/carcin/bgq185 |
| [16] | DAI B, KANG S H, GONG W, et al. Aberrant FoxM1B expression increases matrix metalloproteinase-2 transcription and enhances the invasion of glioma cells[J]. Oncogene, 2007, 26(42): 6212–6219. DOI:10.1038/sj.onc.1210443 |
| [17] | JIN H, LI X J, PARK M H, et al. FOXM1-mediated downregulation of uPA and MMP9 by 3, 3′-diindolylmethane inhibits migration and invasion of human colorectal cancer cells[J]. Oncol Rep, 2015, 33(6): 3171–3177. DOI:10.3892/or.2015.3938 |
| [18] | DING D, XI P, ZHOU J, et al. Human telomerase reverse transcriptase regulates MMP expression independently of telomerase activity via NF-κB-dependent transcription[J]. FASEB J, 2013, 27(11): 4375–4383. DOI:10.1096/fj.13-230904 |
| [19] | YU S T, CHEN L, WANG H J, et al. hTERT promotes the invasion of telomerase-negative tumor cells in vitro[J]. Int J Oncol, 2009, 35(2): 329–336. |
| [20] | YANG L, CUI M, ZHANG L, et al. FOXM1 facilitates gastric cancer cell migration and invasion by inducing cathepsin D.[J]. Oncotarget, 2017. DOI:10.18632/oncotarget.19254 |
| [21] | MAJOR M L, LEPE R, COSTA R H. Forkhead box M1B transcriptional activity requires binding of Cdk-cyclin complexes for phosphorylation-dependent recruitment of p300/CBP coactivators[J]. Mol Cell Biol, 2004, 24(7): 2649–2661. DOI:10.1128/mcb.24.7.2649-2661.2004 |
| [22] | COHN O, FELDMAN M, WEIL L, et al. Chromatin associated SETD3 negatively regulates VEGF expression[J]. Sci Rep, 2016, 6: 37115. DOI:10.1038/srep37115 |
| [23] | LV C, ZHAO G, SUN X, et al. Acetylation of FOXM1 is essential for its transactivation and tumor growth stimulation[J]. Oncotarget, 2016, 7(37): 60366–60382. DOI:10.18632/oncotarget.11332 |



