急性肝损伤是由多种原因导致的肝功能异常,如病毒感染,滥用药物、酒精,摄取有毒物质等。提高肝细胞存活率被认为是治疗各种急性肝损伤和急性肝衰竭的有效方法之一[1-2]。肝细胞膜破裂是肝细胞损伤的主要病理基础[2]。细胞膜修复蛋白MG53是由477个氨基酸组成的Tripartite motif家族成员之一,其结构包含3个结构域,从N端到C端分别是锌指结构域、B-box和卷曲螺旋结构[3-4],特异性表达于心肌与骨骼肌细胞。以往研究发现:在细胞膜受到损伤后,MG53可由细胞浆向细胞膜转移,聚集于胞膜破损处,封闭胞膜缺口,修复细胞膜[5-6]。给予腺相关病毒过表达MG53和外源性给予rhMG53可以通过膜修复功能促进细胞的存活,达到治疗心、脑、肾损伤的作用[7-11]。但是,MG53是否可以修复受损的肝细胞膜,对急性肝损伤有无保护作用少见报道。因此,本研究通过相关指标的检测来探讨rhMG53对CCl4诱导的急性肝损伤的保护作用,探索治疗急性肝损伤新的靶点与方法。
1 材料与方法 1.1 实验材料人肝癌细胞(HepG2)购自美国ATCC细胞库;rhMG53和兔源MG53抗体均由美国俄亥俄州立大学麻建杰教授提供;DMEM/F12培养基、FBS胎牛血清购自美国Gibco公司;ALT、AST、LDH、DAPI、CCK-8试剂盒为美国Sigma公司产品;花生油为市售商品;CCl4、戊巴比妥钠、PBS、多聚甲醛等均为市售分析纯。
1.2 动物模型制备选取12周龄SPF级雄性健康C57小鼠40只,体质量25~30 g,由第三军医大学大坪医院野战外科研究所实验动物中心提供。采用完全随机化分组法分为4组:对照组、rhMG53组、CCl4组、rhMG53+CCl4组,每组10只。用微量移液器取20 μL CCl4加入20 mL花生油中,混合均匀,配制成浓度为0.1%的CCl4花生油溶液,于通风橱操作,现用现配。rhMG53 2 mg溶于20 mL生理盐水中,配成0.1 mg/mL溶液,于超净台操作,现配现用。CCl4组、rhMG53+CCl4组小鼠予0.1% CCl4花生油溶液2 mL/kg腹腔内注射,rhMG53+CCl4组在注射CCl4前30 min予rhMG53 1 mg/kg肌肉注射。MG53组予rhMG53 1 mg/kg肌肉注射。动物正常进食、进水。所有动物实验符合实验动物伦理法案。
1.3 肝功能检测小鼠正常进食、进水24 h后,经眼球静脉丛取血,3 000 r/min离心10 min,分离血清,检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)水平。
1.4 形态学观察取小鼠部分肝脏右叶,多聚甲醛固定,常规脱水,石蜡包埋,切片,HE染色,光学显微镜下观察肝组织病理改变。采用Image-Pro Plus软件计算坏死面积。
1.5 细胞培养及处理采用含5 mmol/L葡萄糖、10%胎牛血清的DMEM/F12培养基在37 ℃、5%CO2条件下培养HepG2细胞。将处于对数生长期的细胞进行胰酶消化, 接种至12孔及96孔细胞培养板中。12孔板中预先放入细胞爬片,接种HepG2细胞数0.5×106/孔,96孔板细胞数约5 000/mL。
1.5.1 药物处理细胞后观察细胞活力96孔板HepG2细胞在37 ℃、5%CO2条件下培养24 h。加药时使用含1%胎牛血清的DMEM/F12细胞培养基。加入不同试剂处理细胞:①对照组,不做特殊处理;②CCl4组,吸取CCl4溶于适量含1%胎牛血清的DMEM/F12培养基中,以少量的二甲亚砜助溶,二甲亚砜终浓度为0.1%(体积分数),配成终浓度为20 mmol/L的CCl4溶液;③rhMG53+CCl4组, 分别加入rhMG53 5、10、20、30、50 μg/mL,30 min后分别加入CCl4配成终浓度为20 mmol/L的CCl4溶液。于37 ℃、5%CO2条件下培养,分别于培养1、3、6、12、24 h,采用CCK-8检测细胞活力。每组设1组副孔。每孔加入10 μL CCK-8溶液。在细胞培养箱内继续孵育0.5 h, 使用酶标仪在波长450 nm处测定光密度值[D(450)]。细胞活力=各实验组D(450)值/对照组D(450)值×100%。重复实验3次。
1.5.2 HepG2细胞免疫荧光染色HepG2细胞在12孔板37 ℃、5%CO2条件下培养24 h。换取含1%胎牛血清的DMEM/F12细胞培养基30 min。加入不同试剂处理细胞,分别为:①对照组,不做特殊处理;②FITC-rhMG53组(20 μg/mL);③CCl4组(20 mmol/L);④FITC-rhMG53+CCl4组,FITC标记的rhMG53 (20 μg/mL)溶液,预处理30 min后加入CCl4(20 mmol/L);⑤FITC-rhMG53+MG53Ab+CCl4组,FITC标记的rhMG53和MG53抗体(1 :100)4 ℃中和过夜,蛋白抗体复合物预处理30 min后加入CCl4(20 mmol/L);⑥FITC-rhMG53灭活+CCl4组,FITC标记的rhMG53 100 ℃水浴30 min灭活,预处理30 min后加入CCl4(20 mmol/L);在37 ℃、5% CO2条件下孵育30 min。取细胞爬片于载玻片上,4%多聚甲醛固定(30 min)。DAPI对细胞核进行染色。激光共聚焦显微镜获得免疫荧光共聚焦图像。
1.6 统计学分析采用SPSS 17.0统计软件。计量资料以x±s表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK法。检验水准:α=0.05。
2 结果 2.1 rhMG53减轻CCl4诱导的小鼠肝功能损伤与对照组比较, CCl4组的小鼠血清中ALT、AST、LDH升高非常明显(P < 0.05), 表明CCl4成功诱导小鼠急性肝损伤模型。与CCl4组比较,rhMG53+CCl4组小鼠血清ALT、AST、LDH活性显著降低(P < 0.05,图 1),提示rhMG53对CCl4诱导的急性肝损伤小鼠具有保护作用。
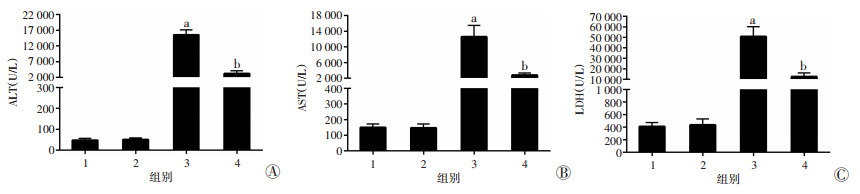
|
| 1:对照组;2:rhMG53组;3:CCl4组;4:rhMG53+CCl4组;a: P < 0.05,与对照组以及rhMG53组比较;b: P < 0.05,与CCl4组比较 图 1 rhMG53减轻CCl4诱导的小鼠血清ALT(A)、AST(B)、LDH(C)水平变化 |
2.2 rhMG53改善CCl4诱导的小鼠肝脏的病理结构
对照组小鼠肝组织结构清晰可见, 肝小叶结构完整,肝细胞大小一致, 形态正常,肝细胞索呈放射状, 排列有序, 汇管区无变性、坏死及炎症细胞浸润。CCl4组肝脏中央静脉周围的肝细胞索不明显, 肝细胞肿胀呈气球样变, 胞浆疏松化, 核深染;肝实质较多炎细胞浸润, 可见点片状坏死、桥状坏死。rhMG53+CCl4组肝细胞肿胀、坏死明显减轻,偶见点状坏死,汇管区只有少量炎细胞浸润(图 2)。与CCl4组比较,rhMG53+CCl4组肝细胞炎性浸润及细胞变性明显减轻,坏死面积明显减少(P < 0.05),rhMG53组和对照组比较差异无统计学意义(P>0.05,图 3)。提示rhMG53可改善CCl4诱导的小鼠肝脏损伤的病理结构。

|
| A:对照组;B:rhMG53组;C:CCl4组;D:rhMG53+CCl4组 图 2 各组小鼠肝组织病理学变化(HE ×20) |
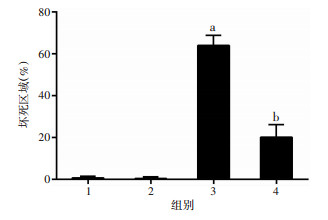
|
| 1:对照组; 2:rhMG53组; 3:CCl4组; 4:rhMG53+CCl4组;a: P < 0.05,与对照组以及rhMG53组比较;b: P < 0.05,与CCl4组比较 图 3 rhMG53减少CCl4诱导的小鼠肝脏坏死面积 |
2.3 rhMG53减轻CCl4诱导的HepG2细胞损伤
CCl4组HepG2细胞活力明显下降,rhMG53+CCl4组HepG2细胞活力下降程度明显减轻;CCl4组HepG2细胞活力随时间延长逐渐降低(P < 0.05),rhMG53+CCl4组HepG2细胞活力随rhMG53剂量的增加逐渐升高(P < 0.05);CCl4组、rhMG53+CCl4组HepG2细胞活力均有时间依赖性(P < 0.05,图 4)。
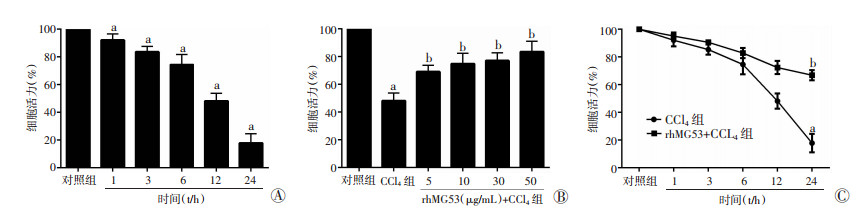
|
|
a: P < 0.05,与对照组比较;b: P < 0.05,与CCl4组比较 A:CCl4组HepG2细胞活力变化;B:不同浓度rhMG53+CCl4处理HepG2细胞12 h细胞活力变化;C: CCl4组、rhMG53(20 μg/mL)+ CCl4组HepG2细胞活力变化 图 4 rhMG53改善CCl4诱导的HepG2细胞活力下降 |
2.4 rhMG53修复CCl4引起的细胞膜损伤
激光共聚焦显微镜下可见:FITC标记rhMG53呈绿色荧光,DAPI标记细胞核呈蓝色荧光。与对照组比较,CCl4组HepG2细胞损伤明显,rhMG53+CCl4组HepG2细胞膜可见MG53聚集,修复细胞膜。仅用FITC标记的rhMG53处理的细胞没有发现绿色荧光,未使用FITC标记的rhMG53处理的细胞也没有显示绿色荧光。为明确rhMG53蛋白是否对荧光具有非特异吸附作用,采用FITC标记的rhMG53和MG53抗体(1 :100)4℃中和过夜和FITC标记的rhMG53 100 ℃水浴30 min灭活实验发现:细胞膜上未见FITC荧光(图 5),表明rhMG53具有特异向膜富集修复损伤细胞膜的生物学功能。
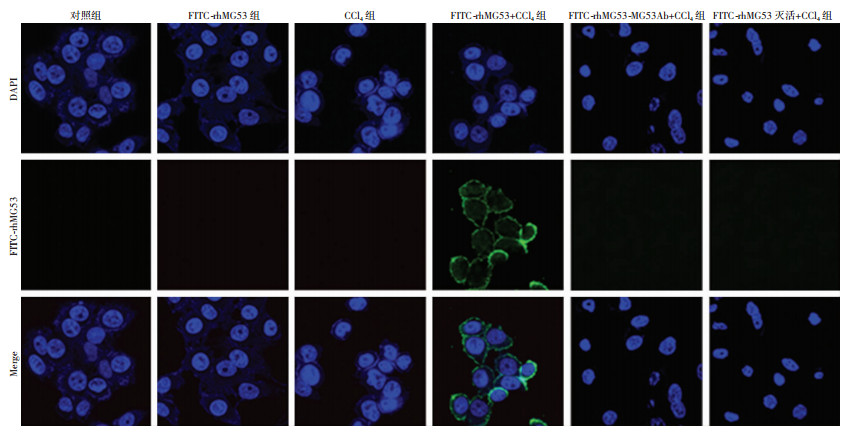
|
| 图 5 MG53修复CCl4引起的细胞膜损伤(激光共聚焦显微镜×100) |
3 讨论
肝损伤是世界范围内日益严重的问题。特别是在西方世界,酒精、药物等因素导致急性肝损伤发病率逐年增加[12]。CCl4诱导急性肝损伤是广泛应用的研究肝毒性机制的模型。有研究表明:CCl4进入体内后,其在肝滑面内质网代谢,分解成为三氯甲基自由基和氯自由基,具有自由基的三氯甲基自由基可通过共用电子和P450磷脂部分发生反应,继而与膜脂质和蛋白质大分子进行共价结合,使蛋白质代谢障碍,引起膜结构和功能完整性的破坏。最终导致肝细胞质中可溶性溶酶ALT、AST、LDH从肝细胞内释放入血, 导致血清ALT、AST、LDH升高[13]。血清可溶性溶酶ALT、AST、LDH是监测肝功能的敏感指标。本实验采用的给予0.1%CCl4花生油溶液2 mL/kg即能引起典型的肝细胞损伤,血清ALT、AST、LDH活性即显著升高,24 h后中央静脉周围出现广泛坏死。
MG53(也称为TRIM72)是心肌和骨骼肌特异性的具有多种生物功能的三重结构域蛋白(tripartite Motif,TRIM)家族成员,是涉及多器官重要生理和病理过程的多功能蛋白,是各种人类疾病有希望的治疗靶点[14]。MG53通过不同的机制参与各种组织的多种生理和病理功能的调节。MG53是质膜完整性的必要条件,是质膜修复的中心部分[4]。正常情况下,血液中的MG53不聚集到细胞膜,在细胞膜受损伤时MG53富集于细胞膜修复细胞膜缺损[5]。静脉注射rhMG53可以改善骨骼肌损伤,包括毒性化合物(心脏毒素VⅡ4)、遗传性肌肉疾病(mdx小鼠)、缺血再灌注(I/R)和烧伤[3, 5]。小鼠肌肉注射rhMG53后血液中能检测到MG53,在注射后4 h达最高峰[3]。CAO等[7]研究发现,除了膜修复外,MG53是细胞内心脏保护性信号通路的关键介质,对心脏缺血预处理保护是不可缺少的。rhMG53可保护心脏免受I/R损伤[6-8]。在缺血前或缺血后静脉注射rhMG53,减少猪心脏梗死面积和肌钙蛋白Ⅰ释放[8]。在肺中,MG53在Ⅰ型和Ⅱ型肺泡上皮细胞上表达;内源性MG53的过表达和应用rhMG53促进肺泡上皮细胞修复,预防肺损伤[9]。与WT相比,mg53-/-小鼠中I/R诱导的肾损伤明显加重。静脉注射rhMG53消除I/R及化疗药物诱导的肾损伤,MG53表现出肾脏保护作用[10]。rhMG53蛋白质有助于修复脑缺血再灌注损伤;外源性rhMG53蛋白可以保护培养的神经元免受缺氧/再氧化诱导的损伤[11]。在体内模型中,rhMG53蛋白显著促进伤口愈合并防止组织损伤[15]。生理条件下,MG53在肝脏中不能检测到,而在缺血再灌注等应激刺激的诱导下,MG53在肝脏中有表达,外源性rhMG53给药后,MG53蛋白在损伤肝脏中的表达显著增加[16]。
本研究在在体研究中先予1 mg/kg rhMG53肌肉注射,再给予CCl4腹腔注射诱导急性肝损伤的小鼠,24 h后血清可溶性酶ALT、AST、LDH的升高明显减轻,炎性细胞浸润下降,肝脏坏死面积明显减少。在离体研究中, 以HepG2细胞为研究对象, 选择CCl4作为肝细胞损伤因素, 观察rhMG53是否对CCl4损伤肝脏细胞具有保护效应。结果显示:给予不同浓度的rhMG53能够明显抑制CCl4引起的细胞活力下降效应, 并呈现一定浓度依赖性, 其中抑制CCl4介导的活性下降最大幅度改善73%左右。为了进一步探讨rhMG53抑制CCl4引起的细胞活力下降的原因, 采用了FITC标记的rhMG53与CCl4共作用于HepG2细胞,荧光显微镜显示外源性rhMG53富集于细胞膜。为明确是否为rhMG53蛋白对荧光的非特异吸附,本研究采用FITC标记的rhMG53和MG53抗体中和实验和FITC标记的rhMG53灭活实验发现:细胞膜上未见FITC荧光,表明rhMG53具有特异向膜富集修复损伤细胞膜的生物学功能。既往研究表明:MG53可以结合组织损伤部位暴露的磷脂酰丝氨酸,减少细胞凋亡保护损伤细胞[10]。当然,不能排除MG53可能具有直接对抗氧化酶或抗凋亡因子从而减少肝细胞坏死的可能性,是否还有其他能够招募MG53结合到肝细胞膜的特定蛋白质也需要进一步研究。
本研究发现在MG53存在下,CCl4诱导的小鼠肝功能损伤明显减轻,肝脏坏死面积明显减少。CCl4导致HepG2细胞损伤,预先加入MG53的HepG2细胞活力下降明显减轻。MG53可修复CCl4导致的HepG2细胞膜损伤。实验证明MG53对CCl4诱导的肝损伤具有明显的保护作用。该发现将有助于进一步阐明肝脏损伤的分子机制,为急性肝损伤的治疗提供新的靶点和策略。
| [1] | KHOURY T, RMEILEH A A, YOSHA L, et al. Drug innduced liver injury: review with a focus on genetic factors, tissue diagnosis, and treatment options[J]. J Clin Transl Hepatol, 2015, 3(2): 99–108. DOI:10.14218/JCTH.2015.00007 |
| [2] | OH I S, PARK S H. Immune-mediated liver injury in hepatitis B virus infection[J]. Immune Netw, 2015, 15(4): 191–198. DOI:10.4110/in.2015.15.4.191 |
| [3] | WEISLEDER N, TAKIZAWA N, LIN P, et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy[J]. Sci Transl Med, 2012, 4(139): 139ra85. DOI:10.1126/scitranslmed.3003921 |
| [4] | CAI C, MASUMIYA H, WEISLEDER N, et al. MG53 nucleates assembly of cell membrane repair machinery[J]. Nat Cell Biol, 2009, 11(1): 56–64. DOI:10.1038/ncb1812 |
| [5] | ZHU H, HOU J, ROE J L, et al. Amelioration of ischemia-reperfusion-induced muscle injury by the recombinant human MG53 protein[J]. Muscle Nerve, 2015, 52(5): 852–858. DOI:10.1002/mus.24619 |
| [6] | WANG X, XIE W, ZHANG Y, et al. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair[J]. Circ Res, 2010, 107(1): 76–83. DOI:10.1161/CIRCRESAHA.109.215822 |
| [7] | CAO C M, ZHANG Y, WEISLEDER N, et al. MG53 constitutes a primary determinant of cardiac ischemic preconditioning[J]. Circulation, 2010, 121(23): 2565–2574. DOI:10.1161/CIRCULATIONAHA.110.954628 |
| [8] | LIU J, ZHU H, ZHENG Y, et al. Cardioprotection of recombinant human MG53 protein in a porcine model of ischemia and reperfusion injury[J]. J Mol Cell Cardiol, 2015, 80: 10–19. DOI:10.1016/j.yjmcc.2014.12.010 |
| [9] | JIA Y, CHEN K, LIN P, et al. Treatment of acute lung injury by targeting MG53-mediated cell membrane repair[J]. Nat Commun, 2014, 5: 4387. DOI:10.1038/ncomms5387 |
| [10] | DUANN P, LI H, LIN P, et al. MG53-mediated cell membrane repair protects against acute kidney injury[J]. Sci Transl Med, 2015, 7(279): 279ra36. DOI:10.1126/scitranslmed.3010755 |
| [11] | YAO Y G, ZHANG B, ZHU H, et al. MG53 permeates through blood-brain barrier to protect ischemic brain injury[J]. Oncotarget, 2016, 7(16): 22474–22485. DOI:10.18632/oncotarget.7965 |
| [12] | CUBERO F J, ZOUBEK M E, HU W, et al. Combined activities of JNK1 and JNK2 in hepatocytes protect against toxic liver injury[J]. Gastroenterology, 2016, 150(4): 968–981. DOI:10.1053/j.gastro.2015.12.019 |
| [13] | WEBER L W, BOLL M, STAMPFL A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model[J]. Crit Rev Toxicol, 2003, 33(2): 105–136. DOI:10.1080/713611034 |
| [14] | ZHANG Y, WU H K, LV F, et al. MG53: biological function and potential as a therapeutic target[J]. Mol Pharmacol, 2017, 92(3): 211–218. DOI:10.1124/mol.117.108241 |
| [15] | LI H, DUANN P, LIN P H, et al. Modulation of wound healing and scar formation by MG53 protein-mediated cell membrane repair[J]. J Biol Chem, 2015, 290(40): 24592–24603. DOI:10.1074/jbc.M115.680074 |
| [16] | YAO W, LI H, HAN X, et al. MG53 anchored by dysferlin to cell membrane reduces hepatocyte apoptosis which induced by ischaemia/reperfusion injury in vivo and in vitro[J]. J Cell Mol Med, 2017. DOI:10.1111/jcmm.13171 |



