2. 313000 浙江 湖州,解放军第九八医院:骨科;
3. 313000 浙江 湖州,解放军第九八医院:神经外科
2. Department of Orthopedics, No. 98 Hospital of PLA, Huzhou, Zhejiang Province, 313000, China;
3. Department of Neurosurgery, No. 98 Hospital of PLA, Huzhou, Zhejiang Province, 313000, China
骨骼系统和造血系统是两个独立的系统,均起源于骨髓腔,两个系统来源的细胞能够在局部相互影响[1]。研究表明,骨髓造血干细胞来源的巨核细胞及其相关分泌因子对骨骼代谢平衡起着重要作用[2-3]。巨核细胞可以通过整合素β1,激活成骨细胞p38/MAPKAPK2/p90RSK级联信号,增加c-fos和cyclin A表达,降低细胞周期G1期比例,从而促进成骨细胞增殖[3]。小鼠体内敲除巨核细胞分化关键因子GATA-1或NF-E2后,巨核细胞数量增加,血小板水平减少,最终导致骨量显著增加[4-6],原因可能与促血小板生成素(thrombopoietin, TPO)通过其受体(C-Mpl)增加巨核细胞数量及巨核细胞分泌的成骨细胞因子相关[1, 7-8]。有研究表明过表达TPO引起骨髓腔内巨核细胞数量增加,出现骨硬化表型[9]。C-Mpl在造血干细胞和巨核细胞表面表达。PERRY等[10]发现,与野生型(WT)小鼠比较,2月龄C-Mpl敲除小鼠(C-Mpl-/-)体内巨核细胞数量下降约80%,但骨量差异无统计学意义。本研究观察C-Mpl敲除后对骨量和骨生长的影响,初步探讨其可能机制,以期为进一步研究C-Mpl与骨代谢的相互作用提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂α-MEM培养基购自美国HyClone公司,AnnexinV-FITC细胞凋亡检测试剂盒和活性氧检测试剂盒购自碧云天生物技术有限公司,TRAP染色试剂盒购自南京建成生物公司,M-CSF和RANKL购自美国RD公司。
1.1.2 实验动物6月龄雄性SPF级C-Mpl-/-小鼠8只,体质量(26.1±4.4)g;同窝野生型C57BL/6J小鼠8只,体质量(25.9±4.7)g,来自美国Jackson实验室,饲养繁殖于第三军医大学SPF级实验动物中心,相对湿度51%~59%, 室温(22±3) ℃,自由进食、水。
1.2 方法 1.2.1 实验动物的分组与处理选择同期出生的小鼠(6月龄),分为WT组和C-Mpl-/-组,每组8只。眼球取血后,断颈处死,取出双侧股骨,左侧股骨用生理盐水纱布包裹后,置于4 ℃冰箱,用于生物力学检测。右侧股骨4%多聚甲醛固定,行Micro-CT扫描,完成后行石蜡包埋或树脂包埋。
1.2.2 Micro-CT扫描将股骨放入小动物Micro-CT扫描仪(SkyScan,德国Bruker公司)的样品管中扫描和三维重建。扫描参数:电压70 kV,电流120 μA,分辨率10 μm。从股骨远端生长板消失后15层开始,向股骨近端取80层(800 μm)为骨小梁和重建区域。分析指标主要有骨密度(BMD)、骨体积与组织体积比(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁分离度(Tb.Sp)和结构模型指数(SMI)。
1.2.3 长骨生物力学分析应用ELectro全电脑控制测试机,将股骨水平放置于跨距支架上,然后以0.05 mm/s的速度垂直向下压缩股骨中段,直至股骨折断,每0.01秒记录1次压力及弯曲位移数据。绘制出应力-位移曲线,计算得出断裂载荷和刚度。
1.2.4 硬组织切片和Vonkossa染色采用德国Leica硬组织切片机对树脂包埋块常规切片,厚度30 μm,进行Von Kossa染色,观察骨矿化情况。
1.2.5 石蜡切片、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色股骨标本固定后,经EDTA室温脱钙14 d,常规梯度酒精脱水后石蜡包埋,采用德国Leica切片机进行石蜡组织切片,厚度4 μm, 60 ℃烘干进行TRAP染色,观察破骨细胞情况。
1.2.6 原代成骨细胞(osteoblast, OB)和破骨细胞(osteoclast, OC)的分离[11]、细胞凋亡、活性氧检测成骨细胞:处死新生2~3 d的小鼠,剪开鼠头,剪取颅骨本质部分,去除所有软组织,加入胶原酶Ⅱ溶液,37 ℃摇床孵育10 min,重复5次,针式过滤器过滤细胞,α-MEM培养基重悬细胞,每3天传代1次,选取P1代细胞进行实验。破骨细胞:断颈处死6月龄小鼠,取出股骨和胫骨,冲出全骨髓细胞。2×106/mL全骨髓细胞用α-MEM培养基(10% FCS+50 ng/mL M-CSF+50 ng/mL RANKL)培养,每3天换液1次,培养10 d,直至破骨细胞形成。收集细胞,使用凋亡和活性氧检测试剂盒处理样本,随后使用BD ACCuri C6进行检测。
1.2.7 茜素红染色PBS漂洗细胞3次,4%多聚甲醛固定25 min,PBS洗净,加入1%茜素红染液室温染色30 min,吸尽染液后用PBS漂洗细胞3 min×3次,晾干后扫描成像。
1.2.8 qPCR检测TRIzol裂解细胞,提取细胞总RNA,采用TaKaRa试剂盒,步骤见说明书。利用Cq值相对定量。FoxO1引物上游:5′-CCCAGGCCGGAG-TTTAACC-3′,下游:5′-GTTGCTCATAAAGTCGGTGCT-3′,片段大小132 bp;Nrf2引物上游:5′-ACCAAGGGGCACCATATG-3′,下游5′-CTTCGCCGAGTTGCACTCA-3′,片段大小114 bp。
1.2.9 Western blot检测收集细胞,提取蛋白并用BCA法进行蛋白定量,变性,进行SDS-PAGE电泳、PVDF转印。5%脱脂奶粉封闭,加入一抗(p38 1 :500,p-p38 1 :500,FoxO1 1 :500,Nrf2 1 :500,β-actin 1 :1 000),4 ℃孵育过夜。加入二抗(1 :3 000)37 ℃孵育,于Bio-Rad多功能成像系统显影成像。用Image J软件扫描灰度值,分析蛋白质相对表达量。
1.3 图像采集与处理组织切片的各种染色完成后,均于Olympus BX51倒置显微镜下观察,并利用其内置的彩色数码相机采集相关图像。明确破骨细胞阳性标准:胞浆呈酒红色且附着于骨质边缘;随机选择10个小鼠切片的高倍视野(×400),计数阳性细胞占整个视野内细胞数的比例并评分。
1.4 统计学分析每个实验独立重复3次,采用SPSS 22.0统计软件,数据以x±s表示,对计量资料进行正态性检验,根据正态性检验结果,对正态性分布资料进行两独立样本t检验;对不服从正态分布经过转换呈正态分布再进行分析。对计数资料进行χ2检验。检验水准:α=0.05。
2 结果 2.1 C-Mpl-/-小鼠松质骨骨量增加明显利用Micro-CT扫描观察骨微细结构的变化,C-Mpl-/-小鼠股骨干骺端松质骨较WT小鼠明显增多,C-Mpl-/-小鼠有更丰富的骨小梁结构(图 1)。骨小梁的扫描结果定量分析后发现,骨密度(BMD)、骨体积与组织体积比(BV/TV)、骨小梁数量(Tb.N)在C-Mpl-/-小鼠均显著升高,骨小梁间隙(Tb.Sp)和结构模型指数SMI均明显降低,骨小梁厚度(Tb.Th)差异无统计学意义(表 1),提示C-Mpl-/-小鼠具有更高的骨量。
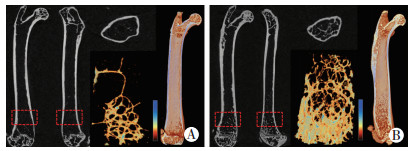
|
| A:WT小鼠;B: C-Mpl-/-小鼠从左至右分别是股骨二维断面,股骨远端骨小梁三维重建和三维冠状面重建 图 1 WT和C-Mpl-/-小鼠股骨Micro-CT平扫及三维重建 |
| 组别 | BMD(g/mm3) | BV/TV(%) | Tb.Th(mm) | Tb.Sp(mm) | Tb.N(1/mm) | SMI |
| WT组 | 0.111±0.004 | 1.022±0.440 | 0.042±0.008 | 0.524±0.030 | 0.219±0.072 | 2.763±0.038 |
| C-Mpl-/-组 | 0.169±0.015a | 4.324±1.090a | 0.052±0.004 | 0.342±0.015a | 0.866±0.162a | 2.208±0.092a |
| a:P < 0.05,与WT组比较 | ||||||
2.2 C-Mpl-/-小鼠长骨骨质量明显下降
取材时发现,C-Mpl-/-小鼠的胫骨和股骨较WT小鼠容易折断。因此进行股骨三点弯曲实验,得出C-Mpl-/-小鼠断裂负荷和刚度均小于WT小鼠,生物力学强度下降(表 2)。表明尽管C-Mpl-/-小鼠的长骨骨量显著增加,但其骨质量却有所下降。采用股骨硬组织切片的钙化结节染色(Von Kossa染色)观察发现,C-Mpl-/-小鼠股骨矿化程度轻度降低(图 2)。原代分离成骨细胞诱导分化14 d,经茜素红矿化染色得出类似结果(图 3)。骨质量的高低也与骨骼代谢水平相关,因此检测血清中的钙、磷含量,发现C-Mpl-/-小鼠血清中钙、磷含量也有所降低(表 3)。
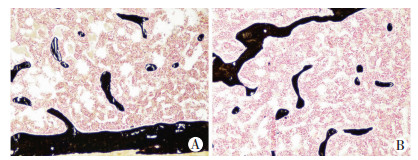
|
| A:WT组;B: C-Mpl-/-组 图 2 Von Kossa染色检测两组小鼠股骨矿化程度(×400) |
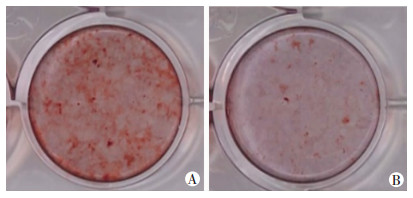
|
| A: WT组;B: C-Mpl-/-组 图 3 茜素红矿化染色检测两组小鼠原代成骨钙化结节 |
| 组别 | 压缩负荷(N) | 刚度(N/mm) |
| WT组 | 23.66±0.67 | 126.30±4.05 |
| C-Mpl-/-组 | 19.45±0.64a | 101.90±3.47a |
| a:P < 0.05,与WT组比较 | ||
| 组别 | n | 钙离子 | 磷离子 |
| WT组 | 8 | 1.588±0.130 | 3.555±0.123 |
| C-Mpl-/-组 | 8 | 1.222±0.018a | 2.697±0.232a |
| a:P < 0.05,与WT组比较 | |||
2.3 C-Mpl-/-小鼠体内破骨活动的变化
对小鼠股骨切片行破骨细胞TRAP染色,定量分析发现C-Mpl-/-组小鼠股骨生长板周围破骨细胞数量(8.667±1.202)显著低于WT组(18.000±1.732, P < 0.01,图 4)。分离骨髓细胞,并诱导其分化为破骨细胞,流式细胞仪检测细胞凋亡,发现C-Mpl-/-组小鼠破骨细胞的凋亡率为(14.54±1.17)%,较WT组小鼠破骨细胞的凋亡率[(5.38±0.56)%,P < 0.05,图 5]。
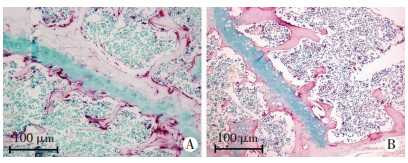
|
| A: WT组;B: C-Mpl-/-组 图 4 两组小鼠股骨破骨细胞形态TRAP染色观察 |

|
| A: WT组;B:C-Mpl-/-组 图 5 流式细胞仪检测两组小鼠股骨破骨细胞凋亡 |
2.4 C-Mpl-/-小鼠破骨细胞活性氧水平降低
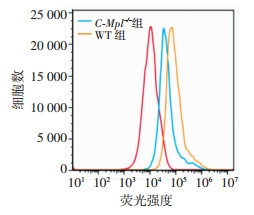
流式细胞仪检测RANKL诱导形成破骨细胞的活性氧水平,发现C-Mpl-/-组小鼠破骨细胞活性氧水平(6 833.0±176.4)明显低于WT组(12 933.0±202.8,P < 0.05,图 6)。
|
| 图 6 流式细胞仪检测两组小鼠股骨破骨细胞中ROS水平 |
2.5 C-Mpl-/-小鼠破骨细胞p-p38、FoxO1和Nrf2水平降低
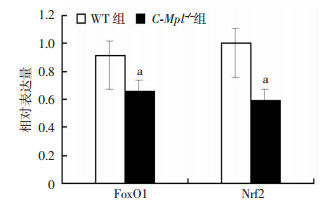
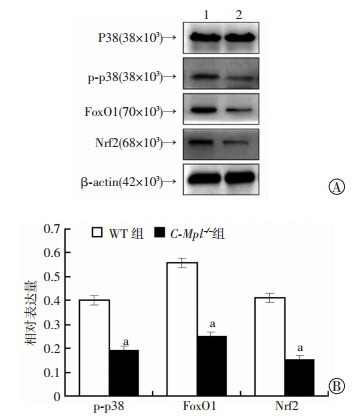
qPCR检测发现,C-Mpl-/-组小鼠破骨细胞中FoxO1和Nrf2较WT组小鼠破骨细胞转录明显下降(图 7)。Western blot检测也证实C-Mpl-/-组小鼠破骨细胞中p-p38、FoxO1和Nrf2水平均显著下降(图 8)。
|
| a:P < 0.05,与WT组比较 图 7 qPCR检测两组小鼠破骨细胞中FoxO1和Nrf2 mRNA转录水平 |
|
| A:Western blot检测1:WT组;2:C-Mpl-/-组;B:半定量分析a:P < 0.05,与WT组比较 图 8 Western blot检测两组小鼠破骨细胞中p-p38、FoxO1和Nrf2蛋白表达 |
3 讨论
TPO在促进巨核细胞生成和分化过程中起着重要作用,其受体C-Mpl在造血干细胞表达,是Ⅰ型细胞因子受体家族成员。在C-Mpl-/-小鼠模型中,巨核细胞及红系、造血前体细胞水平均明显降低[12]。破骨细胞由髓系细胞产生,C-Mpl-/-小鼠髓系细胞降低后会直接影响破骨细胞的功能。BETHEL等[13]发现破骨细胞及其前体细胞表面存在C-Mpl,TPO通过C-Mpl受体能够促进破骨细胞形成。有研究报道:2月龄WT小鼠和C-Mpl-/-小鼠比较,骨量差异无统计学意义,且无骨质疏松发生。本研究发现6月龄的WT小鼠松质骨骨量明显少于C-Mpl-/-小鼠,可见C-Mpl在骨骼代谢过程中具有一定作用。
骨形成和骨吸收二者之间的平衡是维持正常骨量的关键:成骨细胞分泌骨基质,增加骨量;破骨细胞进行骨吸收,两者协同作用调控骨量。MEIJOME等[14]研究发现:5月龄的C-Mpl-/-小鼠较WT小鼠松质骨骨量增加,检测到C-Mpl基因在成骨细胞有表达,并发现C-Mpl-/-成骨细胞增殖能力增强,通过增加细胞周期S/G2比率,促进成骨细胞的增殖,进而引起骨量增加。本研究同样发现6月龄C-Mpl-/-小鼠骨量增加,但是骨强度却明显下降。骨强度不仅仅取决于骨量的多少,也与骨骼的结构、矿化程度、胶原特性、代谢等有关。因此,进一步进行C-Mpl-/-小鼠股骨Von Kossa染色,发现股骨矿化能力下降,血清中钙、磷水平也明显低于WT小鼠,原代分离成骨细胞,诱导分化后茜素红矿化染色,C-Mpl-/-小鼠成骨细胞比WT小鼠成骨细胞钙化能力也有所下降。综合MEIJOME团队和我们前期的研究结果,C-Mpl-/-小鼠成骨活性增强,骨量增加,但是成骨细胞分化能力下降[14],大量增生的松质骨不能被皮质化,可能是引起骨强度下降的原因之一。但是,骨骼皮质化的过程不能离开破骨细胞的作用,既然C-Mpl能够影响成骨和破骨的平衡,那么破骨活性的改变就不能被忽视。因此,本研究着重关注C-Mpl基因对破骨活性的影响作用及机制。
本研究中TRAP染色发现C-Mpl-/-小鼠破骨细胞的数量明显少于WT小鼠。进一步研究发现在原代培养破骨细胞,C-Mpl-/-小鼠破骨细胞增殖明显慢于WT小鼠。同时检测细胞周期和凋亡,未见细胞周期明显改变,但是C-Mpl-/-小鼠破骨细胞凋亡速度明显加快。那么是什么原因引起破骨细胞的凋亡加快呢?查阅文献发现:活性氧在骨平衡中起着双重作用,在正常生理情况下,活性氧维持着破骨细胞的正常生理功能,在破骨细胞分化和存活中起着关键作用[15]。在病理条件下,如炎症或者骨折,则会产生过多的活性氧而导致骨量下降或骨修复减慢[16]。因此,我们检测破骨细胞在RANKL诱导下活性氧含量,发现C-Mpl-/-小鼠破骨细胞的活性氧含量显著低于WT小鼠破骨细胞。活性氧能激活JNK和P38基因的表达,在破骨细胞的生长过程中发挥着重要作用[17]。据最近研究报道,过氧化氢在细胞内的积聚和活性氧在破骨细胞内的产物对其生成和维持骨稳态至关重要[18]。通常FoxOs和Nrf2等基因被激活转录为抗氧化酶来减少活性氧积聚引起的氧化应激损伤[19-21]。氧化应激能通过JNK通路活化FoxOs,理论上C-Mpl-/-小鼠破骨细胞内活性氧减少,FoxOs也应该减少。有研究表明Nrf2通过活性氧相关信号通路抑制了破骨细胞的分化[22]。进一步qPCR和Western blot检测发现,C-Mpl-/-小鼠破骨细胞的FoxO1和Nrf2mRNA和蛋白表达均明显下降。最后,磷酸化P38的表达水平减少也说明C-Mpl-/-小鼠破骨细胞生成减少。
综上所述,本研究发现C-Mpl-/-小鼠破骨细胞数量减少,并通过活性氧生成减少,引起破骨细胞凋亡增加,可能导致骨量增加。提示造血系统和骨代谢可能存在某些直接联系,为进一步研究骨质疏松治疗提供了新的策略。
| [1] | OLSON T S, CASELLI A, OTSURU S, et al. Megakaryocytes promote murine osteoblastic HSC niche expansion and stem cell engraftment after radioablative conditioning[J]. Blood, 2013, 121(26): 5238–5249. DOI:10.1182/blood-2012-10-463414 |
| [2] | OLIVOS D J 3rd, ALVAREZ M, CHENG Y H, et al. Lnk deficiency leads to TPO-mediated osteoclastogenesis and increased bone mass phenotype[J]. J Cell Biochem, 2017, 118(8): 2231–2240. DOI:10.1002/jcb.25874 |
| [3] | CHENG Y H, STREICHER D A, WANING D L, et al. Signaling pathways involved in megakaryocyte-mediated proliferation of osteoblast lineage cells[J]. J Cell Physiol, 2015, 230(3): 578–586. DOI:10.1002/jcp.24774 |
| [4] | KACENA M A, GUNDBERG C M, NELSON T, et al. Loss of the transcription factor p45 NF-E2 results in a developmental arrest of megakaryocyte differentiation and the onset of a high bone mass phenotype[J]. Bone, 2005, 36(2): 215–223. DOI:10.1016/j.bone.2004.09.024 |
| [5] | KACENA M A, SHIVDASANI R A, WILSON K, et al. Megakaryocyte-osteoblast interaction revealed in mice deficient in transcription factors GATA-1 and NF-E2[J]. J Bone Miner Res, 2004, 19(4): 652–660. DOI:10.1359/JBMR.0301254 |
| [6] | MEIJOME T E, HOOKER R A, CHENG Y H, et al. GATA-1 deficiency rescues trabecular but not cortical bone in OPG deficient mice[J]. J Cell Physiol, 2015, 230(4): 783–790. DOI:10.1002/jcp.24803 |
| [7] | MARTY C, PECQUET C, NIVARTHI H, et al. Calreticulin mutants in mice induce an MPL-dependent thrombocytosis with frequent progression to myelofibrosis[J]. Blood, 2016, 127(10): 1317–1324. DOI:10.1182/blood-2015-11-679571 |
| [8] | SOVES C P, MILLER J D, BEGUN D L, et al. Megakaryocytes are mechanically responsive and influence osteoblast proliferation and differentiation[J]. Bone, 2014, 66: 111–120. DOI:10.1016/j.bone.2014.05.015 |
| [9] | YAN X Q, LACEY D, HILL D, et al. A model of myelofibrosis and osteosclerosis in mice induced by overexpressing thrombopoietin (mpl ligand): reversal of disease by bone marrow transplantation[J]. Blood, 1996, 88(2): 402–409. |
| [10] | PERRY M J, REDDING K A, ALEXANDER W S, et al. Mice rendered severely deficient in megakaryocytes through targeted gene deletion of the thrombopoietin receptor c-Mpl have a normal skeletal phenotype[J]. Calcif Tissue Int, 2007, 81(3): 224–231. DOI:10.1007/s00223-007-9051-z |
| [11] | DOMINICI M, RASINI V, BUSSOLARI R, et al. Restoration and reversible expansion of the osteoblastic hematopoietic stem cell niche after marrow radioablation[J]. Blood, 2009, 114(11): 2333–2343. DOI:10.1182/blood-2008-10-183459 |
| [12] | ZHAO M, PERRY J M, MARSHALL H, et al. Megakaryocytes maintain homeostatic quiescence and promote post-injury regeneration of hematopoietic stem cells[J]. Nat Med, 2014, 20(11): 1321–1326. DOI:10.1038/nm.3706 |
| [13] | BETHEL M, BARNES C L, TAYLOR A F, et al. A novel role for thrombopoietin in regulating osteoclast development in humans and mice[J]. J Cell Physiol, 2015, 230(9): 2142–2151. DOI:10.1002/jcp.24943 |
| [14] | MEIJOME T E, BAUGHMAN J T, HOOKER R A, et al. C-Mpl is expressed on osteoblasts and osteoclasts and is important in regulating skeletal homeostasis[J]. J Cell Biochem, 2016, 117(4): 959–969. DOI:10.1002/jcb.25380 |
| [15] | TAI T W, CHEN C Y, SU F C, et al. Reactive oxygen species are required for zoledronic acid-induced apoptosis in osteoclast precursors and mature osteoclast-like cells[J]. Sci Rep, 2017, 7: 44245. DOI:10.1038/srep44245 |
| [16] | SHEWEITA S A, KHOSHHAL K I. Calcium metabolism and oxidative stress in bone fractures: role of antioxidants[J]. Curr Drug Metab, 2007, 8(5): 519–525. |
| [17] | LEE N K, CHOI Y G, BAIK J Y, et al. A crucial role for reactive oxygen species in RANKL-induced osteoclast differentiation[J]. Blood, 2005, 106(3): 852–859. DOI:10.1182/blood-2004-09-3662 |
| [18] | YAMASAKI N, TSUBOI H, HIRAO M, et al. High oxygen tension prolongs the survival of osteoclast precursors via macrophage colony-stimulating factor[J]. Bone, 2009, 44(1): 71–79. DOI:10.1016/j.bone.2008.09.015 |
| [19] | THUMMURI D, VGM N, CHAUDHARI P. Carnosic acid attenuates RANKL-induced oxidative stress and osteoclastogenesis via induction of Nrf2 and suppression of NF-κB and MAPK signalling[J]. J Mol Med, 2017, 95(10): 1065–1076. DOI:10.1007/s00109-017-1553-1 |
| [20] | THUMMURI D, JEENGAR M K, SHRIVASTAVA S, et al. Thymoquinone prevents RANKL-induced osteoclastogenesis activation and osteolysis in an in vivo model of inflammation by suppressing NF-KB and MAPK signalling[J]. Pharmacol Res, 2015, 99: 63–73. DOI:10.1016/j.phrs.2015.05.006 |
| [21] |
侯凤艳, 罗莉, 朱俊宇, 等. 胍丁胺对脂多糖诱导RAW264.7细胞氧化应激损伤的保护作用[J].
第三军医大学学报, 2016, 38(9): 949–953.
HOU F Y, LUO L, ZHU J Y, et al. Protective effects of agmatine on oxidative stress induced by lps in raw264.7 cells[J]. J Third Mil Med Univ, 2016, 38(9): 949–953. DOI:10.16016/j.1000-5404.201510107 |
| [22] | KANZAKI H, SHINOHARA F, KAJIYA M, et al. Nuclear Nrf2 induction by protein transduction attenuates osteoclastogenesis[J]. Free Radic Biol Med, 2014, 77: 239–248. DOI:10.1016/j.freeradbiomed.2014.09.006 |



