肝衰竭是临床常见的严重肝病症候群,治疗困难,病死率高。在我国,乙型肝炎病毒(hepatitis B virus, HBV)感染是引起肝衰竭的首要原因,乙型肝炎病毒相关性慢加急性肝衰竭(hepatitis B virus associated acute-on-chronic liver failure, HBV-ACLF)在临床上最为常见。迄今为止,核苷(酸)类似物[nucleot(s)ides analogues, NAs]抗HBV治疗慢性乙型病毒性肝炎近20年,疗效已得到公认。然而,目前关于NAs抗病毒治疗是否能改善肝衰竭患者的预后仍存在争议。
2006年我国第1版《肝衰竭诊疗指南》指出“HBV DNA阳性的肝衰竭患者在知情同意的基础上可尽早酌情使用NAs, 如拉米夫定、阿德福韦酯、恩替卡韦等,但应注意后续治疗中病毒变异和停药后病情加重的可能”[1]。而2012年版《肝衰竭诊治指南》虽指出“对HBV DNA阳性的肝衰竭患者,不论其测出的HBV DNA滴度高低,建议立即使用NAs抗病毒治疗”,但同时指出“抗病毒治疗似难以改善肝衰竭的结局”[2]。那么NAs抗病毒治疗到底能否改善HBV-ACLF患者的结局呢?HBV-ACLF发病机制十分复杂,涉及病毒、免疫、组织及遗传等多方面因素,常累及多器官损害,出现肝性脑病、自发性细菌性腹膜炎、肝肾综合征、消化道出血等并发症,加之各研究病例的纳入标准不同、开始使用NAs抗病毒时患者所处的病程阶段不同、病例数有限等影响,导致研究结论不一致[7]。有研究认为HBV-ACLF患者使用NAs治疗能有效改善肝功能,提高患者的生存率[3-4]。但亦有研究认为NAs抗病毒治疗虽能降低体内HBV DNA水平,但并不能改善肝衰竭患者的结局[5-6]。所以,使用NAs抗病毒治疗HBV-ACLF患者的疗效尚需进一步证实。同时,临床应用的多种NAs中,哪种药物疗效更佳,也是值得探讨的问题。研究表明,早、中、晚期肝衰竭患者病死率逐渐升高,早诊断、早治疗是提高HBV-ACLF患者生存率的有效方法。因此,本研究的对象仅限于早期HBV-ACLF患者,也使研究对象趋于一致,以利于更准确评价药物疗效。我们收集本研究所2002-2012年收治的早期HBV-ACLF住院患者的临床资料,根据其是否使用NAs抗病毒治疗分为抗病毒组和对照组,回顾性分析比较两组患者治疗后的非肝移植治疗自然生存(简称自然生存)数据,进一步明确NAs抗病毒治疗对早期HBV-ACLF患者预后的影响。
1 资料与方法 1.1 研究对象获取本研究所乙型肝炎生物样本库2002年1月至2012年12月住院患者的病例资料,以出院主要诊断“肝衰竭”为关键词,从系统导出数据共3 171份,根据2012年版《肝衰竭诊治指南》[2]中的诊断标准筛选早期HBV-ACLF患者的资料进行回顾性分析。纳入标准包括:①HBsAg阳性半年以上;②血清HBV DNA水平≥3 lgDNA(拷贝/mL);③血清总胆红素(total bilirubin, TBIL)≥171 μmol/L或上升≥17.1 μmol/(L·d);④凝血国际标准化:凝血酶原活动度(prothrombin time activity,PTA)>30%~40%,或国际标准化比值(inte-rnational normalized ratio,INR)>1.5~1.9;⑤无失代偿腹水、腹腔感染、消化道出血等并发症。排除其他肝炎病毒感染、酒精性肝病和自身免疫性肝病。
最终纳入符合诊断标准的早期HBV-ACLF患者618例,抗病毒治疗与未抗病毒治疗病例的年份分布情况见图 1,其中男性568例,女性50例,年龄12~77(41.29±11.38)岁。所有患者充分知情抗病毒治疗方案。样本库于2014年通过西南医院伦理委员会审批(批准号:2014KY35)。
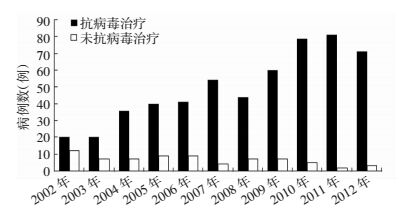
|
| 图 1 早期HBV-ACLF患者病例年份分布情况 |
1.2 治疗方法与分组
所有患者入院后给予保肝、对症、支持等常规内科综合治疗。在此基础上,用NAs抗病毒治疗>7 d的患者为抗病毒组,共546例,其中男性503例,女性43例,年龄12~77(41.11±11.21)岁,抗病毒药物包括拉米夫定、阿德福韦酯、替比夫定和恩替卡韦。抗病毒方案为单用或阿德福韦酯联合其他任意一种核苷类似物。未抗病毒治疗的患者作为对照组,共72例,其中男性65例,女性7例,年龄19~69(42.64±12.60)岁,回顾性分析比较两组患者的临床资料及预后。
1.3 观察疗效判定自然生存:非肝移植治疗后仍生存≥90 d,占50.3%(311/618);非自然生存[8]:肝移植治疗,占1.6%(10/618);明确死亡,占48.1%(297/618)。
1.4 统计学方法应用SPSS 22.0统计软件分析,计量资料采用t或t'检验,用x±s表示;方差不齐的计量资料采用秩和检验,用中位数和四分位数间距M(Q25~Q75)表示;计数资料采用χ2检验,用百分率表示;治疗前各基线指标及治疗方案对预后的影响采用单因素COX回归分析,单因素分析有统计学差异的变量进行多因素COX回归分析,筛选出与死亡结局相关的独立影响因素,并绘制生存曲线。检验水准:α=0.05。
2 结果 2.1 两组患者基线特征两组患者的年龄、性别、基线HBeAg、HBV DNA、Meld评分、碱性磷酸酶(alkaline phosphatase,ALP)、TBIL、INR、白细胞(white blood cell, WBC)、血小板(blood platelet,PLT)水平差异无统计学意义(P>0.05);谷丙转氨酶(glutamic-pyruvic transaminase,ALT)、谷草转氨酶(glutamic-oxaloacetic transaminase,AST)、谷氨酰转肽酶(glutamyltranspetidase,GGT)、白蛋白(albumin,ALB)、血清肌酐(serum creatinine,Cr)、血浆Na+浓度差异有统计学意义(P<0.05,表 1)。
| 组别 | n | 男/女 | 年龄(岁) | HBeAg阳性 [例(%)] | HBV DNA [lgDNA(拷贝/mL)] | Meld评分a | 基线临床常规指标 | ||
| ALT(U/L) | AST(U/L) | ||||||||
| 抗病毒组 | 546 | 503/43 | 41.11±11.21 | 235(43.04) | 6.07(4.61~7.43) | 23.93(22.66~25.22) | 337.00(156.00~712.00) | 282.00(139.50~641.75) | |
| 对照组 | 72 | 65/7 | 42.64±12.60 | 25(34.72) | 5.64(4.29~6.91) | 24.07(23.02~25.41) | 217.00(115.25~587.00) | 178.50(102.25~422.75) | |
| 统计值 | 0.292 | -0.640 | 1.806 | -1.780 | -0.598 | -2.233 | -2.598 | ||
| P值 | 0.589 | 0.522 | 0.179 | 0.075 | 0.550 | 0.026 | 0.009 | ||
| 组别 | n | GGT(U/L) | ALP(U/L) | ALB(g/L) | TBIL(μmol/L) | ||||
| 抗病毒组 | 546 | 82.50(56.75~129.00) | 143.00(120.00~174.00) | 33.00(30.38~35.80) | 308.90(222.48~402.13) | ||||
| 对照组 | 72 | 70.50(48.00~93.25) | 137.50(122.50~169.75) | 31.10(28.05~35.00) | 331.85(225.98~449.48) | ||||
| 统计值 | -3.159 | -0.498 | -2.985 | -0.810 | |||||
| P值 | 0.002 | 0.618 | 0.003 | 0.418 | |||||
| 组别 | n | Cr(μmol/L) | Na+(mmol/L) | INR | PTA(%) | WBC | PLT | ||
| 抗病毒组 | 546 | 67.00(57.68~79.50) | 136.45(133.78~139.00) | 1.76(1.64~1.91) | 37.18(32.71~41.58) | 6.19(4.73~7.82) | 95(67.00~118.25) | ||
| 对照组 | 72 | 72.65(61.10~83.85) | 135.35(130.95~137.95) | 1.70(1.62~1.88) | 39.11(33.60~42.43) | 6.50(4.75~9.39) | 97(62.50~115.25) | ||
| 统计值 | -2.364 | -2.351 | -1.351 | -1.351 | -0.968 | -0.733 | |||
| P值 | 0.018 | 0.019 | 0.185 | 0.185 | 0.333 | 0.464 | |||
| a: Meld score计算公式:Meld score=9.6×ln(Cr/88.4)+3.8×ln(TBIL/17.1)+11.2×lnINR+6.4 | |||||||||
2.2 治疗前的基线指标及抗病毒治疗对预后的影响
单因素COX回归分析结果显示,在分析的17个因素中,与治疗预后显著相关的因素有8个,包括抗病毒治疗、性别、年龄、Meld评分、TBIL、ALT、血浆Na+浓度、WBC。对预后的多因素COX回归分析,结果显示以治疗后是否死亡为状态,以单因素回归分析有统计学意义的因素为协变量,进行多因素COX回归分析(LR向前法)。结果显示有6个因素为预后的独立影响因素(P<0.05,表 2),分别为抗病毒治疗、性别、年龄、血浆Na+浓度、TBIL和WBC。采用NAs抗病毒治疗方案、女性、年龄越小、无顽固性低钠、胆红素水平越低、没有合并感染,均有利于预后恢复。
| 变量 | 单因素COX回归分析 | 多因素COX回归分析 | ||||
| B值 | OR(95%CI) | P值 | B值 | OR(95%CI) | P值 | |
| 抗病毒治疗 | -0.743 | 0.476(0.347~0.651) | <0.001 | -0.777 | 0.460(0.336~0.630) | <0.001 |
| 性别(女) | -0.724 | 0.485(0.284~0.829) | 0.008 | -0.784 | 0.456(0.266~0.784) | 0.005 |
| 年龄 | 0.035 | 1.035(1.026~1.045) | <0.001 | 0.035 | 1.036(1.027~1.046) | <0.001 |
| Meld评分 | 0.086 | 1.089(1.053~1.127) | <0.001 | |||
| PT-INR | 0.131 | 1.140(0.768~1.693) | 0.514 | |||
| TBIL | 0.002 | 1.002(1.001~1.003) | <0.001 | 0.002 | 1.002(1.001~1.003) | <0.001 |
| Cr | 0.002 | 1.002(1.000~1.003) | 0.085 | |||
| HBeAg(阴性) | -0.141 | 0.868(0.691~1.092) | 0.227 | |||
| HBV DNA [lgDNA(拷贝/mL)] | 0.033 | 1.033(0.968~1.102) | 0.324 | |||
| ALT | <0.001 | 1.000(0.999~1.000) | 0.005 | |||
| AST | <0.001 | 1.000(1.000~1.000) | 0.305 | |||
| GGT | <0.001 | 1.000(0.999~1.002) | 0.431 | |||
| ALP | 0.001 | 1.001(1.000~1.002) | 0.099 | |||
| ALB | -0.023 | 0.977(0.953~1.001) | 0.064 | |||
| Na+ | -0.024 | 0.977(0.966~0.988) | <0.001 | -0.023 | 0.977(0.963~0.991) | 0.002 |
| WBC | 0.070 | 1.072(1.041~1.104) | <0.001 | 0.045 | 1.047(1.013~1.081) | 0.007 |
| PLT | -0.001 | 0.999(0.996~1.001) | 0.357 | |||
2.3 不同NAs抗病毒药物对预后的影响
抗病毒组单用恩替卡韦治疗者自然生存率为56.4%(66/117),单用阿德福韦酯治疗为52.0%(13/25),单用拉米夫定治疗为50.80%(153/301),单用替比夫定治疗为48.1%(13/27),拉米夫定联合阿德福韦酯治疗为55.2%(37/67),替比夫定联合阿德福韦酯治疗为0.0%(0/5),恩替卡韦联合阿德福韦酯治疗为50.0%(2/4)。不同抗病毒方案之间的自然生存率差异无统计学意义(χ2=6.939,P>0.05)。
2.4 生存率与生存分析抗病毒组的自然生存率为52.0%(284/546),对照组的自然生存率为36.1%(26/72),差异有统计学意义(χ2=6.436,P<0.05)。随访至基线后180 d,失访57例(抗病毒组42例,对照组15例),以COX回归分析绘制生存曲线。其中,对照组生存时间18.00(6.00~114.75)d,抗病毒组生存时间93.50(35.00~154.00)d,差异有统计学意义(χ2=-5.214,P<0.05)。同时,通过COX回归分析绘制的生存曲线分析图可以直观地了解HBV-ACLF患者的自然病程为90 d,随访90~180 d的自然生存率无显著下降(图 2)。
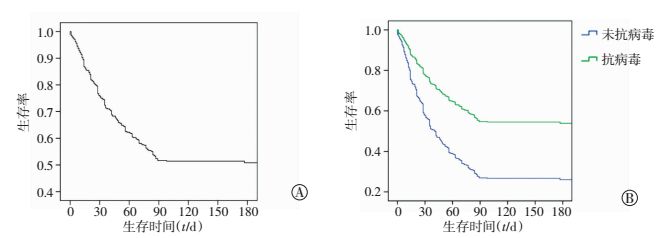
|
| A:早期HBV-ACLF患者生存分析曲线;B:抗病毒和对照组的生存曲线 图 2 早期HBV-ACLF患者总的生存曲线 |
3 讨论
我国是乙型肝炎大国,ACLF是HBV感染者常见最凶险的临床表型之一,其病理表现为慢性肝损害的基础上,新出现大量的肝细胞变性坏死,预后差且病死率高。针对该疾病,近年出现许多新的治疗方法,如人工肝、血浆置换、干细胞肝脏移植等,虽能临时改善肝功能,但能否提高生存率仍不明确[7-8]。原位肝移植虽为较有效的治疗方法,但肝源缺乏,ACLF患者无时间等待,且治疗费用昂贵。HBV-ACLF的发病机制十分复杂,其中HBV是导致肝衰竭的启动因素,NAs抗病毒治疗通过抑制HBV DNA的复制来阻止疾病进展,但其能否改善肝衰竭患者预后,不同学者的文献报道存在差异。其主要原因在于既往大部分研究的样本量较小,纳入标准不统一,要进一步明确NAs抗病毒治疗对肝衰竭患者预后的影响,需要更大样本数据的支持。
本研究共回顾性分析了618例早期HBV-ACLF患者的临床资料,多因素COX回归分析结果显示是否抗病毒治疗是影响预后的独立影响因素,进一步证实早期抗病毒治疗能改善早期HBV-ACLF患者的预后。本研究表明早期HBV-ACLF患者预后受多种因素影响,除了是否抗病毒治疗外,性别、年龄、血浆Na+浓度、TBIL和WBC也是独立影响因素。年轻、女性、血浆Na+浓度趋于正常、TBIL相对低和没有并发感染的患者预后较好;相反,年龄越大、TBIL越高、顽固性低钠、合并严重感染的患者预后越差。女性的生存率明显高于男性,可能与机体的免疫反应存在性别差异相关,雄激素对细胞和体液免疫均产生抑制作用,而雌激素抑制细胞免疫但增强体液免疫,孕激素则促进细胞免疫向体液免疫转化,因而女性比男性具有更强的细胞和体液免疫[11]。我们认为,在临床实际工作中,对早期HBV-ACLF患者应做到及时使用NAs抗病毒,加强营养支持,积极控制感染,纠正低钠血症,维持水、电解质平衡,加强辅助治疗(人工肝、血浆置换等)。
本研究结果显示患者的自然生存率为50.3%。其中,抗病毒组的自然生存率(52.0%)显著高于对照组(36.1%,χ2=6.436, P<0.05)。这提示NAs抗病毒治疗可有效提高HBV-ACLF患者的生存率,改善预后。文献[9-10]报道,拉米夫定联合阿德福韦酯抗病毒治疗HBV-ACLF患者的疗效优于单用恩替卡韦治疗。而本研究结果显示,对于早期HBV-ACLF患者,单用恩替卡韦组的自然生存率最高(56.4%),其次为拉米夫定联合阿德福韦酯组(55.2%)及单用拉米夫定组(50.8%),但生存率差异无统计学意义(χ2=6.939,P>0.05)。鉴于近年多个权威指南仅推荐恩替卡韦和替诺福韦为一线抗HBV药物,因此我们建议将恩替卡韦作为HBV-ACLF患者抗病毒的首选药物。
此外,抗病毒组的生存时间显著长于对照组[93.50(35.00~154.00)d vs 18.00(6.00~114.75)d],差异有统计学意义(χ2=-5.214,P<0.05),提示NAs抗病毒治疗可延长HBV-ACLF患者的生存时间,为准备肝移植争取机会。同时,通过生存曲线分析图可直观地看到180 d的生存率相比发病90 d的自然生存率无明显下降,说明患者存活90 d后如不发生意外事件可长期生存。对这些患者,连续NAs抗病毒治疗可防止HBV反弹,令患者长期受益,但远期生存率需进一步数据支持。
通过本研究,我们认为NAs抗病毒药物对早期HBV-ACLF患者的治疗是有效的,可显著提高早期患者的生存率。早期抗病毒治疗能抑制HBV复制,阻止肝细胞进一步坏死,减轻病毒本身引起的免疫损伤,降低炎性介质/细胞因子对肝细胞的第二次打击[12-13],提高自然生存率。本研究不足的是:①回顾性分析,具有一定局限性;②近年来核苷(酸)类抗病毒药的使用越来越普遍,未抗病毒的病例资料较为稀缺,导致抗病毒组与对照组的入选比例差异较大;③接受不同NAs抗病毒治疗的例数不均衡,需更大样本研究的支持。
| [1] |
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊疗指南(2006年版)[J].
中华肝脏病杂志, 2006, 14(9): 643–646.
Chinese Society of Infectious Diseases, Chinese Medical Association, Severe Liver Diseases and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Assoction. Diagnostic and Treatment Guidelines For Liver Failure[J]. Chin J Hepatol, 2006, 14(9): 643–646. |
| [2] |
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2012年版)[J].
中华移植杂志(电子版), 2013, 7(1): 48–56.
Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, CMA, Severe Liver Diseases and Artificial Liver Group, Chinese Society of Hepatology, CMA. Guidelines for Diagnostic and Treatment of Liver Failure[J]. Chin J Chin Infect Dis, 2013, 7(1): 48–56. DOI:10.3877/cma.j.issn.1647-3903.2013.01.011 |
| [3] |
曹海燕, 蔡胜蓝, 张妍. 不同核苷(酸)类抗病毒药物对慢性重型乙型肝炎近期预后的影响[J].
实用医学杂志, 2009, 25(23): 4027–4028.
CHAO H Y, CAI S L, ZHANG Y. Effects of different nucleoside (acid) antiviral drugs on the short-term prognosis of chronic severe hepatitis B[J]. J Prac Med, 2009, 25(23): 4027–4028. DOI:10.3969/j.issn.1006-5725.2009.23.049 |
| [4] | MA K, GUO W, HAN M, et al. Entecavir treatment prevents disease progression in hepatitis B virus-related acute-on-chronic liver failure: establishment of a novel logistical regression model[J]. Hepatol Int, 2012, 6(4): 735–743. DOI:10.1007/s12072-012-9344-9 |
| [5] |
徐启桓, 许镇, 舒欣, 等. 抗病毒治疗对不同分期的乙型肝炎相关慢加急性肝衰竭患者短期生存率的影响[J].
中山大学学报(医学科学版), 2010, 31(3): 381–384.
XU Q H, XU Z, SHU X, et al. Short-term efficacy of antiviral treatment in patients with different stages of acute-on-chronic hepatitis B liver failure[J]. J Sun Yat-sen Univ(Med Sci), 2010, 31(3): 381–384. |
| [6] | CUI Y L, YAN F, WANG Y B, et al. Nucleoside analogue can improve the long-term prognosis of patients with hepatitis B virus infection-associated acute on chronic liver failure[J]. Dig Dis Sci, 2010, 55(8): 2373–2380. DOI:10.1007/s10620-010-1257-7 |
| [7] |
陈至明, 杨文龙, 熊墨龙, 等. 乙型肝炎相关慢加急性肝衰竭抗病毒治疗118例临床观察[J].
临床合理用药杂志, 2015, 8(6): 11–13.
CHEN Z M, YANG W L, XIONG M L, et al. Clinical observation of antiviral treatmen in 118 cases of hepatitis B related acute on chronic liver failure[J]. Chin J of Clinical Rational Drug Use, 2015, 8(6): 11–13. DOI:10.15887/j.cnki.13-1389/r.2015.17.006 |
| [8] | LI Y H, XU Y, WU H M, et al. Umbilical cord-derived mesenchymal stem cell transplantation in hepatitis B virus related acute-on-chronic liver failure treated with plasma exchange and entecavir: a 24-month prospective study[J]. Stem Cell Rev, 2016, 12(6): 645–653. DOI:10.1007/s12015-016-9683-3 |
| [9] | LIU F, WANG X, WEI F, et al. Efficacy and resistance in de novo combination lamivudine and adefovir dipivoxil therapy versus entecavir monotherapy for the treatment-naive patients with chronic hepatitis B: a meta-analysis[J]. Virol J, 2014, 11: 59. DOI:10.1186/1743-422X-11-59 |
| [10] | FAN X H, GENG J Z, WANG L F, et al. De novo combination therapy with lamivudine and adefovir dipivoxil in chronic hepatitis B patients[J]. World J Gastroenterol, 2011, 17(43): 4804–4809. DOI:10.3748/wjg.v17.i43.4804 |
| [11] |
尹雪如, 钟晓祝, 廖慧华, 等. 慢性乙型病毒性肝炎初治患者核苷(酸)类似物抗病毒治疗应答相关因素Logistic回归分析[J].
世界华人消化杂志, 2015, 23(31): 5039–5044.
YIN X R, ZHONG X Z, LIAO H H, et al. Logistic regression analysis offactors influencing virological responseto nucleos(t)ide analog therapy in previouslyun treated chronic hepatitis B patients[J]. World Chin J Digestol, 2015, 23(31): 5039–5044. |
| [12] | WANG Y M, TANG Y Z. Antiviral therapy for hepatitis B virus associated hepatic failure[J]. HBPD INT, 2009, 8(1): 17–24. DOI:10.1007/978-1-4020-9353-1_20 |
| [13] |
卢向鹏, 罗光汉. 乙型肝炎病毒相关性肝衰竭/重型肝炎抗病毒治疗的研究进展[J].
医学综述, 2011, 17(3): 395–397.
LU X P, LUO G H. Hepatitis B virus associated liver failure or severe hepatitis: a review of research progress in antiviral treatment[J]. Med Recapitulate, 2011, 17(3): 395–397. DOI:10.3969/j.issn.1006-2084.2011.03.026 |



