2. 400016 重庆,重庆医科大学附属第一医院感染科
2. Department of Infectious Diseases, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
脓毒症(Sepsis)是严重感染、创伤、休克、外科手术等患者的严重并发症,是ICU病人死亡的主要原因之一,死亡率高却缺乏有效防治措施。因此,深入研究脓毒症发生发展机制,对于脓毒症的诊断及防治具有重要意义。
近年来,越来越多的研究发现微小RNA(microRNA,miRNA)与脓毒症炎性反应密切相关。miRNAs通过调控脓毒症发生的多条重要炎症信号通路发挥抑炎或促炎的作用,密切参与了脓毒症的病理生理机制。有研究发现,miR-16在脓毒症患者的血清中[1],以及在LPS诱导的大鼠和小鼠ALI/ARDS中,miR-16的表达均显著下调[2-3]; miR-16可抑制IKKα(inhibitor of nuclear factor kappa-B kinase)的表达,进而抑制NF-κB的活化[4]; miR-16还可以抑制LPS诱导的A549细胞中TNFα和IL-6的表达[2],提示miR-16与脓毒症密切相关并发挥重要的抗炎作用,因此成脓毒症抗炎治疗的重要新靶点。
PPARγ(peroxisome proliferators-activated receptors)属于非类固醇激素类核受体,经配体活化后对脓毒症发挥重要的保护作用[5]。但PPARγ的抗炎机制仍需深入研究,尤其是其抗炎机制是否与调节重要的抗炎miRNA分子miR-16有关目前尚不清楚。
因此,本研究通过实验发现在人单核细胞THP-1和小鼠巨噬细胞RAW246.7细胞中,PPARγ可显著促进miR-16的表达进而抑制炎症反应及对脓毒症小鼠的保护作用,并进一步探讨了其作用机制,为阐明PPARγ和miR-16的抗炎作用提供新的实验依据,为脓毒症的抗炎治疗提供新的靶标。
1 材料与方法 1.1 实验动物及主要试剂SPF级8周龄BALB/c雄性小鼠,体质量18~22 g,均购于重庆医科大学实验动物中心。胎牛血清(FBS)、RPMI-1640培养基、DMEM培养基购自美国Gibco公司; PBMCs细胞分离液购自美国GE公司; PPARγ激动剂罗格列酮(Rosiglitazone,RGZ)、拮抗剂GW9662购自美国Cayman Chemical公司; miRNA检测试剂盒购自美国GeneCopeia公司; PPARγ siRNA、antagomir-16由上海吉玛制药公司合成; 报告基因检测试剂购自美国Promega公司; IKKα兔多克隆抗体(#2682)购自美国CST公司; β-actin小鼠单克隆抗体(ab8226)购自美国Abcam公司; 山羊抗鼠、山羊抗兔二抗均购自北京中杉公司; ECL化学发光试剂盒均购自美国Bio-Rad公司。
1.2 细胞培养采用Ficoll-PaqueTM PREMIUM细胞分离液,按照试剂说明操作分离人和小鼠外周血单核细胞。人单核细胞THP-1和小鼠巨噬细胞RAW246.7购自上海中科院细胞库。细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640培养基培养,置于5%、CO2、37 ℃恒温恒湿培养箱中培养。
1.3 实验分组为了检测PPARγ对miR-16表达的影响,THP-1和RAW246.7细胞接种至6孔板中,24 h后细胞进入对数生长期后,分别加入PPARγ激动剂罗格列酮(RGZ)(终浓度0.5、2、5 μmol/L)和对照DMSO(终浓度0.1%),作用24 h检测miR-16及其靶基因IKKα的表达(n=3);细胞分别转入PPARγ siRNA或control siRNA (终浓度10 nmol/L)24 h,再加入RGZ(5 μmol/L)或对照DMSO(终浓度0.1%)处理24 h,将细胞分为DMSO+siControl组、5 μmol/L RGZ+siControl、5 μmol/L RGZ+siPPARγ组,检测miR-16及其靶基因IKKα的表达(n=3);细胞分别转入miR-16抑制剂(antagomir-16)或对照组(antagomir-16 NC) (终浓度50 nmol/L),24 h,再加入RGZ(5 μmol/L)或对照DMSO(终浓度0.1%)处理24 h,将细胞分为DMSO+antagomir-16 NC、5 μmol/L RGZ+antagomir-16、5 μmol/L RGZ+antagomir-16组,检测IKKα的表达(n=3)。为了检测PPARγ通过上调miR-16的表达抑制炎症细胞TNF-α和IL-6的表达,细胞经PPARγ激动剂RGZ预处理24 h,再经LPS (100 ng/mL)处理细胞6 h,将细胞分为MOCK组、LPS+DMSO组、LPS+5 μmol/L RGZ组; 此外,细胞细胞转染antagomir-16 24 h后,经PPARγ激动剂RGZ处理24 h,再经LPS (100 ng/mL)处理细胞6 h,将细胞分为MOCK组、LPS+DMSO+antagomir-16 NC组、LPS+5 μmol/L RGZ+antagomir-16 NC组、LPS+5 μmol/L RGZ+antagomir-16组,ELISA检测TNF-α和IL-6的表达(n=3)。
1.4 小鼠脓毒症模型的复制与分组采用LPS腹腔注射制备小鼠脓毒症模型,LPS注射剂量为20 mg/kg。小鼠注射LPS后出现寒战,呼吸频率加快,活动力降低,毛发耸立、解稀水样粪便等症状。将小鼠随机分为正常对照(Vehicle)组、DMSO组、RGZ组、DMSO+antagomir-16 NC组、DMSO+antagomir-16组、RGZ+antagomir-16 NC组、RGZ+antagomir-16组,每组6只。Vehicle组小鼠腹腔注射生理盐水+DMSO,0.2 mL,DMSO组小鼠腹腔注射0.2 mL DMSO,RGZ组腹腔注射0.2 mL RGZ(40 mg/kg),DMSO+antagomir-16 NC组腹腔注射0.2 mL DMSO+antagomir-16 NC(50 mg/kg),DMSO+antagomir-16组腹腔注射0.2 mL DMSO+antagomir-16(50 mg/kg),RGZ+antagomir-16 NC组腹腔注射0.2 mL RGZ+antagomir-16 NC(50 mg/kg)、RGZ+antagomir-16组腹腔注射0.2 mL RGZ +antagomir-16(50 mg/kg),连续注射6 d后,于第7天分别对Vehicle组小鼠腹腔注射0.2 mL生理盐水+DMSO,对其他各组小鼠腹腔注射20 mg/kg LPS,24 h后鼠眼球取血,分离外住血单核细胞,检测miR-16的表达,4 h后检测血清TNF-α和IL-6的表达的表达。
1.5 Real-time PCR检测首先依据Trizol说明书提取细胞总RNA,再采用All-in-OneTM miRNA qRT-PCR试剂盒,根据操作说明书检测miR-16表达,以U6为内参Real-time PCR检测miR-16的表达,U6内参引物上游:5′-CGCTTCGGCAG-CACATATACTAA-3′,下游:5′-TATGGAACG CTTCAC-GAATTTGC-3′; 成熟miR-16上游引物:5′-TAGCAGC-ACGTAAATATTGGCG-3′,下游引物由试剂盒提供的通用引物。依据Trizol说明书提取细胞总RNA,利用PrimeScriptTMRT reagent Kit试剂盒逆转录为cDNA,以β-actin为内参进行Real-time PCR检测PPARγ表达,人PPARγ上游引物:5′-CTCGAGGACACCGGAGAGG-3′,下游引物:5′-AGGAGTGGGAGTGGTCTTCC-3′; β-actin上游引物:5′-CGAGGCCCCCCTGAAC-3′,下游引物:5′-GCCAGAGGCGTACAGGGATA-3′。
1.6 Western blot检测处理后的细胞经含RIPA裂解液裂解后离心取上清,BCA试剂盒测定蛋白浓度。取50 μg蛋白样品经10%SDS-PAGE凝胶电泳后,半干法转PVDF膜,于5%脱脂奶粉中室温封闭2 h,将膜置于IKKα兔多克隆抗体稀释液(1 :1 000)、β-actin小鼠单克隆抗体(1 :1 000),4 ℃孵育过夜,PBST洗膜后,将膜置于二抗(1 :10 000)中室温孵育2 h,PBST洗膜3次,ECL化学发光试剂均匀涂于膜上,于化学发光检测仪上检测。
1.7 细胞转染及报告基因检测THP-1和Raw246.7细胞生长至对数生长期,将细胞于转染前24 h接种至24孔培养板中(密度约为1×105个细胞/孔),继续培养16 h后,根据TurboFect转染试剂(美国Fermentas公司)说明将pGL/promoter-miR-16报告基因质粒(含miR-16基因的启动子)转染细胞,同时转染内参海肾报告基因质粒p-TK,转染6 h后,细胞换成低血清(2%)培养基,再经PPARγ激动剂RGZ(终浓度为5 μmol/L)、拮抗剂GW9662(终浓度为10 μmol/L)处理细胞、以及对照DMSO分别处理24 h,收集细胞,经细胞裂解液裂解细胞,离心收集上清,根据Dual-LuciferaseTM Reporter Assay System试剂盒(Promega公司)说明,于化学发光检测仪上分别检测虫荧光和海肾荧光的发光强度,并以海肾荧光强度作为内参,通过虫荧光和海肾荧光的比值进行统计学分析。
1.8 血清TNFα和IL-6检测均采用双抗体夹心ELISA法检测,具体步骤按说明书操作。
1.9 统计学分析计量数据以x±s表示,采用SPSS18.0统计软件进行分析,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,P < 0.05差异有统计学意义。
2 结果 2.1 脓毒症患者外周血单核细胞中PPARγ与miR-16的表达显著正相关收集20例脓毒症患者和20例健康者的外周血单核细胞,经real time RT-PCR检测PPARγ和miR-16的表达。如图 1所示,相对于健康者,脓毒症患者外周血单核细胞中PPARγ与miR-16的表达均降低(P < 0.05,图 1A、B),经Pearson相关性分析显示,二者的表达呈显著负相关(R2=0.839,P < 0.05,图 1C),提示PPARγ与miR-16可能有一定的表达调控关系。
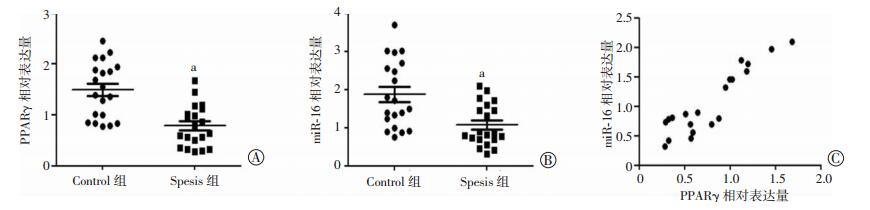
|
| 图 1 Real-time PCR检测脓毒症患者外周血单核细胞中PPARγ(A)与miR-16(B)的表达情况以及他们表达的相关性分析(C) |
2.2 活化的PPARγ上调THP-1和RAW246.7细胞中miR-16的表达
人单核细胞THP-1和小鼠巨噬细胞RAW246.7细胞经PPARγ激动剂罗格列酮(RGZ)处理,结果显示,相对于对照(DMSO)组,PPARγ激动剂RGZ显著促进miR-16的表达,同时miR-16靶基因IKKα的表达受到抑制(P < 0.05,图 2A、B); 细胞经PPARγ siRNA处理以沉默PPARγ,再加入PPARγ激动剂RGZ处理细胞,结果显示,相对于对照组,沉默PPARγ后,miR-16表达明显降低,而miR-16靶基因IKKα的表达则增强(P < 0.05,图 2C、D); 此外,细胞经miR-16抑制剂(antagomir-16)处理细胞以抑制内源性miR-16及其功能,再加入PPARγ激动剂RGZ,结果显示,相对于对照组(antagomir-16 NC),miR-16靶基因IKKα的表达得以回复(P < 0.05,图 2E)。以上结果提示,激动剂RGZ活化PPARγ可促进miR-16的表达,进而抑制miR-16靶分子IKKα的表达。
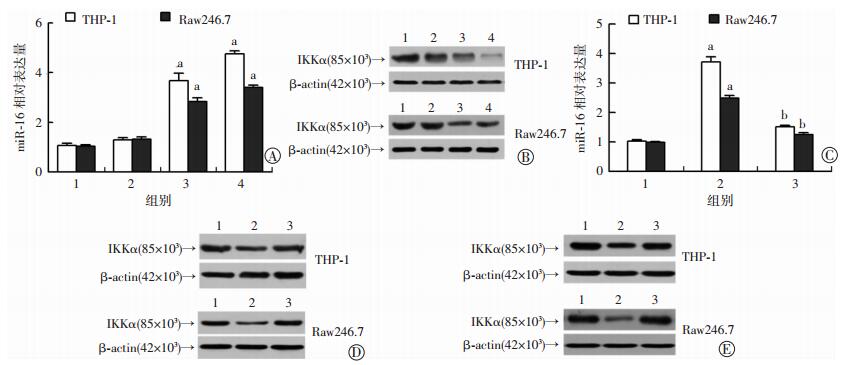
|
| A、B:Real-time PCR(A)和Western blot(B)检测miR-16(A)及其靶基因IKKα(B)在PPARγ激动剂RGZ处理THP-1和RAW246.7细胞后表达结果。1:DMSO组; 2~5:0.5、2、5 μmol/L RGZ组。a:P < 0.05,与DMSO组比较; C、D:Real-time PCR(C)和Western blot(D)检测miR-16(C)及其靶基因IKKα(D)在PPARγ siRNA处理THP-1和RAW246.7细胞后表达结果。1:DMSO+siControl组; 2:5 μmol/L RGZ+siControl组; 3:5 μmol/L RGZ+siPPARγ组a:P < 0.05,与DMSO+siControl组比较; b:P < 0.05,与5 μmol/L RGZ+siControl组比较; E:Western blot检测miR-16靶基因IKKα在miR-16抑制剂antagomir-16和PPARγ激动剂RGZ处理THP-1和RAW246.7细胞后表达结果。1:DMSO+antagomir-16 NC组; 2:5 μmol/L RGZ+antagomir-16 NC组; 3:5 μmol/L RGZ+antagomir-16组 图 2 Real-time PCR和Western blot检测活化的PPARγ对miR-16表达的影响 |
2.3 活化的PPARγ促进miR-16的启动子活性
为了进一步探讨PPARγ上调miR-16表达的具体分子机制,将含有miR-16启动子的报告基因质粒转入细胞,再经PPARγ激动剂RGZ或拮抗剂GW9662处理,通过检查报告基因活性发现,相对于对照组,激动剂活化的PPARγ可明显增强miR-16的启动子活性,而相对于激动剂,PPARγ拮抗剂GW9662则明显抑制了miR-16的启动子活性(P < 0.05,图 3A、B)。以上结果提示,激动剂RGZ活化PPARγ促进miR-16的表达可能通过在转录水平上增强miR-16启动子活性实现。
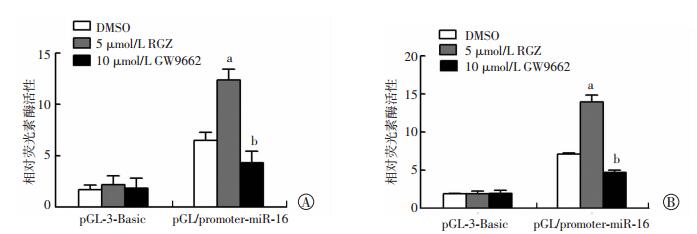
|
| A:THP-1细胞转染报告基因质粒的萤火虫荧光素酶/海肾荧光素酶活性; B:Raw246.7细胞转染报告基因质粒的萤火虫荧光素酶/海肾荧光素酶活性; a:P < 0.05,与DMSO组比较; b:P < 0.05,与5 μmol/L RGZ组比较; 图 3 双荧光素酶报告基因检测活化的PPARγ对miR-16启动子活性的影响 |
2.4 激动剂活化的PPARγ上调miR-16进而抑制炎症细胞释放细胞因子
细胞经PPARγ激动剂RGZ处理,再经LPS (100 ng/mL)处理细胞,ELISA检测炎症细胞因子TNFα和IL-6的表达,结果显示,相对于对照组,PPARγ可显著降低LPS诱导的炎症因子TNF-α和IL-6的表达(P < 0.05,图 4A、B); 此外,细胞转入antagomir-16可显著减弱PPARγ对LPS诱导的炎症因子TNFα和IL-6的抑制作用(P < 0.05,图 4C、D)。以上结果提示,PPARγ对炎症细胞产生炎症因子的抑制作用,部分由miR-16介导。
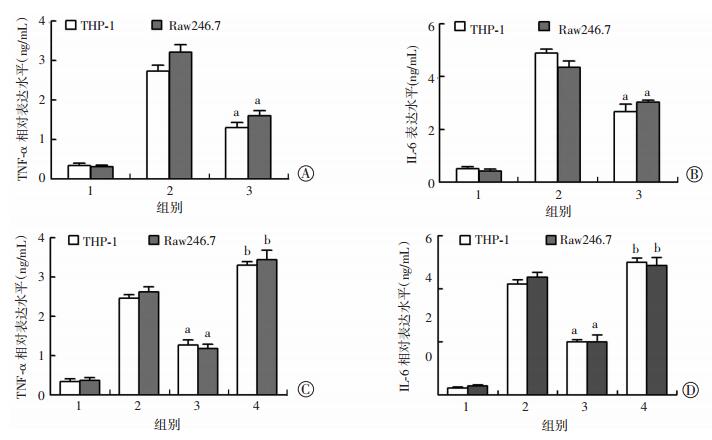
|
| A、B:ELISA检测TNF-α(A)和IL-6(B)在THP-1和Raw246.7细胞中的表达。1:MOCK组; 2:LPS+DMSO组; 3:LPS+5 μmol/L RGZ组; a:P < 0.05,与LPS+DMSO组比较; C、D:ELISA检测TNF-α(C)和IL-6(D)在THP-1和Raw246.7细胞转染antagomir-16后的表达。1:MOCK组; 2:LPS+DMSO+antagomir-16 NC组; 3:LPS+5 μmol/L RGZ+antagomir-16 NC组; 4:LPS+5 μmol/L RGZ+antagomir-16组; a:P < 0.05,与LPS+DMSO+antagomir-16 NC组比较; b:P < 0.05,与LPS+5 μmol/L RGZ+antagomir-16 NC组比较 图 4 ELISA检测PPARγ上调miR-16进而抑制炎症细胞TNF-α和IL-6的表达情况 |
2.5 激动剂活化的PPARγ上调miR-16进而抑制脓毒症小鼠的炎症反应
LPS诱导的脓毒症小鼠经PPARγ激动剂RGZ处理,经Real-time PCR检测小鼠外周血单核细胞中miR-16的表达,ELISA检查血清炎症因子TNF-α和IL-6的表达。结果显示,相对于对照组,激动剂RGZ组小鼠外周血单核细胞中miR-16表达升高(P < 0.05,图 5A),且血清TNF-α和IL-6的表达显著减弱(P < 0.05,图 5B、C); 进一步采用antagomir-16(抑制内源性miR-16的表达和功能),结果发现,antagomir-16预处小鼠的血清炎症因子TNF-α和IL-6的表达明显增加。(P < 0.05,图 5D、E)。以上结果提示,PPARγ上调miR-16的表达可抑制脓毒症小鼠的炎症反应,对脓毒症小鼠具有一定的保护作用。
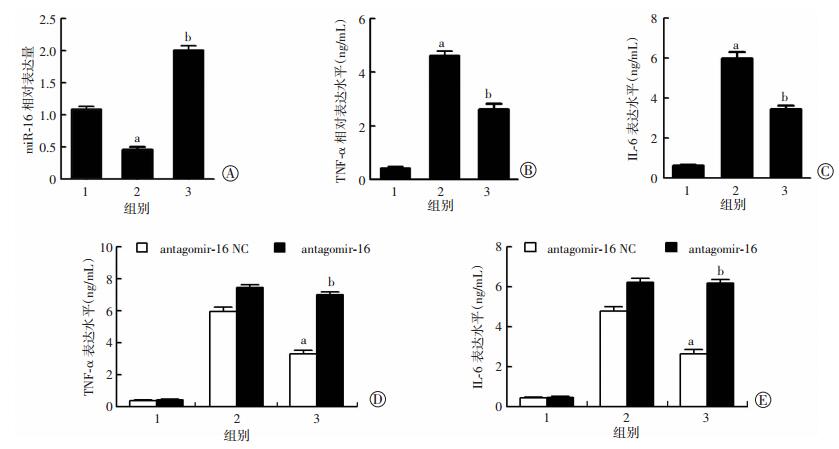
|
| A:Real-time PCR检测LPS诱导的脓毒症小鼠外周血单核细胞miR-16的表达; B、C:ELISA检测LPS诱导的脓毒症小鼠血清TNF-α(B)和IL-6(C)的表达。1:Vehicle组; 2:LPS+DMSO组; 3:LPS+5 μmol/L RGZ组; a:P < 0.05,与Vehicle组比较; b:P < 0.05,与LPS+DMSO组比较; D:ELISA检测小鼠经antagomir-16处理后TNF-α(D)和IL-6(E)的表达。1:Vehicle组; 2:LPS+DMSO组; 3:LPS+5 μmol/L RGZ组; a:P < 0.05,与LPS+DMSO+antagomir-16 NC组比较; b:P < 0.05,与LPS+5 μmol/L RGZ+antagomir-16 NC组比较 图 5 PPARγ上调miR-16抑制脓毒症小鼠的炎症反应情况 |
3 讨论
脓毒症是ICU主要死亡原因,缺乏有效的救治手段,已成为重症医学研究的重点。研究发现,炎症信号通路的激活和级联放大,导致炎症细胞因子过度释放是脓毒症发生发展的重要机制之一,因此有效地抑制促炎症因子,调节促炎因子和抗炎因子之间的平衡,是提高脓毒症患者生存率的关键。
miRNA是生物体内长度约23个核苷酸的非编码小RNA,通过与蛋白编码基因的mRNA互补配对在转录后水平抑制靶基因的表达[6]。miRNA在机体多种生理病理过程中发挥着重要作用。在免疫炎症反应中,miRNA能直接调节促炎因子和抗炎因子的表达,还能通过调节炎症信号传导通路中的关键分子调节炎症相关因子的表达,维持促炎因子和抗炎因子间的平衡。已有的研究发现,多种miRNA与通过作用于炎症通路的重要基因而与炎症密切相关,其中包括miR-16、miR-150、miR-21、miR-146、miR-223、miR-214等等[7-9]。miRNA-146a通过作用于TLR信号通路中的关键蛋白—IL-1受体相关激酶1(IRAK1)和TNF受体相关因子6(TRAF6)来负性调节TLR的活化[10]。miRNA-155通过调节MyD88[11-12]和TAK1结合蛋白2(TAB 2)发挥调控TLR信号活化作用[13]。miRNA-21通过调节PDCD4的表达,调节NF-κB的活性[14]。miR-146a和miR-223已成为脓毒症的重要生物标志[1]。目前,通过miRNA芯片检测可以发现更多与脓毒症炎症相关的miRNA,因此,进一步筛查脓毒症炎症相关的miRNA,并深入研究其对上下游信号通路中重要分子的调控机制,可能为脓毒症的预防和治疗开拓新的思路。本实验中,我们在脓毒症患者和LPS诱导的脓毒症小鼠中发现miR-16的表达均显著下降,研究发现,miR-16可抑制IKKα的表达,进而抑制NF-κB的活化[4],提示miR-16与脓毒症密切相关,因此,有效地上调miR-16可能是有利于脓毒症的治疗。
大量的研究显示,核受体PPARγ是一个重要的抗炎分子,PPARγ与配体结合激活后通常是结合于靶基因启动子区的PPAR反应元件(PPRE)上,进而促进或抑制靶基因的转录活性。PPARγ抗炎机制主要是经过配体激活后抑制NF-κB、AP-1、MAPK等多条炎症信号通路活化,抑制促炎介质生成[15-17],抑制细胞因子,趋化因子,黏附分子等基因的表达[18]。那么,与同样具有抗炎作用的miR-16是否有一定的相关性,因此,在本实验中,我们发现在脓毒症患者外周血单核细胞中PPARγ与miR-16的表达显著正相关。这提示PPARγ与miR-16可能有一定的表达调控关系,进而我们用PPARγ激动处理人单核细胞THP-1和小鼠巨噬细胞RAW246.7细胞,结果发现miR-16的表达显著升高,同时miR-16下游的靶基因IKKα的表达也随之显著降低。通常真核生物的基因表达调控可发生在转录前、转录及转录后、翻译及翻译后水平上,PPARγ作为一个多功能的转录因子,其发挥调控作用通常是作用用靶基因的启动子区,进而发挥转录活化的功能,因此,我们通过生物信息学分析miR-16启动子区,发现其启动子区存在PPARγ的结合位点(PPRE),进一步构建含有PPARγ的结合位点miR-16启动子区的双荧光素酶报告基因,通过细胞转染和报告基因检测发现PPARγ可促进miR-16启动子的转录活性,这提示PPARγ可能在转录水平上促进miR-16的表达。转录因子调控靶基因,可能通过直接结合到靶基因启动子上,调节靶基因的表达,也可能通过影响其他转录因子而间接调控靶基因的表达的表达,因此,我们的实验中虽然发现了PPARγ可能在转录水平上促进miR-16的转录活性,但是其具体具体的调控miR-16分子机制是通过直接作用还是间接作用仍需要进一步深入研究。为了探讨PPARγ通过上调miR-16这一通路对的炎症反应的抑制作用,我们在炎症细胞和脓毒症小鼠模型上发现,PPARγ可通过上调miR-16的表达抑制炎症细胞TNF-α和IL-6的表达,并抑制LPS诱导的脓毒症小鼠的炎症反应,但其具体分子机制尚需深入研究。
综上所述,本研究证实了激动剂活化的PPARγ可在转录水平上促进miR-16的表达,抑制炎症细胞TNF-α和IL-6的产生,并抑制LPS诱导的脓毒症小鼠的炎症反应。PPARγ/miR-16通路是PPARγ和miR-16发挥抗炎作用的新机制。为深入阐明PPARγ和miR-16对脓毒症保护作用提供新的实验依据,有望成为脓毒症治疗的新靶标。
| [1] | WANG J F, YU M L, YU G, et al. Serum miR-146a and miR-223 as potential new biomarkers for sepsis[J]. Biochem Biophys Res Commun, 2010, 394(1): 184–188. DOI:10.1016/j.bbrc.2010.02.145 |
| [2] | CAI Z G, ZHANG S M, ZHANG Y, et al. MicroRNAs are dynamically regulated and play an important role in LPS-induced lung injury[J]. Can J Physiol Pharmacol, 2012, 90(1): 37–43. DOI:10.1139/y11-095 |
| [3] | HUANG C, XIAO X, CHINTAGARI N R, et al. MicroRNA and mRNA expression profiling in rat acute respiratory distress syndrome[J]. BMC Med Genomics, 2014, 7: 46. DOI:10.1186/1755-8794-7-46 |
| [4] | LI T, MORGAN M J, CHOKSI S, et al. MicroRNAs modulate the noncanonical transcription factor NF-kappaB pathway by regulating expression of the kinase IKKalpha during macrophage differentiation[J]. Nat Immunol, 2010, 11(9): 799–805. DOI:10.1038/ni.1918 |
| [5] | KERSTEN S, DESVERGNE B, WAHLI W. Roles of PPARs in health and disease[J]. Nature, 2000, 405(6785): 421–424. DOI:10.1038/35013000 |
| [6] | BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215–233. DOI:10.1016/j.cell.2009.01.002 |
| [7] | BOLDIN M P, BALTIMORE D. MicroRNAs, new effectors and regulators of NF-kappaB[J]. Immunol Rev, 2012, 246(1): 205–220. DOI:10.1111/j.1600-065X.2011.01089.x |
| [8] | CARDOSO A L, GUEDES J R, de Lima M C. Role of microRNAs in the regulation of innate immune cells under neuroinflammatory conditions[J]. Curr Opin Pharmacol, 2016, 26: 1–9. DOI:10.1016/j.coph.2015.09.001 |
| [9] | TOMANKOVA T, PETREK M, GALLO J, et al. MicroRNAs: Emerging Regulators of Immune-Mediated Diseases[J]. Scand J Immunol, 2012, 75(2): 129–141. DOI:10.1111/j.1365-3083.2011.02650.x |
| [10] | TAGANOV K D, BOLDIN M P, CHANG K J, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci USA, 2006, 103(33): 12481–12486. DOI:10.1073/pnas.0605298103 |
| [11] | TANG B, XIAO B, LIU Z, et al. Identification of MyD88 as a novel target of miR-155, involved in negative regulation of Helicobacter pylori-induced inflammation[J]. FEBS Lett, 2010, 584(8): 1481–1486. DOI:10.1016/j.febslet.2010.02.063 |
| [12] | HUANG R S, HU G Q, LIN B, et al. MicroRNA-155 silencing enhances inflammatory response and lipid uptake in oxidized low-density lipoprotein-stimulated human THP-1 macrophages[J]. J Investig Med, 2010, 58(8): 961–967. DOI:10.231/JIM.0b013e3181ff46d7 |
| [13] | CEPPI M, PEREIRA P M, DUNAND-SAUTHIER I, et al. MicroRNA-155 modulates the interleukin-1 signaling pathway in activated human monocyte-derived dendritic cells[J]. Proc Natl Acad Sci USA, 2009, 106(8): 2735–2740. DOI:10.1073/pnas.0811073106 |
| [14] | SHEEDY F J, PALSSON-MCDERMOTT E, HENNESSY E J, et al. Negative regulation of TLR4 via targeting of the proinflammatory tumor suppressor PDCD4 by the microRNA miR-21[J]. Nat Immunol, 2010, 11(2): 141–147. DOI:10.1038/ni.1828 |
| [15] | KIM J S, LEE Y H, CHANG Y U, et al. PPARγ regulates inflammatory reaction by inhibiting the MAPK/NF-κB pathway in C2C12 skeletal muscle cells[J]. J Physiol Biochem, 2017, 73(1): 49–57. DOI:10.1007/s13105-016-0523-3 |
| [16] | WANG F, LIU Y, BI Z. Pioglitazone inhibits growth of human retinoblastoma cells via regulation of NF-κB inflammation signals[J]. J Recept Signal Transduct Res, 2017, 37(1): 94–99. DOI:10.3109/10799893.2016.1171341 |
| [17] | SENOL S P, TEMIZ M, GUDEN D S, et al. Contribution of PPARα/β/γ, AP-1, importin-α3, and RXRα to the protective effect of 5, 14-HEDGE, a 20-HETE mimetic, against hypotension, tachycardia, and inflammation in a rat model of septic shock[J]. Inflamm Res, 2016, 65(5): 367–387. DOI:10.1007/s00011-016-0922-5 |
| [18] | FUENTES E, GUZM N-JOFRE L, MOORE-CARRASCO R, et al. Role of PPARs in inflammatory processes associated with metabolic syndrome (Review). Mol Med Rep[J]. 2013, 8(6): 1611-1616. DOI: 10.3892/mmr.2013.1714. |



