2. 510220 广州,南方医科大学珠江医院超声诊断科
2. Department of Ultrasound diagnosis, Zhujiang Hospital, Southern Medical University, Guangzhou, Guangdong Province, 510220, China
动脉粥样硬化是建立在动脉粥样硬化斑块基础之上的一种最为常见的动脉硬化类型,是多数心脑血管疾病的病理基础[1]。动脉粥样硬化主要病理表现为动脉壁的脂质浸润、血小板沉积、内膜炎症性损伤、血管平滑肌及纤维组织增生等,从而造成患者心、脑、肾等重要器官缺血,发生功能障碍而导致死亡[2]。动脉粥样硬化斑块的发病机制十分复杂,多种基因参与其中。血凝素样氧化低密度脂蛋白受体1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)能够介导内皮细胞摄取氧化型低密度脂蛋白(oxidized low density lipoproteins,ox-LDL),后者已被证实是诱导血管内皮细胞损伤、炎症细胞趋化、泡沫细胞形成、血小板活化及单核细胞增生的关键[3]。研究证实,临床常用的他汀类降脂药、阿司匹林等抗炎药物、二甲双胍等降糖药及姜黄素等抗氧化剂可以降低LOX-1的表达,而钙通道阻滞剂则能抑制其功能[4]。然而,这些药物都无法从根本上消除LOX-1的致病影响。本研究旨在通过一系列体内外实验证实,超声微泡造影剂能够作为载体向大鼠血管内皮细胞中转染LOX-1特异性siRNA并发挥相应的生物学效应,对动脉粥样硬化斑块发挥治疗作用。
1 材料与方法 1.1 主要试剂及设备主要试剂:oxLDL购自广州奕源生物公司。siRNA由苏州吉玛公司合成并进行FAM荧光标记及2'-O-me修饰;Lipofectamin 2000、TRIzol购自美国Invitrogen公司;反转录试剂盒及SYBR Green PCR Master Mix试剂盒购自大连宝生物公司;兔抗LOX-1多克隆抗体、兔抗β-actin多克隆抗体均购自英国Abcam公司;细胞裂解液及Western blot全套试剂购自上海碧云天公司。设备:CO2培养箱(美国Thermo公司),激光共聚焦显微镜(日本Nikon公司),倒置显微镜(德国Zeiss公司),Nanodrop2000超微量分光光度计(美国Thermo公司),NanoBrook 90Plus Zeta电位-粒度分析仪(美国Brookhaven公司),CFX96荧光定量PCR仪(美国伯乐公司),水平及垂直电泳仪/转膜仪(美国伯乐公司),凝胶成像系统(美国UVP公司),高速低温离心机(德国Eppendoff公司),EUB-6500 B型超声诊断仪(日本日立公司)。
1.2 平滑肌细胞培养动脉平滑肌细胞(vascular smooth muscle cells,VSMCs)培养及鉴定参考熊晓昉等[5]方法,将5只实验Wistar大鼠(购自并饲养于南方医科大学实验动物中心SPF实验室)先后脱颈处死后,浸泡于75%酒精中消毒10 min,无菌条件下取胸主动脉,清洗血液,取平滑肌层修剪为1 mm2小块,置于培养皿中贴壁,4 h后加入添加了10%胎牛血清(美国Gibco公司)及终浓度为100 U/mL的青链霉素的DMEM培养基(美国Invitrogen公司),培养环境37 ℃,5%CO2;待细胞爬出并覆盖80%培养皿底后,消化细胞传代,典型的VSMCs呈梭形,生长密集时呈“峰谷样形态”,传3~4代待形状稳定后的细胞用于后续实验。
1.3 载siRNA微泡的构建采用李硕阳等[6]方法构建载siRNA微泡,以二棕榈酰磷脂酰胆碱、二硬脂酰基磷脂酰乙醇胺及二苯基磷酰基叠氮化物为基本原料,通过薄膜-水化-超声乳化法构建脂质纳米泡(nanobubbles, NBs-siRNA),PEG-PLL两嵌段共聚物能够与siRNA自组装形成PEG-PLL-siRNA胶束,NBs可以和带正电的PEG-PLL-siRNA胶束结合组装成为NBs-siRNA微泡。用PBS溶液稀释样品后,将其置于电位-粒度分析仪样品池中,在激发波长660 nm、激发角度90°的条件下(室温)检测微泡的粒径及Zeta电位分布情况。
1.4 凝胶迁移阻滞实验将siRNA溶液、PEG-PLL-siRNA及NBs-siRNA微泡溶液(siRNA上样量为0.1 μg)上样于1%琼脂糖凝胶后进行电泳(电压100 V),凝胶成像系统观察后照相。
1.5 siRNA细胞内化实验将对数生长期的VSMCs消化、离心接种于6孔板中培养24 h;将细胞分为2组,阴性对照组培养液加入FAM标记的LOX-1-siRNA(F-LOX-1-siRNA)/PBS混合液,转染组使用Lipofectamin 2000转染F-LOX-1-siRNA,实验组使用超声治疗仪,将含有F-LOX-1-siRNA的NBs-siRNA微泡(F-NBs-siRNA)转染入靶细胞内,参数设置为频率2.0 MHz,强度2.0 W/cm2,辐照时间1 min;6 h后避光条件下消化细胞,PBS洗后重悬,上流式细胞仪(Cytomics FC 500型,美国贝克曼公司)检测荧光信号。
1.6 LOX-1靶基因沉默实验将对数生长期的VSMCs消化、离心接种于6孔板中培养24 h;将细胞分为3组,阴性对照组培养液加入LOX-1-siRNA/PBS混合液,实验组使用超声治疗仪将含有LOX-1-siRNA的NBs-siRNA微泡100 μg(以siRNA计量)转染入细胞(条件同1.5),转染组使用Lipofectamin 2000转染LOX-1-siRNA,孵育48 h;qRT-PCR检测各组细胞LOX-1 mRNA:LOX-1引物上游5′-GA-AGCCTAAAGGGCTGCATTTGCT-3′,下游5′-AGTTAA-AGGGCCCATGGAAGAGGT-3′;β-actin上游5′-CAGG-GCGTGATGGTGGGCA-3′,下游5′-CAAACATCATCTG-GGTCATCTTCTC-3′,每样设3复孔,参数设置:95 ℃ 3 min,94 ℃ 10 s,56 ℃ 15 s,72 ℃ 15 s,54个循环;Western blot检测各组LOX-1蛋白表达水平:将样品于冰上加入RIPA细胞裂解液(上海碧云天公司)后提取总蛋白,BCA试剂盒(美国Pierce公司)定量,加入上样缓冲液制样,行SDS聚丙烯酰胺凝胶电泳后转膜,封闭后与兔多克隆LOX-1抗体(美国Abcam公司,1:1 000)4 ℃共孵育过夜,之后加入HRP标记的羊抗兔二抗室温孵育1 h,ECL法显影后,使用成像仪拍照(上海天能公司)。
1.7 细胞泡沫化实验将对数生长期的VSMCs消化、离心接种于载有盖玻片的6孔板中培养24 h;将细胞分为4组,阴性对照组、oxLDL诱导组、实验组及转染组。实验组使用超声治疗仪将含有LOX-1-siRNA的NBs-siRNA微泡100 μg(以siRNA计量)转染入细胞(条件同1.5),转染组使用Lipofectamin 2000转染LOX-1-siRNA,孵育48 h;之后阴性对照组培养液加入PBS溶液,oxLDL诱导组、实验组及转染组给予终浓度为60 μg/mL的oxLDL诱导;48 h后去培养液,PBS洗3次后使用多聚甲醛固定,油红O染色10 min,60%酒精分化30 s,捞取盖玻片,树胶封片,显微镜照相,观察细胞内脂质聚集情况。
1.8 体内实验健康SPF级Wistar大鼠50只,均为雄性,体质量180~200 g,购买并寄养于南方医科大学实验动物中心。将实验鼠分为4组,即阴性对照组、siRNA对照组、实验组及微泡对照组。阴性对照组实验鼠给予基础饲料,后3组实验鼠根据郭延松等[7]方法采用高脂饲料饲养+维生素D3肌肉注射+主动脉球囊损伤术的方法大鼠构建动脉硬化模型:高脂饲料配方包括2%胆固醇、0.5%胆酸钠、3%猪油、0.2%丙基硫氧嘧啶及94.3%基础饲料;维生素D3注射剂量为1.25×106U/kg;主动脉球囊损伤术:切开大腿根部皮肤,分离暴露股浅动脉,逆行插入20 mm×2 mm带球囊导管,充气后缓慢回拉造成动脉内膜损伤,放气后再次插管、回拉,重复3次之后结扎动脉,缝合伤口。造模成功后,阴性对照组给予NC-siRNA/PBS鼠尾静脉注射,siRNA对照组给予LOX-1-siRNA/PBS溶液鼠尾静脉注射;实验组经鼠尾静脉注射含有LOX-1-siRNA的NBs-siRNA微泡100 μg,并于注射4 h后使用超声仪在造模部位以频率1 MHz,强度2.0 W/cm2,照射15 min;微泡对照组注射含有LOX-1-siRNA的NBs-siRNA微泡100 μg,但不进行超声仪照射。治疗15 d后,处死实验鼠,剥离造模动脉约2 cm,部分组织使用4%多聚甲醛固定,苏丹Ⅲ染色后取斑块形成区域进行石蜡切片HE染色;采用免疫组化法检测斑块组织中LOX-1表达情况(全套试剂购自武汉博士德公司),采用半定量计分法[8]根据阳性细胞数及着色情况对LOX-1表达进行评估。
1.9 统计学分析使用SPSS 22.0统计软件对数据进行处理,数据以x±s表示,对NBs-siRNA微泡的粒径及Zeta电位进行单因素方差分析,对qRT-PCR、Western blot靶基因沉默实验组间的两两比较采用LSD-t检验,以α=0.05为检验水准。
2 结果 2.1 NBs-siRNA微泡的粒径及Zeta电位siRNA带正电荷,NBs带有负电荷,两者通过电场力结合在一起,NBs-siRNA胶束带弱正电,与预期相符,粒径较负载前增大约30 nm(表 1)。
| 粒子 | 粒径(nm) | Zeta电位(mV) |
| PEG-PLL-siRNA | 60.5±7.7 | 23.4±0.9 |
| NBs | 229.7±34.6 | -18.5±0.7 |
| NBs-siRNA | 261.3±28.7 | 9.5±1.2 |
2.2 凝胶迁移阻滞实验
实验结果显示,PEG-PLL可使siRNA电泳速度减慢,而NBs可以将所含siRNA阻滞于加样孔中,证实NBs与siRNA结合在一起,NBs-siRNA微泡构建成功(图 1)。
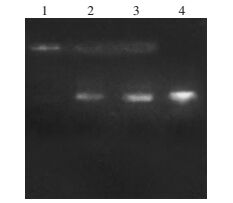
|
| 1:NBs-siRNA;2、3:PEG-PLL-siRNA;4:siRNA 图 1 凝胶迁移阻滞实验验证NBs与siRNA结合 |
2.3 siRNA细胞内化实验
流式细胞实验结果显示,阴性对照组细胞内无荧光信号,而与使用Lipofectamin 2000转染FAM-LOX-1-siRNA的转染组类似,实验组VSMCs中可检测到荧光信号,流式细胞峰出现荧光偏移,说明NBs可通过超声照射介导siRNA内化入VSMCs之中(图 2)。

|
| A:阴性对照组;B:转染组;C:实验组 图 2 siRNA细胞内化实验 |
2.4 靶基因沉默实验
qRT-PCR及Western blot检测结果显示,与阴性对照组类似,实验组VSMCs LOX-1-mRNA及蛋白表达水平降低(P<0.01),但与阳性对照组相比其基因沉默效率稍高(图 3)。
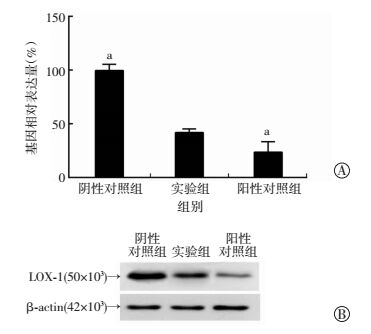
|
| a:P<0.01,与实验组比较 图 3 qRT-PCR(A)和Western blot(B)靶基因沉默实验 |
2.5 细胞泡沫化实验
实验组使用超声辐照介导NBs-siRNA内化入VSMCs,转染组使用Lipofectamin 2000向VSMCs转染LOX-1-siRNA,之后加入oxLDL诱导细胞泡沫化。结果显示,与加入PBS的阴性对照组相比,其余3组细胞胞浆内均有油红O阳性染色表现,出现不同程度的泡沫化表现,以oxLDL诱导组最为显著,实验组次之,转染组最弱(图 4)。
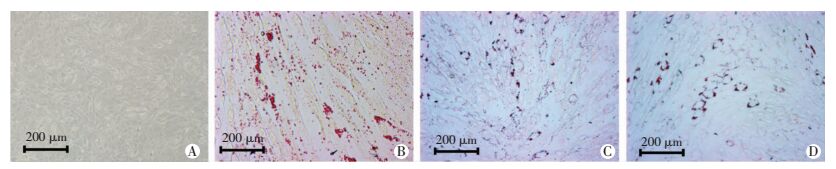
|
| A:阴性对照组;B:oxLDL诱导组;C:实验组;D:转染组 图 4 油红O染色观察各组细胞泡沫化表现(LM) |
2.6 体内实验
各组实验鼠主动脉标本经苏丹Ⅲ染色后,可见橙红色动脉粥样硬化斑块,取斑块部位进行石蜡包埋后行HE染色。结果显示,阴性对照组、siRNA对照组及微泡对照组大鼠动脉硬化斑块处内膜增厚、管腔狭窄,内膜下炎性细胞浸润,并有大量脂质沉积,可见斑块形成,中膜平滑肌细胞排列紊乱;而实验组大鼠动脉斑块病变中内膜增厚、中膜萎缩及炎细胞浸润情况与阴性对照组、siRNA对照组、微泡对照组比较程度较轻(图 5)。免疫组化实验结果显示,实验组动脉斑块中LOX-1表达水平较阴性对照组、siRNA对照组及微泡对照组降低(P<0.01,图 6、7)。

|
| A:阴性对照组;B:siRNA对照组;C:实验组;D:微泡对照组 图 5 HE染色观察各组动脉硬化斑块情况(LM ×200) |

|
| A:阴性对照组;B siRNA对照组;C:实验组;D:微泡对照组 图 6 免疫组化观察各组动脉斑块中LOX-1的表达(S-P) |
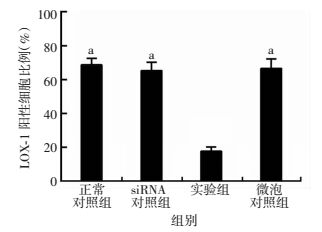
|
| a:P<0.01,与实验组比较 图 7 各组动脉斑块LOX-1表达定量分析 |
3 讨论
LOX-1是一种广泛表达于巨噬细胞、血管内皮细胞及血管平滑肌细胞等细胞膜上的跨膜受体,由270个氨基酸组成,包括N端胞质结构域、跨膜域、颈结构域及C端血凝素样结构域,oxLDL是其主要配体[9]。正常血管壁中,LOX-1表达量极低而难以被检测到,在各种促动脉粥样硬化因素的作用下,LOX-1表达水平将迅速上调。研究表明,LOX-1和oxLDL之间存在着正反馈关系,一方面,LOX-1可以通过介导细胞摄取oxLDL来促进泡沫细胞的形成;另一方面,进入细胞内的oxLDL又可以通过NF-κB等信号通路上调LOX-1表达,进一步增强了细胞对oxLDL摄取能力[10]。除oxLDL可以调节LOX-1表达外,同型半胱氨酸、C反应蛋白也被认为是LOX-1的配体,能够与其结合并促进内皮细胞等对炎症因子的合成和释放,进而损伤血管壁,促进动脉粥样硬化的形成。此外,脂多糖、TNF-α、TGF-β、IL-1、IL-6等炎症因子也同样可以诱导LOX-1的表达[11]。因此,一旦LOX-1表达被激活,就意味着一系列促动脉粥样硬化反应的启动,因此有必要采取措施阻断LOX-1与其配体之间的相互作用。熊晓舫等[5]研究表明,小蘖碱可以通过抑制LOX-1表达及NF-κB信号通路活性,减少oxLDL的摄取及VSMCs泡沫化,可能对动脉硬化斑块发挥治疗作用。林清飞等[12]发现虾青素可以降低大鼠体内oxLDL水平,抑制主动脉内皮细胞LOX-1的表达及氧化应激反应的严重程度。此外,研究表明临床常用的他汀类降脂药物既可以使LOX-1因无法在细胞膜表面实现集中分布而活性降低,又可以阻断其与oxLDL的结合位点而减轻细胞泡沫化程度,从而发挥抗动脉粥样硬化的作用[13]。然而,抗动脉粥样硬化药物均存在不同程度的副作用,因此有必要找出靶向性好的治疗策略。
靶向超声微泡是近几年发展起来的一种极有可能应用于临床的新型药物递送介质,其既能递送药物发挥治疗作用,又能实现对病灶的分子成像,具有辅助诊断、追踪疗效的作用[14]。本实验主要关注于能否降低病灶部位的LOX-1基因表达,进而减轻动脉粥样硬化损害。siRNA能够特异性地沉默靶基因表达,是基础研究中应用十分广泛的基因操纵工具。体外实验中,siRNA可以凭借脂质体介导或电穿孔,通过细胞膜进入靶细胞内部,但体内实验却无法以相同方式获得相同的细胞内化效果[15]。因此,人们开发出了包括抗体、单链抗体、纳米颗粒等一系列载体以期介导特异性siRNA通过血液循环到达病灶,内化入细胞发挥靶基因沉默的生物学作用[16]。我们考虑,如果能够将超声微泡的靶向性与siRNA的基因沉默作用结合起来,也许能发挥出一定的治疗效果。本研究通过鼠尾静脉注射载LOX-1-siRNA微泡,待其广泛分布于血液循环之中后,在病灶部位进行超声照射。结果显示,超声可以介导循环中的载LOX-1-siRNA微泡进入病灶中的内皮细胞或平滑肌细胞,抑制LOX-1表达,进而减轻动脉硬化斑块的严重程度。前期预实验中,我们通过活体成像观察到在注射4 h后超声微泡可分布于大鼠全身血液循环,因此将超声照射时间定为注射后4 h。此外,我们考虑如果能在超声微泡表面偶联抗体或单链抗体也许能够进一步降低超声微泡的总体用量,提高其靶向性。
综上所述,本研究成功制备了能够有效运载LOX-1-siRNA的超声微泡,体内外实验证实该微泡可以在超声辐照下内化入靶细胞内部,下调LOX-1表达,减少泡沫细胞形成,降低动脉硬化斑块病变的严重程度。
| [1] | MOORE K J, SHEEDY F J, FISHER E A. Macrophages in atherosclerosis: A dynamic balance[J]. Nat Rev Immunol, 2013, 13(10): 709–721. DOI:10.1038/nri3520 |
| [2] | ZERNECKE A, WEBER C. Chemokines in atherosclerosis: Proceedings resumed[J]. Arterioscler Thromb Vasc Biol, 2014, 34(4): 742. DOI:10.1161/ATVBAHA.113.301655 |
| [3] | TRPKOVIC A, RESANOVIC I, STANIMIROVIC J, et al. Oxidized low-density lipoprotein as a biomarker of cardiovascular diseases[J]. Crit Rev Clin Lab Sci, 2015, 52(2): 70. DOI:10.3109/10408363.2014.992063 |
| [4] |
李倩, 芮耀诚. LOX-1—心血管疾病防治的新靶标[J].
药学实践杂志, 2014(5): 321–323.
LI Q, RUI Y C. LOX-1, a new target in cardiovascular disease[J]. J Pharm Prac, 2014(5): 321–323. DOI:10.3969/j.issn.1006-0111.2014.05.001 |
| [5] |
熊晓昉, 蒋雯, 祝芬, 等. 小蘖碱对oxLDL诱导平滑肌细胞泡沫化及LOX-1、NF-κB表达变化的影响[J].
微循环学杂志, 2014, 24(2): 31–34.
XIONG X F, JIANG W, ZHU F, et al. Effect of berberine on oxLDL induced foam cell formation and LOX-1, NF-κB expression in vascular smooth muscle cells[J]. Chin J Microcirc, 2014, 24(2): 31–34. DOI:10.3969/j.issn.1005-1740.2014.02.008 |
| [6] |
李硕阳, 尹庭辉, 李景果, 等. 载sirna微泡实现肿瘤治疗与疗效评估一体化的可行性分析[J].
南方医科大学学报, 2015, 35(6): 874–878.
LI S Y, YIN T H, LI J G, et al. Feasibility of integrating tumor therapy with therapeutic effect evaluation using siRNA-loaded microbubbles[J]. J Southern Med Univ, 2015, 35(6): 874–878. DOI:10.3969/j.issn.1673-4254.2015.06.019 |
| [7] |
郭延松, 吴宗贵, 杨军柯, 等. 三种大鼠动脉粥样硬化模型复制方法的比较[J].
中国动脉硬化杂志, 2003, 11(5): 465–469.
GUO Y S, WU Z G, YANG J K, et al. Comparison on the three duplication methods of atherosclerosis model in rats[J]. Chin J Arteriosler, 2003, 11(5): 465–469. DOI:10.3969/j.issn.1007-3949.2003.05.021 |
| [8] |
刘莉, 陆远, 王媛, 等. Egfr、her2、cxcr4在非小细胞肺癌中的表达及临床意义[J].
现代生物医学进展, 2014, 14(6): 1069–1073.
LIU L, LU Y, WANG Y, et al. Expression and clinical significance of EGFR, HER2 and CXCR4 in non-small cell lung cancer[J]. Prog Mod Biomed, 2014, 14(6): 1069–1073. DOI:10.13241/j.cnki.pmb.2014.06.018 |
| [9] |
刘军锋, 贾克刚, 刘运德. 血凝素样氧化低密度脂蛋白受体-1与冠心病损伤机制的研究现状[J].
中华临床医师杂志:电子版, 2013, 7(9): 147–149.
LIU J F, JIA K G, LIU Y D. The research progress of lectin like oxidized low-density lipoprotein receptor -1 and the mechanism of coronary heart disease injury[J]. Chin J Clinicians (Electr Ed), 2013, 7(9): 147–149. DOI:10.3877/cma.j.issn.1674-0785.2013.09.051 |
| [10] | CHEN B, LI J, ZHU H. AMP-activated protein kinase attenuates oxLDL uptake in macrophages through PP2A/NF-κB/LOX-1 pathway[J]. Vascul Pharmacol, 2016, 85: 1–10. DOI:10.1016/j.vph.2015.08.012 |
| [11] | HOSSAIN E, OTA A, KARNAN S, et al. Arsenic augments the uptake of oxidized ldl by upregulating the expression of lectin-like oxidized ldl receptor in mouse aortic endothelial cells[J]. Toxicol Appl Pharmacol, 2013, 273(3): 651–658. DOI:10.1016/j.taap.2013.10.012 |
| [12] |
林清飞, 王华军, 林静, 等. 虾青素对糖尿病大鼠血管内皮功能的保护作用及机制[J].
中华高血压杂志, 2015, 23(6): 530–536.
LIN Q F, WANG H J, LIN J, et al. The protective effect and related mechanisms of astaxanthin on endothelial function in diabeticrats[J]. Chin J Hypertens, 2015, 23(6): 530–536. DOI:10.16439/j.cnki.1673-7245.2015.06.016 |
| [13] | BIOCCA S, IACOVELLI F, MATARAZZO S, et al. Molecular mechanism of statin-mediated lox-1 inhibition[J]. Cell Cycle, 2015, 14(10): 1583–1595. DOI:10.1080/15384101.2015.1026486 |
| [14] |
张聪, 王玉凤, 李隆敏, 等. 靶向超声微泡在肝癌治疗领域的研究进展[J].
现代肿瘤医学, 2017, 25(1): 154–157.
ZHANG C, WANG Y F, LI L M, et al. Advances of ultrasound targeted microbubbles in the field of liver cancer treatment[J]. J Mod Oncol, 2017, 25(1): 154–157. DOI:10.3969/j.issn.1672-4992.2017.01.42 |
| [15] | WILLIFORD J M, WU J, REN Y, et al. Recent advances in nanoparticle-mediated siRNA delivery[J]. Ann Rev Biomed Eng, 2014, 16: 347–370. DOI:10.1146/annurev-bioeng-071813-105119 |
| [16] | LU Y, WANG Y, ZHANG M, et al. Her2-sirna delivered by egfr-specific single chain antibody inhibits nsclc cell proliferation and tumor growth[J]. Oncotarget, 2016, 7(17): 23594–23607. DOI:10.18632/oncotarget.8053 |



