2. 400016 重庆, 重庆医科大学:第一临床学院2013级临床医学七年制
2. Seven-year Training Group of Grade 2013, First Clinical College of Chongqing Medical University, Chongqing, 400016, China
糖尿病是一种代谢障碍性疾病, 以糖代谢紊乱为基础而出现的高血糖及伴各种并发症为主要表现, 严重损害人体健康[1]。其中, 2型糖尿病占据绝大多数, 主要表现为不同程度的机体胰岛素相对缺乏或者胰岛素抵抗。目前, 主要的糖尿病治疗方案在于通过促进胰岛素分泌或者直接注射胰岛素等各种方式, 来提升机体胰岛素水平、减轻胰岛素抵抗或者增加组织对胰岛素的敏感性, 从而提高胰岛素的利用率来治疗糖尿病。但此类药物归根结底都是利用胰岛素本身来降低血糖, 而除了它们本身的副作用外, 随着长期使用, 疗效变差, 在糖尿病晚期大多只能依靠注射胰岛素来维持生命, 这种方式既不方便, 也伴随低血糖和过敏反应的风险。因此, 如何在避免此类风险的基础上探索新的糖尿病治疗方案, 是糖尿病相关研究的重点。
机体的血糖水平离不开肝脏的代谢作用, 血糖浓度的升高一方面来自于糖原分解, 另一方面来自糖异生合成。水通道蛋白9(AQP9)是水通道蛋白的一种, 对多种小分子物质(水、甘油等)的转运有显著作用。相关研究表明, AQP9在肝细胞中大量表达[2]。肝细胞中AQP9的表达上调能够促进其对甘油的摄取, 通过糖异生作用, 会促进血糖水平的升高[3-4]。在调控AQP9表达的相关信号通路中[5], 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路发挥着重要作用, 其中经典MAPK信号通路包括:p38、ERK和JNK MAPK通路[6]。本课题组的前期实验已经证明, 在脑缺血和高渗环境下, p38-MAPK能够调控AQP9在脑组织星形胶质细胞中的表达[7-8]。然而, 目前对2型糖尿病大鼠肝脏中AQP9和MAPK信号通路之间关系的研究尚不充分。本研究旨在检测AQP9和MAPK信号通路在T2DM模型鼠肝脏中的表达变化情况, 探讨MAPK信号通路对AQP9可能的调控方式, 为通过抑制甘油糖异生途径来调节血糖平衡, 提供实验基础。
1 材料与方法 1.1 主要试剂与器材蛋白免疫印迹封闭液、一抗、二抗稀释液、DAPI、SDS-PAGE蛋白上样缓冲液(5×)、PMSF、大鼠GAPDH单克隆IgG、RIPA裂解液、BCA蛋白浓度测定试剂盒均购自碧云天生物有限公司, 链脲霉素(STZ)(Sigma公司), SDS-PAGE凝胶制备试剂盒(康为世纪生物技术公司), 化学发光(ECL)检测试剂盒于Thermo公司购得, AQP9兔抗抗体从美国ADI公司购买, 兔抗p-p38抗体、鼠抗AQP9从美国Stanta Cruz公司购买, 兔抗JNK、兔抗p38、兔抗ERK、鼠抗p-JNK、兔抗p-ERK从博士德生物技术公司购买, 488标记山羊抗兔IgG抗体从中杉金桥生物技术公司购买, 台式高速低温冷冻离心机(3K15)从Sigma公司购买, BM-E型生物研究显微镜、免疫荧光显微镜从德国Leica公司购买, 蛋白电转仪、电泳仪在Bio-Rad公司购取。
1.2 实验动物及动物模型构建健康雄性2周龄SD大鼠20只, 购自重庆医科大学实验动物中心, 称量标记后将其随机分为对照组和2型糖尿病组(n=10)。对照组大鼠普通饮食。糖尿病组大鼠高脂高糖饮食4周后, 以50 mg/kg链脲霉素(STZ)小剂量一次性腹腔注射, 3 d后监测血糖, 1周内血糖保持在16.7 mmol/L以上则认为2型糖尿病建模成功。
1.3 组织取材切片以100 g/mL腹腔注射3.5%的水合氯醛, 将麻醉好的大鼠先后打开腹腔及胸腔, 暴露肝脏及心脏, 由左心室插入灌注针头至主动脉弓处, 在右心耳处剪出开口, 用灌注泵注入4 ℃生理盐水经体循环达到右心耳, 以肝脏、四肢变苍白为宜, 切取肝脏组织, 迅速冻存于-80 ℃。
1.4 实验方法 1.4.1 观察肝脏组织形态学变化取两组大鼠肝脏组织, 使用多聚甲醛固定后, 再石蜡包埋切片, 按步骤对石蜡切片进行HE染色, 光学显微镜下观察肝脏组织的形态学改变。
1.4.2 组织免疫荧光观察AQP9在肝组织中的表达分布对肝组织行冰冻切片, 用4%多聚甲醛固定, PBS溶液清洗3次, 每次10 min, 先后浸泡于10%、20%、30%蔗糖溶液梯度脱水, 荧光封闭液封闭30 min, 设立阴性对照后, 加入一抗(1 :100)于4 ℃过夜, 37 ℃恒温箱复温1 h, PBS溶液清洗3次, 每次10 min。加入二抗(1 :200)37 ℃恒温箱孵育1 h、PBS清洗30 min、DAPI染色5 min、PBS清洗30 min。封片后于显微镜观察荧光变化[7]。实验重复3次。
1.4.3 Western blot检测AQP9蛋白水平将不同组的鼠肝脏, 加入RIPA裂解液来提取两组细胞的总蛋白, 用BCA法检测各样品蛋白浓度, 制备12%的SDS聚丙烯酰胺凝胶, 每孔按照测定的蛋白浓度均匀上量, 电泳结束后, 转至PVDF膜, 在室温下使用5%的脱脂奶粉封闭2 h, 再分别于一抗中孵育(稀释比例分别为GAPDH 1 :1 000, AQP9 1 :100, ERK 1 :200, JNK 1 :200, p38 1 :200, p-ERK 1 :200, p-JNK 1 :200, p-p38 1 :200), 在4 ℃环境下过夜, 次日TBST清洗30 min后加入二抗, 37 ℃恒温箱孵育1 h, 经TBST清洗10 min后, 在ECL化学发光试剂盒中显影[7]。各组实验最少重复3次。最后使用Quantity One软件测定各条带灰度值并分析比较, 以待测蛋白与内参的灰度值比值表示蛋白含量。
1.5 统计学分析采用SPSS 19.0统计软件, 数据以x ±s表示, 组间对应指标差异性检验采用单因素方差分析比较, 组间相关性采用计算相关系数r分析比较。
2 结果 2.1 2型糖尿病鼠的肝组织细胞形态HE染色结果表明, 对照组SD大鼠肝细胞排列整齐紧密, 细胞形态清晰, 细胞质丰富, 细胞核染色均匀(图 1A)。而与对照组相比, 2型糖尿病鼠的肝细胞排列紊乱, 细胞间隙增宽, 肝细胞水样变性, 细胞水肿明显, 并伴有炎性细胞浸润(图 1B)。

|
| A:对照组; B;2型糖尿病组 图 1 各组大鼠肝组织病理学变化(HE×400) |
2.2 AQP9在2型糖尿病鼠肝脏中的分布
对两组肝脏分别进行免疫荧光染色发现, AQP9在对照组和糖尿病组的肝脏中均有表达, 主要分布于朝向肝血窦的肝细胞质膜上。与对照组相比, 糖尿病组肝脏中AQP9的表达明显增强(图 2)。

|
| ↑:示AQP9表达位置 图 2 免疫荧光检测2组大鼠肝脏AQP9表达情况 |
2.3 AQP9在2型糖尿病肝脏中的表达
Western blot实验结果显示, AQP9在对照组与糖尿病组肝脏中均有表达, 但与正常组(0.43±0.10)相比较, 糖尿病组肝脏中AQP9的表达水平显著上升(0.95±0.09)(P < 0.01, 图 3)。
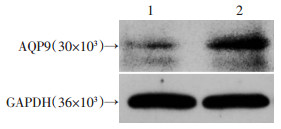
|
| 1:对照组; 2:糖尿病组 图 3 Western blot检测AQP9在肝脏中的表达 |
2.4 MAPK在2型糖尿病肝脏中的表达
Western blot实验结果显示, p38-MAPK, ERK-MAPK, JNK-MAPK在对照组与糖尿病组肝脏中均有表达, 与对照组(0.81±0.04)相比较, 2型糖尿病鼠肝脏中p-p38/p38的表达(0.40±0.04)下降(P < 0.05), 与AQP9的表达变化具有相关性(r=0.889, P < 0.05);p-JNK/JNK的表达上升[(0.57±0.06) vs (1.27±0.10)](P < 0.05), 与AQP9的表达变化具有相关性(r=0.707, P < 0.05);p-ERK/ERK的表达没有明显变化[(1.06±0.14) vs (0.96±0.04)](P>0.05, 图 4)。
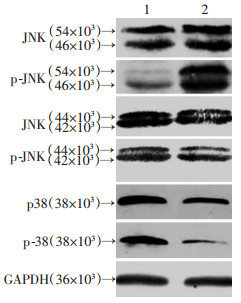
|
| 1:对照组; 2:糖尿病组 图 4 Western blot检测MAPK在肝脏中的表达变化 |
3 讨论
肝脏和骨骼肌对维持血糖水平的稳定起到重要的调节作用, 前者控制葡萄糖生成, 后者调节组织对葡萄糖的利用和消耗。众所周知, 肝脏一方面可以借糖异生合成葡萄糖, 另一方面可通过糖原分解而释放葡萄糖。而糖异生的主要底物包括乳酸、甘油和丙酮酸等, 在肾组织中谷氨酰胺也是重要的成糖物质[9]。在上述糖异生底物中, 乳酸的量是最主要的, 但绝大多数乳酸的碳架本身主要就来自于葡萄糖的代谢。所以, 这类来自乳酸的转换, 并不是真正意义上新葡萄糖的合成, 而通过脂肪分解等其他路径所产生的葡萄糖可以说是新生的。研究表明, 在经过一夜空腹后, 随着机体内脂肪分解加速, 肝脏摄取的甘油将增加而促进糖异生作用。同时, 血糖中由甘油异生而来的葡萄糖可占其总量的10% ~15%, 而在长期饥饿时由甘油异生的葡萄糖甚至可达总量的1/3[10]。这说明机体的血糖浓度很大程度上也受到甘油糖异生作用的影响。
作为水通道蛋白中的一种, 水通道蛋白9(aquaporin 9, AQP9)广泛分布于人体, 在脑组织、肝脏、睾丸中均有表达, 尤其在肝细胞细胞质朝肝血窦面有大量表达[11]。研究表明, AQP9与AQP3、AQP7和AQP10类似, 都同属于水甘油通道蛋白亚族, 能转运水和甘油, 尿素等小分子物质[12]。AQP9基因的启动子上含有胰岛素负性响应元件, 胰岛素对AQP9的表达可以起到抑制作用[13-14]。以往的研究发现, 尽管带有胰岛素抵抗的db/db小鼠可表现为高胰岛素血症、高血糖, 并伴有血浆中高浓度的甘油, 但肝脏AQP9 mRNA的表达仍有增加, 提示AQP9在肝脏甘油代谢中发挥着重要作用[15]; 肝组织AQP9 mRNA水平在禁食和重新喂食条件下会分别上升和下降[14]; 链脲霉素引起的胰岛素缺乏既能引起糖异生作用加强和血浆甘油水平上调, 也会使肝脏AQP9 mRNA的表达水平上升[15]; 而在体外实验中, 胰岛素的加入可以使得肝细胞中AQP9 mRNA的表达减少[16-17]。本研究同样发现, AQP9的表达水平在2型糖尿病鼠肝脏中显著上升(图 3), 其主要分布于朝肝血窦面的肝细胞细胞质膜上(图 2), 提示AQP9在肝细胞对甘油的摄取中可能起到重要作用。
在本课题组前期对脑水肿的研究中发现, MAPK信号通路能够调节脑组织中AQP9的表达[7-8]。而本研究结果也表明, 相较于对照组, 2型糖尿病鼠肝脏中AQP9的表达上升。同时由于MAPK信号通路中, p38信号通路表现为受抑制, JNK通路表现为激活, 而ERK通路没有差异性改变(图 4), 提示AQP9表达水平的改变在2型糖尿病鼠肝脏中, 会受到p38-MAPK, JNK-MAPK信号通路二者(不排除其他通路)的共同影响, 而ERK-MAPK信号通路可能不是调控AQP9的表达水平的主要通路。但这仍然需要更深入的实验来验证。此外, 在不同的组织细胞中, MAPK信号通路对AQP9的表达调控方式或许并不相同, 例如ERK-MAPK信号通路在糖尿病肝脏中的表达变化与其在星形胶质细胞中一致, 但p38-MAPK信号通路的表达变化却不相同[18]。
综上所述, 通过对AQP9表达水平的调控来抑制肝脏对甘油的摄取, 或许可以有效地抑制肝脏糖异生的作用, 从而达到维持血糖平衡。然而, 糖尿病高血糖症状的产生是由多种因素共同引起的, 类似的研究也已经在糖尿病合并冠心病或者肾病的病变组织中, 发现了有关的蛋白或者信号通路[19-20]。本研究也通过检测MAPK与AQP9的表达关系, 提出了一种可能的调控方式。但本研究仅通过体内实验探讨了肝脏中AQP9对肝脏糖异生可能起到的作用, 而对于AQP9在其他组织细胞和机体代谢中的作用仍不清楚, 以及对AQP9的表达调控也还有待更深入的研究。
| [1] | MATTSON J S, CERUTIS D R. Diabetes mellitus:a review of the literature and dental implications[J]. Compend Contin Educ Dent, 2001, 22(9): 757–760. |
| [2] | ELKJAER M, VAJDA Z, NEJSUM L N, et al. Immunolocalization of AQP9 in liver, epididymis, testis, spleen, and brain[J]. Biochem Biophys Res Commun, 2000, 276(3): 1118–1128. DOI:10.1006/bbrc.2000.3505 |
| [3] | TSUKAGUCHI H, WEREMOWICZ S, MORTON C C, et al. Functional and molecular characterization of the human neutral solute channel aquaporin-9[J]. Am J Physiol, 1999, 277(5 Pt 2): F685–F696. |
| [4] | ISHIBASHI K, KUWAHARA M, GU Y, et al. Cloning and functional expression of a new aquaporin (AQP9) abundantly expressed in the peripheral leukocytes permeable to water and urea, but not to glycerol[J]. Biochem Biophys Res Commun, 1998, 244(1): 268–274. DOI:10.1006/bbrc.1998.8252 |
| [5] | PEARSON G, ROBINSON F, BEERS GIBSON T, et al. Mitogen-activated protein (MAP) kinase pathways:regulation and physiological functions[J]. Endocr Rev, 2001, 22(2): 153–183. DOI:10.1210/edrv.22.2.0428 |
| [6] | CHANG L, KARIN M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410(6824): 37–40. DOI:10.1038/35065000 |
| [7] | WEI X, REN X, JIANG R, et al. Phosphorylation of p38 MAPK mediates aquaporin 9 expression in rat brains during permanent focal cerebral ischaemia[J]. J Mol Histol, 2015, 46(3): 273–281. DOI:10.1007/s10735-015-9618-3 |
| [8] | PERONI O, LARGE V, BEYLOT M. Measuring gluconeogenesis with[J]. Am J Physiol, 1995, 269(3 Pt 1): E516–E523. |
| [9] | ROJEK A M, SKOWRONSKI M T, FVCHTBAUER E M, et al. Defective glycerol metabolism in aquaporin 9 (AQP9) knockout mice[J]. Proc Natl Acad Sci USA, 2007, 104(9): 3609–3614. DOI:10.1073/pnas.0610894104 |
| [10] | KO SB, UCHIDA S, NARUSE S, et al. Cloning and functional expression of rAOP9L a new member of aquaporin family from rat liver[J]. Biochem Mol Biol Int, 1999, 47(2): 309–318. DOI:10.1080/15216549900201333 |
| [11] | GONEN T, WALZ T. The structure of aquaporins[J]. Q Rev Biophys, 2006, 39(4): 361–396. DOI:10.1017/S0033583506004458 |
| [12] | SULOCHANA K N, RAJESH M, RAMAKRISHNAN S. Insulin receptor tyrosine kinase activity in monocytes of type 2 diabetes mellitus patients receiving oral L-lysine[J]. Indian J Biochem Biophys, 2001, 38(5): 331–334. |
| [13] | KONDO H, SHIMOMURA I, KISHIDA K, et al. Human aquaporin adipose (AQPap) gene.Genomic structure, promoter analysis and functional mutation[J]. Eur J Biochem, 2002, 269(7): 1814–1826. DOI:10.1046/j.1432-1033.2002.02821.x |
| [14] | KURIYAMA H, SHIMOMURA I, KISHIDA K, et al. Coordinated regulation of fat-specific and liver-specific glycerol channels, aquaporin adipose and aquaporin 9[J]. Diabetes, 2002, 51(10): 2915–2921. DOI:10.2337/diabetes.51.10.2915 |
| [15] | BRISSON D, VOHL M C, ST-PIERRE J, et al. Glycerol:a neglected variable in metabolic processes[J]. Bioessays, 2001, 23(6): 534–542. DOI:10.1002/bies.1073 |
| [16] | HIBUSE T, MAEDA N, NAGASAWA A, et al. Aquaporins and glycerol metabolism[J]. Biochim Biophys Acta, 2006, 1758(8): 1004–1011. DOI:10.1016/j.bbamem.2006.01.008 |
| [17] | YANG M, GAO F, LIU H, et al. Hyperosmotic induction of aquaporin expression in rat astrocytes through a different MAPK pathway[J]. J Cell Biochem, 2013, 114(1): 111–119. DOI:10.1002/jcb.24308 |
| [18] |
曹运兰, 胡龙江, 宋耀明. 核苷酸结合寡聚化结构域样受体蛋白3炎性体在2型糖尿病并发冠心病过程中的作用[J].
第三军医大学学报, 2017, 39(8): 801–806.
CAO Y L, HU L J, SONG Y M. Role of nucleotide binding oligomerization domain-like receptor protein 3 inflammasome in occurrence of coronary heart disease in patients with type 2 diabetes mellitus[J]. J Third Mil Med Univ, 2017, 39(8): 801–806. DOI:10.16016/j.1000-5404.201611179 |
| [19] |
刘军辉, 唐璐瑶, 侯世会, 等. Slit2/Robc1信号通路蛋白在早期糖尿病肾病肾小球中的表达及临床意义[J].
第三军医大学学报, 2017, 39(1): 60–66.
LIU J H, TANG L Y, HOU S H, et al. Expression and significance of Slit2/Robo1 signaling pathway in glomeruli of early diabetic nephropathy[J]. J Third Mil Med Univ, 2017, 39(1): 60–66. DOI:10.16016/j.1000-5404.201607038 |



