盆腔器官脱垂(pelvic organ prolapse, POP)是一种常见的妇科疾病。有报道称50%的经产妇会发病,但只有10%~20%患者选择了手术治疗且术后还有30%的患者需要二次手术[1]。目前临床上常用聚丙烯补片来治疗POP,但是存在力学顺应性差、组织侵蚀率较高的缺陷[2]。新近研究发现,细胞外基质(extracellular matrix, ECM)是经过脱细胞处理后的天然胶原支架,主要由Ⅰ型和Ⅲ型胶原纤维构成,具有良好的组织相容性[3],有望成为理想的生物工程材料。在常用的ECM材料中,脱细胞膀胱基质(urinary bladder matrix, UBM)具有较全面的功能,具有耐久好、顺应性好、组织细胞相容性和抗菌性优良的特点[4],而且近期研究发现,UBM在植入机体后还能够诱导血液中的成体干细胞向植入部位富集[5],并且分化成多种组织如神经[6]、血管、平滑肌[7]、心肌、鼓膜[8]等,从而达到组织修复的目的。但是还是存在富集的细胞数量不足以及诱导组织再生和自身降解的矛盾,远期疗效不稳定的问题[9]。为了解决上述问题,更快地促进组织的修复,有研究人员提出了利用单克隆抗体来增加生物支架富集自体干细胞的能力,将anti-sca-1单克隆抗体通过化学交联剂和胶原支架相结合,通过体内体外实验证明了该方法可以捕获自体循环干细胞,但能否进一步促进细胞分化成熟还有待研究[10]。碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是一种广泛存在于人体中的生物活性因子,能够促进组织再生和创伤的修复,但是内源性的因子含量较低,通过外源性给药可以更好地促进组织修复;sulfo-smcc是一种双特异性交联剂,包含一个胺反应性的羟基琥珀酰亚胺和一个巯基反应性马来酰亚胺基团。它可以同时结合胺和巯基,形成稳定的酰胺键和硫醚键。研究人员利用这一特性,将bFGF和胶原蛋白支架结合,结果表明交联后的支架可以延缓bFGF的释放,能更好地促进组织的修复和再生,如腹膜的再生、膀胱的再生和神经的恢复[11-14]。因此,本研究拟通过化学交联剂sulfo-smcc将anti-sca-1和bFGF交联到UBM上,形成anti-sca-1/bFGF-UBM生物支架,进一步验证该生物支架富集干细胞以及促进干细胞分化成熟的能力。
1 材料与方法 1.1 一般材料将新鲜猪膀胱机械分离出膀胱基质,然后进行脱细胞处理得到UBM,冻干后于第三军医大学辐照中心辐照后备用。选取6只2~3周龄雌性C57小鼠,体质量8~10 g,分离出双下肢进行小鼠骨髓间充质干细胞(mouse mesenchymal stem cells,mMSCs)培养(C57小鼠购买于第三军医大学实验动物中心)。
1.2 方法 1.2.1 mMSCs分离培养与鉴定按照ZHU等[15]的方法分离培养mMSCs。取第3代细胞进行鉴定。对细胞进行成脂、成骨、成软骨诱导分化培养,另外采用流式细胞仪检测细胞表面抗原。
1.2.2 anti-sca-1和bFGF与UBM的结合2-亚氨基硫烷盐酸盐(traut’s reagent)可以和伯胺反应生成巯基基团,当它和UBM反应后,可以使UBM生成巯基基团。首先将UBM制成长宽各1 cm的大小,用5 mg/mL的traut’s与UBM在室温下孵育2 h,用pH=8.0的含4 mmol/L EDTA的PBS清洗3次。与此同时,将0.5 mg/mL的anti-sca-1和bFGF、0.5 mg/mL的anti-sca-1、0.5 mg/mL的bFGF分别与0.5 mg/mL的双特异性交联剂sulfo-smcc在室温下反应1 h,用10 mL的超滤管(3KD)去除多余的sulfo-smcc,收集超滤液,得到anti-sca-1/bFGF-sulfo-smcc、anti-sca-1-sulfo-smcc和bFGF-sulfo-smcc复合物,然后将活化的UBM和上述3种复合物在室温下反应2 h,PBS清洗3次,即可得到anti-sca-1/bFGF-UBM、anti-sca-1-UBM和bFGF-UBM 3种复合物,对照组用牛血清白蛋白(albumin from bovine serum,BSA)和PBS与UBM结合。将得到的5种材料进行冻干,然后用扫描电子显微镜进行观察。
1.2.3 mMSCs在anti-sca-1/bFGF-UBM生物支架上的培养按上述方法构建双因子生物支架,将生物支架平铺于6孔板,超净台上自然干燥。取第3代mMSCs,用结合绿色荧光蛋白(green fluorescent protein, GFP)的腺病毒处理细胞,培养24 h后,更换新鲜的不含病毒的完全培养基,待细胞融合达80%左右,胰蛋白酶消化细胞,离心计数,以1×104/cm2的密度接种于生物支架上,加入完全培养基培养48 h,PBS清洗3次,于共聚焦显微镜下观察细胞的生长情况。
1.2.4 anti-sca-1和bFGF最佳浓度的确定用5 mg/mL的Traut’s处理UBM(方法同1.2.2)。与此同时,用浓度梯度(nmol/L)anti-sca-1: bFGF为1.11: 0.31、0.55: 0.31、0.28: 0.31、0.28: 0.61、0.28: 1.22分别与0.5 mg/mL的sulfo-smcc在室温下反应2 h,其余操作同上,最后得到5种不同浓度的anti-sca-1/bFGF-UBM生物支架。将生物支架平铺在6孔板中,于超净台自然风干。取第3代mMSCs细胞,按照1×104/cm2的密度接种于生物支架上,每孔加入1.5 mL完全培养基培养48 h后吸走培养基,PBS轻轻洗涤3次以去除未结合的细胞,重新加入含10% CCK-8的完全培养基,放在培养箱中反应2 h。将反应后的溶液移入96孔板中,每孔100 μL,每组3个孔,用酶标仪在450 nm的波长下测量光密度值[D(450)],间接反映生物支架上细胞的数量。
1.2.5 anti-sca-1/bFGF-UBM生物支架上两种因子含量的测定将UBM生物支架制成0.6 mm直径大小,平铺于96孔板底部,双因子生物支架制备方法同上。分anti-sca-1和bFGF两个实验组和两个对照组, 每组3个样品,对照组用PBS代替anti-sca-1和bFGF进行处理。然后anti-sca-1组和其对照组加入1: 200的结合FITC的荧光二抗室温下反应1 h,PBS充分洗涤后于酶标仪上测量样本荧光强度。bFGF组和其对照组首先加入1: 100的anti-bFGF单克隆抗体,室温反应1 h后PBS清洗3次,再加入1: 200的结合cy3的荧光二抗室温反应1 h,PBS充分洗涤后于酶标仪上测量样本荧光强度。
1.2.6 anti-sca-1/bFGF-UBM生物支架体外诱导mMSCs迁移anti-sca-1/bFGF-UBM生物支架构建方法同上,将制备好的支架平铺于24孔板中,对照组用PBS处理。取第3代mMSCs按照2×105/mL的浓度制成细胞悬液,将100 μL细胞悬液加入到8 μm孔径的Transwell小室中,下室加入600 μL完全培养基,24 h后,用棉签刮除上室的细胞,下室更换含10% CCK-8的完全培养基,2 h后将反应后的培养液加入96孔板中,每孔100 μL,450 nm波长下用酶标仪检测D(450)。
1.2.7 anti-sca-1/bFGF-UBM生物支架体外诱导mMSCs成熟分化anti-sca-1/bFGF-UBM生物支架构建方法同上,对照组用PBS处理,将第3代mMSCs以1×104/cm2的密度接种于生物支架上,每孔加入1.5 mL完全培养基培养7 d,每3天换液。7 d后,用4%多聚甲醛固定15 min,PBS清洗后用1: 100的抗平滑肌肌动蛋白(anti-SMA)处理支架,4度冰箱孵育16 h,PBS洗涤后加入1: 200的结合cy3的IgG二抗,室温下孵育1 h,PBS洗涤后用hoechst 33258处理15 min,PBS清洗后于共聚焦显微镜下进行观察。
1.3 统计学分析采用SPSS 17.0统计软件,所有数据服从正态分布。计量资料以x±s表示,两样本均数比较采用独立样本t检验,多个样本均数比较采用完全随机设计方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 mMSCs诱导分化和流式细胞检测细胞表面抗原成脂诱导分化结束,油红O染色可见大量红色圆球形的脂肪细胞(图 1A)。成骨诱导分化结束,茜素红染色可见红色块状结节,为钙结节染色(图 1B)。成软骨诱导分化结束,阿利辛蓝染色,着色部分显示的是软骨组织中的内酸性粘多糖(图 1C)。说明培养的细胞具有成脂、成骨、成软骨分化的能力。流式细胞表面抗原检测结果:CD29、CD44、SCA-1表面抗原阳性率分别为98.82%、99.82%、87.66%;CD34、CD45阳性率分别为1.14%和0.19%(图 1D~H)。流式细胞检测结果符合小鼠间充质干细胞表面抗原的特点。证明分离培养的细胞为mMSCs。

|
| A~C:分别为光学显微镜观察mMSCs成脂(油红染色)、成骨(茜素红染色)、成软骨(阿利辛蓝染色)诱导分化;D~H:流式细胞仪检测细胞表面抗原,分别对应FITC标记的CD29、SCA-1,PE标记的CD44、CD34、CD45 图 1 mMSCs诱导分化和流式细胞检测细胞表面抗原 (×200) |
2.2 5种生物支架外观
通过扫描电子显微镜观察5种生物支架,可以看到3个实验组表面均附着了数量不等的白色块状物,且anti-sca-1/bFGF-UBM组数量最多,对照组表面未见(图 2)。说明交联后生物支架表面附着了生物因子。
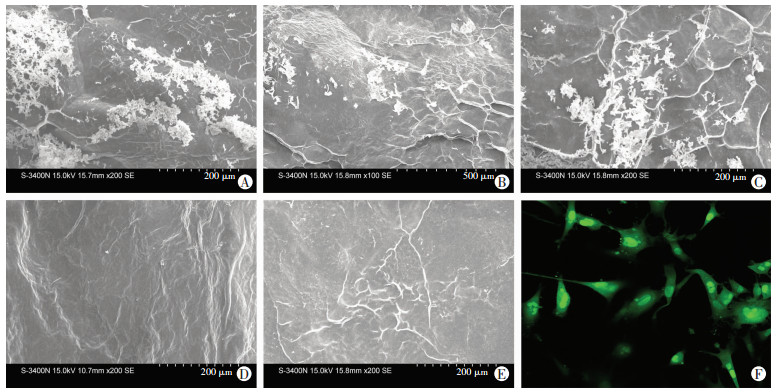
|
| A~E:分别为扫描电子显微镜观察anti-sca-1/bFGF-UBM、anti-sca-1-UBM、bFGF-UBM、UBM(BSA)、UBM(PBS) 5种生物支架外观;F:共聚焦显微镜下观察GFP标记的mMSCs与anti-sca-1/bFGF-UBM支架结合情况(×200) 图 2 5组生物支架的外观和双因子生物支架细胞结合能力 |
2.3 生物支架的细胞结合能力
培养48 h后,共聚焦显微镜下可见到携带GFP的mMSCs附着在生物支架表面,形态完整,数量较多(图 2F)。说明支架能够较好地与细胞结合。
2.4 5组生物支架吸光度的检测通过酶标仪检测5组生物支架对应的D(450)值,各组差异有统计学意义(P < 0.05),anti-sca-1: bFGF浓度(nmol/L)为0.55: 0.31时具有最大值,此浓度为实验最终选取的浓度(图 3A)。
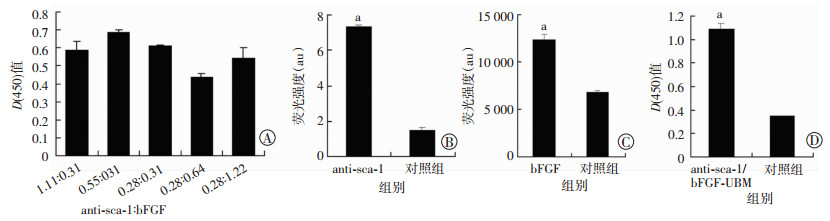
|
| a: P < 0.05,与对照组比较A、D:分别为酶标仪检测浓度梯度配比及体外诱导mMSCs迁移后的D(450)值;B、C:分别为酶标仪检测2组生物支架上anti-sca-1、bFGF的荧光强度 图 3 酶标仪检测各组D(450)值和荧光强度 |
2.5 anti-sca-1和bFGF荧光强度测定
实验组的荧光强度明显高于对照组。荧光强度分析结果显示:与对照组相比,anti-sca-1组、bFGF组荧光强度显著升高(P < 0.05,图 3B、C)。
2.6 体外富集mMSCs细胞培养24 h后,anti-sca-1/bFGF-UBM组的D(450)值明显高于对照组(P < 0.05,图 3D)。说明anti-sca-1/bFGF-UBM生物支架能够显著诱导mMSCs迁移,富集细胞。
2.7 mMSCs分化为平滑肌细胞实验组(anti-sca-1/bFGF-UBM)可见大量红染的平滑肌细胞(图 4A),而对照组未见明显红色荧光(图 4B),说明实验组能够诱导细胞分化成熟。
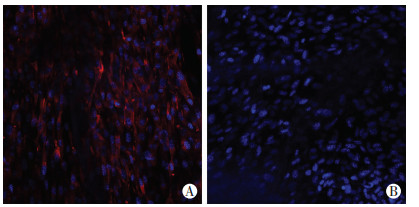
|
| A:anti-sca-1/bFGF-UBM组;B:对照组 图 4 共聚焦显微镜观察生物支架诱导mMSCs分化 (×200) |
3 讨论
本研究在之前对于UBM、anti-sca-1和bFGF研究的基础上[4, 10, 12],通过sulfo-smcc双特异性化学交联剂将anti-sca-1和bFGF特异性结合在UBM上,构建出了含两种生物因子的anti-sca-1/bFGF-UBM生物支架。研究表明该生物支架既能富集sca-1阳性细胞,又能进一步促进细胞的分化成熟。它也许可以成为治疗POP的新型生物支架。
由于目前对UBM的研究越来越深入,UBM作为天然的生物支架,能够诱导循环干细胞像植入部位富集并分化成多种有效的组织[5-7],但是富集的细胞数量较少,远期效果不稳定[9]。近年来,干细胞已经成为了再生医学研究的热点。由于MSCs的获取面临的伦理问题较少而成为了最常用的干细胞。本研究采取ZHU等[15]提出的mMSCs培养方法,不同于现有的全骨髓贴壁法和免疫磁珠培养法等[16-17],本方法具有操作步骤简单,所需仪器设备简单,重复性高,成本低等优点,而且通过鉴定证明得到的细胞是mMSCs。有学者证明,将MSCs接种于生物支架上,然后植入体内可以促进骨折愈合[18]、颅骨再生[19-20]、胰腺功能的恢复[21]。Sca-1是Ly-6家族的一员,是最常见的小鼠循环干细胞的标记。本研究将sca-1单克隆抗体结合在支架上,通过抗原抗体反应来富集sca-1阳性细胞。由于单克隆抗体的特性,支架富集细胞的能力得到了显著的提升[10],从而能提高损伤部位干细胞的密度,这与之前的研究结果类似。由于bFGF能够促进腹膜、膀胱及神经等组织器官的再生[11-14],具有促进细胞分化成熟的能力。当细胞在损伤部位富集后,bFGF可以促进其分化为相应的组织,达到功能上的再生和修复。因此,用sulfo-smcc将anti-sca-1、bFGF和UBM三者结合起来构建双因子生物支架,通过扫描电子显微镜观察生物支架,从外观上证明了anti-sca-1和bFGF生物因子与UBM相结合。然后在生物支架上接种含GFP的mMSCs,确认了生物支架本身的安全性以及结合细胞的能力。另外通过体外transwell小室的培养,证实了生物支架具有富集sca-1阳性细胞的能力;而体外的诱导分化实验证明了anti-sca-1/bFGF-UBM生物支架具有促进细胞分化的能力。这在功能上证实了anti-sca-1和bFGF生物因子与UBM相结合。从而表明anti-sca-1/bFGF-UBM生物支架既能捕获干细胞,又能进一步促进其分化成熟。但是就目前而言,anti-sca-1抗体只有小鼠具有,使得类似的实验不能在其他物种进行。下一步我们将构建POP模型鼠,然后进行体内实验验证生物支架的功能和生物学特性。
综上所述,本研究提供了一种制备新型生物支架的方法,既能捕获干细胞,又能进一步促进其分化成熟。为盆腔器官脱垂生物支架替代治疗提供了一个新的思路。
| [1] | CHALIHA C, KHULLAR V. Surgical repair of vaginal prolapse: a gynaecological hernia[J]. Int J Surg, 2006, 4(4): 242–250. DOI:10.1016/j.ijsu.2005.10.015 |
| [2] | KERI S W, TERRY W, ANDREW J W, et al. Adverse events associated with pelvic organ prolapse surgeries that use implants[J]. Obstet Gynecol, 2013, 122(6): 1239–1245. DOI:10.1097/AOG.0000000000000008 |
| [3] | ALARAB M, KUFAISHI H, LYE S, et al. Expression of extracellular matrix-remodeling proteins is altered in vaginal tissue of premenopausal women with severe pelvic organ prolapse[J]. Reprod Sci, 2014, 21(6): 704–715. DOI:10.1177/1933719113512529 |
| [4] | LIU L, LI D, WANG Y, et al. Evaluation of the biocompatibility and mechanical properties of xenogeneic (porcine) extracellular matrix (ECM) scaffold for pelvic reconstruction[J]. Int Urogynecol J, 2011, 22(2): 221–227. DOI:10.1007/s00192-010-1288-9 |
| [5] | CRAPO P M, GILBERT T W, Badylak S F. An overview of tissue and whole organ decellularization processes[J]. Biomaterials, 2011, 32(12): 3233–3243. DOI:10.1016/j.biomaterials.2011.01.057 |
| [6] | BIBLE E, DELL'ACQUA F, SOLANKY B, et al. Non-invasive imaging of transplanted human neural stem cells and ECM scaffold remodeling in the stroke-damaged rat brain by 19F and diffusion-MRI[J]. Biomaterials, 2012, 33(10): 2858–2871. DOI:10.1016/j.biomaterials.2011.12.033 |
| [7] | BORUCH A V, NIEPONICE A, QURESHI I R, et al. Constructive remodeling of biologic scaffolds is dependent on early exposure to physiologic bladder filling in a canine partial cystectomy model[J]. J Surg Res, 2010, 161(2): 217–225. DOI:10.1016/j.jss.2009.02.014 |
| [8] | KIM J, KIM S W, CHOI S J, et al. A healing method of tympanic membrane perforations using three-dimensional porous chitosan scaffolds[J]. Tissue Engineering Part A, 2011, 17(21): 2763–2772. DOI:10.1089/ten.tea.2010.0533 |
| [9] | MORGAN D M. Discussion: The use of biological materials in urogynecologic reconstruction: a systematic review[J]. Plast Reconstr Surg, 2012, 130(5 Suppl 2): 254–255S. DOI:10.1097/PRS.0b013e3182615501 |
| [10] | SHI C, LI Q, ZHAO Y, et al. Stem-cell-capturing collagen scaffold promotes cardiac tissue regeneration[J]. Biomaterials, 2011, 32(10): 2508–2515. DOI:10.1016/j.biomaterials.2010.12.026 |
| [11] | SHI Q, GAO W, HAN X, et al. Collagen scaffolds modified with collagen-binding bFGF promotes the neural regeneration in a rat hemisected spinal cord injury model[J]. Sci China Life Sci, 2014, 57(2): 232–240. DOI:10.1007/s11427-014-4612-7 |
| [12] | SHI C, CHEN W, ZHAO Y, et al. Regeneration of full-thickness abdominal wall defects in rats using collagen scaffolds loaded with collagen-binding basic fibroblast growth factor[J]. Biomaterials, 2011, 32(3): 753–759. DOI:10.1016/j.biomaterials.2010.09.038 |
| [13] | HONNAMI M, CHOI S, LIU I L, et al. Bone regeneration by the combined use of tetrapod-shaped calcium phosphate granules with basic fibroblast growth factor-binding ion complex gel in canine segmental radial defects[J]. J Vet Med Sci, 2014, 76(7): 955–961. DOI:10.1292/jvms.14-0027 |
| [14] | CHEN W, SHI C, YI S, et al. Bladder regeneration by collagen scaffolds with collagen binding human basic fibroblast growth factor[J]. J Urol, 2010, 183(6): 2432–2439. DOI:10.1016/j.juro.2010.02.042 |
| [15] | ZHU H, GUO Z K, JIANG X X, et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J]. Nat Protoc, 2010, 5(3): 550–560. DOI:10.1038/nprot.2009.238 |
| [16] | BADDOO M, HILL K, WILKINSON R, et al. Characterization of mesenchymal stem cells isolated from murine bone marrow by negative selection[J]. J Cell Biochem, 2003, 89(6): 1235–1249. DOI:10.1002/jcb.10594 |
| [17] | SOLEIMANI M, NADRI S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow[J]. Nat Protoc, 2009, 4(1): 102–106. DOI:10.1038/nprot.2008.221 |
| [18] | XUE D, ZHANG W, Chen E, et al. Local delivery of HMGB1 in gelatin sponge scaffolds combined with mesenchymal stem cell sheets to accelerate fracture healing[J]. Oncotarget, 2017, 8(26): 42098–42115. DOI:10.18632/oncotarget.16887 |
| [19] | TAKESHITA K, MOTOIKE S, KAJIYA M, et al. Xenotransplantation of interferon-gamma-pretreated clumps of a human mesenchymal stem cell/extracellular matrix complex induces mouse calvarial bone regeneration[J]. Stem Cell Res Ther, 2017, 8(1): 101. DOI:10.1186/s13287-017-0550-1 |
| [20] | CHAMIEH F, COLLIGNON A M, COYAC B R, et al. Accelerated craniofacial bone regeneration through dense collagen gel scaffolds seeded with dental pulp stem cells[J]. Sci Rep, 2016, 6: 38814. DOI:10.1038/srep38814 |
| [21] | WANG D, DING X, XUE W, et al. A new scaffold containing small intestinal submucosa and mesenchymal stem cells improves pancreatic islet function and survival in vitro and in vivo[J]. Int J Mol Med, 2017, 39(1): 167–173. DOI:10.3892/ijmm.2016.2814 |



