支气管哮喘简称哮喘,是以气道慢性炎症和气道高反应性为特征的异质性疾病,以反复喘息和咳嗽为主要临床表现[1]。全球大约有3亿哮喘患者,每年至少有25万人死于此种疾病。因此,哮喘成为最常见的慢性肺部疾病,严重威胁人类健康[2]。目前哮喘的一线治疗手段是吸入β2受体激动剂和糖皮质激素,但哮喘的患病率仍居高不下且易反复发作,需要寻求新的药物来辅助控制哮喘[3]。薄荷醇分子式为C10H20O,是从薄荷中提取出的饱和环萜醇,是薄荷油的主要活性成分。1995年日本学者发现雾化吸入薄荷醇可能有降低轻度哮喘患者气道高反应性的作用[4]。近年研究发现,薄荷醇可以减轻香烟烟雾对呼吸道的刺激,减轻皮肤的神经源性炎症[5-6]。既往在豚鼠的体内外实验中也证明,薄荷醇有减轻支气管收缩的作用[7]。以上这些作用可能与Ca2+、冷敏感受体及C类神经纤维有关,但具体机制尚不清楚[5-8]。P物质(substance P, SP)是由前速激肽原基因编码的具有多种生物活性的11肽。气道SP主要来自支气管肺C类纤维,其末端分布在气道上皮、平滑肌及黏膜下腺。哮喘时气道上皮损伤使C类纤维末梢暴露,受到气道内炎症介质刺激后释放SP引起气道神经源性炎症,从而使支气管平滑肌收缩、血浆渗出、黏液分泌增加等,促进哮喘的发生、发展[9-10]。本研究采用鸡卵清蛋白(ovalbumin, OVA)建立的小鼠哮喘模型探究薄荷醇是否改善气道炎症和降低气道高反应性,并进一步研究其对神经递质SP含量的影响,为临床预防及治疗哮喘提供新思路及理论依据。
1 材料与方法 1.1 实验动物、试剂及仪器30只SPF级3周龄BALB/c雌鼠购于重庆医科大学实验动物中心,饲养于重庆医科大学附属儿童医院实验动物中心SPF级,温度22~26 ℃,湿度55%~60%,光照12 h/d,给予不含OVA的特殊饲料喂养至6~8周龄开始建模。OVA、氢氧化铝凝胶[Al(OH)3]及乙酰甲胆碱购于美国Sigma-Aldrich公司,薄荷醇购于日本TCI公司,小鼠肺功能仪器购于法国EMKA公司,小鼠IgE ELISA试剂盒购于欣博盛公司,小鼠SP ELISA试剂盒购于美国Cayman公司,SP兔多克隆抗体购于美国GeneTex公司。
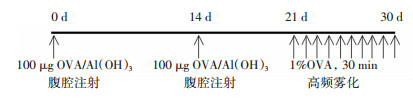
1.2 实验方法 1.2.1 动物分组及处理用随机数字表法将30只6~8周龄BALB/c雌鼠分为对照组、哮喘组和薄荷醇治疗组。哮喘建模方法参考文献[11]并加以改进。哮喘组分别于第0、14天腹腔注射200 μL致敏液[100 μg OVA,100 μL PBS,100 μL Al(OH)3], 第21天起给予5 mL 1% OVA高频雾化吸入30 min激发,每天1次,连续10 d(图 1)。对照组在相同时间给予PBS致敏和激发,给药剂量及方式同哮喘组。薄荷醇治疗组致敏激发同哮喘组,在每次OVA雾化激发前给予1.6%薄荷醇溶液5 mL雾化吸入30 min,每天1次,连续10 d。
|
| 图 1 哮喘模型建模方法 |
1.2.2 气道高反应性的测定
于末次雾化激发后24 h内检测小鼠气道高反应性,用EMKA体积描记仪检测清醒状态下小鼠的自主呼吸,待检测小鼠先测量基础值2 min,再分别给予不同浓度的乙酰甲胆碱(0、3.125、6.25、12.5、25、50 mg/mL)雾化3 min,休息2 min后记录5 min,所有浓度完成后收集Penh数据,取其平均值分析小鼠气道高反应性。
1.2.3 支气管肺泡灌洗液(BALF)的灌取及细胞计数于末次雾化激发48 h内用10%水合氯醛麻醉小鼠,眼球取血后断颈处死,仰卧位固定,充分暴露气管和胸腔,用止血钳夹闭左侧肺门,留置针插入气管适宜深度并固定,用预冷无菌PBS进行右肺支气管肺泡灌洗,每次0.5 mL,共3次,回收率在80%以上。2 500 r/min,4 ℃离心5 min,上清液分装保存于-80 ℃。剩余细胞沉淀中加入1 mL PBS混匀后取20 μL作细胞总数计数,计数后再次2 500 r/min,4 ℃离心5 min,弃上清后取细胞沉渣涂片,自然晾干后行瑞氏染色细胞分类计数。
1.2.4 病理组织的处理BALF灌取后松开左侧肺门处的止血钳,用PBS心脏灌流冲洗双肺血管中的血液,取下双肺,右肺保存于-80 ℃,左肺于4%甲醛溶液中常温固定至少24 h,经梯度乙醇脱水、石蜡包埋后,切成4 μm薄片于黏附载玻片上,60 ℃烤箱烘烤48 h后行HE染色,观察肺部炎症细胞浸润情况并进行炎症评分。肺组织炎症严重程度按0~3分评判[12]:0分=无炎症反应;1分=轻度炎症反应,支气管、血管壁及肺泡隔有点状炎症细胞浸润;2分=中度炎症反应,支气管、血管壁及肺泡隔有斑片状炎症细胞浸润,浸润面积小于肺横截面积的1/3;3分=重度炎症反应,支气管、血管壁及肺泡隔有弥漫性炎症细胞浸润,浸润面积为肺横截面积的1/3~2/3。
1.2.5 血清总免疫球蛋白E(IgE)含量的检测小鼠眼球取血,常温2 500 r/min离心5 min,取上清再次常温2 500 r/min离心10 min后取上层血清,根据ELISA试剂盒说明书检测血清中总IgE含量。
1.2.6 肺匀浆SP含量的检测取小鼠右肺组织,按1 mg肺组织加10 μL肺组织裂解液[20 mmol/L Tris-HCl pH 7.6, 0.5% NP40, 250 mmol/L NaCl, 3 mmol/L EDTA, 2 mmol/L DTT, 0.5 mmol/L苯甲基磺酰氟(PMSF), 20 mmol/L β-甘油磷酸, 1 mmol/L钒酸钠, 1 μg/mL亮抑酶肽][13]比例制作肺匀浆,13 000 r/min,4 ℃离心15 min,取上清液分装,根据ELISA试剂盒说明书检测肺匀浆中SP的含量。
1.2.7 免疫组化观察肺组织SP的表达将石蜡切片常规脱蜡至水后用0.01 mol/L pH 6.0枸橼酸钠行抗原修复,3%过氧化氢消除内源性过氧化物酶,5% BSA封闭30 min,SP一抗(1: 300稀释)孵育过夜,滴加二抗及辣根酶标记链霉卵白素工作液,DAB镜下控制显色,苏木精染核,脱水封片,显微镜下观察SP的表达。SP强度表达评判标准:依据肺组织区域细胞着色强度进行判定。着色强度:无染色为(-),阴性;淡黄色为(+),弱阳性;黄色为(+ +),中度阳性;棕黄色为(+ + +),强阳性。用Image Pro-Plus6.0图像分析软件测定阳性区平均光密度值(Mean IOD)并进行统计。
1.3 统计学方法采用Graph Pad Prism 5.0软件进行统计分析,方差齐时,各组用单因素方差分析或Turkey检验;方差不齐时,各组用Kruskal-Wallis检验。组间比较用多因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠气道高反应性测定结果各组小鼠Penh基础值基本在同一水平,随着吸入乙酰甲胆碱浓度的增高,小鼠气道高反应性逐渐增加(图 2)。乙酰甲胆碱浓度为0和3.125 mg/mL时,哮喘组Penh值与对照组相比差异无统计学意义(P > 0.05)。在乙酰甲胆碱浓度为6.25、12.5、25、50 mg/mL时,哮喘组Penh值较对照组明显升高(P < 0.01),而薄荷醇治疗组小鼠Penh值较哮喘组明显下降(P < 0.05)。

|
| a:P < 0.01, 与对照组比较;b:P < 0.05,c:P < 0.01,与哮喘组比较 图 2 各组小鼠在不同浓度乙酰甲胆碱激发时的气道高反应性 |
2.2 BALF细胞计数及分类计数结果
哮喘组BALF细胞总数[(38.813±6.384)×105/mL]较对照组[(8.709±1.178)×105/mL]明显增多(P < 0.01), 薄荷醇雾化治疗后细胞总数[(6.279±0.488)×105/mL]较哮喘组明显减少(P < 0.01),而薄荷醇治疗组与对照组差异无统计学意义(P > 0.05)。哮喘组BALF中嗜酸性粒细胞绝对计数[(0.931±0.093)×105/mL]较对照组(0×105/mL)明显升高(P < 0.01),薄荷醇治疗组[(0.016±0.007)×105/mL]较哮喘组明显降低(P < 0.01),而薄荷醇治疗组与对照组差异无统计学意义(P > 0.05)。各组小鼠BALF细胞沉渣瑞氏染色结果见图 3。

|
| A:对照组;B:哮喘组;C:薄荷醇治疗组 图 3 瑞氏染色观察各组小鼠BALF细胞沉渣 (油镜×1 000) |
2.3 肺组织病理HE染色结果
对照组小鼠支气管及肺泡结构正常,支气管周围基本无炎症细胞浸润(图 4A)。哮喘组小鼠支气管和血管周围有大量炎症细胞浸润(图 4B),经薄荷醇雾化治疗后,支气管周围炎症细胞浸润明显减少,气道炎症明显减轻(图 4C)。病理炎症评分结果显示:哮喘组炎症评分明显高于对照组(P < 0.01),薄荷醇治疗组炎症评分较哮喘组显著降低(P < 0.01,图 4D)。

|
| A:对照组;B:哮喘组;C:薄荷醇治疗组;D:各组病理炎症评分a:P < 0.01, 与对照组比较;b:P < 0.01,与哮喘组比较 图 4 各组小鼠肺组织病理HE染色(×200)及炎症评分 |
2.4 血清总IgE含量检测结果
哮喘组小鼠血清总IgE含量[(4.442±0.147) ng/mL]较对照组[(1.579±0.153)ng/mL]明显升高(P < 0.01)。薄荷醇雾化吸入后,小鼠血清总IgE含量[(2.768±0.133)ng/mL]较哮喘组明显下降(P < 0.01)。
2.5 肺匀浆P物质含量检测结果哮喘组小鼠肺匀浆P物质含量[(2.719±0.068)ng/mL]较对照组[(2.221±0.079)ng/mL]升高(P < 0.01),薄荷醇雾化吸入后P物质含量[(2.476±0.069)ng/mL]较哮喘组显著下降(P < 0.05)。
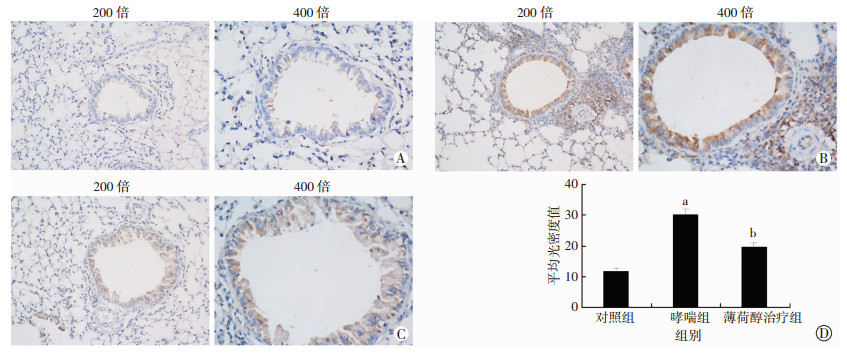
2.6 肺组织P物质分布及量化结果免疫组化结果显示SP在对照组中主要表达于支气管上皮细胞,呈淡黄色,为弱阳性表达(图 5A);SP在哮喘组中主要表达于支气管上皮细胞及血管周围的炎症细胞,呈棕黄色,为强阳性表达(图 5B);而经薄荷醇雾化治疗后其呈黄色,为中度阳性表达(图 5C)。哮喘组平均光密度值较对照组增加(P < 0.01),薄荷醇治疗组平均光密度值比哮喘组显著降低(P < 0.01,图 5D)。
|
| A:对照组;B:哮喘组;C:薄荷醇治疗组;D:各组P物质量化分析a:P < 0.01, 与对照组比较;b:P < 0.01,与哮喘组比较 图 5 免疫组化观察各组小鼠肺组织P物质分布及量化分析 |
3 讨论
薄荷为唇形科多年生草本植物,性凉味辛, 归肺、肝经。薄荷醇是薄荷挥发油中的主要成分,其主要作用有发汗解热、抑菌、止痉、抗病毒、止痛止痒等,临床可用于风热感冒、扁桃体炎、肠易激综合征、鼻出血、头痛、神经痛等疾病[14-15]。既往研究发现,薄荷醇能减轻尼古丁对呼吸道的刺激及减轻支气管平滑肌收缩,可能会减轻哮喘患者的气道高反应性,局部使用还可减轻皮肤的神经源性炎症[4-7]。但关于薄荷醇对哮喘气道炎症及气道高反应性的作用,尚无研究对其进行完整全面的阐述。本研究采用OVA致敏激发建立小鼠哮喘模型,结果显示,哮喘组较对照组有明显气道高反应性,BALF细胞总数及嗜酸性粒细胞绝对计数均较对照组明显升高,肺组织支气管及血管周围有大量炎性细胞浸润,且血清总IgE水平明显上升,提示哮喘模型建立成功。本研究中薄荷醇采用雾化给药方式,倾向于模拟人体给药方法,且局部给药可降低药物副作用对机体产生不良影响。结果显示,给予哮喘小鼠薄荷醇雾化治疗后,上述指标较哮喘组均得到改善,且差异有统计学意义。说明薄荷醇能减轻哮喘小鼠气道炎症及降低气道高反应性,且能降低血清总IgE水平。在哮喘发病过程中,IgE的升高在哮喘发病早期及慢性期发挥重要作用[16]。IgE的合成与调节过程非常复杂,其中IL-4在免疫球蛋白同型转换中起决定性的作用,且能诱导IgE的合成[17]。近年有研究发现,给予血吸虫病模型小鼠薄荷提取物(主要为薄荷醇)治疗后,其血中嗜酸性粒细胞及IL-4水平下降[18],故推测薄荷醇可能通过影响IL-4和IgE的同型转换及合成,从而使哮喘小鼠血清总IgE水平降低,改善小鼠过敏状态。
支气管哮喘发病机理复杂,目前被较多学者接受的气道慢性炎症、气道高反应性和气道重构学说均涉及神经机制的参与。越来越多的研究发现,非肾上腺素能非胆碱能神经及其释放的神经递质(如SP、神经激肽A等)在气道神经源性炎症和高反应性中发挥重要作用[9-10, 19-20]。SP在人肺分布广泛,主要由支气管肺C类纤维末梢释放,是含量最多的感觉神经肽。既往研究发现,在哮喘患者及哮喘动物模型中,哮喘发作期其体内SP的含量均较对照组明显升高,且与哮喘严重程度呈正相关,给予SP受体拮抗剂后哮喘症状明显减轻[9, 19]。因此,SP在哮喘气道炎症中起着至关重要的作用。与以往研究结论一致,本研究结果发现,与对照组相比,哮喘组肺匀浆SP含量较对照组增加,肺组织免疫组化也观察到支气管上皮细胞及血管周围SP强阳性表达,说明OVA致敏激发后哮喘组肺组织SP增多,进而引发哮喘的神经源性炎症反应。而给予薄荷醇雾化治疗后,肺组织SP较哮喘组减少,且差异有统计学意义,说明薄荷醇可以减少哮喘肺中的SP,从而减轻哮喘的神经源性炎症。有研究发现,薄荷醇可抑制辣椒素引起的迷走神经活化[21],而人肺中SP绝大部分由支气管肺C类纤维末梢释放,且支气管肺C类纤维约占迷走神经传入神经的75%[22]。我们推测,薄荷醇可能是通过抑制支气管肺C类纤维活化进而减少哮喘肺组织中的SP。
综上所述,雾化吸入薄荷醇可以减轻哮喘的气道炎症及气道高反应性,可能与减少肺组织SP含量进而减轻肺部神经源性炎症相关,但其具体机制需进一步研究。
| [1] |
中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南(2016年版)[J].
中华儿科杂志, 2016, 54(3): 167–181.
Pediatrics of Chinese Medical Association Branch of the Breathing Group. Guidelines for the diagnosis and prevention of childhood bronchial asthma (2016 Edition)[J]. Chin J Pediatr, 2016, 54(3): 167–181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 |
| [2] | CROISANT S. Epidemiology of asthma: prevalence and burden of disease[J]. Adv Exp Med Biol, 2014, 795: 17–29. DOI:10.1007/978-1-4614-8603-9_2 |
| [3] | FAHY J V. Type 2 inflammation in asthma--present in most, absent in many[J]. Nat Rev Immunol, 2015, 15(1): 57–65. DOI:10.1038/nri3786 |
| [4] | TAMAOKI J, CHIYOTANI A, SAKAI A, et al. Effect of menthol vapour on airway hyperresponsiveness in patients with mild asthma[J]. Respir Med, 1995, 89(7): 503–504. DOI:10.1016/0954-6111(95)90127-2 |
| [5] | HA M A, SMITH G J, CICHOCKI J A, et al. Menthol attenuates respiratory irritation and elevates blood cotinine in cigarette smoke exposed mice[J]. PLoS ONE, 2015, 10(2): e0117128. DOI:10.1371/journal.pone.0117128 |
| [6] | ANDERSEN H H, GAZERANI P, ARENDT-NIELSEN L. High-concentration L-menthol exhibits counter-irritancy to neurogenic inflammation, thermal and mechanical hyperalgesia caused by trans-cinnamaldehyde[J]. J Pain, 2016, 17(8): 919–929. DOI:10.1016/j.jpain.2016.05.004 |
| [7] | ITO S, KUME H, SHIRAKI A, et al. Inhibition by the cold receptor agonists menthol and icilin of airway smooth muscle contraction[J]. Pulm Pharmacol Ther, 2008, 21(5): 812–817. DOI:10.1016/j.pupt.2008.07.001 |
| [8] | LIU B Y, LIN Y J, LEE H F, et al. Menthol suppresses laryngeal C-fiber hypersensitivity to cigarette smoke in a rat model of gastroesophageal reflux disease: the role of TRPM8[J]. J Appl Physiol, 2015, 118(5): 635–645. DOI:10.1152/japplphysiol.00717.2014 |
| [9] | SUN J, BHATIA M. Substance P at the neuro-immune crosstalk in the modulation of inflammation, asthma and antimicrobial host defense[J]. Inflamm Allergy Drug Targets, 2014, 13(2): 112–120. DOI:10.2174/1871528113666140323202419 |
| [10] |
李艳梅, 张慧云, 何韶衡. P物质与肺部疾病[J].
江苏医药, 2011, 37(13): 1585–1587.
LI Y M, ZHANG H Y, HE S H. Substance P and lung diseases[J]. Jiangsu Med, 2011, 37(13): 1585–1587. |
| [11] | NIU C, LIU N, LIU J, et al. Vitamin A maintains the airway epithelium in a murine model of asthma by suppressing glucocorticoid-induced leucine zipper[J]. Clin Exp Allergy, 2016, 46(6): 848–860. DOI:10.1111/cea.12646 |
| [12] | TRIANTAPHYLLOPOULOS K, HUSSAIN F, PINART M, et al. A model of chronic inflammation and pulmonary emphysema after multiple ozone exposures in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 300(5): L691–700. DOI:10.1152/ajplung.00252.2010 |
| [13] | ZHAO L, ZHUANG J, ZANG N, et al. Prenatal nicotinic exposure upregulates pulmonary C-fiber NK1R expression to prolong pulmonary C-fiber-mediated apneic response[J]. Toxicol Appl Pharmacol, 2016, 290: 107–115. DOI:10.1016/j.taap.2015.10.023 |
| [14] |
沈梅芳, 李小萌, 单琪媛. 薄荷化学成分与药理作用研究新进展[J].
中华中医药学刊, 2012, 30(7): 1484–1487.
SHEN M F, LI X M, SHAN Q Y. Research progress of chemical compositions and pharmacological actions of mentha canadensis[J]. Chin Arch Trad Chin Med, 2012, 30(7): 1484–1487. DOI:10.13193/j.archtcm.2012.07.46.shenmf.051 |
| [15] | OZ M, NEBRISI E G E, YANG K H S, et al. Cellular and molecular targets of menthol actions[J]. Front Pharmacol, 2017, 8: 472. DOI:10.3389/fphar.2017.00472 |
| [16] | PALOMARESÓ, SÁNCHEZ-RAMÓN S, DÁVILA I, et al. dIvergEnt: How IgE axis contributes to the continuum of allergic asthma and anti-IgE therapies[J]. Int J Mol Sci, 2017, 18(6): 1328. DOI:10.3390/ijms18061328 |
| [17] | FROIDURE A, MOUTHUY J, DURHAM S R, et al. Asthma phenotypes and IgE responses[J]. Eur Respir J, 2016, 47(1): 304–319. DOI:10.1183/13993003.01824-2014 |
| [18] | ZAIA M G, TD C, FEITOSA K A, et al. Anti-inflammatory properties of menthol and menthone in Schistosoma mansoni infection[J]. Front Pharmacol, 2016, 7: 170. DOI:10.3389/fphar.2016.00170 |
| [19] | RAMALHO R, ALMEIDA J, BELTR O M, et al. Substance P antagonist improves both obesity and asthma in a mouse model[J]. Allergy, 2013, 68(1): 48–54. DOI:10.1111/all.12052 |
| [20] | DEVOS F C, BOONEN B, ALPIZAR Y A, et al. Neuro-immune interactions in chemical-induced airway hyperreactivity[J]. Eur Respir J, 2016, 48(2): 380–392. DOI:10.1183/13993003.01778-2015 |
| [21] | MAHER S A, BIRRELL M A, BONVINI S J, et al. P6 menthol has beneficial effects in the airways through a Trpm8-independent mechanism[J]. Thorax, 2014, 69(Suppl 2): A79–A80. |
| [22] | LEE L Y. Respiratory sensations evoked by activation of bronchopulmonary C-fibers[J]. Respir Physiol Neurobiol, 2009, 167(1): 26–35. DOI:10.1016/j.resp.2008.05.006 |



