2. 400037 重庆,第三军医大学新桥医院:内分泌科
2. Department of Endocrinology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
YANG Shiming, E-mail:shimingyang@yahoo.com
随着生活质量的提高,非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)的发生率也越来越高,在正常人群的发生率为20%[1],在肥胖人群发生率可高达75%[2],其主要病理表现为肝细胞内脂质沉积[3]。NAFLD最终可能引起肝硬化,甚至肝脏肿瘤[4-5],已严重威胁到人类健康。肝脏是调控机体脂代谢的重要器官[6],参与脂质合成、脂质分解、脂蛋白合成与分泌等过程,而肝细胞脂代谢紊乱是导致NAFLD发生、发展的重要原因[7]。目前临床对肝脏脂代谢紊乱治疗并未获得良好的效果,因此,寻找新的干预措施成为今后研究的关键。
近年,研究发现自噬也参与肝脏脂代谢过程,且发挥着重要作用[8]。研究证实,细胞内脂滴与自噬标志分子LC3在饥饿状态下共定位于细胞溶酶体,提示自噬可以介导脂滴运输到溶酶体进行降解[9]。溶酶体是细胞内自噬完成的主要场所,其内含有高浓度的酸性水解酶,用以降解被包裹受损的细胞器、蛋白质等大分子物质。溶酶体相关膜蛋白家族(lysosome associated membrane proteins, LAMPs)参与维持溶酶体膜结构的完整性[10]。小鼠LAMP2基因缺陷能减少高脂饮食诱导的肥胖[11],说明LAMP2在肝细胞脂代谢中具有重要作用。此外,LAMP2已被报道在甲状腺素诱导的肝细胞脂代谢中表达上调[12];LAMP3是溶酶体相关膜蛋白家族成员之一,在氨基酸序列及结构上与LAMP2非常相似。正常情况下,LAMP3在内皮细胞、肺上皮细胞中表达[13]。近年研究表明,LAMP3在多种肿瘤中表达升高,且与肿瘤的不良预后密切相关[14-15],但其在脂代谢中的作用并不清楚。缺氧诱导的PERK信号通路可显著上调LAMP3的表达,而PERK信号通路在脂质合成过程中具有重要作用[16]。这些研究结果提示,LAMP3在脂质代谢中可能具有重要作用。本研究检测高脂处理后肝细胞中LAMP3的表达变化,通过基因过表达手段检测LAMP3对肝细胞脂质合成、脂质分解水平,以及脂代谢过程中关键基因表达变化的影响,以期为肝脏脂代谢紊乱的治疗研究提供实验基础。
1 材料与方法 1.1 主要试剂棕榈酸(P5585-10G)、油酸(O1008-5G)、油红O(O0625)、苏木精(H9627)购于Sigma公司,无脂肪酸BSA(4197)购于Cell Maxx公司,Lipofectamin 3000(L3000015)购于Invitrogen公司,TRNzol总RNA提取试剂(DP405)购于天根生化科技有限公司,逆转录试剂盒(RR047A)及荧光定量PCR试剂盒(RR820A)购于TaKaRa公司,甘油三酯检测试剂盒(E1013-105)购于北京普利莱公司,ATP检测试剂盒(S0026B)购于碧云天公司,β-羟基丁酸检测试剂盒(69-98591)购于默沙克公司,BCA蛋白浓度测定试剂盒(P0010)、蛋白裂解液(P0013B)购于碧云天生物科技有限公司,用于免疫印迹的抗体anti-LAMP3(sc-98657)、anti-GAPDH (sc-47724)购于Santa Cruz公司,anti-PPARγ(C26H12)购于Cell Signaling Technology公司,anti-SCD-1(ab19862)购于Abcam公司。
1.2 细胞培养人肝癌细胞系Huh7购于上海中国科学院细胞库,用含10%胎牛血清的DMEM(Life technology)培养于37 ℃,5% CO2培养箱内。
1.3 游离脂肪酸配制使用0.1 mol/L氢氧化钠溶液配制100 mmol/L棕榈酸储存液与100 mmol/L油酸溶液,再配制10%无脂肪酸BSA溶液。将棕榈酸与油酸以1 :2的比例加入10% BSA得到5 mmol/L的游离脂肪酸(free fatty acids,FFAs)溶液。55 ℃水浴10 min,冷却至室温后用0.22 μm针头式滤器过滤,-20 ℃储存。
1.4 载体构建与转染PCR扩增LAMP3基因编码区1 250 bp,并通过酶切位点NheⅠ和BamHⅠ克隆到过表达载体pcDNA3.1上。LAMP3编码区扩增引物:5′-GCTAGCATGCCCCGGCAGCTCAGCGC-3′,5′-GAATTCTTAGATTCTCTGGT-ATCCAGA-3′。构建好的过表达载体pcDNA3.1-LAMP3由Sanger测序鉴定。Huh7细胞接种于6孔板中,细胞汇合度达80%后,使用试剂Lipofectamin 3000瞬时转染过表达质粒,转染剂量为质粒1 μg/孔。
1.5 荧光定量PCR(quantitative real-time PCR, qRT-PCR)采用TRNzol试剂提取细胞总RNA,通过NanoDrop2000检测RNA浓度后,取1 μg mRNA逆转录为cDNA。PCR反应程序:95 ℃预变性3 min,95 ℃变性10 s,57 ℃退火30 s,72 ℃延伸15 s,循环数40。引物序列见表 1。
| 基因名 | 引物序列(5′→3′) | 片段大小(bp) |
| LAMP3 | 上游GGGAGCCTATTTGACCGTCT 下游AGGCTTGAAGTTGGACATCG |
170 |
| PPARγ | 上游CATAAAGTCCTTCCCGCTGA 下游CATAAAGTCCTTCCCGCTGA |
158 |
| SCD-1 | 上游GCACCACAGCATATCGCAAG 下游TCCAGAGGAGGTACTACAAACCT |
135 |
| CPT1A | 上游GCACATCGTCGTGTACCATC 下游AATAGGCCTGACGACACCTG |
160 |
| PGC-1α | 上游TCCTTTGGGGTCTTTGAGAA 下游GGCACGCAATCCTATTCATT |
117 |
| GAPDH | 上游CTCCTCCTGTTCGACAGTCAGC 下游CCCAATACGACCAAATCCGTT |
130 |
1.6 油红染色
称取0.5 g油红粉末溶于100 mL异丙醇中,配制为油红储存液。储存液使用前,以油红:水为3 :2的比例稀释,再用中性滤纸过滤备用。取出处理后的细胞,PBS洗两遍后使用4%多聚甲醛固定30 min;加入油红染液500 μL,染色15 min;再用苏木精复染60 s,PBS洗去多余染液,封片,10×光学显微镜下拍照。油红定量时,在油红染色结束后直接加入100%异丙醇溶液溶解脂滴,用酶标仪(SpectraMax i3x)进行油红量化检测[检测D(520)值]。
1.7 甘油三酯、ATP、β-羟基丁酸检测甘油三酯检测,使用裂解液冰上裂解细胞后,70 ℃水浴加热10 min,2 000 r/min离心5 min,取10 μL上清加入190 μL工作液后用酶标仪(550 nm)检测甘油三酯含量。ATP检测时,冰上裂解细胞,4 ℃ 12 000×g离心5 min,取20 μL上清加入100 μL工作液中,采用酶标仪测定细胞ATP浓度。使用人β-羟基丁酸ELIISA试剂盒检测细胞培养上清中β-羟基丁酸含量。
1.8 Western blot检测细胞转染质粒48 h后收集细胞,使用裂解液于冰上裂解细胞30 min。采用BCA法测定蛋白浓度,按体积加入5×上样缓冲液,100 ℃水浴加热5 min,再使用超声细胞破碎仪(SJIALAB)超声2 min(10%超声强度)破碎细胞,4 ℃ 12 000×g离心10 min取上清。Western blot具体操作如下:将提取蛋白进行聚丙烯酰胺凝胶电泳(80~120 V)后,转移至PVDF膜上,封闭,加一抗(1 :500~1 :1 000)4 ℃孵育过夜,加二抗(1 :3 000)37 ℃孵育2 h,显色检测并使用化学发光成像分析系统(Vilber,Fusion FX5S)采集图片。
1.9 统计学方法使用SPSS 13.0软件分析,计量资料数据以x±s表示,两组间比较采用t检验,检验水准α=0.05。
2 结果 2.1 高脂处理后肝细胞LAMP3表达上调为了观察肝细胞在高脂条件下LAMP3在肝细胞中的表达变化,我们用游离脂肪酸0.4 mmol/L处理肝癌细胞系(Huh7)24 h,采用qRT-PCR及Western blot法检测Huh7细胞中LAMP3表达变化。结果显示高脂处理Huh7细胞后,LAMP3表达显著上调(图 1),表明LAMP3在肝细胞脂代谢中可能具有调节作用。
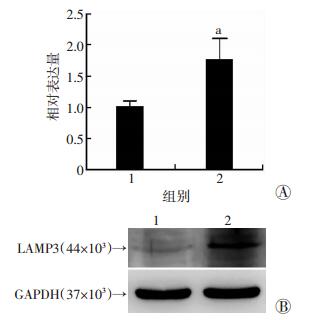
|
| 1:对照组(10% BSA);2:0.4 mmol/L FFAs A:qRT-PCR检测LAMP3 mRNA表达水平;B:Western blot检测LAMP3蛋白表达水平a:P < 0.05,与对照组比较 图 1 LAMP3在高脂环境下的表达水平增高 |
2.2 过表达LAMP3促进FFAs诱导的肝细胞脂质沉积
为了阐明LAMP3在肝细胞脂质代谢中的作用,Huh7细胞分别在正常环境(10% BSA)及高脂环境下(0.4 mmol/L FFAs)外源性过表达LAMP3,使用油红染色及甘油三酯试剂盒检测细胞内脂质变化。结果显示,在高脂环境下(0.4 mmol/L FFAs),Huh7细胞过表达LAMP3 24 h,收集细胞,Huh7细胞中脂滴沉积显著增加(P < 0.05,图 2A、B),细胞内甘油三酯含量也明显升高(P < 0.05,图 2C),说明过表达LAMP3促进FFAs诱导的肝细胞脂质沉积。
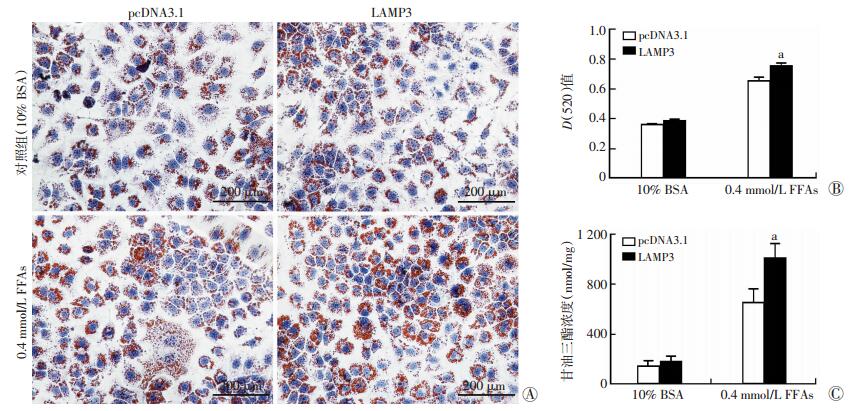
|
| A:油红染色检测细胞内脂滴沉积;B:油红定量分析;C:甘油三酯水平a:P < 0.05,与10% BSA比较 图 2 LAMP3促进FFAs诱导的肝细胞脂质沉积 |
2.3 LAMP3对肝细胞脂质分解无明显作用
由于肝细胞脂质沉积可由脂质合成增加和脂质分解减少引起,所以我们在Huh7细胞中LAMP3表达后,检测了脂质分解代谢产物ATP和β-羟基丁酸的含量变化。结果显示,Huh7细胞转染pcDNA3.1或pcDNA3.1-LAMP3 6 h后,加10% BSA或0.4 mmol/L FFAs处理24 h,细胞中ATP和β-羟基丁酸的含量均无显著变化(图 3),表明LAMP3对肝细胞脂质分解代谢无明显作用,其过表达引起的细胞脂质沉积主要由脂质合成增加导致。

|
| A:ATP含量;B:β-羟基丁酸含量 图 3 LAMP3对肝细胞脂质分解的影响 |
2.4 过表达LAMP3促进肝细胞脂合成基因表达
为了进一步阐明LAMP3在脂质代谢过程中的作用,我们在Huh7细胞过表达LAMP3后,用qRT-PCR检测Huh7细胞脂质合成与分解代谢过程中重要基因的表达水平变化。Huh7细胞转染pcDNA3.1或pcDNA3.1-LAMP3 6 h后,加入0.4 mmol/L FFAs处理24 h。检测结果显示,pcDNA3.1-LAMP3转染组细胞中LAMP3 mRNA和蛋白表达水平显著升高(P < 0.01,图 4A、F);qPCR筛选发现脂合成重要基因PPARγ和SCD-1的表达升高(P < 0.05,图 4B、C)。LAMP3过表达对脂肪酸分解代谢重要基因CPT1A、PGC-1α的表达无明显调控作用(图 4D、E)。为了进一步验证LAMP3对脂合成基因的促进作用,采用Western blot法检测PPARγ和SCD-1的蛋白表达水平,发现过表达LAMP3后,二者的蛋白表达水平均显著升高(图 4F)。以上结果表明LAMP3主要调控脂质合成代谢。
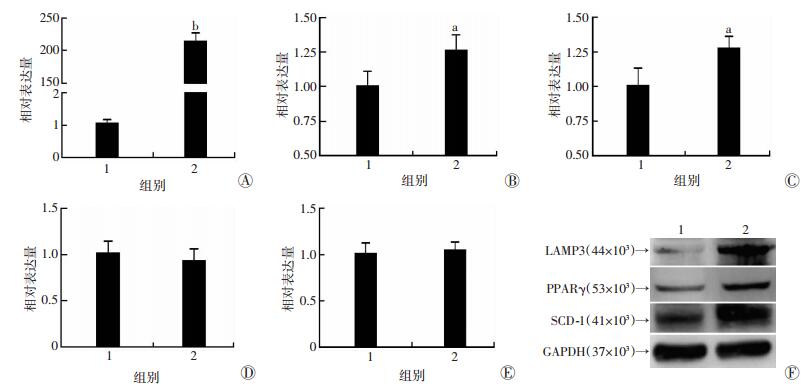
|
| 1:pcDNA3.1;2:LAMP3 A:qRT-PCR检测LAMP3过表达效率检测;B、C:qRT-PCR检测脂肪合成代谢基因PPARγ、SCD-1表达;D、E:q-PCR检查脂肪酸分解代谢基因CPT1A、PGC-1α的表达水平;F:Western blot检测LAMP3、PPARγ、SCD-1蛋白表达a:P < 0.05,b:P < 0.01,与pcDNA3.1比较 图 4 过表达LAMP3促进脂合成相关基因表达 |
3 讨论
本研究初步探索LAMP3在肝细胞脂质代谢中的调控作用,发现在高脂环境下,肝细胞LAMP3的表达显著上调;而上调LAMP3可促进肝细胞Huh7内脂质沉积,进而发现上调LAMP3可显著促进脂合成基因PPARγ与SCD-1的表达。然而LAMP3上调后,Huh7细胞中脂质分解代谢产物ATP[17]和β-羟基丁酸[18]的含量无显著变化,脂肪分解过程重要基因CPT1A、PGC-1α的表达也无明显变化。说明LAMP3可能主要通过促进脂肪合成从而促进肝细胞脂质沉积,而对脂质分解代谢无明显影响。目前,关于LAMP3的研究较为单一,主要集中在对肿瘤转移与预后的作用研究[14, 19-20]。本研究发现LAMP3在促进肝细胞脂质合成代谢中具有重要的调控作用,为该基因在未来的研究中开拓了新的方向,同时也为肝脏脂代谢调控网络的相关研究提供新的思路。
本研究发现,LAMP3上调脂质合成相关基因(PPARγ及SCD-1)的表达。其中PPARγ属于核受体超家族PPARs成员之一,该家族主要调控糖脂代谢中多种基因的表达及细胞增殖、分化等过程。PPARγ主要调控脂肪细胞分化,促进脂合成[21]。研究发现,PPARγ在ob/ob肥胖小鼠肝脏及肥胖NAFLD患者肝脏中表达升高[22-23]。PPARγ基因缺陷的ob/ob小鼠肝脏脂滴与甘油三酯均较AlbCre转基因ob/ob-PPARγ(fl/fl)小鼠明显降低[24],说明PPARγ在肝脏脂质合成中发挥重要作用。另外,SCD-1参与单不饱和脂肪酸的合成,在瘦素基因缺陷的ob/ob肥胖小鼠肝脏中SCD-1表达显著升高,SCD-1基因突变的ob/ob小鼠与正常ob/ob小鼠相比体质量、肝脏甘油三酯、低密度脂蛋白均显著降低,说明SCD-1在肝脏脂合成中也具有重要调控作用[25]。实验结果显示上调LAMP3能显著促进PPARγ与SCD-1表达,进一步证实LAMP3在调控脂质合成中的重要作用。
本研究目前未能对LAMP3促进肝细胞脂质合成的分子机制进行深入探索。在NAFLD中,肝细胞内质网应激也是促进疾病进展的重要因素[26-27]。内质网应激调控的PERK信号通路在肥胖小鼠及肥胖者肝脏中显著激活[28-29],另外,PERK磷酸化水平的升高可促进脂合成重要基因FASN、SCD-1、ACL等的表达,促进脂质合成[30]。近年有研究表明缺氧诱导内质网应激的激活可通过PERK/eIF2a/ATF4信号通路显著上调LAMP3表达[16, 31-32]。因此,LAMP3促进肝细胞脂质合成的作用可能与内质网应激有关。此外,Akt/mTOR信号通路是促进肝细胞脂质合成的重要途径[33],使用雷帕霉素抑制mTOR信号通路能明显改善高脂饮食诱导的小鼠肝脏脂质沉积[34]。激活Akt/mTOR信号通路可显著促进脂合成基因PPARγ与SCD-1的表达[35-36],而本研究发现LAMP3过表达在促进肝细胞脂质合成的同时,也显著上调肝细胞PPARγ与SCD-1表达(图 4F)。那么LAMP3促进肝细胞脂质合成的作用是否与Akt/mTOR信号通路有关,后续研究将进一步探讨。
总之,本研究发现,LAMP3基因表达升高可以促进肝细胞脂质合成,但其具体的调控机制尚需进一步研究。
| [1] | WILLAMS C D, STENGEL J, ASIKE M I, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study[J]. Gastroenterology, 2011, 140(1): 124–131. DOI:10.1053/j.gastro.2010.09.038 |
| [2] | SCHREUDER T C, VERWER B J, VAN NIEUWKERK C M, et al. Nonalcoholic fatty liver disease: an overview of current insights in pathogenesis, diagnosis and treatment[J]. Word J Gastroenterol, 2008, 14(16): 2474–2486. DOI:10.3748/wjg.14.2474 |
| [3] | FUCHS C D, CLAUDEL T, KUMARI P, et al. Absence of adipose triglyceride lipase protects from hepatic endoplasmic reticulum stress in mice[J]. Hepatology, 2012, 56(1): 270–280. DOI:10.1002/hep.25601 |
| [4] | EKSTEDT M, HAGSTROM H, NASR P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up[J]. Hepatology, 2015, 61(5): 1547–1554. DOI:10.1002/hep.27368 |
| [5] | Fu T, Zhao X, Evans R M. Liver cancer checks in when bile acid clocks out[J]. Cancer Cell, 2016, 30(6): 827–828. DOI:10.1016/j.ccell.2016.11.012 |
| [6] | WANG S, KAUFMAN R J. How does protein misfolding in the endoplasmic reticulum affect lipid metabolism in the liver[J]. Curr Opin Lipidol, 2014, 25(2): 125–132. DOI:10.1097/mol.0000000000000056 |
| [7] | MA C, KESARWALA A H, EGGERT T, et al. NAFLD causes selective CD4(+) T lymphocyte loss and promotes hepatocarcinogenesis[J]. Nature, 2016, 531(7593): 253–257. DOI:10.1038/nature16969 |
| [8] | SINGH R, KAUSHIK S, WANG Y, et al. Autophagy regulates lipid metabolism[J]. Nature, 2009, 458(7242): 1131–1135. DOI:10.1038/nature07976 |
| [9] | SINHA RA, YOU SH, ZHOU J, et al. Thyroid hormone stimulates hepatic lipid catabolism via activation of autophagy[J]. J Clin Investi, 2012, 122(7): 2428–2438. DOI:10.1172/JCI60580 |
| [10] | JU X, YAN Y, LIU Q, et al. Neuraminidase of influenza A virus binds lysosome-associated membrane proteins directly and induces lysosome rupture[J]. J Virol, 2015, 89(20): 10347–10358. DOI:10.1128/jvi.01411-15 |
| [11] | YASUDA-YAMAHARA M, KUME S, YAMAHARA K, et al. Lamp-2 deficiency prevents high-fat diet-induced obese diabetes via enhancing energy expenditure[J]. Biochem Biophys Res Commun, 2015, 465(2): 249–255. DOI:10.1016/j.bbrc.2015.08.010 |
| [12] | TSENG Y H, KE P Y, LIAO C J, et al. Chromosome 19 open reading frame 80 is upregulated by thyroid hormone and modulates autophagy and lipid metabolism[J]. Autophagy, 2014, 10(1): 20–31. DOI:10.4161/auto.26126 |
| [13] | WEICHERT N, KALTENBORN E, HECTOR A, et al. Some ABCA3 mutations elevate ER stress and initiate apoptosis of lung epithelial cells[J]. Respiratory research, 2011, 12(1): 4. DOI:10.1186/1465-9921-12-4 |
| [14] | LIAO X, CHEN Y, LIU D, et al. High expression of LAMP3 is a novel biomarker of poor prognosis in patients with esophageal squamous cell carcinoma[J]. Int J Mol Sci, 2015, 16(8): 17655–17667. DOI:10.3390/ijms160817655 |
| [15] | KANAO H, ENOMOTO T, KIMURA T, et al. Overexpression of LAMP3/TSC403/DC-LAMP promotes metastasis in uterine cervical cancer[J]. Cancer Res, 2005, 65(19): 8640–9645. DOI:10.1158/0008-5472.CAN-04-4112 |
| [16] | MUJCIC H, NAGELKERKE A, ROUSCHOP K M, et al. Hypoxic activation of the PERK/eIF2alpha arm of the unfolded protein response promotes metastasis through induction of LAMP3[J]. Clinical Cancer Research, 2013, 19(22): 6126–6137. DOI:10.1158/1078-0432.CCR-13-0526 |
| [17] | WANG C, CHI Y, LI J, et al. FAM3A activates PI3K p110alpha/Akt signaling to ameliorate hepatic gluconeogenesis and lipogenesis[J]. Hepatology, 2014, 59(5): 1779–1790. DOI:10.1002/hep.26945 |
| [18] | ARSENIJEVIC D, CAJOT J F, FELLAY B, et al. Uninephrectomy-induced lipolysis and low-grade inflammation are mimicked by unilateral renal denervation[J]. Front Physiol, 2016, 7: 227. DOI:10.3389/fphys.2016.00227 |
| [19] | LU J, MA H, LIAN S, et al. Clinical significance and prognostic value of the expression of LAMP3 in oral squamous cell carcinoma[J]. Dis Markers, 2017, 2017: 1218254. DOI:10.1155/2017/1218254 |
| [20] | WANG D, CAO X, ZHANG Y, et al. LAMP3 expression correlated with poor clinical outcome in human ovarian cancer[J]. Tumour Biol, 2017, 39(3): 10104283176. DOI:10.1177/1010428317695014 |
| [21] | AHMADIAN M, SUH J M, HAH N, et al. PPARγ signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013, 19(5): 557–566. DOI:10.1038/nm.3159 |
| [22] | KANURI G, LANDMANN M, PRIEBS J, et al. Moderate alcohol consumption diminishes the development of non-alcoholic fatty liver disease (NAFLD) in ob/ob mice[J]. Eur J Nutr, 2016, 55(3): 1153–1164. DOI:10.1007/s00394-015-0929-7 |
| [23] | PETTINELLI P, VIDELA L A. Up-regulation of PPAR-γ mRNA expression in the liver of obese patients: an additional reinforcing lipogenic mechanism to SREBP-1c induction[J]. J Clin Endocrinol Metab, 2011, 96(5): 1424–1430. DOI:10.1210/jc.2010-2129 |
| [24] | MATSUSUE K, HALUZIK M, LAMBERT G, et al. Liver-specific disruption of PPARγ in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes[J]. J Clin Invest, 2003, 111(5): 737–747. DOI:10.1172/JCI200317223 |
| [25] | COHEN P, MIYAZAKI M, SOCCI N D, et al. Role for stearoyl-CoA desaturase-1 in leptin-mediated weight loss[J]. Science, 2002, 297(5579): 240–243. DOI:10.1126/science.1071527 |
| [26] | GONZALEZ-RODRIGUEZ A, MAYORAL R, AGRA N, et al. Impaired autophagic flux is associated with increased endoplasmic reticulum stress during the development of NAFLD[J]. Cell Dath Dsease, 2014, 5, 4(4): e1179. DOI:10.1038/cddis.2014.162 |
| [27] | ZHANG X Q, XU C F, YU C H, et al. Role of endoplasmic reticulum stress in the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2014, 20(7): 1768–1776. DOI:10.3748/wjg.v20.i7.1768 |
| [28] | OZCAN U, CAO Q, YILMAZ E, et al. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes[J]. Science, 2004, 306(5695): 457–461. DOI:10.1126/science.1103160 |
| [29] | GREGOR M F, YANG L, FABBRINI E, et al. Endoplasmic reticulum stress is reduced in tissues of obese subjects after weight loss[J]. Diabetes, 2009, 58(3): 693–700. DOI:10.2337/db08-1220 |
| [30] | BOBROVNIKOVA-MARJON E, HATZIVASSILIOU G, GRIGORIADOU C, et al. PERK-dependent regulation of lipogenesis during mouse mammary gland development and adipocyte differentiation[J]. Proc Natl Acad Sci USA, 2008, 105(42): 16314–16319. DOI:10.1073/pnas.0808517105. |
| [31] | NAGELKERKE A, BUSSINK J, MUJCIC H, et al. Hypoxia stimulates migration of breast cancer cells via the PERK/ATF4/LAMP3-arm of the unfolded protein response[J]. Breast Cancer Res, 2013, 15(1): R2. DOI:10.1186/bcr3373 |
| [32] | MUJCIC H, RZYMSKI T, ROUSCHOP K M, et al. Hypoxic activation of the unfolded protein response (UPR) induces expression of the metastasis-associated gene LAMP3[J]. Radiother Oncol, 2009, 92(3): 450–459. DOI:10.1016/j.radonc.2009.08.017 |
| [33] | YIN F, SHAREN G, YUAN F, et al. TIP30 regulates lipid metabolism in hepatocellular carcinoma by regulating SREBP1 through the Akt/mTOR signaling pathway[J]. Oncogenesis, 2017, 6(6): e347. DOI:10.1038/oncsis.2017.49 |
| [34] | JIA Y, WU C, KIM J, et al. Astaxanthin reduces hepatic lipid accumulations in high-fat-fed C57BL/6J mice via activation of peroxisome proliferator-activated receptor (PPAR) alpha and inhibition of PPAR gamma and Akt[J]. J Nutr Biochemi, 2016, 28: 9–18. DOI:10.1016/j.jnutbio.2015.09.015 |
| [35] | LI J, HUANG Q, LONG X, et al. CD147 reprograms fatty acid metabolism in hepatocellular carcinoma cells through Akt/mTOR/SREBP1c and P38/PPARalpha pathways[J]. J Hepatol, 2015, 63(6): 1378–1389. DOI:10.1016/j.jhep.2015.07.039 |
| [36] | LAPLANTE M, SABATINI D M. An emerging role of mTOR in lipid biosynthesis[J]. Cur Biol, 2009, 19(22): R1046–R52. DOI:10.1016/j.cub.2009.09.058 |



