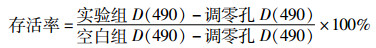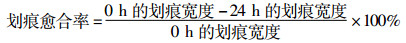2. 400042 重庆,第三军医大学大坪医院野战外科研究所药剂科;
3. 400038 重庆,第三军医大学药学院教学实验中心
2. Department of Pharmacy, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042;
3. Teaching Experimental Center, College of Pharmacy, Third Military Medical University, Chongqing, 400038, China
恶性黑色素瘤是一种恶性度极高的皮肤肿瘤,其最大特点是转移早,进展快,临床发现时多在中晚期。目前,恶性黑色素瘤的治疗手段主要有手术切除、放疗和化疗。尽管这些治疗方法很大程度上清除或杀灭了肿瘤组织和肿瘤细胞并延长了患者的生存期,但是仍然不能解决恶性黑色素瘤易转移复发的问题[1]。小鼠黑色素瘤B16F10细胞恶性度高,成瘤性好,常经皮下或尾静脉注射到小鼠体内,在皮肤、肝、肺等部位形成移植瘤[2]。根据肿瘤干细胞理论,肿瘤组织中仅有0.1%~1%的肿瘤细胞才是导致肿瘤复发转移的根源,也是造成恶性肿瘤细胞致瘤性强的主要原因,这类肿瘤细胞被称为干性样肿瘤细胞[3]。全反式维甲酸(all-trans retinoic acid,ATRA)是一个经典的细胞诱导分化剂,是治疗急性早幼粒白血病的一线药物,其软膏剂可外用于痤疮、银屑病等多种角化异常性皮肤病[4-5]。此外,ATRA在肿瘤干细胞的研究中也隐藏着巨大潜力,已有研究发现ATRA可抑制乳腺癌干细胞、头颈癌干细胞等多种肿瘤干细胞的恶性生长,并诱导其向正常细胞分化[6-7]。有研究报道ATRA可通过体内给药抑制小鼠黑色素瘤B16F10细胞在C57BL/6小鼠体内的肝肺转移[8],但对B16F10细胞致瘤性及其抑瘤机制的研究,目前国内尚少见报道。本研究以小鼠黑色素瘤B16F10细胞为研究对象,考察ATRA对B16F10细胞体外增殖、迁移、凋亡、致瘤性的影响及其初步的抗肿瘤机制,以期为恶性黑色素瘤的临床治疗提供思路。
1 材料与方法 1.1 细胞与动物小鼠黑色素瘤B16F10细胞和小鼠成纤维L929细胞由四川大学华西药学院惠赠,本实验室传代所得;雌性C57BL/6小鼠10只,6~8周龄,体质量16~21 g,由第三军医大学大坪医院野战外科研究所动物实验中心提供,动物许可证号:SCXK(渝)2012-0005,动物饲养及实验过程严格遵守《实验动物管理与使用指南》相关规定。
1.2 药品、试剂与仪器全反式维甲酸(纯度98%,上海萨恩化学技术有限公司),胎牛血清(美国HyClone公司),RPMI1640培养基(美国Gibco公司),MTT和DMSO(美国Sigma公司),青链霉素双抗、Annexin V-FITC/PI细胞凋亡检测试剂盒、DAPI染色液、线粒体膜电位检测试剂盒(JC-1,中国碧云天公司),Caspase-3、Caspase-9试剂盒(南京凯基科技有限公司),酶标仪(美国Molecular Devices公司),流式细胞仪(美国Beckman公司),Transwell小室(美国Millipore公司),荧光显微镜(美国Life Technologies公司),荧光分光光度计(日本HITACHI公司),垂直层流洁净工作台(上海上净净化设备有限公司)。
1.3 细胞培养将B16F10细胞和L929细胞分别接种于含10%胎牛血清、100 U/mL青链霉素双抗的RPMI1640完全培养基,置37 ℃恒温,5% CO2细胞培养箱中培养,取对数生长期细胞进行实验。
1.4 MTT实验取对数生长期细胞,经0.25%胰酶和EDTA混合液消化成单细胞悬液,稀释成1×104/孔接种于96孔板,设5个复孔,同时设置调零孔和空白对照孔。待细胞贴壁过夜后,用含不同浓度ATRA(0、6.25、12.5、25、50、100 μmol/L)的培养基处理细胞。37 ℃,5% CO2条件下培养24 h,每孔继续加入20 μL新配的MTT溶液(5 mg/mL),4 h后,用注射器小心吸弃孔内培养液,每孔加入150 μL DMSO使甲臜结晶充分溶解,用酶标仪测定490 nm处的光密度值D(490),计算IC50和细胞存活率。
1.5 形态学实验根据MTT实验结果,选用低、中、高(6.25、16、40 μmol/L)3个浓度的ATRA进行细胞形态学实验。取对数生长期B16F10和L929细胞,以2×105/孔接种于6孔板,细胞贴壁过夜后给药,药物作用24 h后,倒置显微镜下观察各浓度组细胞形态变化。
1.6 划痕实验将对数期B16F10细胞以3×105/孔接种于6孔板,贴壁过夜后用20 μL灭菌枪头在单细胞层上垂直划痕,再用灭菌的PBS溶液冲洗2~3次,除去脱落细胞。实验组用低、中、高(6.25、16、40 μmol/L)3个浓度的ATRA处理细胞,空白对照组加等量不含药的培养液,显微镜下拍照记录给药0 h和24 h的细胞迁移情况。利用Image J软件测量不同点的划痕宽度,并计算平均划痕愈合率,划痕愈合率越高,表明细胞迁移能力越强。
1.7 Transwell实验根据划痕实验结果,选用中浓度(16 μmol/L)ATRA进行Transwell实验。消化收集对数期B16F10细胞于规格为8 μm的24孔Transwell小室。实验组上室加入含5%胎牛血清和16 μmol/L ATRA的细胞悬液200 μL,对照组不加药;下室均加入含20%胎牛血清的培养液600 μL。24 h后,吸弃上室培养液,移去小室,PBS洗涤并用湿棉签拭去上室未迁移细胞。经冷甲醇固定20 min,0.1%结晶紫染色10 min,PBS充分洗涤后置显微镜下拍照并随机选取3个视野进行计数。
1.8 DAPI染色实验根据前期实验结果,选用中浓度(16 μmol/L)进行后续实验。取对数生长期B16F10细胞以3×105/孔接种于6孔板,贴壁后分组给药,实验组加浓度为16 μmol/L的ATRA培养液,空白对照组加等量不含药物的培养液。37 ℃、5% CO2条件下继续培养24 h后,吸弃培养液,加1.5 mL 4%多聚甲醛固定10 min,PBS冲洗2~3次,用1 mg/mL的DAPI工作液染色2~10 min,PBS洗涤1~2次,于荧光显微镜下观察细胞核形态。
1.9 Annexin V-FITC/PI染色实验将对数期B16F10细胞以2×105/孔接种于6孔板,贴壁过夜后分组给药(同1.8),24 h后,0.25%胰蛋白酶消化成单细胞悬液,PBS洗涤细胞,低速(1 000 r/min)离心5 min,弃上清,收集细胞。分别加入Annexin V-FITC结合液500 μL,Annexin V-FITC和PI染色液各5 μL,室温下避光染色10 min,用流式细胞仪检测细胞凋亡率。
1.10 JC-1染色实验取对数生长期B16F10细胞以2×105/孔细胞接种于6孔板,实验组加浓度为16 μmol/L的ATRA培养液,阳性对照组和空白对照组加入等量不含药的培养液。24 h后,阳性对照组先加入10 μmol/L的氰氯苯腙质子载体(carbonyl cyanide m-chlorophenylhydrazone,CCCP)处理20 min。吸弃各组培养液,分别加入1 mL RPMI1640培养液和1 mL JC-1染色工作液,混匀后于细胞培养箱中孵育20 min,孵育结束后弃上清,再加JC-1染色缓冲液洗涤2~3次,最后加2 mL不完全培养液,荧光显微镜下随机选取3个视野拍照观察。
1.11 检测Caspase-9、Caspase-3活性取对数生长期B16F10细胞以3×105/孔接种于6孔板,贴壁过夜后分组给药(同1.8)。按试剂盒说明书进行操作,药物作用24 h后收集细胞,先加入200 μL冰冷Lysis Buffer和2 μL DTT,冰浴裂解60 min,期间涡旋4次,每次10 s,4 ℃离心1 min(10 000 r/min)。取150 μL细胞裂解上清液,加50 μL 2×Reaction Buffer和0.5 μL DTT,再加20 μL Caspase-9 Substrate/Caspase-3 Substrate反应液,37 ℃避光孵育4 h,用荧光分光光度计测定荧光强度RFU(激发波长=485 nm,发射波长=535 nm)。用RFUATRA组/RFU空白对照组代表Caspase-9或Caspase-3的活性增加倍数,倍数越大表明给药组蛋白活性越高。
1.12 体内成瘤实验将对数生长期细胞以2×105/孔接种于6孔板,贴壁过夜后加药(同1.8)。药物作用5 h后重悬细胞,将细胞悬液皮下接种于10只成年C57BL/6小鼠腋下,每次接种100 μL(约1×104 个细胞)。接种后小鼠连续饲养21 d,每周观察并记录瘤体生长情况。饲养结束后,脱颈处死,分离皮下肿瘤,拍照记录,并用游标卡尺测出瘤体最长径(L)和最短径(W),根据公式计算瘤体体积: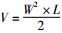
计量资料数据用x±s表示,采用SPSS 19.0统计软件,两样本均数比较采用student t检验,检验水准:α=0.05。
2 结果 2.1 ATRA抑制细胞增殖不同浓度ATRA(6.25、12.5、25、50、100 μmol/L)处理细胞24 h后,ATRA呈浓度依赖性地抑制B16F10细胞和L929细胞的增殖;相同给药浓度下,正常成纤维L929细胞的存活率显著高于小鼠黑色素瘤B16F10细胞(P < 0.05,图 1)。利用IC50软件算得ATRA作用于B16F10细胞的IC50为16.53 μmol/L,作用于L929细胞的IC50为111.25 μmol/L,表明ATRA在此给药浓度范围内能选择性地杀伤肿瘤细胞而不损伤正常细胞。
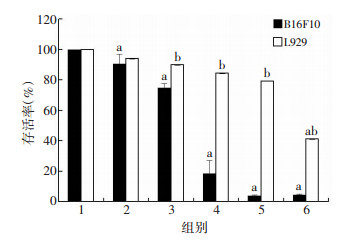
|
| 1:空白对照组;2~6:分别为6.25、12.5、25、50、100 μmol/L ATRA组a:P < 0.05,与空白对照组比较;b:P < 0.05,与同浓度B16F10细胞存活率比较 图 1 MTT检测ATRA对小鼠黑色素瘤B16F10细胞和小鼠成纤维L929细胞增殖能力的影响 |
2.2 ATRA改变细胞形态
药物作用24 h后,细胞形态发生显著改变,见图 2。显微镜下可见空白对照组和低浓度ATRA组B16F10细胞生长快速,细胞质饱满呈梭形;中浓度ATRA组部分细胞变圆,皱缩;高浓度ATRA组大部分细胞细胞质出现发泡现象,细胞连接松散,部分脱落。而L929细胞在空白对照组和低、中浓度ATRA组均生长快速,呈纤维状,细胞核完整;而高浓度时,L929细胞丧失正常形态,细胞膜完整但细胞质出现许多空泡状结构。进一步表明中浓度组(16 μmol/L)的ATRA能诱导肿瘤细胞B16F10死亡或者凋亡,而不影响小鼠正常细胞的生长。
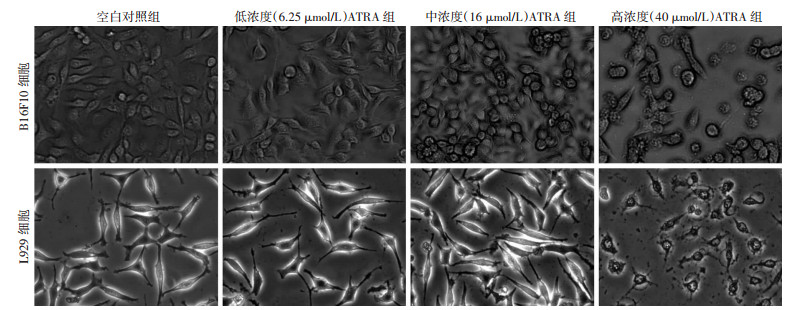
|
| 图 2 倒置显微镜下观察各组B16F10细胞和L929细胞形态 (×200) |
2.3 ATRA抑制B16F10细胞体外迁移
药物处理B16F10细胞24 h后,空白对照组和低剂量组细胞生长密集且明显向划痕中心处迁移(图 3),划痕愈合率分别为(75.46±4.04)%、(48.46± 3.61)%;而中剂量组划痕愈合率为(0.17±6.11)%,与空白对照组相比,细胞迁移能力几乎100%受抑制(P < 0.05);高剂量组细胞则大量死亡并脱落。进一步通过Transwell实验检测发现中浓度的ATRA能显著抑制B16F10细胞的迁移能力。随机选取3个视野计数,空白对照组的细胞迁移数为(81.00±4.04),ATRA组细胞迁移数为(13.00±2.65),差异具有统计学意义(P < 0.05,图 4)。
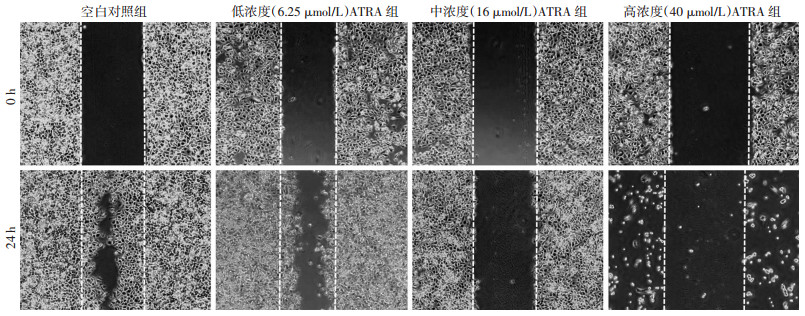
|
| 图 3 划痕实验观察各组B16F10细胞体外迁移能力 (倒置显微镜×40) |

|
| A:空白对照组;B:中浓度ATRA组 图 4 Transwell实验观察两组B16F10细胞体外迁移能力 (倒置显微镜×100) |
2.4 ATRA诱导B16F10细胞凋亡
细胞处理24 h后,DAPI染色结果见图 5。空白对照组B16F10细胞核染色质均匀,呈明亮的蓝色荧光;ATRA处理组染色质固缩,核边缘化,甚至可见核裂解和凋亡小体。进一步采用流式细胞仪检测,空白对照组细胞凋亡率为(1.47±0.52)%,ATRA组的细胞凋亡率为(37.27±4.42)%,说明中浓度(16 μmol/L)ATRA能够有效诱导B16F10细胞凋亡(P < 0.05)。
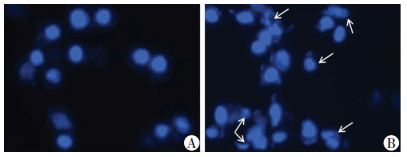
|
| A:空白对照组;B:中浓度ATRA组↑:示凋亡细胞 图 5 DAPI染色观察两组B16F10细胞凋亡 (荧光显微镜×400) |
2.5 ATRA降低B16F10线粒体膜电位
通过观察细胞内绿色荧光和红色荧光的强弱来定性地检测线粒体膜电位的变化,从而推断细胞凋亡途径。细胞经JC-1染色后,空白对照组在荧光显微镜下呈现出强烈的红色荧光,CCCP阳性对照组由于细胞大量受损,线粒体膜电位下降而发出强烈的绿色荧光,ATRA给药组(16 μmol/L)绿色荧光增强,红色荧光减弱,线粒体膜电位显著下降(图 6)。表明ATRA可能是通过线粒体途径介导B16F10细胞凋亡。
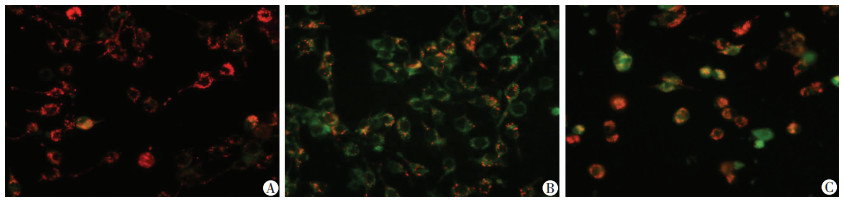
|
| A:空白对照组;B:阳性对照组;C:中浓度ATRA组 图 6 JC-1实验检测各组B16F10细胞线粒体膜电位 (荧光显微镜×400) |
2.6 ATRA增强Caspase-9、Caspase-3的活性
荧光分光光度计测定结果显示,相比空白对照组,给药组Caspase-9活性增加了(1.54±0.00)倍,Caspase-3活性增加了(3.09±0.01)倍,差异均有统计学意义(P < 0.05)。进一步表明ATRA可能是通过线粒体途径激活Caspase通路从而诱导B16F10细胞凋亡。
2.7 ATRA抑制B16F10细胞致瘤性B16F10肿瘤细胞给药5 h后移植到C57BL/6小鼠皮下,小鼠在饲养过程中观察到ATRA实验组只有1只小鼠致瘤,空白对照组每只小鼠均致瘤,且肿瘤生长速度较ATRA组快,肿瘤体积较ATRA组大。21 d后小心剥离皮下肿瘤,空白对照组体积为(154.68±24.96)mm3,ATRA组体积为(0.87±1.94)mm3(P < 0.01,图 7)。提示ATRA作用后的B16F10细胞在C57BL/6小鼠体内的成瘤能力(致瘤性)明显受到抑制。
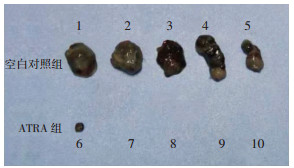
|
| 1~10:成年C57BL/6小鼠 图 7 体内成瘤实验检测B16F10细胞致瘤性 |
3 讨论
恶性黑色素瘤被称为皮肤肿瘤中的“无声杀手”,近年在亚洲人群中的发病率呈逐年上升趋势,常规的手术治疗和放化疗效果均不理想,临床危害严重。主要是因为干性样黑色素瘤细胞的存在,这些细胞虽然在肿瘤组织中数量甚少,且常处于低复制状态,但却具有无限增殖、多向分化的能力和高致瘤性,控制着肿瘤的发生发展。已有研究报道小鼠黑色素瘤B16F10细胞中可分离鉴定出干性样B16F10细胞,其致瘤性是普通B16F10细胞的10~1 000倍[9]。ATRA是维生素A的衍生物,在肿瘤干细胞领域和黑色素瘤研究领域具有重要研究价值[10]。一项大型前瞻性研究发现每日补充维生素A( > 19.3 μg/d)可以降低患黑色素瘤的风险[11]。YIN等[12]发现局部涂抹维甲酸软膏可以提高CD8+细胞免疫活性从而抑制B16F10移植瘤的体内生长。因此,本研究以B16F10细胞为考察对象,分析ATRA对B16F10细胞体外增殖、迁移、凋亡以及体内成瘤性(致瘤性)的影响,探讨其初步的抗肿瘤机制。
本研究首先通过MTT实验和形态学实验观察不同浓度ATRA对小鼠黑色素瘤细胞B16F10和小鼠正常成纤维细胞L929的抑制作用,确定ATRA的最佳给药浓度为16 μmol/L,在此浓度下既能损伤肿瘤细胞又不伤害正常细胞。划痕实验提示B16F10细胞在中浓度(16 μmol/L)的ATRA作用后体外迁移能力即明显受到抑制,进一步通过Transwell实验发现在以此浓度下B16F10细胞体外迁移行为确实显著受到抑制,此结果与SENGUPTA等[13]研究报道一致。
本研究还发现B16F10细胞经16 μmol/L的ATRA作用24 h后,B16F10细胞明显呈凋亡样改变,细胞凋亡率达(37.27±4.42)%。一般地,启动细胞凋亡主要有两条途径:一是Fas、TNFR1等死亡受体介导的膜受体途径,二是线粒体凋亡途径。线粒体是细胞生命活动的控制中心,也是细胞凋亡的调控中心。多数凋亡刺激因子通过开放线粒体膜上的PTP孔,使线粒体内膜通透性增加,跨膜电位耗散,外膜破裂,细胞色素C释放到细胞质,与凋亡相关因子1(Apaf-1)结合成多聚体,进一步激活凋亡因子Caspase蛋白,诱导细胞凋亡。有研究表明ATRA可通过促进Fas蛋白表达从而诱导人皮肤恶性黑色素瘤A375细胞的体外凋亡[14],也可通过损伤线粒体从而诱导原发性人黑色素瘤细胞WM164、WM793、WM278、WM115和转移性小鼠黑色素瘤细胞451Lu、1205Lu、WM1617、WM239A的凋亡[15]。本实验通过JC-1染色实验发现中浓度(16 μmol/L)ATRA处理组相对空白对照组绿色荧光增强,红色荧光减弱,提示B16F10细胞经ATRA处理后,线粒体膜电位显著下降。进一步利用荧光分光光度计检测Caspase-9、Caspase-3活性,发现二者活性均显著增强。由此可见,ATRA可能是通过线粒体途径活化Caspase从而诱导B16F10细胞凋亡的。
体内成瘤实验被认为是研究肿瘤细胞致瘤性的一种常见方法。潘猛等[16]将极少量(1×104个)具有干性特征表型的B16F10细胞和不具有干性特征表型的B16F10细胞皮下注射于C57BL/6小鼠体内,发现前者在小鼠饲养16~24 d时全部长出肿瘤,而后者在小鼠饲养36 d后仍未长出肿瘤,几乎无致瘤性。本实验B16F10细胞经ATRA处理5 h后同样以1×104个皮下注射成瘤,结果显示空白对照组5只小鼠全部致瘤,给药组仅有1只小鼠致瘤,且肿瘤体积明显小于空白对照组。这些结果说明本实验所用的B16F10细胞具有很强的致瘤性,其中应有少量干性样B16F10细胞存在,同时也说明ATRA能显著抑制B16F10细胞的致瘤性。
综上所述,ATRA在抑制B16F10细胞体外增殖、迁移、体内成瘤,诱导细胞凋亡方面具有重要作用,其抑制成瘤的初步作用机制可能与损伤细胞线粒体,活化凋亡蛋白Caspase有关,具体分子机制还需进一步研究。
| [1] |
李欣, 石三军, 周敏, 等. 酪氨酸激酶抑制剂达沙替尼抗黑色素瘤的体外研究[J].
第三军医大学学报, 2016, 38(23): 2479–2485.
LI X, SHI S J, ZHOU M, et al. Effect of Tyrosine kinase inhibitor dasatinib on melanoma cell lines in vitro[J]. J Third Mil Med Univ, 2016, 38(23): 2479–2485. DOI:10.16016/j.1000-5404.201606059 |
| [2] | SHI S, ZHOU M, LI X, et al. Synergistic active targeting of dually integrin αvβ3/CD44-targeted nanoparticles to B16F10 tumors located at different sites of mouse bodies[J]. J Control Release, 2016, 235: 1–13. DOI:10.1016/j.jconrel.2016.05.050 |
| [3] | DOU J, PAN M, WEN P, et al. Isolation and identification of cancer stem-like cells from murine melanoma cell lines[J]. Cell Mol Immunol, 2007, 4(6): 467–472. |
| [4] | JOHNSON D E, REDNER R L. An atractive future for differentiation therapy in AML[J]. Blood Rev, 2015, 29(4): 263–268. DOI:10.1016/j.blre.2015.01.002 |
| [5] | PAN J, WANG Q, TU P. A Topical medication of All-Trans Retinoic acid reduces sebum excretion rate in patients with forehead acne[J]. Am J Ther, 2017, 24(2): e207–e212. DOI:10.1097/MJT.0000000000000390 |
| [6] |
曾维根, 胡攀, 王佳妮, 等. 全反式维甲酸对乳腺癌干细胞的抑制作用[J].
中华肿瘤杂志, 2013, 35(2): 89–93.
ZENG W G, HU P, WANG J N, et al. All-trans retinoic acid effectively inhibits breast cancer stem cells growth in vitro[J]. Chin J Oncol, 2013, 35(2): 89–93. DOI:10.3760/cma.j.issn.0253-3766.2013.02.003 |
| [7] | LIM Y C, KANG H J, KIM Y S, et al. All-trans-retinoic acid inhibits growth of head and neck cancer stem cells by suppression of Wnt/β-catenin pathway[J]. Eur J Cancer, 2012, 48(17): 3310–3318. DOI:10.1016/j.ejca.2012.04.013 |
| [8] | REJI R M, SIDDIKUZZAMAN. ATRA entrapped in DSPC liposome enhances anti-metastasis effect on lung and liver during B16F10 cell line metastasis in C57BL6 mice[J]. Anti Cancer Agents Med Chem, 2017, 17(6): 875–884. DOI:10.2174/1871520616666160927103458 |
| [9] | DOU J, HE X, LIU Y, et al. Effect of downregulation of ZEB1 on vimentin expression, tumour migration and tumourigenicity of melanoma B16F10 cells and CSCs[J]. Cell Biol Int, 2014, 38(4): 452–461. DOI:10.1002/cbin.10223 |
| [10] | FRIEDMAN M D, JEEVAN D S, TOBIAS M, et al. Targeting cancer stem cells in glioblastoma multiformeusing mTOR inhibitors and the differentiating agent all-trans retinoic acid[J]. Oncol Rep, 2013, 30(4): 1645–1650. DOI:10.3892/or.2013.2625 |
| [11] | ASGARI M M, BRASKY T M, WHITE E. Association of vitamin A and carotenoid intake with melanoma risk in a large prospective cohort[J]. J Invest Dermatol, 2012, 132(6): 1573–1582. DOI:10.1038/jid.2012.21 |
| [12] | YIN W, SONG Y, LIU Q, et al. Topical treatment of all-trans retinoic acid inhibits murinemelanoma partly by promoting CD8+ T-cell immunity[J]. Immunology, 2017. DOI:10.1111/imm.12768 |
| [13] | SENGUPTA S, RAY S, CHATTOPADHYAY N, et al. Effect of retinoic acid on integrin receptors of B16F10 melanoma cells[J]. J Exp Clin Cancer Res, 2000, 19(1): 81–87. |
| [14] |
周勇, 杨洁, 赵华, 等. 全反式维甲酸对恶性黑色素瘤A375细胞增殖及Fas蛋白表达的影响[J].
四川大学学报(医学版), 2010, 41(3): 464–466.
ZHOU Y, YANG J, ZHAO H, et al. Effect of all-trans retinoic acid on the proliferation of and Fas protein expression in human malignant melanoma A375 cells[J]. J Sichuan Univ (Med Sci Edi), 2010, 41(3): 464–466. |
| [15] | ZHANG H, SATYAMOORTHY K, HERLYN M, et al. All-trans retinoic acid (atRA) differentially induces apoptosis in matched primary and metastatic melanoma cells-a speculation on damage effect of atRA via mitochondrial dysfunction and cell cycle redistribution[J]. Carcinogenesis, 2003, 24(2): 185–191. DOI:10.1093/carcin/24.2.185 |
| [16] |
潘猛, 文萍, 窦骏, 等. 从鼠黑色素瘤细胞系中分离和鉴定癌干细胞样细胞[J].
生物技术通讯, 2008, 19(4): 500–502.
PAN M, WEN P, DOU J, et al. Isolation and identification of cancer stem like cells from murine melanoma cell lines[J]. Lett Biotech, 2008, 19(4): 500–502. DOI:10.3969/j.issn.1009-0002.2008.04.006 |