干眼(dry eye)是一种常见的眼科疾病,指由于泪液的量、质或流体动力学异常,引起的泪膜不稳定和(或)眼表损害,进而导致眼不适症状及视功能障碍[1]。中重度干眼可引起角膜上皮细胞脱落及上皮屏障功能受损(角膜荧光染色阳性)[2]。干眼的发病机制复杂,多种因素包括炎症、免疫、细胞凋亡、性激素水平等均被报道参与了干眼病理过程。然而,干眼病理过程的最终通路是泪膜不稳定,泪液中电解质浓度升高导致泪液渗透压升高。正常人泪液渗透压为(302.0±9.7)mOsm/L,而干眼患者泪液渗透压为(326.9±22.1)mOsm/L。因此,泪液的高渗透压是干眼病发病机制中的关键因素[3],既往已有研究用高渗盐水点眼成功建立了小鼠干眼模型[4]。
越来越多证据表明:细胞外液渗透压参与了上皮细胞结构与功能调节,包括支气管上皮细胞[5]、外周血单核细胞[6]和人角膜上皮细胞[7]。然而泪液高渗透压在干眼引起的眼表损害(角膜上皮完整性受损)中的作用及其机制目前尚不明确。因此,本研究以人角膜上皮细胞单层为研究对象,通过考察高渗状态对细胞紧密连接及跨膜电阻的作用,评价其对角膜上皮屏障功能的影响,并探讨p38/MAPK信号通路在这一过程中的作用,为干眼的发病机制提供新的线索。
1 材料与方法 1.1 实验材料人永生化角膜上皮细胞(human corneal epithelial cells,HCEC)由第三军医大学西南医院病理科惠赠,DMEM/F12培养基、0.25%胰蛋白酶购于Gibco公司,胎牛血清购于Biological Industries公司,单克隆兔抗ZO-1抗体、单克隆兔抗Claudin-1抗体、单克隆兔抗P-p38抗体及单克隆兔抗GADPH抗体购自Cell Signaling Technology公司,单克隆兔抗p38抗体购自武汉博士德生物技术公司。免疫荧光一抗稀释液、二抗稀释液、固定液、封闭液、Alexa Fluor 488标记山羊抗兔IgG、BCA蛋白质测定试剂盒、蛋白质裂解液RIPA、PMSF、青-链霉素均购自碧云天生物技术有限公司。过氧化物酶标记羊抗兔二抗购自北京中杉金桥生物技术公司。Immobilon Western发光液、PVDF膜购自Millipore公司。Transwell小室(直径12 mm,孔径0.4 μm,面积1.1 cm2)购自美国Corning公司。
1.2 实验方法 1.2.1 细胞培养和保存HCEC用包含10%胎牛血清、100 U/mL青霉素/链霉素的DMEM/F12培养基在5% CO2、37 ℃细胞孵育箱中培养,每1~2天换液。当细胞生长至80%~90%融合时,用0.25%胰蛋白酶消化,消化时间约为37 ℃,5 min,按1 :3传代培养。
细胞冻存:取生长状态良好的细胞,0.25%胰蛋白酶,37 ℃,5 min消化后调整细胞数至2×106~2×107/mL,离心去上清液,加等量细胞冻存液(10%DMSO+90%胎牛血清)重悬,加入冻存管,放入冻存盒,-80 ℃冰箱过夜后放入液氮长期保存。
1.2.2 调整培养基渗透压及实验分组在含10%胎牛血清、100 U/mL青霉素/链霉素的DMEM/F12培养基中加入无菌饱和氯化钠溶液,通过渗透压计分别调整培养基渗透压为302(正常渗透压组)、350、500 mOsm/L。不同渗透压培养基pH值均为7.2±0.2。
1.2.3 CCK-8法检测不同浓度渗透压对角膜上皮细胞增殖活性的影响HCEC用普通培养基重悬均匀铺于96孔板中(1×104/孔,100 μL/孔),每组设3个复孔。不同浓度渗透压处理细胞24 h后加入CCK-8溶液(10 μL/孔),置细胞孵箱孵育2 h,酶标仪设定450 nm波长检测各组光密度值[D(450)]。根据公式(增殖率=高渗透压组光密度值平均值/正常渗透压组光密度值平均值×100%)计算增殖率。
1.2.4 实验阻断模型的建立在37 ℃下给予10 μmol/L SP203580孵育细胞10 min,弃上清液,然后给予不同渗透压分别处理细胞24 h。
1.2.5 免疫荧光法观察不同浓度渗透压对紧密连接结构的影响HCEC接种于盖玻片上进行细胞爬片,待细胞生长融合至80%左右,照上述实验分组处理细胞,细胞孵育箱中孵育24 h后取出盖玻片,PBS漂洗3次(每次2 min)后,用免疫荧光固定液固定爬片15 min,PBS漂洗3次(每次2 min),加入免疫荧光封闭液,室温封闭30 min,分别加入一抗ZO-1(1 :100稀释)和Claudin-1(1 :100稀释)4 ℃摇床孵育过夜,次日室温复温45 min,弃去抗体,PBS漂洗3次(每次2 min),暗室室温孵育荧光二抗(1 :500稀释)1 h,PBS漂洗3次(每次2 min),封片后于荧光显微镜下观察并拍照。对照组和实验组均设3个复孔。
1.2.6 Western blot检测不同渗透压对紧密连接蛋白表达水平的影响HCEC用普通培养基重悬均匀铺于6孔板,按1.2.2实验分组处理细胞,并按1.2.4实验阻断模型行阻断实验,24 h后,用RIPA蛋白裂解液裂解,提总蛋白,用BCA蛋白定量法行蛋白质定量,以30 μg/孔的浓度进行12%聚丙烯酰胺凝胶电泳,将电泳完的聚丙烯氨酰凝胶用湿法转膜转移到PVDF膜上,转膜完毕后,将PVDF膜放入5%脱脂奶粉封闭液中进行室温封闭1 h,然后分别与抗ZO-1(1 :1 000稀释)、抗Claudin-1(1 :1 000稀释)、抗P-p38(1 :1 000稀释)、抗p38(1 :1 000稀释)和抗GADPH(1 :5 000稀释)摇床上4 ℃孵育过夜;次日回收一抗,1×TBST洗3次,每次10 min。山羊抗兔(1 :5 000稀释)二抗分别与抗ZO-1、抗Claudin-1、抗P-p38、抗p38和抗GADPH结合,常温孵育1 h后,1×TBST洗3次,每次10 min,滴加适量ECL反应液,采用Bio-Rad成像系统曝光PVDF膜,Image Lab软件行灰度分析,GADPH、p38作为内部参照,分别以ZO-1/GADPH、Claudin-1/GADPH、P-p38/p38灰度值作为ZO-1、Claudin-1和P-p38的相对表达量。每组实验均独立重复3次。
1.2.7 不同渗透压下角膜上皮细胞跨膜电阻的测量将HCEC重悬后按9×104/cm2细胞密度接种于12孔Transwell小室中,接种后隔天更换培养基1次,顶侧培养基为0.5 mL,基底侧培养基为1.5 mL。细胞培养期间于倒置显微镜下观察细胞生长情况,并用Milicell ERS-2电阻检测仪测定同时间点的角膜上皮细胞跨膜电阻(transepithelial electrical resistance, TEER),在TEER趋于稳定时,按1.2.2实验分组并按1.2.4实验阻断模型行阻断实验,细胞孵育箱孵育24 h后,分别测量小室的3个不同点,取测量值的平均值,为实际TEER,不接种细胞的小室为空白对照,测得的电阻值为空白TEER,细胞TEER=(实际TEER-空白TEER)×Transwell有效膜面积,单位用Ω·cm2表示。每组实验均独立重复3次。
1.3 统计学分析采用SPSS 20.0软件对实验数据进行统计分析,计量资料3组及以上用单因素方差分析,组间比较用LSD-t检验。检验水准:α=0.05。
2 结果 2.1 细胞形态及高渗透压对细胞增殖活性的影响光镜下可见HCEC细胞呈多角形,并逐渐相互融合为细胞单层(图 1A、B)。350、500 mOsm/L渗透压浓度分别作用HCEC细胞24 h后对细胞形态及增殖没有影响(图 1C)。
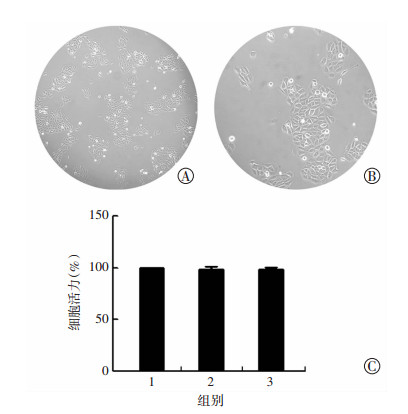
|
| 1:正常渗透压组(302 mOsm/L);2:350 mOsm/L高渗透压组;3:500 mOsm/L高渗透压组 图 1 人永生化角膜上皮细胞形态(A:×100,B:×400)及高渗透压对细胞增殖活性的影响(C) |
2.2 免疫荧光染色
HCEC细胞紧密连接蛋白ZO-1和Claudin-1进行免疫荧光染色后可见(图 2):正常渗透压下的HCEC细胞(正常渗透压组)ZO-1和Claudin-1蛋白定位于其细胞膜上,呈线性分布,围绕细胞膜形成环状结构,细胞与细胞之间互相连接。而在高渗透压下,细胞膜上的ZO-1和Claudin-1蛋白荧光染色信号明显减弱,出现断裂、模糊,且荧光破坏现象随着渗透压增高而表现越明显,提示在高渗透压下HCEC细胞间紧密连接蛋白ZO-1和Claudin-1受到破坏。
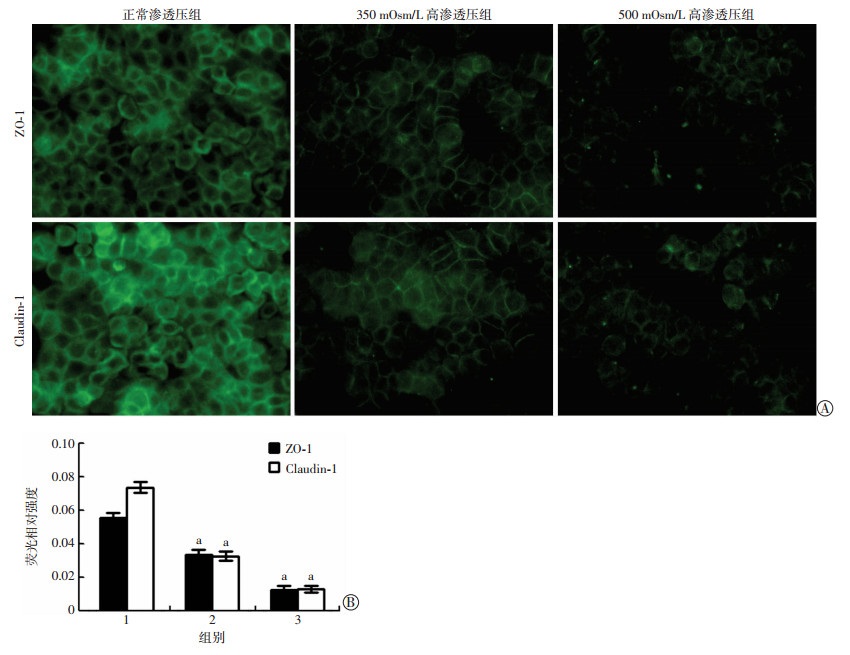
|
| A:免疫荧光染色观察不同渗透压下的HCEC细胞Z0-1和Claudin-1蛋白定位; B:免疫荧光染色半定量分析1:正常渗透压组; 2: 350 mOsm/L高渗透压组;3: 500 mOsm/L高渗透压组; a: P < 0.05,与正常渗透压组比较 图 2 高渗透压下HCEC细胞紧密连接蛋白免疫荧光染色观察 |
2.3 高渗透压对紧密连接蛋白及p38/MAPK的影响
与正常渗透压组相比,350 mOsm/L和500 mOsm/L渗透压组均能减少HCEC细胞紧密连接蛋白ZO-1和Claudin-1的表达,并呈浓度依赖关系(P < 0.05, 图 3A、B)。与此同时,Western blot检测了在高渗透压破坏紧密连接蛋白的过程中p38/MAPK信号通路的变化情况,结果显示:与正常渗透压组相比,p-p38蛋白浓度随着渗透压增高而表达增加(P < 0.05, 图 3C)。
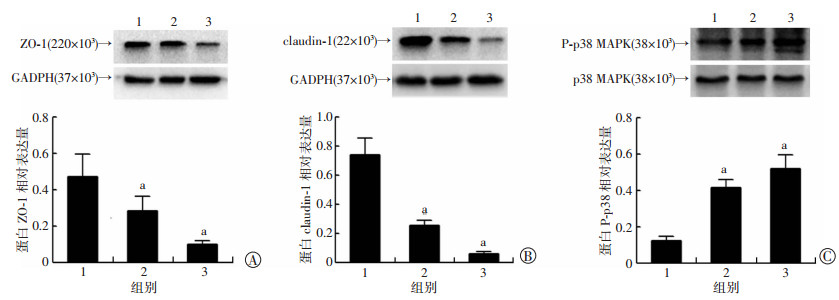
|
| 1:正常渗透压组(302 mOsm/L);2:350mOsm/L高渗透压处理组;3:500 mOsm/L高渗透压处理组;a:P < 0.05,与正常渗透压组比较 图 3 高渗透压对角膜上皮细胞紧密连接蛋白ZO-1(A)、Claudin-1(B)及p38磷酸化(C)的影响 |
在500 mOsm/L高渗透压下,用p38/MAPK阻断剂SB203580处理HCEC细胞后,不但可以抑制高渗透压引起的紧密连接蛋白ZO-1和Claudin-1表达下降(图 4A、B),也可以抑制磷酸化p38通路的活化,即p-p38蛋白表达下降(P < 0.05,图 4C)。上述结果表明:高渗透压通过激活p38/MAPK信号通路下调HCEC细胞紧密连接蛋白ZO-1和Claudin-1的表达。
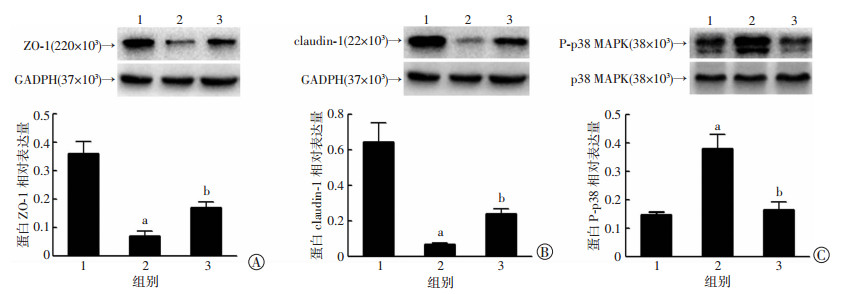
|
| 1:正常渗透压组(302 mOsm/L);2:高渗透压处理组(500 mOsm/L);3:高渗透压处理+阻断组(500 mOsm/L+SB203580);a:P < 0.05,与正常渗透压组比较;b:P < 0.05,与高渗透压处理组比较 图 4 阻断剂SB203580抑制后对角膜上皮细胞紧密连接蛋白ZO-1(A)、Claudin-1(B)及p38磷酸化(C)的影响 |
2.4 高渗透压对细胞跨膜电阻的影响
细胞跨膜电阻结果显示,与正常渗透压组相比,350 mOsm/L和500 mOsm/L渗透压组浓度均能降低细胞间的跨膜电阻,并呈浓度依赖关系(P < 0.05,图 5A)。与此同时,阻断实验结果显示:p38/MAPK阻断剂SB203580处理HCEC细胞后可以抑制高渗透压引起细胞跨膜电阻值的下降(P < 0.05,图 5B)。结果提示高渗透压可引起角膜上皮屏障功能受损,而p38/MAPK阻断剂能够抑制高渗透压引起的角膜上皮屏障功能受损。结果再次表明p38/MAPK信号通路与高渗透压破坏角膜上皮紧密连接密切相关。
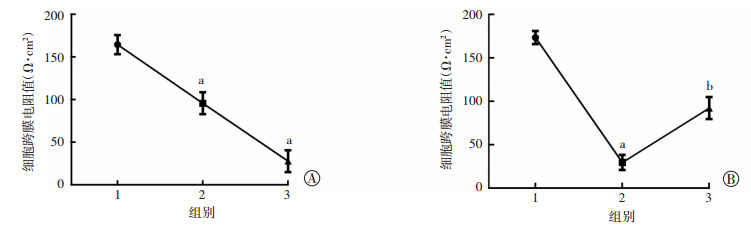
|
|
a:P < 0.05,与正常渗透压组比较;b:P < 0.05,与高渗透压处理组比较 A:高渗透压对角膜上皮细胞跨膜电阻值的影响1:正常渗透压组;2:350 mOsm/L高渗透压处理组;3:500 mOsm/L高渗透压处理组;B:加入阻断剂后高渗透压对角膜上皮细胞跨膜电阻值的影响1:正常渗透压组;2:高渗透压处理组(500 mOsm/L);3:高渗透压处理+阻断组(500 mOsm/L+SB203580) 图 5 高渗透压对角膜上皮细胞跨膜电阻值的影响 |
3 讨论
干眼可引起角膜上皮细胞脱落,上皮完整性受损,但引起这一病理改变的具体因素并不清楚。紧密连接存在于顶层角膜上皮细胞之间,是角膜上皮屏障功能的重要结构基础[8]。紧密连接的破坏是病理情况下角膜上皮细胞脱落的必要条件。本研究发现,在HCEC细胞单层中,高渗透压可导致角膜上皮细胞紧密连接蛋白(ZO-1和Claudin-1)表达下降,跨膜电阻降低,提示角膜上皮的屏障功能受到了破坏。研究结果表明干眼泪液中的高渗透压可能是引起干眼角膜上皮损伤的因素之一。
根据既往研究报道,高渗透压引起细胞损伤可能通过两种机制:①导致细胞凋亡,如高渗透压可通过JNK/SAPK和p38信号转导通路促进兔髓核细胞凋亡[9]。本研究中,虽然高渗透压可破坏角膜上皮细胞紧密连接蛋白,但CCK-8法并未发现高渗透压对HCEC细胞本身的形态和增殖有影响。因此,我们认为高渗透压并非直接损伤细胞导致干眼角膜上皮脱落。②促进炎症因子的释放[10],如高渗盐水可促进小鼠角膜上皮IL-1、TNF-α和MMP-9的释放[11]。而在干眼患者的泪液、角膜上皮中亦检测到TNF-α、IL-6、基质金属蛋白酶(MMPs)等炎症因子的高表达[12]。这些炎症因子可直接破坏上皮细胞紧密连接或通过信号通路影响紧密连接相关蛋白的表达,如MMP-9会导致角膜上皮紧密连接蛋白ZO-1、Claudin-1和Occludin溶解[13]。因此,我们认为高渗透压引起角膜上皮损伤脱落的具体机制可能为:高渗透压促进角膜上皮炎症因子的释放,通过信号通路下调角膜上皮紧密连接蛋白的表达,导致细胞移行、黏附功能受损,进而损伤脱落于角膜基质。
近年来在肠道上皮的相关研究中发现,MAPK信号通路参与了渗透压对肠道上皮紧密连接[14]及胃黏膜上皮[15]增殖、分化、凋亡的调节。鉴于肠道上皮和角膜上皮有着诸多生物学共性,本研究进一步考察MAPK信号通路中p38/MAPK这一信号通路在高渗透压所致角膜上皮紧密连接破坏中的作用。研究结果表明:高渗透压不仅能破坏角膜上皮细胞紧密连接,使紧密连接蛋白表达下降、细胞间跨膜电阻降低,且在相同时间内,此破坏过程呈浓度依赖性。与此同时,p38/ MAPK信号传导通路被激活,磷酸化p38蛋白表达增加。当加入p38/MAPK信号传导通路阻断剂SB203580后,紧密连接蛋白表达开始增加,跨膜电阻值也随之上升。SB203580是p38/MAPK信号通路常用阻断剂[16],它作用于p38 ATP的结合活位点Thr106,使p38/MAPK与ATP失去相互结合能力,从而失去激酶活性[17]。本研究采用SB203580阻断细胞内p38/MAPK通路,进一步观察了此信号通路在高渗透压介导的角膜上皮细胞屏障紧密连接破坏中的作用,结果表明:阻断p38/MAPK信号通路后再次给予高渗透压刺激,P-p38蛋白表达量减少,提示此信号通路参与了高渗透压作用下角膜上皮细胞紧密连接的破坏作用。
综上所述,本研究明确了高渗透压对角膜上皮屏障功能的影响及p38/MAPK信号通路在此过程中的作用,为干眼的发病机制研究提供了新的线索。
| [1] | Definition and Classfication Subcommittee members. The definition and classification of dry eye disease: report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007)[J]. Ocul Surf, 2007, 5(2): 75–92. DOI:10.1016/S1542-0124(12)70081-2 |
| [2] |
林泉, 刘伟民. 干眼诊断的研究进展[J].
中国临床新医学, 2016, 9(3): 269–274.
LIN Q, LIU W M. Research progress of diagnosis of dry-eye disease[J]. Chin J New Clin Med, 2016, 9(3): 269–274. DOI:10.3969/j.issn.1674-3806.2016.03.28 |
| [3] | WARCOIN E, CLOUZEAU C, BRIGNOLE-BAUDOUIN F, et al. Hyperosmolarity: intracellular effects and implication in dry eye disease[J]. J Fr Ophtalmol, 2016, 39(7): 641–651. DOI:10.1016/j.jfo.2016.07.006 |
| [4] |
李晶. 一种新的干眼病模型——高渗盐水点眼小鼠干眼病模型的建立与评估[D]. 重庆: 第三军医大学, 2010.
LI J. A new dry eye disease model:evaluation of A murine model of dry eye disease induced by topical hyperosmolar saline[D]. Chongqing: Third Military Medical University, 2010. |
| [5] | YAGHI A, ZAMAN A, DOLOVICH M B. The direct effect of hyperosmolar agents on ciliary beating of human bronchial epithelial cells[J]. J Aerosol Med Pulm Drug Deliv, 2012, 25(2): 88–95. DOI:10.1089/jamp.2011.0914 |
| [6] | HUANG S M, WU C S, CHAO D, et al. High-glucose-cultivated peripheral blood mononuclear cells impaired keratinocyte function via reduced IL-22 expression: implications on impaired diabetic wound healing[J]. Exp Dermatol, 2015, 24(8): 639–641. DOI:10.1111/exd.12733 |
| [7] | KATSUYAMA I, ARAKAWA T. A convenient rabbit model of ocular epithelium damage induced by osmotic dehydration[J]. J Ocul Pharmacol Ther, 2003, 19(3): 281–289. DOI:10.1089/108076803321908400 |
| [8] | LEONG Y Y, TONG L. Barrier function in the ocular surface: from conventional paradigms to new opportunities[J]. Ocul Surf, 2015, 13(2): 103–109. DOI:10.1016/j.jtos.2014.10.003 |
| [9] |
李方辉, 薛少青, 修焕娟, 等. JNK/SAPK和p38信号转导通路在高渗透压介导的兔髓核细胞凋亡中的作用[J].
复旦学报(医学版), 2012, 39(2): 128–134.
LI F H, XUE S Q, XIU H J, et al. The role of JNK/SAPK and p38 signal pathways in apoptosis of rabbit nucleus pulposus cells induced by high osmolality[J]. Fudan Univ J Med Sci, 2012, 39(2): 128–134. DOI:10.3969/j.issn.1672-8467.2012.02.004 |
| [10] | CHEN Y, LI M, LI B, et al. Effect of reactive oxygen species generation in rabbit corneal epithelial cells on inflammatory and apoptotic signaling pathways in the presence of high osmotic pressure[J]. PLoS ONE, 2013, 8(8): e72900. DOI:10.1371/journal.pone.0072900 |
| [11] | LUO L, LI D Q, CORRALES R M, et al. Hyperosmolar saline is a proinflammatory stress on the mouse ocular surface[J]. Eye Contact Lens, 2005, 31(5): 186–193. |
| [12] | ACERA A, VECINO E, DURAN J A. Tear MMP-9 levels as a marker of ocular surface inflammation in conjunctivochalasis[J]. Invest Ophthalmol Vis Sci, 2013, 54(13): 8285–8291. DOI:10.1167/iovs.13-12235 |
| [13] | MAURIS J, WOODWARD A M, CAO Z, et al. Molecular basis for MMP9 induction and disruption of epithelial cell-cell contacts by galectin-3[J]. J Cell Sci, 2014, 127(Pt 14): 3141–3148. DOI:10.1242/jcs.148510 |
| [14] | WHITTAMORE J M. Osmoregulation and epithelial water transport: lessons from the intestine of marine teleost fish[J]. J Comp Physiol B, 2012, 182(1): 1–39. DOI:10.1007/s00360-011-0601-3 |
| [15] | ZOLOTAREV V A, ANDREEVA IuV, KHROPYCHEVA R P. Effect of mild irritants on gastric outputs of bicarbonates and pepsinogen depends on the rate of acid secretion[J]. Ross Fiziol Zh Im I M Sechenova, 2012, 98(6): 744–756. |
| [16] | XUE Q, WANG X, WANG P, et al. Role of p38MAPK in apoptosis and autophagy responses to photodynamic therapy with Chlorin e6[J]. Photodiagnosis Photodyn Ther, 2015, 12(1): 84–91. DOI:10.1016/j.pdpdt.2014.12.001 |
| [17] | HALL-JACKSON C A, EYERS P A, COHEN P, et al. Paradoxical activation of Raf by a novel Raf inhibitor[J]. Chem Biol, 1999, 6(8): 559–568. DOI:10.1016/S1074-5521(99)80088-X |



