2. 401147 重庆,重庆医科大学附属口腔医院:儿童口腔科,口腔疾病与生物医学重庆市重点实验室,重庆市高校市级口腔生物医学工程重点实验室
2. Department of Pediatric Dentistry, Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences, Chongqing Key Laboratory of Oral Biomedical Engineering of Higher Education, Stomatological Hospital of Chongqing Medical University, Chongqing, 401147, China
种子细胞、支架材料、细胞培养环境是应用于组织工程中的三大要素。在20世纪早期,脂肪干细胞(adipose-derived stem cell, ADSCs)第一次被发现并证实存在于脂肪组织中,脂肪干细胞与其他干细胞比较,在体外获取和培养上存在许多的优势。大量研究也证明脂肪干细胞具有多向分化的能力[1-2],能够向成脂、成骨、成软骨、肌肉、神经细胞等分化。正是由于具有这些优势,脂肪干细胞受到了越来越多的重视,在很多领域作为种子细胞应用于组织工程中[3-4]。目前,作为支架材料在组织工程技术中应用较广泛的是细胞膜片技术(cell sheet)[5]。这种膜片通过含有50 μg/mL抗坏血酸的培养基连续培养2周左右而获得,这样将不会破坏细胞之间分泌的细胞外基质及蛋白,同时避免消化酶作用导致细胞活性的丧失;还具有操作简单、生物相容性好、渗透性好、生物活性好等特点。虽然ADSCs作为临床应用前景广阔的种子细胞且目前体内外实验均证明ADSCs具有成骨分化潜力,但有些学者认为ADSCs成骨能力弱于骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs),成骨向分化能力有限,仍需进一步提高[6]。
富血小板纤维蛋白(platelet-rich fibrin, PRF)为新一代血小板浓缩物,其内含有黏结蛋白,包括纤维蛋白原、纤维连接蛋白等,这些蛋白可以作为骨的基质,也可以作为连接细胞间的分子起到骨诱导的作用[7]。同时,还含有有利于创伤愈合及骨再生相关的多种生长因子,包括血管内皮生长因子和表皮生长因子,它们一方面促进成骨细胞的增殖,另一方面抑制破骨细胞的功能,对创伤愈合和组织再生有着重要作用。ADSCs膜片复合PRF能否提高ADSCs成骨分化能力,使其更好地应用于牙周组织再生呢?基于这个设想,本实验首先分离培养脂肪干细胞,将其培养成细胞膜片并鉴定脂肪干细胞膜片的生物学特性。同时,制备PRF与脂肪干细胞膜片复合物,研究其成骨分化能力的作用,为牙周组织骨再生的研究提供思路。
1 材料与方法 1.1 材料 1.1.1 实验动物12月龄健康比格犬,体质量10~ 12 kg,购于四川养麝研究所比格犬繁育中心。
1.1.2 主要仪器及试剂倒置相差显微镜(日本Nikon Ti-s);离心机(上海菲恰尔分析仪器公司);超净工作台(美国AIRTECH公司);F-12 DMEM、PBS(美国HyClone公司);Ⅰ型胶原酶(美国Sigma公司);胎牛血清(FBS,美国HyClone公司);青霉素,链霉素(美国Sigma公司);0.25%胰酶(美国HyClone公司);抗坏血酸、地塞米松、β-磷酸甘油钠、茜素红、油红O、ALP染色试剂、CCK-8试剂盒(美国Sigma公司);总RNA提取试剂盒(美国Omega公司)。
1.2 方法 1.2.1 犬脂肪组织的分离与培养取1周岁比格犬1只,静脉注射3%的戊巴比妥1 mL/kg麻醉,腹股沟部备皮,消毒后铺巾,沿皮纹方向切开皮肤及皮下组织,止血后分离获得脂肪组织约5 mL,放入含青霉素和链霉素的PBS溶液中。将脂肪组织转移至超静台内,用含有双抗的PBS反复冲洗,去除肉眼可见的血管及筋膜组织,剪碎后加入等体积的Ⅰ型胶原酶,37 ℃恒温水浴箱震荡消化40 min后用含10%胎牛血清的DMEM培养基终止消化,200目筛网过滤至离心管中,以200×g速度离心5 min,弃上清液后加入培养基,再次离心后加入含FBS的F-12培养基重悬,移至T25培养瓶中以37 ℃、5%的CO2浓度培养。24 h后细胞贴壁,每3天换液,待细胞融合约80%时传代培养并在倒置相差显微镜下观察细胞的变化。
1.2.2 犬ADSCs的鉴定 1.2.2.1 生长曲线测定取第3代ADSCs,按1×104/mL的密度接种至96孔板中。每天同一时间取1组细胞加入10 μL CCK-8溶液后用酶标仪测定在450 nm处的光密度值[D(450)],记录连续测定7 d的结果。以时间为横坐标、D(450)为纵坐标绘制细胞生长曲线。
1.2.2.2 多向分化能力鉴定① 成骨能力鉴定:取第3代ADSCs细胞悬液,以1×105/孔的密度接种至6孔板中,细胞贴壁后加入成骨诱导液(含10%FBS的F-12培养液、10 mmol/L β-磷酸甘油钠、10 nmol/L地塞米松、50 μg/mL抗坏血酸)培养21 d后PBS清洗3遍,4%多聚甲醛固定30 min后茜素红染色。镜下观察矿化钙结节;②成脂能力鉴定:取第3代ADSCs细胞悬液,以1×105/孔的密度接种至6孔板中,细胞贴壁后加入成脂诱导液[含10%FBS的F-12培养液、0.5 mmol/L 1-甲基-3-异丁基黄嘌呤(3-isobutyl-methylxanthine, IBMX)、50 nmol/L吲哚美辛、100 nmmol/L地塞米松]培养14 d后,4%多聚甲醛固定30 min后油红O染色。倒置相差显微镜镜下观察脂滴的形成。
1.2.3 犬ADSCs膜片的制备与鉴定 1.2.3.1 犬ADSCs膜片的制备取第3代ADSCs细胞悬液,以4×105/孔接种至60 mm培养皿中,待细胞贴壁后加入成膜诱导液(含50 μg/mL抗坏血酸和10%FBS的F-12培养液)。每2天换液1次,倒置相差显微镜下观察细胞的生长,培养约2周左右时,可见培养皿中形成半透明膜状,边缘微微卷起,此时细胞膜片成熟。
1.2.3.2 犬ADSCs膜片的鉴定① 膜片HE染色:细胞膜片成熟后,PBS清洗后用无菌镊子完整剥离细胞膜片,采用4%多聚甲醛固定1 h,不同梯度乙醇脱水后常规石蜡包埋,行石蜡组织切片,HE染色,显微镜下观察细胞膜片;②扫描电镜观察超微结构:细胞膜片成熟后,PBS清洗后用无菌镊子完整剥离细胞膜片,采用2.5%戊二醛固定1 h,序列乙醇梯度脱水,醋酸异戊酯替换,干燥,喷金后扫描电镜观察细胞膜片超微结构。
1.2.4 PRF对ADSCs膜片成骨能力的影响 1.2.4.1 PRF的制备并将其与ADSCs膜片复合取犬静脉血约5 mL于玻璃离心管中,400×g离心10 min,离心后获得中间层的PRF凝胶,挤压水分后获得PRF膜片,将其处理后进行电镜扫描观察其超微结构。将PRF膜片剪碎成小颗粒状,与ADSCs细胞膜片共培养后获得双膜复合体,扫描电镜观察双膜复合体结合的超微结构。
1.2.4.2 ADSCs膜片复合PRF后成骨能力的相关检测将培养好的细胞膜片分为实验组和对照组,实验组用含有PRF的成骨培养基进行成骨诱导,对照组用成骨培养基诱导。诱导3、5 d时,提取mRNA后进行反转录及基因扩增,应用Real-time PCR技术检测成骨相关基因的表达,包括ALP和Runx2基因,使用Primer Premier 5.0进行基因序列的设计(β-actin引物序列上游:5′-GAACGGAGAAGGTGACAGCA-3′,下游:5′-GGCTTTTGGGAAGGCAAAGG-3′;ALP引物序列上游:5′-CCGTGGGCATCCTATTCTGA-3′,下游:5′-GGC-AGCAGACTTTGGTTTCC-3′;Runx2引物序列上游:5′-CCAAGTGGCCAGCTATCACA-3′,下游:5′-GGATGAGGAATGCGCCCTAA-3′),由上海生工生物科技有限公司合成;诱导7 d后进行ALP染色,诱导14 d后进行茜素红染色,倒置相差显微镜镜下观察并拍照。
1.3 统计学分析采取SPSS 17.0统计软件。定量资料以x±s表示,数据比较采用独立样本t检验。
2 结果 2.1 犬ADSCs的分离培养及鉴定刚贴壁的细胞生长时呈短梭形(图 1A),第3代细胞呈长梭形或纺锤状(图 1B)。成骨诱导21 d后行茜素红染色,镜下可见明显的矿化结节形成(图 1C);成脂诱导14 d后行油红O染色,镜下可见细胞内大小不等的单个或融合呈串珠样结构的红色的脂滴形成(图 1D)。犬ADSCs生长曲线呈“S”形,从第3天起细胞加速生长,生长第6天时达到顶峰,其后进入“平稳期”(图 2)。
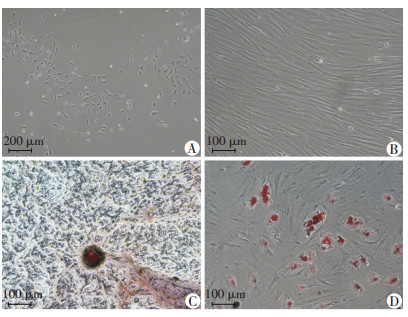
|
| A:P1代;B:P3代;C:ADSCs成骨诱导21 d后茜素红染色;D:ADSCs成脂诱导14 d后油红O染色 图 1 ADSCs的细胞形态与多向分化潜能鉴定 |
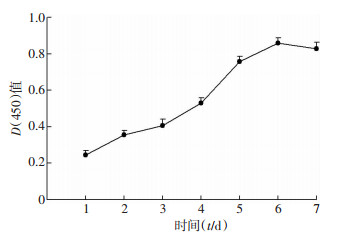
|
| 图 2 ADSCs生长增殖曲线(n=3,x±s) |
2.2 犬ADSCs膜片形态学观察
ADSCs成膜诱导成熟后,肉眼观膜片呈白色半透明膜状,紧密贴附于培养皿底部,边缘微微卷起(图 3A),与培养皿分离的膜片边缘菲薄,可收缩,卷曲成不规则形态(图 3B)。镜下观察ADSCs膜片的细胞呈长梭形,细胞外基质将细胞紧密结合在一起,排列成螺旋状,细胞极性较一致(图 3C)。HE染色见细胞膜片约2层细胞,含大量细胞外基质,蓝染的细胞核分布较均匀,膜片厚度均匀,完整性好(图 3D)。扫描电镜观察可见大量规则的细胞排列,细胞外基质将细胞紧密连接在一起,细胞复层叠片状紧密排列,极性较一致(图 3E、F)。
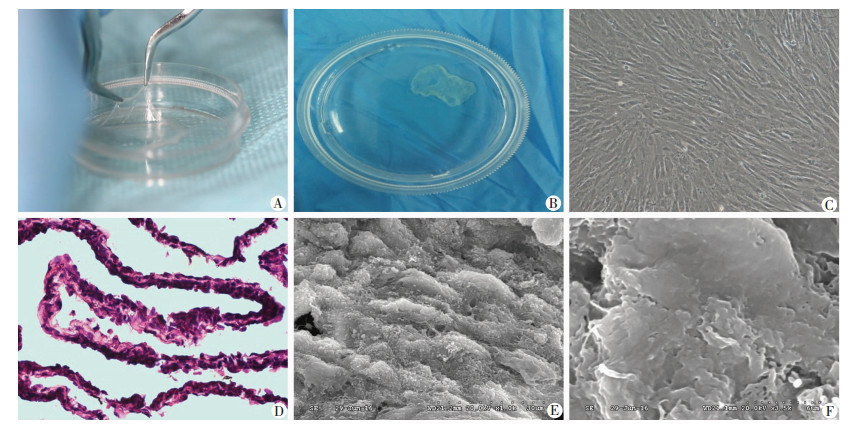
|
| A:贴壁的ADSCs膜片大体观察;B:剥脱的ADSCs膜片大体观察;C:ADSCs膜片形态镜下观察(LM×40);D:ADSCs膜片HE染色观察(×400);E:细胞外基质的扫描电镜观察(×1 000);F:膜片表面的扫描电镜观察(×3 500) 图 3 ADSCs膜片的大体形态、组织形态与超微结构观察 |
2.3 ADSCs膜片复合PRF后的成骨能力观察
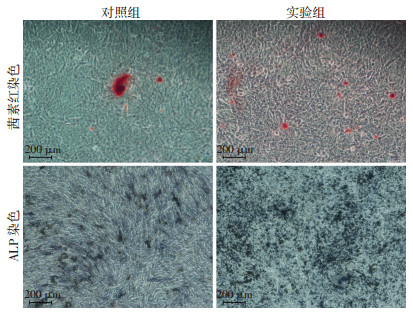
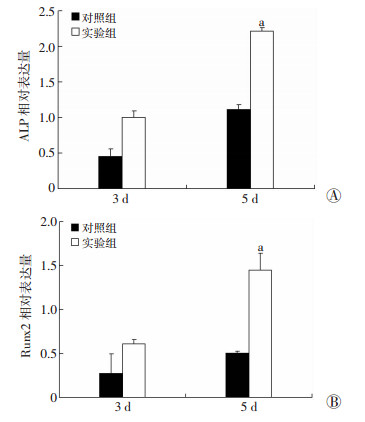
静脉血离心后大体观显示:PRF为乳白色凝胶,扫描电镜观察其超微结构见PRF为紧密排列、疏松多孔的三维立体的纤维蛋白网状结构。PRF与细胞膜片的双膜复合体表面几乎全部为膜片状结构覆盖,PRF小颗粒膜片三维网状结构连接与细胞膜片之间有很好的结合(图 4)。成骨诱导7 d后ALP染色结果显示:实验组和对照组均有ALP的表达,且实验组表达更加明显;成骨诱导14 d后茜素红染色显示实验组钙结节形成量明显多于对照组(图 5)。RT-PCR结果显示:成骨诱导3、5 d时,实验组ALP、Runx2基因mRNA相对表达量明显高于对照组;3 d时,对照组和实验组无明显差异(P>0.05),5 d时,对照组和实验组差异有统计学意义(P < 0.05);2组5 d时的ALP、Runx2基因mRNA相对表达量分别高于3 d时的表达量(图 6)。
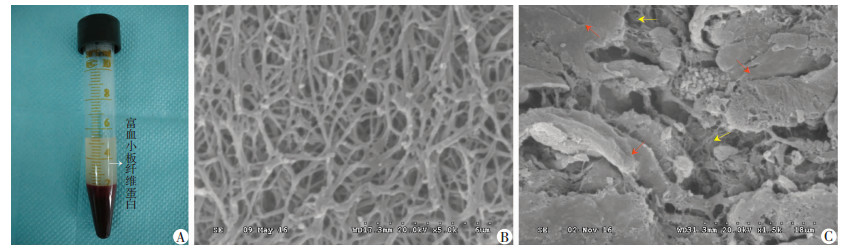
|
| A:PRF的大体观;B:PRF纤维网状结构扫描电镜观察(×5 000);C:细胞膜片与PRF的双膜复合体扫描电镜观察(×1 500)红色箭头示细胞膜片结构;黄色箭头示PRF三维网状结构 图 4 PRF的大体形态学及超微结构观察 |
|
| 图 5 ADSCs膜片成骨诱导后对照组与实验组的ALP染色及茜素红染色观察 |
|
| A:成骨诱导3、5 d时,对照组和实验组ALP基因mRNA相对表达量;B:成骨诱导3、5 d时,对照组和实验组Runx2基因mRNA相对表达量a:P < 0.05,与对照组比较 图 6 RT-PCR分析对照组与实验组ALP、Runx2基因mRNA的表达(n=3,x±s) |
3 讨论
应用ADSCs作为组织工程的种子细胞是目前研究中的一个较活跃领域,ADSCs的体外分离、培养、多向分化潜能及其免疫原性的研究在近几年多有报道[8-10]。本实验成功地从比格犬脂肪组织中分离获取了ADSCs,经过传代培养后成功进行多向潜能诱导分化。结果显示:成骨诱导后可见钙结节沉积,茜素红染色阳性;成脂诱导后可见大量脂滴,油红O染色阳性。证实所获取的犬ADSCs具有多向诱导分化能力,这是干细胞的基本特性。
细胞膜片技术是通过体外诱导促进种子细胞短时间内产生大量的细胞外基质,形成内源性支架,有利于细胞间及细胞与胞外基质间的交互作用和信息传递。有研究认为,在应用细胞膜片进行牙周组织缺损修复的过程中,细胞膜片和植床的充分接触是确保修复效果的关键[11]。细胞膜片的培养技术很多,包括基于温敏材料的细胞膜片技术、外科剥离方法制备细胞膜片等。本实验采用双层细胞膜片外科剥离方法获得细胞膜片,成功构建了ADSCs细胞膜片;对制备的ADSCs膜片的形态通过大体观、倒置相差显微镜、HE染色、扫描电镜进行观察,发现细胞形态从短缩形变为长梭形,极性一致,叠瓦式生长,细胞与细胞之间连接紧密地在一起,从而说明本实验成功构建了ADSCs细胞膜片且制备方法较为成熟。
ADSCs膜片可以作为内源性支架应用于牙周再生组织工程中,但是ADSCs本身成骨能力稍弱于BMMSCs。因此,我们设想是否可以通过加入一些生长因子提高ADSCs的成骨能力。部分学者发现PRF可以促进拔牙窝的愈合[12-13];在促进种植体骨结合方面,PRF也显示出良好的治疗效果[14-15]。本实验通过静脉血高速离心的方法获得中间层的PRF凝胶,PRF和ADSCs复合成骨诱导后的ALP活性和茜素红染色明显优于单独培养的ADSCs,同时ADSCs复合PRF成骨诱导后成骨相关基因ALP、Runx2 mRNA高表达,证实PRF能够提高ADSCs的成骨分化能力。
目前,ADSCs在骨组织工程、脂肪组织工程、软骨和肌肉的损伤修复、整形外科等方面的研究和治疗中广泛应用,有学者报道将牙周膜干细胞应用于再植牙牙周组织再生的动物实验研究,鲜有研究将ADSCs用于再植牙的牙周组织再生。ADSCs的来源方便以及组织再生的优势使其在组织工程应用中备受瞩目,本实验将它与细胞膜片技术相结合作为组织工程支架材料,为组织再生修复奠定良好的基础。但在不同组织工程中,ADSCs微环境的构建与条件及其发挥的重要作用仍需进一步研究。
| [1] |
尚志刚, 郭琼, 李甜, 等. 人脂肪干细胞的培养及鉴定[J].
中国美容医学, 2015, 24(8): 34–37.
SHANG Z G, GUO Q, LI T, et al. Isolation and identification of human adipose stem cells[J]. Chin J Aesthetic Med, 2015, 24(8): 34–37. DOI:10.15909/j.cnki.cn61-1347/r.000340 |
| [2] |
王贤, 张培华. 脂肪干细胞的研究及应用进展[J].
海南医学, 2016, 27(6): 965–967.
WANG X, ZHANG P H. Research and application progress of adipose-derived stem cells[J]. Hainan Med J, 2016, 27(6): 965–967. |
| [3] | TOBITA M, ORBAY H, MIZUNO H. Adipose-derived stem cells: current findings and future perspectives[J]. Discov Med, 2011, 11(57): 160–170. |
| [4] | ROMAGNOLI C, BRANDIM L. Adipose mesenchymal stem cells in the field of bone tissue engineering[J]. World J Stem Cells, 2014, 6(2): 144–152. DOI:10.4252/wjsc.v6.i2.144 |
| [5] | TANI G, USUI N, KAMIYAMA M, et al. In vitro construction of scaffold-free cylindrical cartilage using cell sheet-based tissue engineering[J]. Pediatr Surg Int, 2010, 26(2): 179–185. DOI:10.1007/s00383-009-2543-3 |
| [6] | Liao H T. Osteogenic potential: Comparison between bone marrow and adipose-derived mesenchymal stem cells[J]. World J Stem Cells, 2014, 6(3): 288–95. DOI:10.4252/wjsc.v6.i3.288.Review |
| [7] |
赵伟, 邹德荣. 富血小板血浆在口腔组织再生中应用的影响因素[J].
口腔颌面外科杂志, 2010, 20(3): 203–207.
ZHAO W, ZHOU D R. Influence factors on application of platelet-rich plasma in tissue regeneration in dentistry[J]. J Oral Maxillofac Surg, 2010, 20(3): 203–207. DOI:10.3969/j.issn.1005-4979.2010.03.014 |
| [8] | CASTEILLA L, PLANAT-BENARD V, LAHARRAGUE P, et al. Adipose-derived stromal cells: their identity and uses in clinical trials, an update[J]. World J Stem Cells, 2011, 3(4): 25–33. DOI:10.4252/wjsc.v3.i4.25 |
| [9] | MIZUNO H, TOBITA M, UYSAL A C. Concise review: adipose-derived stem cells as a novel tool for future regenerative medicine[J]. Stem Cells, 2012, 30(5): 804–810. DOI:10.1002/stem.1076 |
| [10] | ZHU X, DU J, LIU G. The comparison of multilineage differentiation of bone marrow and adipose-derived mesenchymal stem cells[J]. Clin Lab, 2012, 58(9/10): 897–903. |
| [11] | ZHOU Y, LI Y, MAO L, et al. Periodontal healing by periodontal ligament cell sheets in a teeth replantation model[J]. Arch Oral Biol, 2012, 57(2): 169–176. DOI:10.1016/j.archoralbio.2011.08.008 |
| [12] | ANTONELLO GDE M, TORRES DO COUTO R, GIONGO C C, et al. Evaluation of the effects of the use of platelet-rich plasma (PRP) on alveolar bone repair following extraction of impacted third molars: prospective study[J]. J Craniomaxillofac Surg, 2013, 41(4): e70–e75. DOI:10.1016/j.jcms.2012.11.003 |
| [13] | CÉLIO-MARIANO R, DE MELO W M, CARNEIRO-AVELINO C. Comparative radiographic evaluation of alveolar bone healing associated with autologous platelet-rich plasma after impacted mandibular third molar surgery[J]. J Oral Maxillofac Surg, 2012, 70(1): 19–24. DOI:10.1016/j.joms.2011.03.028 |
| [14] | JANG E S, PARK J W, KWEON H, et al. Restoration of peri-implant defects in immediate implant installations by Choukroun platelet-rich fibrin and silk fibroin powder combination graft[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2010, 109(6): 831–836. DOI:10.1016/j.tripleo.2009.10.038 |
| [15] | BOORA P, RATHEE M, BHORIA M. Effect of platelet rich fibrin (PRF) on peri-implant soft tissue and crestal bone in one-stage implant placement: a randomized controlled trial[J]. J Clin Diagn Res, 2015, 9(4): ZC18–21. DOI:10.7860/JCDR/2015/12636.5788 |



