2. 400038 重庆,第三军医大学西南医院疼痛科
2. Department of Pain Management, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
阿尔茨海默病(Alzheimer’ s disease,AD)又称老年性痴呆,是老年期前后发生在中枢神经系统的退行性疾病。β-淀粉样蛋白(amyloid β peptide,Aβ)沉积形成的老年斑(senile plaques,SP)是AD的典型病理特征之一[1]。研究表明Aβ沉积是AD发病的始动因素,其诱导小胶质细胞激活并释放多种促炎性细胞因子(如IL-1β、IL-6、TNF-α)的释放,同时可诱导一氧化氮、前列腺素类分子及活性氧类的生成,共同促进神经细胞的病变和凋亡,对外周和中枢神经系统产生重要影响[2]。青蒿素(artemisinin)是从黄花蒿中提取分离出的一种高效低毒的新型抗疟的中草药成分,最早由我国杰出的药理学家屠呦呦教授发现报道[3]。双氢青蒿素(dihydroartemisinin,DHA)为青蒿素在体内的主要活性代谢物和有效成分,具有高效、低毒、代谢迅速等特点[4-5]。临床主要应用于疟疾,国内外研究已证实青蒿素及其衍生物明确的抗炎作用可应用于接触性皮炎[6]、类风湿性关节炎[7]、系统性红斑狼疮及狼疮性肾炎[8-10]等疾病的治疗。但是有关双氢青蒿素在中枢神经系统内抗炎尤其是针对小胶质细胞的抗炎作用方面的研究较少。本研究拟通过脂多糖(lipopolysacc-haride,LPS)诱导BV-2小胶质细胞活化建立小胶质细胞炎性模型,观察双氢青蒿素对小胶质细胞炎性反应是否具有抑制作用,探讨其作用机制。
1 材料与方法 1.1 主要试剂与材料 1.1.1 主要试剂小胶质细胞株(BV-2)由第三军医大学脑科学研究中心惠赠,双氢青蒿素(纯度98%)(成都西亚试剂有限公司),LPS(美国Abcam公司),DMEM/F12培养基(美国HyClone公司),10%胎牛血清(美国Gibco公司),0.25%胰酶(HyClone公司),DMSO(Sigma公司),ELISA检测试剂盒(杭州联科生物公司),核蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),CCK-8试剂盒(贝博生物科技公司),兔抗小鼠TLR4、IκBα、NF-κB/p65、Lamin B、β-actin(CST),HRP标记羊抗兔二抗(Santa Cruz),TRIzol RNA提取试剂盒、反转录试剂盒(TaKaRa公司)。
1.1.2 主要仪器多功能酶标仪(Thermo Fisher,美国),Western blot设备(Bio-Rad,美国),冷冻离心机(Eppendorf,德国),激光共聚焦显微镜(Carl Zeiss,德国),CO2细胞孵箱(Thermo Fisher,美国)。
1.2 细胞培养BV-2小胶质细胞采用10%胎牛血清DMEM/F12培养基(104 IU/L青霉素,100 mg/L链霉素)培养,置于37 ℃、5% CO2饱和湿度恒温培养箱,细胞呈单层贴壁生长,进行常规培养和传代。隔天换液传代,定期观察细胞形态学变化。取对数生长期,细胞状态良好的细胞,接种于培养瓶中。
1.3 CCK-8检测细胞活性取对数期的BV-2细胞按3 000/孔接种至96孔板中。细胞贴壁10 h后将培养基更换为无血清DMEM/F12细胞处理24 h后转为含10%胎牛血清的DMEM/F12。设空白对照组、DMSO(浓度 < 0.1%)组、DHA(0.5、1、2、4 μmol/L)组。每组3个复孔,干预24 h。干预结束后,各孔分别加入10 μL CCK-8溶液,37 ℃孵育2 h后,使用多功能酶标仪在450 nm波长读取光密度值[D(450)]。
1.4 细胞形态学观察将BV-2细胞接种于24孔培养板(1×104/孔),设空白对照组(正常培养组)、LPS(1 μg/mL,培养6 h)组、DHA+LPS组(LPS刺激前30 min加入1 μmol/L DHA预处理)。每组设3个平行孔。各组经过相应处理后,在倒置相差显微镜下观察细胞形态学变化并拍照。
1.5 ELISA检测炎症因子表达水平将细胞以3×104/孔接种于48孔板,按照1.4中分组处理细胞,到达指定时间后,收集细胞上清液,采用ELISA检测细胞上清液中IL-1β、IL-6、TNF-α的水平,严格按ELISA试剂盒说明书进行操作。
1.6 RT-PCR检测促炎性细胞因子基因的表达按TRIzol说明书提取细胞总RNA,定量后按试剂盒操作逆转录进行cDNA合成,将cDNA用于进一步常规PCR扩增。扩增条件:94 ℃预变性1 min,94 ℃ 30 s,58 ℃ 30 s,71 ℃ 40 s,共30个循环,最后72 ℃延伸5 min。引物序列见表 1。
| 基因名称 | 引物序列(5′→3′) | 长度(bp) |
| iNOS | 上游 CTGCAGCACTTGGATCAG GAACCTG | 311 |
| 下游 GGGAGTAGCCTG TGTGCACCTGGAA | ||
| IL-lβ | 上游 GCCCATCCTCTGTGACTCAT | 230 |
| 下游 AGGCCACAGGTATTTTGTCG | ||
| IL-6 | 上游 CCACTTCACAAGTCGGAGGCTT | 396 |
| 下游 CCAGCTTATCTGTTAGGAGAG | ||
| TNF-α | 上游 CGTCAGCCGATTTGCTATCT | 206 |
| 下游 CGGACTCCGCAAAGTCTAAG | ||
| GAPDH | 上游 TGATGACATCAAGAAGGTGGTGAAG | 240 |
| 下游 TCCTTGGAGGCCATGTAGGCCAT |
1.7 Western blot检测NF-κB、IκBα及TLR4蛋白表达
造模及药物孵育结束后收集各组细胞,PBS洗2次,加细胞裂解液置于冰上裂解30 min,离心,收集上清。取上清以BCA法进行蛋白定量,调节每份样品蛋白浓度,在上样缓冲液加入等量蛋白,煮沸,在SDS聚丙烯酰胺凝胶中进行电泳,电转至PVDF膜,3% BSA室温封闭3 h,分别加一抗于4 ℃孵育过夜,TBS-Tween洗膜后加HRP标记的二抗室温孵育2 h,ECL试剂显色,化学发光仪显影。置于Bio-Rad成像仪中分析,采用Image Lab软件进行灰度值分析。实验重复3次。
1.8 统计学方法应用SPSS 20.0统计软件,计量资料以x±s表示,多组均数比较用单因素方差分析,检验水准:α=0.05。
2 结果 2.1 CCK-8检测BV-2细胞活性的影响与空白对照组比较,DMSO(终浓度 < 0.1%)及0.5、1 μmol/L DHA对小胶质细胞活性无明显影响(P > 0.05),2、4 μmol/L DHA对BV-2细胞活性有明显抑制作用(P < 0.01,图 1A)。选择1 μmol/L DHA提前干预细胞,与空白对照组相比,LPS组及DHA组对细胞活性均无明显影响(P > 0.05,图 1B)。
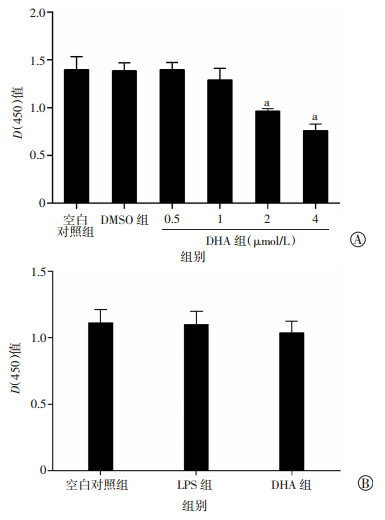
|
| A:不同浓度DHA对BV-2细胞活性的影响a:P < 0.01,与空白对照组比较;B:LPS和DHA对BV-2细胞活性的影响 图 1 CCK-8检测LPS与DHA对BV-2细胞活性的影响 |
2.2 BV-2小胶质细胞的形态学观察
倒置相差显微镜下,空白对照组细胞呈静状态,胞体细长,胞体两侧伸出细长突起呈分枝状(图 2A);LPS组细胞大数呈激活后的阿米巴样,胞体变大变圆,聚集成团,表面突起粗、变短(图 2B);DHA(1 μmol/L)预处理后的细胞状态有一定改善(图 2C)。
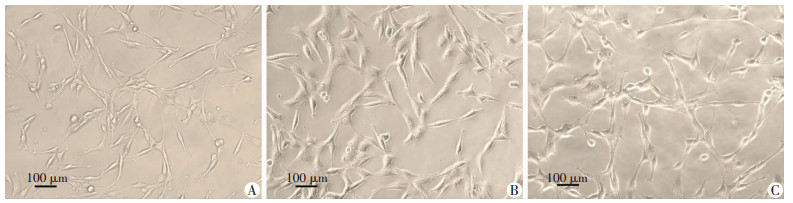
|
| A:空白对照组;B:LPS组(1 μg/mL);C:DHA+LPS组 图 2 倒置相差显微镜下观察各组BV-2小胶质细胞的形态变化 |
2.3 DHA对LPS激活的BV-2小胶质细胞内iNOS、IL-lβ、IL-6、TNF-α mRNA表达的影响
与空白对照组相比,BV-2细胞经LPS处理后iNOS、IL-lβ、IL-6、TNF-α mRNA的表达水平显著升高(P < 0.01);与LPS组相比,DHA(1 μmol/L)预处理后可显著降低iNOS、IL-lβ、IL-6、TNF-α mRNA的表达水平(P < 0.01,图 3)。
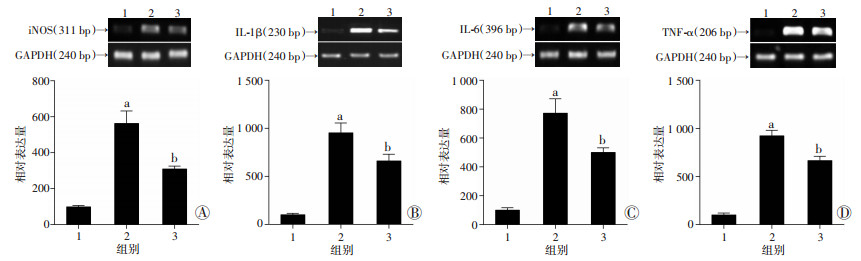
|
| 1:空白对照组;2:LPS组;3:DHA+LPS组a:P < 0.01, 与空白对照组比较;b:P < 0.01,与LPS组比较 图 3 RT-PCR检测各组细胞中iNOS(A)、IL-1β(B)、IL-6(C)和TNF-α(D) mRNA的表达 |
2.4 ELISA检测DHA对LPS诱导BV-2细胞炎症因子分泌的影响
与空白对照组相比,LPS组细胞的IL-1β、IL-6、TNF-α含量明显升高(P < 0.01)。给予DHA预处理后,炎症因子IL-6、IL-1β和TNF-α的水平明显下降(P < 0.01,图 4)。
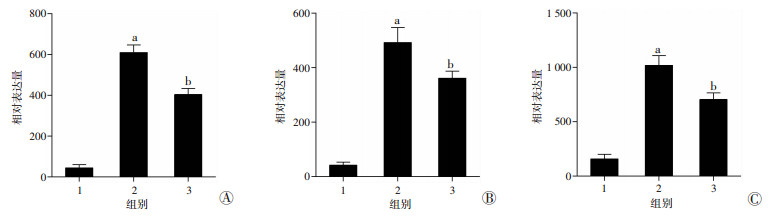
|
| 1:空白对照组;2:LPS组;3:DHA+LPS组a:P < 0.01, 与空白对照组比较;b: P < 0.01, 与LPS组比较 图 4 ELISA检测各组BV-2细胞中IL-1β(A)、IL-6(B)和TNF-α(C)释放 |
2.5 DHA对LPS激活的BV-2小胶质细胞内TLR4、IκBα、NF-κB蛋白表达的影响
与空白对照组比较,LPS组的TLR4蛋白表达量明显上调(P < 0.01);与LPS组比较,DHA+LPS组TLR4蛋白表达量下降(P < 0.01,图 5A)。与空白对照组相比,LPS组细胞核内的NF-κB p65表达量明显增加,细胞质内的减少(图 5B);DHA预处理后细胞核内的p65明显下降,胞质内则增加(图 5C)。与空白对照组比较,LPS组细胞质中IκBα和p65均明显减少(P < 0.01),而用DHA预处理后,细胞质内IκBα和p65的表达则明显增多(P < 0.01,图 5C)。

|
| 1:空白对照组;2:LPS组;3:DHA+LPS组a:P < 0.01, 与空白对照组比较;b: P < 0.01, 与LPS组比较A:细胞质内TLR4蛋白相对表达量;B:细胞核内p65相对表达量;C:细胞质内p65和IκBα相对表达量 图 5 Western blot检测各组TLR4、IκBα、NF-κB p65的表达 |
3 讨论
小胶质细胞激活导致的神经炎症是AD发生的重要因素及始动环节[11-13]。因此,干预小胶质细胞的激活或阻止其释放细胞毒性代谢物,可能对预防AD及延缓疾病的进程具有重要意义。
DHA为脂溶性药物,易通过血脑屏障[14]。除了抗疟作用外,还具有免疫调节及抗炎作用[15],诱导多种细胞自噬[16],抑制肿瘤血管生长[17]及增敏某些化疗药物。研究证明,DHA可以显著抑制促炎细胞因子IL-1β、IL-6和TNF-α的产生[17-18]。近年来其抗炎作用备受关注,但目前尚未充分阐明其作用机制。
在离体研究中常用LPS刺激诱导神经胶质细胞活化模拟神经系统炎症[19],因此本研究中用此模型来探索DHA对LPS诱导的小胶质细胞活化的作用。在本实验中,我们观察到静息状态下BV-2小胶质经LPS刺激后形态迅速发生变化,胞突回缩,胞体增大,呈球样或阿米巴样。而提前30 min DHA预处理后可抑制小胶质细胞向阿米巴样转变。因此推断DHA可能抑制了LPS诱导的BV-2细胞活化。进一步检测细胞中炎性因子的mRNA表达和细胞外炎症因子的分泌,RT-PCR结果提示DHA可以减少LPS刺激下IL-1β、IL-6和TNF-α mRNA的表达;采用ELISA检测细胞上清液中炎症因子,结果提示LPS可致细胞释放上述炎症因子水平明显增加,而DHA预处理后则可减少促炎因子的产生。TLR4受体主要介导LPS炎症信号向胞内传导,在AD的发生、发展中起着重要的作用[20]。NF-κB是LPS所介导TLR4信号通路中最重要的下游通路[21-22],当TLR4与相应配体结合,激活NF-κB,从而诱发各种炎性细胞因子基因表达。IκB是NF-κB的抑制蛋白,调节NF-κB的亚细胞定位。在细胞正常状态下,NF-κB二聚体通过非共价键形式与IκB家族成员结合,以无活性的三聚体形式存在于细胞质中。当细胞受到LPS等促炎因子刺激后,激活IκB激酶复合体(IκB kinase,IKK)将IκBα泛素化、磷酸化后并降解,释放出游离的NF-κB二聚体得以从失活状态活化,并转位入核,与特异性κB序列结合,启动炎性细胞因子转录,从而发挥相应的生理、病理作用[23-24]。本研究发现,DHA可抑制TLR4的表达,并抑制LPS所致的NF-κB p65向核内转位,同时也抑制了LPS导致的细胞质中IκBα的减少。由此可以推测,DHA可能通过抑制TLR4的表达,继而减少了胞质中的IκBα降解,从而减少了NF-κB游离入核,最终减少了炎性因子的转录和表达,由此发挥抗炎作用。
尽管DHA的抗炎作用已有部分研究陆续报道[25-27],但其在神经炎症反应的研究还尚少见报道。本研究发现DHA对LPS诱导的BV2细胞炎性反应有抑制作用,并初步探索了其机制,可能是通过调节TLR4/NF-κB通路实现。
综上所述,本实验从抑制神经炎症角度探讨DHA的神经保护作用,DHA可能通过TLR4/NF-κB通路对小胶质细胞激活进行调控,阐明了该化合物的抗炎作用机制,可能为AD等神经退行性疾病治疗提供一种新的思路,也为DHA临床应用拓展新的方向。
| [1] |
张婷, 曾庆桦, 刘滢, 等. 胰淀素在痴呆小鼠和正常小鼠脑内的分布和表达变化[J].
第三军医大学学报, 2016, 38(3): 258–263.
ZHANG T, ZENG Q H, LIU Y, et al. Distribution and expression of amylin in brain of Alzheimer's disease and normal mice[J]. J Third Mil Med Univ, 2016, 38(3): 258–263. DOI:10.16016/j.1000-5404.201506040 |
| [2] | FU W, PATEL A, JHAMANDAS J H. Amylin receptor: a common pathophysiological target in Alzheimer's disease and diabetes mellitus[J]. Front Aging Neurosci, 2013, 5: 42. DOI:10.3389/fnagi.2013.00042 |
| [3] | WANG Y, HUANG Z, WANG L, et al. The anti-malarial artemisinin inhibits pro-inflammatory cytokines via the NF-κB canonical signaling pathway in PMA-induced THP-1 monocytes[J]. Int J Mol Med, 2011, 27(2): 233–241. DOI:10.3892/ijmm.2010.580 |
| [4] | JIANG L B, MENG D H, LEE S M, et al. Dihydroartemisinin inhibits catabolism in rat chondrocytes by activating autophagy via inhibition of the NF-κB pathway[J]. Sci Rep, 2016, 6: 38979. DOI:10.1038/srep38979 |
| [5] |
尹怡, 曹鎏, 李飞, 等. 双氢青蒿素促进胶质瘤GL261细胞的凋亡[J].
第三军医大学学报, 2013, 35(12): 1179–1182.
YIN Y, CAO L, LI F, et al. Dihydroartemisinin induces apoptosis in GL261 glioma cells[J]. J Third Mil Med Univ, 2013, 35(12): 1179–1182. DOI:10.16016/j.1000-5404.2013.12.002 |
| [6] | HOU J, WANG D, ZHANG R, et al. Experimental therapy of hepatoma with artemisinin and its derivatives: in vitro and in vivo activity, chemosensitization, and mechanisms of action[J]. Clin Cancer Res, 2008, 14(17): 5519–5530. DOI:10.1158/1078-0432.CCR-08-0197 |
| [7] | D'ANGELO J G, BORDÓN C, POSNER G H, et al. Artemisinin derivatives inhibit toxoplasma gondii in vitro at multiple steps in the lytic cycle[J]. J Antimicrob Chemother, 2009, 63(1): 146–150. DOI:10.1093/jac/dkn451 |
| [8] | SHI C, LI H, YANG Y, et al. Anti-inflammatory and immunoregulatory functions of artemisinin and its derivatives[J]. Mediators Inflamm, 2015, 2015: 435713. DOI:10.1155/2015/435713 |
| [9] | YANG C, NIU S, YU L, et al. The aqueous extract of angelica sinensis, a popular Chinese herb, inhibits wear debris-induced inflammatory osteolysis in mice[J]. J Surg Res, 2012, 176(2): 476–483. DOI:10.1016/j.jss.2011.08.011 |
| [10] | HOU L F, HE S J, LI X, et al. SM934 treated lupus-prone NZB × NZW F1 mice by enhancing macrophage interleukin-10 production and suppressing pathogenic T cell development[J]. PLoS ONE, 2012, 7(2): e32424. DOI:10.1371/journal.pone.0032424 |
| [11] | HENEKA M T. Inflammasome activation and innate immunity in Alzheimer's disease[J]. Brain Pathol, 2017, 27(2): 220–222. DOI:10.1111/bpa.12483 |
| [12] |
薛鑫, 陈星星, 王冠, 等. 甲酰基肽受体1对BV-2细胞迁移的影响及机制的体外研究[J].
第三军医大学学报, 2016, 38(1): 44–49.
XUE X, CHEN X X, WANG G, et al. Formyl peptide receptor 1 promotes migration in mouse microglial cell line BV-2[J]. J Third Mil Med Univ, 2016, 38(1): 44–49. DOI:10.16016/j.1000-5404.201504153 |
| [13] | PERRY V H, TEELING J. Microglia and macrophages of the central nervous system: the contribution of microglia priming and systemic inflammation to chronic neurodegeneration[J]. Semin Immunopathol, 2013, 35(5): 601–612. DOI:10.1007/s00281-013-0382-8 |
| [14] | DOU C, DING N, XING J, et al. Dihydroartemisinin attenuates lipopolysaccharide-induced osteoclastogenesis and bone loss via the mitochondria-dependent apoptosis pathway[J]. Cell Death Dis, 2016, 7: e2162. DOI:10.1038/cddis.2016.69 |
| [15] |
喻婉莹, 阚伟娟, 于鹏霞, 等. 青蒿素和二氢青蒿素的抗炎作用及机制[J].
中国中药杂志, 2012, 37(17): 2618–2621.
YU W Y, KAN W J, YU P X, et al. Anti-inflammatory effect and mechanism of artemisinin and dihydroartemisinin[J]. China J Chin Materia Medica, 2012, 37(17): 2618–2621. |
| [16] | HU W, CHEN S S, ZHANG J L, et al. Dihydroartemisinin induces autophagy by suppressing NF-κB activation[J]. Cancer Lett, 2014, 343(2): 239–248. DOI:10.1016/j.canlet.2013.09.035 |
| [17] | DONG F, ZHOU X, LI C, et al. Dihydroartemisinin targets VEGFR2 via the NF-κB pathway in endothelial cells to inhibit angiogenesis[J]. Cancer Biol Ther, 2014, 15(11): 1479–1488. DOI:10.4161/15384047.2014.955728 |
| [18] | ZHAO C, GAO W, CHEN T. Synergistic induction of apoptosis in A549 cells by dihydroartemisinin and gemcitabine[J]. Apoptosis, 2014, 19(4): 668–681. DOI:10.1007/s10495-013-0953-0 |
| [19] |
陈亚星, 袁继超, 刘伟, 等. 莱菔硫烷抑制LPS诱导的小鼠星形胶质细胞增殖[J].
第三军医大学学报, 2017, 39(5): 407–412.
CHEN Y X, YUAN J C, LIU W, et al. Sulforaphane inhibits astrocyte proliferation by induced LPS in mice[J]. J Third Mil Med Univ, 2017, 39(5): 407–412. DOI:10.16016/j.1000-5404.201609133 |
| [20] | BADSHAH H, ALI T, KIM M O. Osmotin attenuates LPS-induced neuroinflammation and memory impairments via the TLR4/NFκB signaling pathway[J]. Sci Rep, 2016, 6: 24493. DOI:10.1038/srep24493 |
| [21] | DOU W, ZHANG J, SUN A, et al. Protective effect of naringenin against experimental colitis via suppression of Toll-like receptor 4/NF-κB signalling[J]. Br J Nutr, 2013, 110(4): 599–608. DOI:10.1017/S0007114512005594 |
| [22] | ZHANG Y, LU Y, MA L, et al. Activation of vascular endothelial growth factor receptor-3 in macrophages restrains TLR4-NF-κB signaling and protects against endotoxin shock[J]. Immunity, 2014, 40(4): 501–514. DOI:10.1016/j.immuni.2014.01.013 |
| [23] | JACOBS M D, HARRISON S C. Structure of an Ikappa B alpha/NF-kappa B complex[J]. Cell, 1998, 95(6): 749–758. DOI:10.1016/s0092-8674(00)81698-0 |
| [24] | YAZDI S, DURDAGI S, NAUMANN M, et al. Structural modeling of the N-terminal signal-receiving domain of IκBα[J]. Front Mol Biosci, 2015, 2: 32. DOI:10.3389/fmolb.2015.00032 |
| [25] | LI W D, DONG Y J, TU Y Y, et al. Dihydroarteannuin ameliorates lupus symptom of BXSB mice by inhibiting production of TNF-alpha and blocking the signaling pathway NF-kappa B translocation[J]. Int Immunopharmacol, 2006, 6(8): 1243–1250. DOI:10.1016/j.intimp.2006.03.004 |
| [26] | YANG D, YUAN W, LV C, et al. Dihydroartemisininsu-presses inflammation and fibrosis in bleomycine-induced pulmonary fibrosis in rats[J]. Int J Clin Exp Pathol, 2015, 8(2): 1270–1281. |
| [27] | ZHANG Z, GUO M, ZHAO S, et al. ROS-JNK1/2-dependent activation of autophagy is required for the induction of anti-inflammatory effect of dihydroartemisinin in liver fibrosis[J]. Free Radic Biol Med, 2016, 101: 272–283. DOI:10.1016/j.freeradbiomed.2016.10.498 |



