金黄色葡萄球菌可引起化脓性感染、食物中毒、烫伤样综合征、毒性休克综合征等感染性疾病,是人类重要的病原菌之一。毒力因子的产生是金黄色葡萄球菌致病的重要基础[1]。金黄色葡萄球菌可产生PV杀白细胞素、毒性休克综合征毒素、肠毒素、血浆凝固酶等数十种毒力因子参与致病。随着研究的不断深入,新的金黄色葡萄球菌毒力因子不断被发现。酚溶调控蛋白(phenol-soluble modulin, PSM)就是新近发现的金黄色葡萄球菌至关重要的毒力因子。PSM为金黄色葡萄球菌等致病性葡萄球菌分泌的一种两亲性小肽[2],具有α螺旋结构及穿孔毒素样特性,对人及动物的白细胞(尤其是中性粒细胞)有着极强的裂解能力,破坏宿主免疫系统,在金黄色葡萄球菌的免疫逃逸中发挥着重要作用;同时也能裂解红细胞,与金黄色葡萄球菌的溶血能力密切相关。PSM能刺激机体产生多种炎症介质,如TNF-α、IL-1、IL-6、IL-8等,诱导炎症反应的发生,导致组织坏死,皮肤溃烂,引起严重的组织病理损伤;PSM还能促进金黄色葡萄球菌生物膜的形成与扩展,与金黄色葡萄球菌感染的播散关系密切[3-4]。
近年研究还发现,PSMs小肽还可调控多种靶基因的表达。BERUB等[5]报道PSMα的缺失可导致hla基因转录延迟及感染早期α-毒素水平的低下,提示PSMα能调控α-毒素的生成。为研究PSMα的缺失是否会影响除α-毒素外其他蛋白的表达,我们利用同源重组技术构建了Newman psmα缺失突变株,并对Newman野生株及psmα缺失突变株培养上清的蛋白表达谱进行了比较分析。
1 材料与方法 1.1 实验材料金黄色葡萄球菌RN4220为限制性内切酶缺陷菌株,可接受并修饰来自大肠埃希菌的穿梭质粒,由中国科学技术大学孙宝林教授惠赠。质粒pBT2为温度敏感型穿梭质粒,具有氨苄和氯霉素抗性。金黄色葡萄球菌Newman购自中国菌种保藏中心。
1.2 主要试剂和实验仪器氯霉素(chloramphenicol,Chl)和氨苄(ampicillin,Amp)、溶葡萄球菌素购自上海生工生物工程技术服务有限公司,PrimeSTAR高保真聚合酶、限制性内切酶、DNA连接酶购自TaKaRa公司,琼脂糖凝胶回收试剂盒、质粒抽提试剂盒购自Promega公司,胰蛋白胨大豆肉汤培养基(Tryptone soya broth,TSB)、胰蛋白胨、酵母提取物等购自英国Oxiod公司。
1.3 实验方法 1.3.1 引物设计根据GenBank中金黄色葡萄球菌Newman基因组序列,利用Primer Premier 5.0软件设计psmα基因上下游片段引物(引物PL1和PL2用于扩增psmα上游DNA片段,片段长799 bp;PR1和PR2用于扩增下游片段,片段长度约957 bp)。为克隆需要,分别在PL1、PL2、PR1及PR2引物序列中引入HindⅢ、SalⅠ、SalⅠ、EcoRⅠ 4个不同的酶切位点。并依据psmα基因上下游片段的外侧序列设计引物LU和RD,用于psmα缺失突变株的鉴定。根据Newman基因组中gyrB、psmα和atlA基因序列设计实时荧光定量PCR引物,所设计的引物均交由重庆百诺合一生物科技有限公司合成(各引物具体序列详见表 1)。
| 引物 | 序列 | 酶切位点 |
| PL1 | 5′-CCCAAGCTTTAAATATCGCATTGAAAACT-3′ | Hind Ⅲ |
| PL2 | 5′-ACGCGTCGACTAAGATTACCTCCTTTG-3′ | Sal Ⅰ |
| PR1 | 5′-AGCGTCGACTTTAAGCGAATTGAATACTT-3′ | Sal Ⅰ |
| PR2 | 5′-CCGGAATTCTAGCATGTTTATTATCTCAAG-3′ | EcoR Ⅰ |
| psmα-F | 5′-ATGGGTATCATCGCTGGCATCATTA-3′ | |
| psmα-R | 5′-TTATTTTGCGAAAATGTCGATAATTGCTT-3′ | |
| LU | 5′-CGAGTCAGCAGGATGGATCAAAGAAC-3′ | |
| RD | 5′-TCCAACGAATGCAAGCCAACCA-3′ | |
| gyrB RT-F | 5′-CAAATGATCACAGCATTTGGTACAG-3′ | |
| gyrB RT-R | 5′-CGGCATCAGTCATAATGACGAT-3 | |
| psmα RT-F | 5′-TATCAAAAGCTTAATCGAACAATTC-3′ | |
| psmα RT-R | 5′-CCCCTTCAAATAAGATGTTCATATC-3′ | |
| atlA RT-F | 5′-AACAGCACCAACGGATTAC-3′ | |
| atlA RT-R | 5′-CATAGTCAGCATAGTTATTCATTG-3′ |
1.3.2 △psmα/Newman敲除株的构建
分别扩增psmα上游片段及下游片段,经限制性内切酶酶切后克隆入质粒pBT2,构建基因敲除载体(pBT2∷psmα)。然后电穿孔转化金黄色葡萄球菌RN4220(限制系统缺陷型金黄色葡萄球菌),涂布于氯霉素平板进行筛选。抽提经过RN4220修饰后的阳性菌株质粒,电转化Newman感受态,置30 ℃孵箱培养。过夜培养经酶切鉴定的阳性Newman菌株,次日以1 :100比例接种于TSB氯霉素抗性培养基中,42 ℃再次培养过夜,过夜菌划平板于42 ℃孵箱培养。挑单菌落纯培养后提基因组,PCR扩增筛选含有整合质粒的单交换突变株克隆后,于25 ℃无抗TSB液体培养基连续诱导3轮,划平板于37 ℃孵箱培养。挑单菌落分别接种无抗TSB和氯霉素抗性TSB平板,37 ℃培养,挑取在无抗培养基上生长而在氯霉素抗性TSB平板上不生长的菌落于无抗TSB中培养后提基因组,以多对引物扩增筛选双交换突变菌株。
1.3.3 野生株和突变株上清蛋白SDS-PAGE分析分别挑取Newman野生株、△psmα/Newman突变株单菌落,接种于5 mL TSB液体培养基中,37 ℃振荡培养过夜。次日将过夜菌按1 :100比例转种5 mL新鲜TSB液体培养基,37 ℃振摇培养,间隔3 h取菌液用TCA-丙酮蛋白浓缩法浓缩沉淀上清蛋白。蛋白样品加入上样buffer,5 min煮沸处理后,进行SDS-PAGE分析。
1.3.4 实时荧光定量PCR分别挑取Newman野生株、△psmα/Newman突变株单菌落,接种于5 mL TSB液体培养基中,37 ℃振荡培养过夜。次日将过夜菌按1 :100比例转种5 mL新鲜TSB液体培养基,37 ℃振摇培养,间隔3 h取1 mL菌液进行细菌总RNA抽提:将菌液离心集菌后,重悬于100 μL TE缓冲液(含3 mg/mL溶菌酶和10 μL 1 mg/mL溶葡萄球菌素),37 ℃作用0.5 h破坏细菌细胞壁,而后用1 mL Tripure试剂(Roche公司)进行细菌总RNA抽提(参照试剂说明书进行),并以DNaseⅠ(Promega公司)处理去除RNA中细菌基因组污染。而后取细菌总RNA取500 ng,用primescript RT Reagent Kit(Takara公司)分别进行cDNA逆转录(参照试剂盒说明书进行)。cDNA样本经100倍稀释后取2 μL作为模板,用SYBR Premix ExTaqTM Ⅱ (Tli RNaseH plus)试剂(TaKaRa公司)对Newman野生株及△psmα/Newman突变株的psmα、atlA基因转录水平进行定量RT-PCR分析比对(psmα及atlA RT-PCR分析所用引物设计详见表一)。RT-PCR反应条件:95 ℃ 30 s;95 ℃ 8 s,52 ℃ 30 s,72 ℃ 20 s,40个循环.
1.3.5 菌株自溶曲线测定过夜培养Newman野生株及△psmα/Newman缺失突变株,次日按1 :100转种新鲜TSB液体培养基,振摇培养至D(600)≈1.0,离心集菌并用含0.1% Triton X-100的PBS重悬,而后在30 ℃条件下继续培养,间隔半小时测定一次培养液D(600)值,计算D(600)值的下降百分比,绘制自溶曲线。
1.4 统计学分析相对表达量和用D(600)值表示的细菌自溶水平用x±s表示,数据符合正态分布,使用SPSS 18.0软件对数据进行两组独立样本t检验,检验水准α=0.01。
2 结果 2.1 △psmα/Newman突变株的筛选与鉴定以金黄色葡萄球菌Newman基因组为模板,分别扩增psmα基因簇上下游片段,克隆入PBT2质粒构建敲除质粒pBT2∷Δpsmα。将pBT2∷Δpsmα质粒先后电转RN4220及Newman感受态。利用质粒温度敏感性特征进行敲除突变株的筛选,并对获得的阳性重组菌株进行PCR鉴定(引物设计及PCR结果如图 1所示)。突变株采用psmα-F+psmα-R、psmα-R+LU、psmα-F+RD引物对扩增均未能扩增出相应目标片片段(图 1泳道2、4、6);采用LU+RD引物对扩增所得PCR产物长2 186 bp(图 1泳道8),较Newman野生株相应扩增产物(2 595 bp,图 1泳道9)短409 bp(psmα基因簇长度),提示psmα基因簇已从Newman基因组中成功敲除。将突变株LU+RD引物对PCR扩增产物送测序,测序结果也证实△psmα/Newman突变株成功构建。
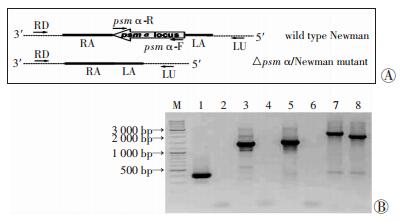
|
| A:△psmα/Newman缺失突变株鉴定PCR引物设计示意图; B:PCR鉴定M:DNA标准;1、3、5、7:Newman野生株;2、4、6、8:△psmα/Newman突变株 图 1 △psmα/Newman缺失突变株的PCR鉴定 |
2.2 △psmα/Newman缺失突变株转录水平分析
培养Newman野生株及psmα缺失突变株,于不同时间段收集菌液,离心集菌后提取细菌总RNA,逆转录生成cDNA,采用实时荧光定量RT-PCR技术对psmα基因的转录水平进行分析。结果表明psmα缺失突变株未检测到psmα cDNA存在(图 2),进一步证实psmα locus已被敲除,△psmα/Newman缺失突变株构建成功。
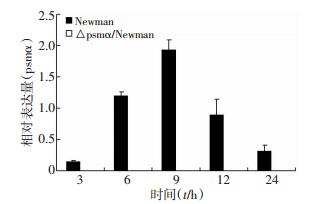
|
| 图 2 Newman野生株及psmα缺失突变株psmα基因转录水平分析 |
2.3 △psmα/Newman缺失突变株培养上清蛋白分析
过夜培养Newman野生株及psmα缺失突变株,次日按1 :100转种新鲜培养基,并于不同时间段回收菌液,离心收集培养上清,TCA法沉淀上清蛋白,而后经10% SDS-PAGE电泳,考马斯亮蓝染色。结果显示:与Newman野生株相比,psmα的缺失可导致一个相对分子质量约135 ×103的分泌蛋白表达水平明显降低(如图 3箭头所示)。继而将此蛋白切胶进行质谱分析,部分结果如表 1所示,依据综合评分高低及蛋白相对分子质量大小,推测该蛋白可能为atlA基因编码的双功能自溶素前体蛋白(即AtlA蛋白)。

|
| M:标准;Wt:Newman野生株;Mu:△psmα/Newman突变株 图 3 Newman野生株及psmα缺失突变株培养上清蛋白电泳分析 |
| 基因及蛋白描述 | 评分 | 氨基酸数 | 相对分子质量 |
| [gene=atl] [protein=bifunctional autolysin precursor] |
362.20 | 1256 | 137.3×103 |
| [gene=fnbA] [protein=fibronectin binding protein A precursor] |
122.57 | 741 | 81.4×103 |
| [gene=sdrE] [protein=Ser-Asp rich fibrinogen] |
74.16 | 1166 | 126.5×103 |
| [gene=map] [protein=MHC class II analog protein] |
44.91 | 584 | 65.5×103 |
| [gene=clfA] [protein=clumping factor A] |
42.54 | 933 | 97.0×103 |
| [gene=lip] [protein=lipase precursor] |
31.78 | 680 | 76.6×103 |
| [gene=NWMN_0777] [protein=conserved hypothetical protein] |
7.38 | 292 | 33.5×103 |
| [gene=rexA] [protein=exonuclease RexA] |
4.51 | 1217 | 141.2×103 |
| [gene=lysS] [protein=lysyl-tRNA synthetase, class-2] |
4.43 | 515 | 59.0×103 |
| [gene=htrA] [protein=serine protease HtrA] |
4.37 | 774 | 87.0×103 |
2.4 实时荧光定量PCR测定atlA转录水平
为进一步验证2.3中这一推定,分别提取培养不同时间段的Newman野生株及psmα缺失突变株的总RNA,逆转录成cDNA。采用定量RT-PCR方法分析比较二者的atlA基因转录水平。结果显示psmα缺失突变株各个时间段的atlA基因转录水平均较野生株有一定程度的降低(图 4),与SDS-PAGE电泳中观察到的AtlA蛋白表达水平的变化趋势一致。
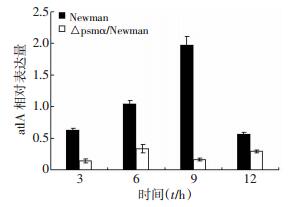
|
| 图 4 Newman野生株及psmα locus缺失突变株atlA基因转录水平分析 |
2.5 Newman野生株及psmα缺失突变株自溶能力比较
psmα缺失导致Newman菌株自溶素AtlA蛋白表达水平降低,细菌的自溶能力也必将减弱,因此,我们进行了细菌自溶实验。结果如图 5所示:△psmα/Newman缺失突变株的自溶能力较野生株有所降低,统计学处理表明Newman缺失突变株的自溶能力下降具有统计学意义(P < 0.01),证明PSMα小肽对atlA基因转录与表达具有正调控作用。

|
| 图 5 Newman野生株及psmα缺失突变株自溶曲线 |
3 讨论
PSMs小肽根据相对分子质量大小及肽链长短,PSM可分为α、β两大类。α类PSM主要与金黄色葡萄球菌的白细胞趋化活性、致炎活性及杀白细胞活性密切相关,其中以PSMα活性最为突出[6];而β类PSM则影响金黄色葡萄球菌生物膜的形成与金黄色葡萄球菌感染的播散[7-8]。关于PSM的研究主要集中在金黄色葡萄球菌的致炎活性、杀白细胞活性及溶血活性等毒素的研究上[1]。实验研究发现:PSM编码基因的缺失或特异性外排系统的阻断能明显减轻感染小鼠皮肤溃烂、组织坏死的病变程度,小鼠的存活率可提高60%~80%[6, 9]。
PSMs除本身具有极强的毒性作用外,最新的研究显示PSMs(尤其是α类PSMs)还拥有转录调控因子功能。BERUBE等[5]研究发现,在金黄色葡萄球菌生长早期,PSMα能促进α-毒素(Hla)的生成,PSMα的缺失可导致hla基因的转录延迟及感染早期α-毒素水平的低下,提示PSMα能调控α-毒素的生成。JOO等[10]也发现PSMα1、PSMα2及PSMα4可阻止PSMs特异性外排系统(Pmt系统)的抑制性调控蛋白(PmtR)与Pmt系统调控区DNA序列结合,阻断PmtR负调控功能的发挥,使Pmt外排系统启动,促进PSMs小肽的外排,防止其在菌体内簇集及自我损伤的发生。JOO等[10]报道将金黄色葡萄球菌MW2菌株的PSMs相关基因(psmα、psmβ及hld基因)敲除后,MW2菌株的基因转录会受到明显影响,已发现36个基因转录水平出现下调,2个基因上调。除此之外,位于Ⅱ型、Ⅲ型及Ⅷ型MRSA SCCmec耐药岛上的psm-mec基因除能编码具有毒力因子功效的PSM-mec小肽外,其转录产物还具有调节RNA的功能,可与金黄色葡萄球菌Agr系统的agrA mRNA直接结合,影响Agr系统功能,降低某些MRSA菌株PSMs小肽的生成[9, 11],上调金黄色葡萄球菌SPA蛋白的表达[12]。
为进一步探讨PSMα的基因调控功能,我们采用同源重组技术对金黄色葡萄球菌Newman菌株的psmα基因簇进行敲除,成功构建了一株psmα基因簇(包含psmα1、psmα2、psmα3、psmα4四个基因,分别编码PSMα1、PSMα2、PSMα3、PSMα4四个亚型的PSMα小肽)缺失的Newman突变株。通过对突变株的培养上清蛋白表达谱分析,发现psmα基因簇的缺失可导致金黄色葡萄球菌双功能自溶素前体蛋白(AtlA蛋白)的表达降低;实时荧光定量PCR结果也显示psmα基因敲除株atlA基因的转录水平较野生株明显减弱,说明PSMα小肽对金黄色葡萄球菌AtlA蛋白的表达具有调控作用。
金黄色葡萄球菌能产生多种自溶素,其中以atlA基因编码的AtlA蛋白最为重要。AtlA前体蛋白相对分子质量约为137.5×103,合成后经蛋白酶水解可产生相对分子质量为62×103的N-乙酰胞壁酰-L-丙氨酸酰氨酶(N-acetylmuramyl-L-alanine amidase, AM)及51×103的内-β-N-乙酰氨基葡糖苷酶(endo-β-N-acetylglucosaminidase, GL)。AM及GL具有酶学活性,均能通过作用于金黄色葡萄球菌细胞壁肽聚糖层,破坏肽聚糖内部连接及细胞壁结构,导致细菌细胞的裂解与自溶,故AtlA蛋白也称为双功能自溶素前体蛋白。其中,AM能降解肽聚糖聚糖支架N-乙酰胞壁酸组分与五肽交联桥L-丙氨酸之间的酰胺键,而GL则作用于聚糖支架N-乙酰胞壁酸与N-乙酰葡糖胺之间的β-(1, 4)-糖苷键[13]。AtlA蛋白具有多种生物学活性,除与细菌细胞的自溶、细胞壁肽聚糖的更新密切相关外,AtlA蛋白还密切参与金黄色葡萄球菌的致病过程。它能促进细菌胞浆蛋白的分泌与外排,影响β-内酰胺类(如青霉素)及糖苷类(如万古霉素)抗生素诱导的细菌裂解,并能促进金黄色葡萄球菌内化,与细菌的抗生素耐受及免疫逃逸密切相关。AtlA蛋白的粘附分子样功能有利于细菌与底物分子之间的初始粘附,促进生物膜形成,导致金黄色葡萄球菌感染慢性化及复发。因此,AtlA蛋白也被认为是金黄色葡萄球菌重要的毒力因子,并作为抗金黄色葡萄球菌感染的疫苗制备靶标受到人们关注[14]。
由于参与了细菌细胞壁肽聚糖的合成、更新及子代细胞的分离,AtlA蛋白在细菌生长繁殖的各个时期均有表达,但该蛋白的存在又可引起菌细胞的裂解及细菌的死亡,故而AtlA蛋白的表达受着严密的调控。以往研究就显示WalK/WalR(也称为YycG/YycF)、YycHI、SrrAB等二元调控系统参与了atlA基因的表达调控[15-16]。本研究也提示PSMα可调控atlA基因的表达,但PSMα调控atlA基因表达的机制至今尚未可知。而且,PSMs小肽作为转录调控因子的相关研究目前尚处于起步阶段,关于PSMs小肽调控的靶基因类型以及可能的调控机制迄今未被清楚揭示。不过,JOO等在研究中曾发现部分PSMs小肽(如PSMα1、PSMα2、PSMα4)具有与DNA结合的能力[11]。于是我们将atlA基因的调控区序列(Newman基因组1 024 637~ 1 024 963 bp)与JOO报道的能与PSMs小肽相结合的DNA片段进行比对,发现二者在碱基组成上具有较高相似性。因此,我们推测PSMα对atlA基因的表达调控极有可能是通过直接结合于atlA基因的调控区域来发挥作用的。当然,这样的推测还尚需要后续的实验研究予以验证。总之,本研究通过成功构建金黄色葡萄球菌Newman psmα基因缺失突变株,观察到敲除株产生的上清蛋白中AtlA蛋白表达降低,转录水平和自溶曲线也证实PSMα敲除株中AtlA的低表达。首次证明PSMα小肽对金黄色葡萄球菌AtlA蛋白的表达具有正调控作用,为进一步研究PSMα小肽对金黄色葡萄球菌AtlA蛋白的具体调控机制提供重要前提,为研究金黄色葡萄球菌致病机制以及抗金黄色葡萄球菌慢性感染策略奠定基础。
| [1] | OTTO M. Staphylococcus aureus toxins[J]. Curr Opin Microbiol, 2014, 17: 32–37. DOI:10.1016/j.mib.2013.11.004 |
| [2] | CHATTERJEE S S, CHEN L, JOO H S, et al. Distribution and Regulation of the Mobile Genetic Element-Encoded Phenol-Soluble Modulin PSM-mec in Methicillin-Resistant Staphylococcus aureus[J]. PLoS ONE, 2011, 6(12): e28781. DOI:10.1371/journal.pone.0028781 |
| [3] | LI S, HUANG H, RAO X, et al. Phenol-soluble modulins: novel virulence-associated peptides of staphylococci[J]. Future Microbiol, 2014, 9(2): 203–216. DOI:10.2217/fmb.13.153 |
| [4] | PESCHEL A, OTTO M. Phenol-soluble modulins and staphylococcal infection[J]. Nat Rev Microbiol, 2013, 11(10): 667–673. DOI:10.1038/nrmicro3110 |
| [5] | BERUBE B J, SAMPEDRO G R, OTTO M, et al. The psmα locus regulates production of Staphylococcus aureus alpha-toxin during infection[J]. Infect Immun, 2014, 82(8): 3350–3358. DOI:10.1128/IAI.00089-14 |
| [6] | WANG R, BRAUGHTON K R, KRETSCHMER D, et al. Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA[J]. Nat Med, 2007, 13(12): 1510–1514. DOI:10.1038/nm1656 |
| [7] | PERIASAMY S, JOO H S, DUONG A C, et al. How Staphylococcus aureus biofilms develop their characteristic structure[J]. Proc Natl Acad Sci USA, 2012, 109(4): 1281–1286. DOI:10.1073/pnas.1115006109 |
| [8] | OTTO M. Staphylococcal infections: mechanisms of biofilm maturation and detachment as critical determinants of pathogenicity[J]. Annu Rev Med, 2013, 64: 175–188. DOI:10.1146/annurev-med-042711-140023 |
| [9] | KAITO C, SAITO Y, IKUO M, et al. Mobile genetic element SCCmec-encoded psm-mec RNA suppresses translation of agrA and attenuates MRSA virulence[J]. PLoS Pathog, 2013, 9(4): e1003269. DOI:10.1371/journal.ppat.1003269 |
| [10] | JOO H S, CHATTERJEE S S, VILLARUZ A E, et al. Mechanism of gene regulation by a Staphylococcus aureus toxin[J]. Mbio, 2016, 7(5). DOI:10.1128/mBio.01579-16 |
| [11] | KAITO C, SAITO Y, NAGANO G, et al. Transcription and translation products of the cytolysin gene psm-mec on the mobile genetic element SCCmec regulate Staphylococcus aureus virulence[J]. PLoS Pathog, 2011, 7(2): e1001267. DOI:10.1371/journal.ppat.1001267 |
| [12] | CHEUNG G Y, VILLARUZ A E, JOO H S, et al. Genome-wide analysis of the regulatory function mediated by the small regulatory psm-mec RNA of methicillin-resistant Staphylococcus aureus[J]. Int J Med Microbiol, 2014, 304(5-6): 637–644. DOI:10.1016/j.ijmm.2014.04.008 |
| [13] | GÖTZ F, HEILMANN C, STEHLE T. Functional and structural analysis of the major amidase (Atl) in Staphylococcus[J]. Int J Med Microbiol, 2014, 304(2): 156–163. DOI:10.1016/j.ijmm.2013.11.006 |
| [14] | HAGHIGHAT S, SIADAT S D, SORKHABADI S M, et al. Cloning, expression and purification of autolysin from methicillin-resistant Staphylococcus aureus: potency and challenge study in Balb/c mice[J]. Mol Immunol, 2017, 82: 10–18. DOI:10.1016/j.molimm.2016.12.013 |
| [15] | DUBRAC S, BONECA I G, POUPEL O, et al. New Insights into the WalK/WalR (YycG/YycF) Essential Signal Transduction Pathway Reveal a Major Role in Controlling Cell Wall Metabolism and Biofilm Formation in Staphylococcus aureus[J]. Journal of Bacteriology, 2007, 189(22): 8257–8269. DOI:10.1128/jb.00645-07 |
| [16] | CAMERON D R, JIANG J H, KOSTOULIAS X, et al. Vancomycin susceptibility in methicillin-resistant Staphylococcus aureus is mediated by YycHI activation of the WalRK essential two-component regulatory system[J]. Scientific Reports, 2016, 6(1). DOI:10.1038/srep30823 |



