LIANG Houjie, E-mail:lianghoujie@sina.com
结肠癌是全球第三大常见的恶性肿瘤,其致死率居所有肿瘤前列[1-3],而转移是导致结肠癌不良预后及复发的重要原因[4],中晚期患者发生结肠癌腹腔转移对预后和生存质量的影响尤为突出[1, 5-7]。腹腔内的多种恶性肿瘤(包括结肠癌)通过多种传播方式转移到大网膜、肠系膜上[8],而脂肪细胞是这些系膜组织的重要成分,提示脂肪细胞可能为肿瘤的恶性进展提供营养支持。为了适应肿瘤细胞无节制的增殖,肿瘤细胞通过改变自身及周围环境的代谢来支持快速增殖所需的大量物质和能量需求[9]。因此,间质细胞的代谢重编程在肿瘤恶性进展的过程中也起着至关重要的作用[10]。谷氨酰胺合成酶(glutamine synthetase, GS)是一种依赖ATP的合成酶,其主要生化功能为催化氨和谷氨酸生成谷氨酰胺[11]。研究表明,GS过表达能促进肿瘤细胞在谷氨酰胺缺乏的条件下生存,并促进肿瘤细胞的恶性增殖[12]。然而,间质细胞中的GS对肿瘤的作用尚不明确。血管生成在肿瘤的生长和转移过程中具有重要作用[13]。血管生成涉及内皮细胞的增殖、迁移等一系列过程。因此,内皮细胞在血管生成中极其重要。本课题拟通过体内实验揭示脂肪细胞GS对结肠癌腹腔转移及血管生成的调控作用,而后在体外实验探索脂肪细胞GS对人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)的增殖、迁移及成管能力的影响。以丰富对GS的认识,对寻找防治结肠癌腹腔种植转移的潜在策略具有重要的指导意义。
1 材料与方法 1.1 主要材料结肠癌细胞系MC38及HUVECs(均由本实验室冻存),恒温恒湿CO2培养箱(美国Thermo Forma公司),高速冷冻离心机(日立公司),低速冷冻离心机(美国Beckman公司),Western blot制胶、电泳、转膜、GelDoc2000凝胶成像系统、显色曝光装置(Bio-rad),倒置显微镜、奥林巴斯显微镜、采图显微镜(OLYMPUS公司,日本),多功能酶标读数仪(美国Thermo Scientific公司),以上器材均由第三军医大中心实验室提供,0.8 μm Transwell小室、24孔细胞培养板、96孔细胞培养板(Corning公司,美国)。
主要试剂:DMEM高糖培养基(美国HyClone公司),胎牛血清(Fetal bovine serum,FBS,HyClone),0.25%胰蛋白酶(美国HyClone公司),DMSO(美国BIOSHARP公司),RIPA蛋白提取试剂盒、BCA蛋白浓度测定试剂盒等Western相关试剂均由上海碧云天生物工程公司提供,Matrigel基质胶(美国BD公司),GS抗体(Abcam公司,美国),Western blot山羊抗兔二抗(博士德生物技术有限公司),CCK8试剂(同仁),CD31(Abcam公司,美国), 免疫组化二抗试剂盒(含山羊封闭血清、辣根过氧化物酶、山羊抗兔二抗)、DAB显色液、EDTA均由北京中杉金桥生物有限公司提供。
1.2 实验方法 1.2.1 细胞培养将MC38结肠癌细胞和HUVECs分别复苏于常规培养瓶中,用完全培养基培养,放于5%CO2、37 ℃恒温恒湿培养箱培养。
1.2.2 构建TgGS小鼠模型脂肪细胞GS条件转基因小鼠(TgGS)由本课题组自行设计,并由广州赛业公司辅助完成构建。将小鼠基因Glul(ORF031394)的cDNA亚克隆到表达载体pRP(Exp),并由脂联素(脂肪特异表达基因)的启动子(5 411 bp)进行驱动。小鼠胚胎细胞的显微注射及阳性克隆筛选由赛业公司完成,TgGS小鼠的阳性鉴定引物正义链:5′-GACATGATGCAGGTCCTGATTGG-3′,反义链:5′-GGGTCTTGCAGC-GCAGTCCTT-3′,预期PCR产物248 bp。将TgGS杂合子小鼠进行杂交,获得了TgGS纯合子及野生型(WT)对照小鼠。应用Western blot检测小鼠全身多个组织及脏器的GS表达水平,筛选出转基因效果最好的品系进行后续实验。
1.2.3 构建腹腔转移小鼠模型TgGS小鼠及WT小鼠(第三军医大学实验动物中心)饲养于第三军医大学西南医院中心实验室,小鼠饲养在温度、条件合适的房间,充足的水源和食物,干净的笼子里。分别取5只6~8周(体质量18~22 g)雄性TgGS小鼠及WT小鼠,将200 μL含有2.0×106的MC38结肠癌细胞注射到两组小鼠腹腔内,第11天处死小鼠,观察小鼠腹腔内的肿瘤数量并测量肿瘤大小。体积计算公式:V=4/3πr3。取下肿瘤分别放入4%多聚甲醛溶液中固定,待免疫组化使用。
1.2.4 附睾脂肪的采集将6~8周(体质量18~22 g)雄性TgGS及WT小鼠处死,将小鼠的腹部剪开,沿腹股沟找出附睾脂肪(即附睾旁边的一块完整的脂肪垫),取出附睾脂肪垫进行后续实验。
1.2.5 Western blot检测分别取足量的TgGS及WT小鼠的附睾脂肪垫及其他脏器组织(心、肝、脾、肺、肾), 搅碎后,使用RIPA缓冲液提取蛋白后进行浓度测定。SDS-PAGE电泳分离蛋白,250 mA恒流转膜70 min,5%BSA溶液室温封闭1 h,加GS一抗(1%BSA 1:1 000稀释)4 ℃孵育过夜,PBST洗3次5 min,加二抗(1%BSA 1:500稀释)室温孵育1 h,PBST洗3次5 min,将ECL显影液均匀滴在膜上,暗室孵育1 min后,置于GelDoc2000凝胶成像系统上分析处理。
1.2.6 条件培养基的提取处死TgGS、WT小鼠后,剪开腹部,找出附睾脂肪垫,取出放入6孔板中(需要无菌操作,500 mg/孔),再用剪刀将脂肪分别剪碎,每孔加入3 mL 2.5%DMEM(DMEM+2.5%FBS),48 h后收取条件培养基,-20 ℃储存。
1.2.7 CCK8细胞增殖实验在96孔板中接种处于对数期的贴壁的HUVECs,共分为2组,每孔加入100 μL的完全培养基中含5 000个细胞,每组5个复孔,设置12、24、48 h共3个时间点。5%CO2、37 ℃敷箱中用完全培养基孵育24 h至完全贴壁后,吸出完全培养基,按分组分别加入:①5%DMEM(DMEM+5%FBS)+同体积的WT条件培养基,②5%DMEM+同体积的TgGS条件培养基;分别培养12、24、48 h, 每隔24 h换液。每孔加入100 μL CCK8试剂混合液(无血清DMEM 1.5 mL+150 μL CCK8试剂)继续培养1 h,终止培养,在酶标仪上悬着波长为450 nm处测定各孔光密度值[D(450)]。绘制曲线。实验重复3次。
1.2.8 HUVECs细胞的小管形成实验取-20 ℃Matrigel基质胶4 ℃解冻后按照60 μL每孔铺入96孔板中,置于5%CO2、37 ℃细胞培养箱中30 min使其凝固待用。将消化好的HUVECs分别用:①5%DMEM+同体积的WT条件培养基,②5%DMEM+同体积的TgGS条件培养基混悬,使其浓度为4×104/200 μL,按200 μL/孔加入铺Matrigel基质胶的96孔中,每组3孔,放入5%CO2、37 ℃敷箱中孵育,约2 h观察1次,小管形成良好时拍照(一般3~4 h小管形成良好),实验重复3次。
1.2.9 HUVECs的Transwell实验取24孔板,分别向Transwell下层孔板中加入:①5%DMEM+同体积的WT条件培养基。②5%DMEM+同体积的TgGS条件培养基各500 μL,各3个复孔,将HUVECs消化、离心后用无血清DMEM培养基稀释至3×104/150 μL,混悬后取150 μL/孔加入Transwell小室上层,放入5%CO2、37 ℃敷箱中孵育,待12 h后进行结晶紫染色。用棉签擦去小室内部的细胞后,在显微镜下观察小室底外部迁移出来的细胞,用刀片切下Transwell小室基底膜放于载玻片上用中性树胶及盖玻片封片后使用奥林巴斯显微镜采图并计数。实验重复3次。
1.2.10 免疫组化实验将固定好的TgGS小鼠及WT小鼠的腹腔转移瘤包蜡块及切片后按免疫组化步骤染色,一抗为CD31(1:300稀释),山羊抗兔的二抗,DAB显色10 s,之后封片拍照。使用微血管密度(MVD)计数血管密度,根据Weidner提出的方法低倍镜下(40×和100×)选取血管最多的区域为“热点”,在高倍镜下(200×)选取3个区域计数并计算平均值。
1.3 统计学分析计量数据以x±s表示,采用SPSS 18.0统计软件进行分析,组间比较采用方差分析和t检验。
2 结果 2.1 TgGS小鼠与WT小鼠附睾脂肪GS蛋白水平的表达分别检测TgGS小鼠及WT小鼠的附睾脂肪垫及其他脏器(心、肝、脾、肺、肾)的GS蛋白表达水平。Western blot检测结果表明,TgGS小鼠较之WT小鼠,其心、肝、脾、肺、肾GS蛋白表达水平无明显差异,而附睾脂肪垫中GS蛋白水平显著上调。见图 1。
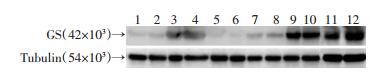
|
| 1:WT心;2:TgGS心;3:WT肝;4:TgGS肝;5:WT脾;6:TgGS脾;7:WT肺;8:TgGS肺;9:WT肾;10:TgGS肾;11:WT脂肪;12:TgGS脂肪 图 1 Western blot检测2种小鼠各组织GS蛋白的表达水平 |
2.2 脂肪细胞GS抑制结肠癌腹腔转移
为了观察脂肪细胞GS对结肠癌腹腔转移的影响,应用TgGS及WT小鼠,构建了结肠癌腹腔转移模型。在腹腔注射MC38细胞后第11天处死小鼠,观察及测量肿瘤的数目及大小。结果显示,同组的肿瘤结节大小较均一,成灰白色,质地较硬,表面光滑(图 2);TgGS小鼠较之WT小鼠肿瘤体积明显减小[(2.35±1.93)vs(9.37±5.07), P < 0.01];且TgGS小鼠较之WT小鼠肿瘤数目也明显减少[(6.33±4.04)vs(16±6.56), P < 0.05]。这些结果提示,脂肪细胞GS可抑制结肠癌腹腔转移。
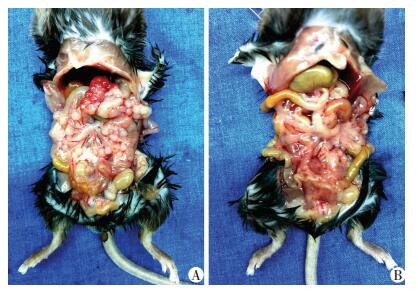
|
| A:WT小鼠;B:TgGS小鼠 图 2 2种小鼠腹腔接种结肠癌细胞后第11天腹腔肿瘤大体观察 |
2.3 脂肪细胞GS抑制结肠癌腹腔转移的血管生成
TgGS小鼠较之WT小鼠MVD明显减少[(4.00±1.00)vs(9.67±2.08),P < 0.05,图 3],提示脂肪细胞GS抑制结肠癌腹腔转移的血管生成。
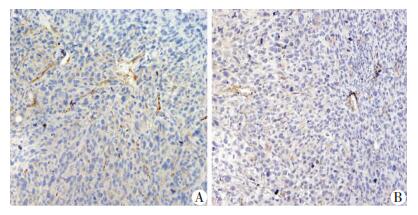
|
| A:WT小鼠;B:TgGS小鼠 图 3 免疫组化实验观察2种小鼠腹腔转移结肠癌的血管生成情况(S-P ×200) |
2.4 脂肪细胞GS对HUVECs细胞的增殖无明显影响
CCK8法检测TgGS小鼠及WT小鼠脂肪细胞条件培养基对HUVECs增殖的影响。结果显示,两种条件培养基对HUVECs增殖活力的影响无明显差异(P>0.05, 图 4),提示脂肪细胞GS对HUVECs的增殖无明显调节作用。
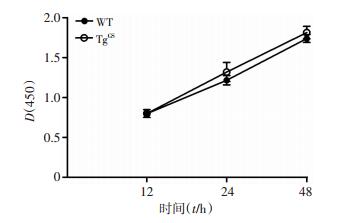
|
| 图 4 CCK8检测两组条件培养基对HUVECs增殖的影响(n=3, x±s) |
2.5 脂肪细胞GS抑制HUVECs细胞的体外成管能力
Matrigel小管形成实验观察TgGS小鼠及WT小鼠脂肪细胞条件培养基对HUVECs成管能力的影响(图 5),结果显示:条件培养基处理4 h即可见TgGS及WT组均有管腔形成,但TgGS小鼠较之WT小鼠小管形成的长度明显缩短(相对值)[(1.00±0.13)vs (1.81±0.31),P < 0.05], 提示脂肪细胞GS可抑制HUVECs细胞的小管形成。
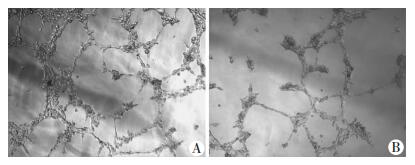
|
| A:WT小鼠;B:TgGS小鼠 图 5 Matrigel胶体外成管实验检测两组条件培养基对HUVECs的成管能力的影响(×100) |
2.6 脂肪细胞GS抑制HUVECs的迁移
Transwell实验观察HUVECs在TgGS小鼠及WT小鼠脂肪细胞条件培养基作用下的迁移能力(图 6),结果显示,TgGS小鼠较之WT小鼠HUVECs穿过小室的细胞数目明显减少[(15.33±5.50)vs(78.33±13.58),P < 0.01],提示脂肪细胞GS可抑制HUVECs的迁移。
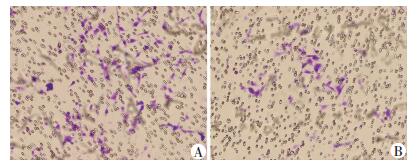
|
| A:WT小鼠;B:TgGS小鼠 图 6 Transwell实验检测两组条件培养基对HUVECs的迁移能力的影响(×100) |
3 讨论
血管为运输氧气和营养的重要渠道,但也为恶性肿瘤等提供营养支持[14]。新近研究表明:血管生成在多种疾病的发病过程中起重要作用,例如:类风湿性关节炎、糖尿病视网膜病变、癌症等。恶性肿瘤的增殖及转移都需要充足的血液供应,因此血管生成对肿瘤转移的发生至关重要。抑制血管生成是除了传统的治疗方法(如手术、化疗和放疗等)之外,另一种很有前途的恶性肿瘤治疗策略[8, 15]。脂肪细胞是代谢微环境的重要组成部分,它为肿瘤生长提供脂肪酸等营养物质,以促进肿瘤生长[16]。脂肪细胞在调节糖脂代谢平衡中起重要作用,但我们对脂肪细胞氨基酸代谢的调节却知之甚少[17]。实体瘤中GS过表达可促进肿瘤细胞增殖及肿瘤恶性进展[18-20]。但是GS在脂肪细胞中对肿瘤转移、血管生成及内皮细胞增殖、迁移、小管形成的作用尚不明确。本研究采用的是脂肪细胞GS表达上调的TgGS小鼠模型(GS只在脂肪组织中高表达)。大网膜、肠系膜、附睾脂肪垫以及其他脏器周围的脂肪垫均属于内脏脂肪,考虑到大网膜脂肪及肠系膜脂肪分布零散且不易取材,而附睾旁的脂肪垫位置固定、体积较大且易于分离;为了提高实验的可重复性,我们重点选择了附睾脂肪垫进行相关研究。本实验从体内研究脂肪细胞GS对结肠癌腹腔转移及血管生成的作用,并从体外观察脂肪细胞GS对HUVECs的增殖、小管形成能力及迁移的影响。
血管生成是一个涉及多种细胞、多种分子的复杂过程,主要包括如下步骤:激活期血管基底膜降解;血管的激活以及新生血管的重建。本研究发现脂肪细胞GS可抑制HUVECs的小管形成及迁移活性。而内皮细胞的激活在血管生成中起着重要的作用,抑制内皮细胞的迁移及小管形成活性可抑制血管生成。那么,脂肪细胞GS是如何调节内皮细胞迁移及小管形成的呢?既往研究表明,脂肪细胞可分泌脂肪细胞相关因子,包括肿瘤坏死因子-α,血管内皮细胞生长因子(VEGF),脂肪细胞特异蛋白(如脂联素、瘦素)等[21]。VEGF是到目前为止发现的最重要的促血管生成因子,与其受体结合后可促进内皮细胞的存活、增殖及迁移,促进肿瘤血管生成[22]。因此,我们猜测GS可能会调节脂肪细胞的分泌活性(比如下调VEGF的分泌),从而抑制HUVECs的小管形成及迁移能力。然而,这些猜测尚需要进一步的实验验证。
GS催化谷氨酸和氨合成谷氨酰胺,而谷氨酰胺能影响细胞的多种代谢途径及信号传导[23]。我们推测GS异常表达可能会导致脂肪细胞的氨基酸代谢发生重编程,从而影响脂肪细胞VEGF的表达及分泌,最终抑制肿瘤的血管生成。接下来可进行代谢组学及基因组学的高通量筛选和验证,寻找GS调节脂肪细胞VEGF表达活性的关键通路及靶点,将有望阐明脂肪细胞GS调控结肠癌血管生成的具体机制。
综上所述,脂肪细胞GS可抑制结肠癌的腹腔转移及肿瘤的血管生成,但机制有待进一步阐明。本研究有望为临床上结肠癌腹腔转移的预防和治疗提供潜在的干预策略。
| [1] | LEMOINE L, SUGARBAKER P, VAN DER SPEETEN K. Pathophysiology of colorectal peritoneal carcinomatosis: Role of the peritoneum[J]. World J Gastroenterol, 2016, 22(34): 7692–7707. DOI:10.3748/wjg.v22.i34.7692 |
| [2] | ARJONA-SÁÁ A, MEDINA-FERNÁNDEZ F J, MUÑOZ-CASARES F C, et al. Peritoneal metastases of colorectal origin treated by cytoreduction and HIPEC: An overview[J]. World J Gastrointest Oncol, 2014, 6(10): 407–412. DOI:10.4251/wjgo.v6.i10.407 |
| [3] | SIEGEL R, DESANTIS C, JEMAL A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2): 104–117. DOI:10.3322/caac.21220 |
| [4] | KIANMANESH R, SCARINGI S, SABATE J M, et al. Iterative cytoreductive surgery associated with hyperthermic intraperitoneal chemotherapy for treatment of peritoneal carcinomatosis of colorectal origin with or without liver metastases[J]. Ann Surg, 2007, 245(4): 597–603. DOI:10.1097/01.sla.0000255561.87771.11 |
| [5] | AOYAGI T. Current treatment options for colon cancer peritoneal carcinomatosis[J]. World J Gastroenterol, 2014, 20(35): 12493. DOI:10.3748/wjg.v20.i35.12493 |
| [6] | EASSON A M, BEZJAK A, ROSS S, et al. The ability of existing questionnaires to measure symptom change after paracentesis for symptomatic ascites[J]. Ann Surg Oncol, 2007, 14(8): 2348–2357. DOI:10.1245/s10434-007-9370-3 |
| [7] | PASSOT G, BAKRIN N, ROUX A S, et al. Quality of life after cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy: A prospective study of 216 patients[J]. Eur J Surg Oncol, 2014, 40(5): 529–535. DOI:10.1016/j.ejso.2013.11.019 |
| [8] | SHANG F T, HUI L L, AN X S, et al. ZnPPIX inhibits peritoneal metastasis of gastric cancer via its antiangiogenic activity[J]. Biomed Pharmacother, 2015, 71: 240–246. DOI:10.1016/j.biopha.2015.03.005 |
| [9] | ACKERMAN D, SIMON M C. Hypoxia, lipids, and cancer: surviving the harsh tumor microenvironment[J]. Trends Cell Biol, 2014, 24(8): 472–478. DOI:10.1016/j.tcb.2014.06.001 |
| [10] | MIAO H, OU J, PENG Y, et al. Macrophage ABHD5 promotes colorectal cancer growth by suppressing spermidine production by SRM[J]. Nat Commun, 2016, 7: 11716. DOI:10.1038/ncomms11716 |
| [11] | ROSE C F, VERKHRATSKY A, PARPURA V. Astrocyte glutamine synthetase: pivotal in health and disease[J]. Biochem Soc Trans, 2013, 41(6): 1518–1524. DOI:10.1042/BST20130237 |
| [12] | BOTT A J, PENG I C, FAN Y, et al. Oncogenic Myc Induces Expression of Glutamine Synthetase through Promoter Demethylation[J]. Cell Metab, 2015, 22(6): 1068–1077. DOI:10.1016/j.cmet.2015.09.025 |
| [13] | WU Q J, GONG C Y, LUO S T, et al. AAV-mediated human PEDF inhibits tumor growth and metastasis in murine colorectal peritoneal carcinomatosis model[J]. BMC Cancer, 2012, 12(1): 129. DOI:10.1186/1471-2407-12-129 |
| [14] | CARMELIET P, JAIN R K. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347): 298–307. DOI:10.1038/nature10144 |
| [15] | MABETA P. Inhibition of phosphoinositide 3-kinase is associated with reduced angiogenesis and an altered expression of angiogenic markers in endothelioma cells[J]. Biomed Pharmacother, 2014, 68(5): 611–617. DOI:10.1016/j.biopha.2014.03.017 |
| [16] | NIEMAN K M, KENNY H A, PENICKA C V, et al. Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth[J]. Nat Med, 2011, 17(11): 1498–1503. DOI:10.1038/nm.2492 |
| [17] | GREEN C R, WALLACE M, DIVAKARUNI A S, et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis[J]. Nat Chem Biol, 2016, 12(1): 15–21. DOI:10.1038/nchembio.1961 |
| [18] |
李一飞, 陈晓珍, 张璇, 等. 脂肪细胞谷氨酰胺合成酶抑制结肠癌细胞的肝、肺转移[J].
第三军医大学学报, 2017, 39(23): 2255–2262.
LI Y F, CHEN X Z, ZHANG X, et al. Glutamine synthetase from adipocytes inhibits hepatic and pulmonary metastasis of colon cancer cells[J]. J Third Mil Med Univ, 2017, 39(23): 2255–2262. DOI:10.16016/j.1000-5404.201707147 |
| [19] | LU W, PELICANO H, HUANG P. Cancer metabolism: is glutamine sweeter than glucose?[J]. Cancer Cell, 2010, 18(3): 199–200. DOI:10.1016/j.ccr.2010.08.017 |
| [20] | WANG J B, ERICKSON J W, FUJI R, et al. Targeting mitochondrial glutaminase activity inhibits oncogenic transformation[J]. Cancer Cell, 2010, 18(3): 207–219. DOI:10.1016/j.ccr.2010.08.009 |
| [21] |
李芬, 肖新华. 脂肪组织的微循环[J].
国际病理科学与临床杂志, 2011, 31(5): 394–397.
LI F, XIAO X F. Microcirculation of adipose tissue[J]. Int J Pathol Clin Med, 2011, 31(5): 394–397. DOI:10.3969/j.issn.1673-2588.2011.10.006 |
| [22] | COOK K M, FIGG W D. Angiogenesis inhibitors: current strategies and future prospects[J]. CA Cancer J Clin, 2010, 60(4): 222–243. DOI:10.3322/caac.20075 |
| [23] | CURI R, LAGRANHA C J, DOI S Q, et al. Molecular mechanisms of glutamine action[J]. J Cell Physiol, 2005, 204(2): 392–401. DOI:10.1002/jcp.20339 |



