肝细胞性肝癌(以下简称肝癌)是发生于肝脏最常见的恶性肿瘤,位列全球肿瘤发生的第5位、肿瘤相关死亡的第2位,而中国的肝癌发病和死亡人数占全球的50%[1]。迄今为止,肝切除术是临床上肝癌治疗的主要方法之一。
肿瘤大小作为肝癌分期的重要指标之一,是评估肝癌患者能否手术切除的主要判断标准[2]。现有分期及标准[3-7]等都采用肿瘤大小作为肝癌疗效的分界线。其中临床应用最为广泛的BCLC分期指南[5]认为,肿瘤> 5 cm的患者,即使其肝功能良好,也不适合外科治疗。然而,随着影像学检查方法的进步,手术相关设备及外科技术的发展,同时围手术期管理及麻醉技术的改进,临床对于大肝癌的切除乃至一些更为复杂的肝切除术也开展得越来越多[8-9]。肝癌指南严苛的手术指征与临床上广泛开展的肝癌手术,产生了一定的矛盾。
肿瘤大小对肝癌患者术后长期生存的影响尚存争议。有研究显示,肝癌的大小直接涉及手术风险和血管侵犯[10-11],大肝癌的预后比小肝癌更差[12-14];也有研究表明,不同大小的肿瘤其预后并没有区别,肿瘤大小不是影响预后的独立危险因素[15-17]。目前我国大肝癌患者的比例较多,且大多数合并有肝炎相关性肝硬化,此类患者情况相对特殊,手术耐受及近远期预后尚待探索。本研究分别回顾性分析了我院合并肝硬化的不同大小肝癌的患者临床资料,拟分析其临床特征及影响近远期预后生存的相关因素,为临床提供参考,为判断并改善预后提供循证依据。
1 资料与方法 1.1 一般资料采用回顾性病例对照研究方法。收集自2008-年在我科行肝癌切除治疗的合并有肝硬化的患者病例。其中肝细胞性肝癌诊断由我院病理科通过对所切除肿瘤组织进行HE染色及免疫组化染色(Glypican-3,AFP,CK8/18,Hepa等)确诊。残留肿瘤分级[18]是评价肿瘤切除后肿瘤残留情况的指标,以肿瘤完全切除(R0)、显微镜下残留(R1) 和肿瘤肉眼残留(R2) 表示。共计入组患者726例,符合入组要求的患者共计703例。排除肝癌破裂出血患者3例、术后病检提示为非肝细胞性肝癌19例及术后资料缺失1例。根据肿瘤最大直径,将患者分为小肝癌组(直径 < 5 cm)和大肝癌组(直径≥5 cm),其中小肝癌组280例,大肝癌组423例。
1.2 纳入、排除标准 1.2.1 纳入标准① 有肝硬化病史且术后病理诊断为肝硬化;② 无其他恶性肿瘤病史;③ 术前影像学检查提示肿瘤无远处转移者;④ 术前肝功能Child-Pugh评分A或B级;⑤ 行肿瘤R0切除者;⑥ 术后组织病理学确诊为肝细胞性肝癌。
1.2.2 排除标准① 因肝癌破裂出血急诊手术;② 术后病理显微镜下肿瘤残留(R1) 和术中肿瘤肉眼残留(R2);③ 临床资料缺乏或病例失访。
1.3 观察指标① 两组患者临床特征比较:性别、年龄、肿瘤最大直径、HBsAg、AFP、AST、白蛋白、总胆红素、血小板计数、肝功能Child-Pugh分级、肿瘤数目、脉管侵犯(脉管癌栓,指术前影像学所见大血管癌栓,也包括术后病检发现的微血管癌栓,但不包含胆管癌栓)。② 两组患者术中情况:手术时间、肝门阻断时间、术中失血量、射频辅助(radiofrequency ablation assist, RFA)、复杂手术。其中的复杂手术,是指除实施肝切除手术外,还需行其他手术,如血管取栓术、胆肠吻合术、脾切除术、门奇静脉断流术、联合胃肠道修补/切除手术、肝门淋巴结清扫等。③ 两组患者近期生存情况(术后并发症)分析:Clavien-Dindo分级[19]将术后并发症分为5级。Ⅰ级:出现不需要药物、内镜、外科等处理的并发症,但包括退烧、止吐、止痛、电解质等一般性对症处理药物,包括切口局部感染、理疗等处理;Ⅱ级:切口感染需抗生素治疗、输血、全肠外营养、药物(不含Ⅰ级所用药物);Ⅲ级:需外科、内镜、介入放射治疗等进一步处理;Ⅳ级:危及生命的严重并发症,包括中枢神经系统并发症、ICU监护处理;Ⅴ级为死亡。④ 两组患者远期生存情况分析:无瘤生存时间和总生存时间。⑤ 大小肝癌患者的预后因素(危险因素)分析。
1.4 随访术后采用电话或门诊方式进行随访。术后第1、2、3个月每月接受超声或CT检查,此后每2~3个月重复以上检查,1年后每3~6个月重复以上检查。两种增强影像学检查发现肝癌典型表现则认为肝内复发或转移。随访日期于2014年09月18日或患者死亡日期截止。703例患者的中位随访时间为39.43(1.03~ 79.37) 个月。
1.5 统计学分析计量资料用x± s形式表示,行t检验或U检验统计两组间临床资料的可比性,分类变量用χ2检验或Fisher确切概率法。使用Logistic回归模型分析术后并发症的危险因素,使用Cox回归模型分析影响无瘤生存率的危险因素,使用Kaplan-Meier法进行生存分析,检验两组差异采用Log-Rank法。统计分析采用SPSS 19.0软件进行。
2 结果 2.1 术前临床病理特征大肝癌组瘤体最大径[(8.0±2.9) cm]明显高于小肝癌组[(3.13±0.84) cm], (P < 0.01);且大肝癌组中AFP >600 ng/mL者的比例(44.4%)明显高于小肝癌组(28.2%, P < 0.01);大肝癌组中AST>40 U/L者的比例为68.8%,白蛋白 < 35 g/L者比例为11.3%,有脉管癌栓者比例为40.2%,与小肝癌组差异明显(54.3%,P < 0.01)、(6.4%,P=0.029)、(26.1%,P < 0.01);小肝癌组血小板计数PLT<100×109/L者比例为43.6%,高于大肝癌组患者(24.8%,P < 0.01)。而两组间在血清总胆红素水平、肝功能Child-Pugh分级、肿瘤多发比例等指标上并无显著性差异,见表 1。
| 组别 | n | 男/女(例) | 年龄(岁,x± s) | 肿瘤最大直径(cm,x± s) | HBsAg(例) | AFP(例) | AST (例) | 白蛋白(例) | 总胆红素(例) | 血小板计数(例) | Child-Pugh(例) | 肿瘤数目(例) | 脉管癌栓(例) | |||||||||||||||||
| 阳性 | 阴性 | ≥600 ng/mL | <600 ng/mL | ≤40 U/L | >40 U/L | ≤35 g/L | >35 g/L | ≤21 μmol/L | >21 μmol/L | <100×109/L | ≥100×109/L | A级 | B级 | 单发 | 多发 | 阳性 | 阴性 | |||||||||||||
| 小肝癌组 | 280 | 252/28 | 48.0±10.5 | 3.13±0.84 | 266 | 14 | 79 | 201 | 128 | 152 | 18 | 262 | 50 | 230 | 122 | 158 | 266 | 14 | 206 | 74 | 73 | 207 | ||||||||
| 大肝癌组 | 423 | 386/37 | 47.8±10.7 | 8.0±2.9 | 409 | 14 | 192 | 231 | 132 | 291 | 48 | 375 | 94 | 329 | 105 | 318 | 390 | 33 | 316 | 107 | 170 | 253 | ||||||||
| P | 0.575 | 0.842 | 0.000 | 0.262 | 0.000 | 0.000 | 0.029 | 0.160 | 0.000 | 0.145 | 0.737 | 0.000 | ||||||||||||||||||
2.2 两组患者术中情况
与小肝癌组比较,大肝癌组的手术时间(276.6±85.9 min)、肝门阻断时间(23.6±24.2 min)均明显长于小肝癌组(237.2±93.5) min,P < 0.01和(16.3±20.7) min,P < 0.01);比较两组间的术中失血量,大肝癌组≥500 mL者为35.9%,明显高于小肝癌组(20.7%,P < 0.01);复杂手术比例大肝癌组为13.9%,而小肝癌为8.9%,二者间差异显著P=0.045,见表 2。
| 组别 | n | 手术时间(min,x± s) | 肝门阻断时间(min,x± s) | 术中失血量(例) | RFA辅助(例) | 复杂手术(例) | |||||
| < 500 mL | ≥500 mL | 是 | 否 | 是 | 否 | ||||||
| 小肝癌组 | 280 | 237.2±93.5 | 16.3±20.7 | 222 | 58 | 66 | 214 | 25 | 255 | ||
| 大肝癌组 | 423 | 276.6±85.9 | 23.6±24.2 | 271 | 152 | 100 | 323 | 59 | 364 | ||
| P | < 0.001 | < 0.001 | < 0.001 | 0.983 | 0.045 | ||||||
2.3 两组患者术后并发症分析
对比两组术后总体并发症发生率,大肝癌组(35.0%)明显高于小肝癌组(27.1%,P=0.029)。按Clavien-Dindo分类统计,比较相同级别(Ⅰ~Ⅴ级)并发症比率,二者间均无明显差异,见表 3。
| 组别 | n | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | Ⅴ级 |
| 小肝癌组 | 76 | 13 | 16 | 35 | 5 | 7 |
| 大肝癌组 | 148a | 24 | 27 | 60 | 16 | 21 |
| a: P < 0.05, 与小肝癌组比较 | ||||||
2.4 两组患者术后并发症危险因素
对肝癌术后并发症的危险因素进行单因素分析发现:复杂手术和RFA辅助无论是在大肝癌组(P=0.043和P=0.039) 或是小肝癌组(P=0.015和P=0.010) 均为危险因素。而在多因素分析中,小肝癌组的独立危险因素为复杂手术(P=0.017),大肝癌组则为白蛋白 < 35 g/L(P < 0.01) 和手术时间>240 min(P < 0.01)。见表 4。
| 组别 | 危险因素 | 单因素分析 | 多因素分析 | |||||
| OR | 95% CI | P | OR | 95% CI | P | |||
| 小肝癌组 | 复杂手术 | 3.588 | 1.041~12.368 | 0.043 | 2.755 | 1.196~6.344 | 0.017 | |
| RFA辅助 | 2.326 | 1.046~5.176 | 0.039 | |||||
| 大肝癌组 | 白蛋白水平( < 35 g/L) | 3.861 | 1.704~9.346 | 0.001 | 4.049 | 2.105~7.752 | 0.000 | |
| 手术时间(>240 min) | 2.526 | 1.338~4.770 | 0.004 | 3.044 | 1.912~4.847 | 0.000 | ||
| 复杂手术 | 2.543 | 1.195~5.411 | 0.015 | |||||
| RFA辅助 | 2.212 | 1.208~4.051 | 0.010 | |||||
2.5 两组患者术后无瘤生存及总生存分析
与小肝癌组相比,大肝癌组的无瘤生存期(progression-free survival, PFS)和总生存(overall-survival, OS)均明显缩短(P < 0.001)。大肝癌组患者的中位无瘤生存期为166 d,在小肝癌组为487 d。同样,大肝癌组患者中位总生存期为562 d,明显短于小肝癌组865 d,见图 1。
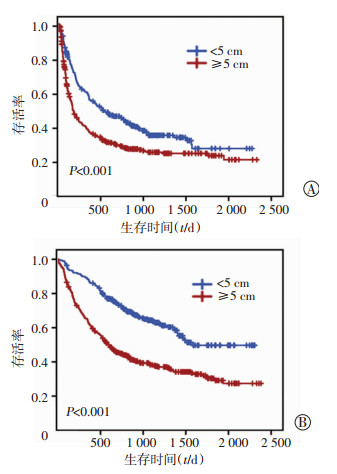
|
| 图 1 大肝癌组与小肝癌组患者无瘤生存(A)及总生存(B)曲线 |
2.6 两组患者术后生存分析危险因素分析 2.6.1 影响无瘤生存期的危险因素分析
针对肝癌术后的无瘤生存期进行多因素分析发现,仅有脉管癌栓被评估为小肝癌组的独立危险因素(P < 0.01)。而脉管癌栓及手术时间>240 min为大肝癌组的独立危险因素,P值分别为 < 0.01和0.018。单因素分析发现,RFA辅助为大肝癌组的保护因素(P=0.022),见表 5。
| 组别 | 危险因素 | 单因素分析 | 多因素分析 | |||||
| OR | 95% CI | P | OR | 95% CI | P | |||
| 小肝癌组 | 脉管癌栓 | 2.197 | 1.603~3.102 | < 0.001 | 1.990 | 1.438~2.754 | <0.001 | |
| 大肝癌组 | 脉管癌栓 | 2.163 | 1.407~3.325 | < 0.001 | 2.618 | 2.059~3.327 | <0.001 | |
| 手术时间(>240 min) | 1.473 | 1.062~2.042 | 0.020 | 1.344 | 1.053~1.717 | 0.018 | ||
| RFA辅助 | 0.681 | 0.491~0.946 | 0.022 | |||||
2.6.2 影响总生存期的危险因素分析
Cox回归模型分析评估多因素研究发现:脉管癌栓是影响大小肝癌术后生存的共同的独立危险因素(P < 0.01);除此之外,小肝癌组中肝功能Child-Pugh B级以及复杂手术也是独立相关因素(P=0.008),而大肝癌组中AST>40 U/L是独立危险因素(P=0.008),见表 6。
| 组别 | 危险因素 | 单因素分析 | 多因素分析 | |||||
| OR | 95% CI | P | OR | 95% CI | P | |||
| 小肝癌组 | Child-Pugh B级 | 4.898 | 1.110~21.616 | 0.036 | 2.355 | 1.252~4.430 | 0.008 | |
| 脉管癌栓 | 2.814 | 1.021~7.754 | 0.045 | 3.123 | 2.080~4.687 | <0.001 | ||
| 复杂手术 | 2.535 | 1.216~5.285 | 0.013 | 2.083 | 1.207~3.596 | 0.008 | ||
| 大肝癌组 | AST(>40 U/L) | 1.493 | 1.036~2.151 | 0.032 | 1.463 | 1.105~1.937 | 0.008 | |
| PLT (<100×109/L) | 1.549 | 1.058~2.270 | 0.025 | |||||
| 脉管癌栓 | 2.625 | 1.671~4.125 | < 0.001 | 3.167 | 2.461~4.075 | < 0.001 | ||
3 讨论
目前手术切除仍然是治疗肝癌的首选方法。但能否进行肝脏切除,主要的评价指标还是肝癌分期,其中肿瘤大小是肝癌分期及治疗的重要参考指标,当前多个分期系统[3-7]都采用了5 cm作为评判肝癌分期的参数,借此来指导治疗和判断预后,并将直径≥5 cm的肝癌定义为中、晚期肝癌指标之一。有关肝癌大小对于肝切除指征及预后的影响一直存在分歧,目前全世界使用最广泛的BCLC分期指南清楚地表明,仅限早期肝癌的患者(单发肿瘤≤5 cm,或者多发肿瘤≤3个且总直径≤3 cm)才能接受肝切除手术。但在临床实际应用过程中,该指南受到多种质疑,TORZILI[20]报道BCLC分期B/C期肝癌患者行手术治疗可有与早期肝癌类似的临床疗效。周伟平教授[21]也指出BCLC分期B期患者手术切除较TACE术后生存率更佳。肝癌的大小能否作为手术切除的绝对判断指标及预后判断指标,仍存在争议,并在部分学者的努力中逐渐得到循证医学的依据。近来新的香港分期指南(HKLC)[3]指出,肝功能Child-Pugh A级的中期肝癌患者(肿瘤 < 5 cm或者多于3个肿瘤结节,有肝外血管侵犯;肿瘤>5 cm,少于3个肿瘤结节,无肝外血管侵犯)可行手术治疗,并且可有效地提高肝癌患者中位生存时间约一倍。其手术适应证较BCLC更广泛、激进,旨在通过调整方案以使更多患者获益。
本研究共纳入703例连续患者,其中肿瘤最大径超过5 cm的患者占了60.2%(423/703),这一数据反映了我国肝癌发病的特殊性和特殊医疗国情。在这样的背景条件下,简单地照搬国外的肝癌治疗指南是否会导致相当部分的肝癌患者丧失从手术中获益的机会,我们应该去寻找新的有力循证医学证据。
肝癌尤其是大肝癌接受肝切除治疗还需考虑的重要问题是剩余肝脏功能,即肝脏储备功能。最近有研究[22-23]表明,如果肿瘤的位置及肝脏储备功能允许,肿瘤大小不应该被作为肝切除术的甄选标准。在我们的研究数据中,从Child-Pugh肝功能分级情况看,大小肝癌组间并无显著性差异,这一现象我们认为应该与术前严格把握肝功能分级实施病例筛选有关。在我国国情下,肝炎合并有肝硬化的患者居多,相应的肝脏储备功能更差,耐受肝切除手术的可能性较小,术后发生肝衰竭风险较大,因此针对大肝癌患者,必须更多地关注其肝功能。有文献报道肝切除术后并发症与术前白蛋白水平相关[24-25],这一点与本研究结果相似。本研究中,虽然两组之间肝功能Child-Pugh分级相似,但大肝癌组患者白蛋白水平、AST水平较之小肝癌组均有明显统计学差异。这提示肿瘤负荷对于肝脏功能产生了不良影响,可能与肿瘤压迫血管或胆管导致肝组织缺血、缺氧或产生淤胆等原因有关。有趣的是,大肝癌组中门脉高压者的比例较少,其间接反应为因继发脾功能亢进而导致的低血小板血症者的比例更低。这一点与临床实际工作中,外科医生常更为谨慎地将门脉高压视为大肝癌患者的高风险因素,从而把这部分患者从手术治疗范围中排除。
东方肝胆医院薛峰等[26]报道肿瘤直径>5 cm,其门脉癌栓合并率显著增加,与本研究结果一致。由于大肝癌患者瘤体大、合并癌栓及淋巴结转移更多等原因,因此其手术不仅切除范围更广,有的还涉及血管、胆管的切除或重建、取癌栓术等,因而手术更大、更为复杂。我们的数据中,与小肝癌组相比,大肝癌组术中所需手术时间、肝门阻断时间更长,失血量更多,复杂手术所占比例更大。
我们观察到虽然大肝癌组(35.0%)较小肝癌组(27.1%)的术后总体并发症的发生率更高(P=0.029),但以Clavien-Dindo并发症分级进行分层比较,两组间在Ⅰ~Ⅲ级并发症的发生率上无显著性差异,Ⅳ、Ⅴ级并发症大肝癌组略高,但也无统计学差异(P=0.128和P=0.102)。因此我们认为就手术的安全性而言,虽然手术治疗大肝癌伴有并发症的较多,但严重并发症的发生率其实与小肝癌无异。大肝癌者切除的肝脏体积更多,剩余肝脏体积则相对可能更少,综合肝门阻断、感染等因素,因而导致术后肝功能衰竭的风险更高。这样就能够解释反应肝功能的白蛋白水平会成为影响大肝癌组术后并发症出现的独立危险因素的原因。而大肝癌组另一个影响术后并发症的独立危险因素是手术时间(>240 min),手术时间的长短取决于手术本身的困难程度,施行肝切除术时可能需要行长时间的操作,比如当肿瘤细胞侵犯胆管或是邻近器官,胆管则需要被切除、重建,邻近组织和器官则需要被切除[27-29],在这种背景下并发症的概率必然增大。在小肝癌组,复杂手术则是影响术后并发症独立的危险因素。仔细分析这些病例发现,肿瘤虽小,但可能出现血管或周围组织器官等侵犯需要行复杂手术,这势必造成并发症概率上升。因此,我们认为术前充分的评估患者肝功能、纠正低蛋白血症,通过如熟练手术操作、合理使用手术器械等方式缩短手术时间,有助于降低大肝癌患者术后并发症和提高手术安全性。
肝癌的RFA辅助肝切除治疗逐渐兴起并成熟,并且发展为实施肝切除之前使用该技术在肝肿瘤周围通过射频建立凝固坏死带,从而能够显著减少肝切除过程中失血的方法[30-31],我们称之为RFA辅助的肝切除法。我们研究结果表明,RFA辅助是影响大小肝癌组术后并发症的危险因素,但并不是独立的危险因素。值得注意的是,在大肝癌组中,RFA辅助还是其PFS的保护因素。两者看似矛盾,但我们推测,往往因为医生倾向于在大肝癌术中采用RFA辅助,而大肝癌的手术相对复杂,因而术后并发症(如胆漏、腹腔感染等)的发生较多,这是导致RFA辅助与大肝癌术后并发症率间在单因素分析中建立起统计学相关性的原因,然而在多因素分析中即排除了其作为独立危险因素的可能性。同时,RFA辅助治疗可能是由于损毁了肿瘤周围卫星病灶,抑或是形成的凝固坏死隔离带阻止了手术操作过程中因挤压所导致的肿瘤扩散、转移,因而构成了大肝癌术后PFS的保护性因素。
从无瘤生存时间和总体生存情况来看,术后小肝癌的明显优于大肝癌,统计学分析P值无论是PFS或OS均 < 0.01,差异性显著。大肝癌者因肿瘤血管浸润、淋巴结转移及术后并发症的发生率更高,因此我们认为这一结果是符合肿瘤的生物学行为。但我们也应注意到,所有大肝癌组中有相当一部分患者存在多发肿瘤(25.3%)及脉管癌栓(59.8%),理论上纳入这部分患者必然会导致术后PFS及OS的下降。然而,703例行肝切除患者总的中位PFS为234 d,总的中位OS为684 d,这一水平与以往的研究并未相去甚远[8, 32-33],从某种意义上说,这一数据间接证明了手术治疗对于大肝癌的价值。我们的研究还发现:对于大肝癌而言,AST>40 U/L和手术耗时长(>240 min)分别是大肝癌患者无瘤生存期和总体生存率的独立危险因素,而癌栓则即是FPS的独立危险因素,也OS的独立危险因素。这一结果提示我们:术前注意肝功能的评估、保护和改善,以便捷的手术器械和熟练的手术操作(如辅助RFA)等方法缩短手术时间,有望进一步提高大肝癌的手术治疗效果,在这一点上,它与并发症预防的要点相同。无疑癌栓的存在会极大地影响>5 cm肝肿瘤术后的效果,临床工作中如将术前影像学确诊癌栓者排除于手术病例之外,势必提高大肝癌的治疗效果。同时,我们认为单纯以肝癌直径的大小作为甄选手术适应证的依据,而不考虑癌栓等因素,难免有失偏颇,势必造成部分大肝癌患者未能从手术中获益。
综上,我们认为:就肝癌手术而言,肿瘤最大径<5 cm比肿瘤最大径≥5 cm者有着更好的近、远期生存。但单纯的以肿瘤直径(5 cm)作为判断手术适应证的依据,可能会导致部分患者无法从手术中获益。选择无癌栓的大肝癌病例,改善术前白蛋白、转氨酶水平,提高手术熟练度及合理使用手术器械(如辅助RFA)以缩短手术时间,不但可以降低术后并发症,也将改善大肝癌的手术治疗效果。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | EL-SERAG H B. Hepatocellular carcinoma[J]. N Engl J Med, 2011, 365(12): 1118–1127. DOI:10.1056/NEJMra1001683 |
| [3] | YAU T, TANG V Y, YAO T J, et al. Development of Hong Kong Liver Cancer staging system with treatment stratification for patients with hepatocellular carcinoma[J]. Gastroenterology, 2014, 146(7): 1691–1700. DOI:10.1053/j.gastro.2014.02.032 |
| [4] | VAUTHEY J N, LAUWERS G Y, ESNAOLA NF, et al. Simplified staging for hepatocellular carcinoma[J]. J Clin Oncol, 2002, 20(6): 1527–1536. DOI:10.1200/JCO.2002.20.6.1527 |
| [5] | LLOVET J M, BRú C, BRUIX J. Prognosis of hepatocellular carcinoma: the BCLC staging classification[J]. Semin Liver Dis, 1999, 19(3): 329–338. DOI:10.1055/s-2007-1007122 |
| [6] | EDGE S B, COMPTON C C. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471–1474. DOI:10.1245/s10434-010-0985-4 |
| [7] |
杨秉辉, 夏景林. 原发性肝癌的临床诊断与分期标准[J].
中华肝脏病杂志, 2001, 9(6): 324.
YANG B H, XIA J L. Clinical diagnosis and staging criteria of primary liver cancer[J]. Chin J Hepatol, 2001, 9(6): 324. |
| [8] | ANDREOU A, VAUTHEY J N, CHERQUI D, et al. Improved long-term survival after major resection for hepatocellular carcinoma: a multicenter analysis based on a new definition of major hepatectomy[J]. J Gastrointest Surg, 2013, 17(1): 66–77. DOI:10.1007/s11605-012-2005-4 |
| [9] | POON R T P, FAN S T. Hepatectomy for hepatocellular carcinoma: Patient selection and postoperative outcome[J]. Liver Transplantation, 2004, 10(S2): S39–S45. DOI:10.1002/lt.20040 |
| [10] | KIM S J, LEE K K, KIM D G. Tumor size predicts the biological behavior and influence of operative modalities in hepatocellular carcinoma[J]. Hepatogastroenterology, 2010, 57(97): 121–126. |
| [11] | EGUCHI S, TAKATSUKI M, HIDAKA M, et al. Predictor for Histological Microvascular Invasion of Hepatocellular Carcinoma: A Lesson from 229 Consecutive Cases of Curative Liver Resection[J]. World Journal of Surgery, 2010, 34(5): 1034–1038. DOI:10.1007/s00268-010-0424-5 |
| [12] | HIROKAWA F, HAYASHI M, MIYAMOTO Y, et al. Predictors of poor prognosis by recurrence patterns after curative hepatectomy for hepatocellular carcinoma in Child-Pugh classification A[J]. Hepatogastroenterology, 2015, 62(137): 164–168. |
| [13] | GOH B K, TEO J Y, CHAN C Y, et al. Importance of tumor size as a prognostic factor after partial liver resection for solitary hepatocellular carcinoma: Implications on the current AJCC staging system[J]. J Surg Oncol, 2016, 113(1): 89–93. DOI:10.1002/jso.24099 |
| [14] | HO C M, HU R H, LEE P H, et al. Long-term survival in patients with T2 hepatocellular carcinoma after primary curative resection can be further stratified by tumor size[J]. Medicine (Baltimore), 2014, 93(27): e203. DOI:10.1097/MD.0000000000000203 |
| [15] | GOH B K, CHOW P K, TEO J Y, et al. Number of nodules, Child-Pugh status, margin positivity, and microvascular invasion, but not tumor size, are prognostic factors of survival after liver resection for multifocal hepatocellular carcinoma[J]. J Gastrointest Surg, 2014, 18(8): 1477–1485. DOI:10.1007/s11605-014-2542-0 |
| [16] | ETTORRE G M, LEVI SANDRI G B, COLASANTI M, et al. Liver resection for hepatocellular carcinoma ≥5 cm[J]. Transl Gastroenterol Hepatol, 2017, 2: 22. DOI:10.21037/tgh.2017.03.13 |
| [17] | KOBAYASHI T, ITAMOTO T, TASHIRO H, et al. Tumor-related factors do not influence the prognosis of solitary hepatocellular carcinoma after partial hepatectomy[J]. J Hepatobiliary Pancreat Sci, 2011, 18(5): 689–699. DOI:10.1007/s00534-011-0379-4 |
| [18] |
吴力群, 邱法波, 张顺, 等. 原发性肝细胞癌R0切除标准的探讨[J].
中国实用外科杂志, 2011, 31(11): 1027–1030.
WU L Q, QIU F B, ZHANG S, et al. Estimate of the criterion for R0 resection in primary hepatocellular carcinoma[J]. Chin J Prac Surg, 2011, 31(11): 1027–1030. |
| [19] | CLAVIEN P A, BARKUN J, de Oliveira M L, et al. The Clavien-Dindo classification of surgical complications: five-year experience[J]. Ann Surg, 2009, 250(2): 187–196. DOI:10.1097/SLA.0b013e3181b13ca2 |
| [20] | TORZILLI G, DONADON M, Marconi M, et al. Hepatectomy for stage B and stage C hepatocellular carcinoma in the Barcelona Clinic Liver Cancer classification: results of a prospective analysis[J]. Arch Surg, 2008, 143(11): 1082–1090. DOI:10.1001/archsurg.143.11.1082 |
| [21] | YIN L, LI H, LI A J, et al. Partial hepatectomy vs. transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond Milan criteria: A RCT[J]. Journal of Hepatology, 2014, 61(1): 82-88. DOI: 10.1016/j.jhep.2014.03.012. |
| [22] | DE LOPE C R, TREMOSINI S, FORNER A, et al. Management of HCC[J]. J Hepatol, 2012, 56(Suppl 1): S75–S87. DOI:10.1016/S0168-8278(12)60009-9 |
| [23] | European Association For The Study Of The L, European Organisation For R, Treatment Of C. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908–943. DOI:10.1016/j.jhep.2011.12.001 |
| [24] | JARNAGIN W R, GONEN M, FONG Y, et al. Improvement in perioperative outcome after hepatic resection: analysis of 1, 803 consecutive cases over the past decade[J]. Ann Surg, 2002, 236(4): 397–406. DOI:10.1097/01.SLA.0000029003.66466.B3 |
| [25] | VIRANI S, MICHAELSON J S, HUTTER M M, et al. Morbidity and mortality after liver resection: results of the patient safety in surgery study[J]. J Am Coll Surg, 2007, 204(6): 1284–1292. DOI:10.1016/j.jamcollsurg.2007.02.067 |
| [26] |
薛峰, 沈锋, 奚韬. 肝癌切除病人门静脉癌栓的分布状况[J].
外科理论与实践, 2004, 9(04): 278–281.
XUE F, SHEN F, XI T. The distribution of portal vein tumor thrombus in patients with primary liver carcinoma[J]. J Sur Concep Prac, 2004, 9(04): 278–281. DOI:10.3969/j.issn.1007-9610.2004.04.006 |
| [27] | MERCADO M A, CHAN C, OROZCO H, et al. Long-term evaluation of biliary reconstruction after partial resection of segments Ⅳ and Ⅴ in iatrogenic injuries[J]. J Gastrointest Surg, 2006, 10(1): 77–82. DOI:10.1016/j.gassur.2005.07.003 |
| [28] | NANASHIMA A, Abo T, TAKESHITA H, et al. Safety of hepatectomy accompanying combined resection of other organs[J]. Hepatogastroenterology, 2012, 59(118): 1915–1920. DOI:10.5754/hge11812 |
| [29] | ZHANG X Y, LI C, WEN T F, et al. Synchronous splenectomy and hepatectomy for patients with hepatocellular carcinoma and hypersplenism: A case-control study[J]. World J Gastroenterol, 2015, 21(8): 2358–2366. DOI:10.3748/wjg.v21.i8.2358 |
| [30] | GUO R, FENG X, XIAO S, et al. Short-and long-term outcomes of hepatectomy with or without radiofrequency-assist for the treatment of hepatocellular carcinomas: a retrospective comparative cohort study[J]. Biosci Trends, 2015, 9(1): 65–72. DOI:10.5582/bst.2014.01142 |
| [31] | WEBER J C, NAVARRA G, JIAO L R, et al. New Technique for Liver Resection Using Heat Coagulative Necrosis[J]. Annals of Surgery, 2002, 236(5): 560–563. DOI:10.1097/00000658-200211000-00004 |
| [32] | KUDO M, IZUMI N, SAKAMOTO M, et al. Survival Analysis over 28 Years of 173, 378 Patients with Hepatocellular Carcinoma in Japan[J]. Liver Cancer, 2016, 5(3): 190–197. DOI:10.1159/000367775 |
| [33] | LIU X Y, XU J F. Liver resection for young patients with large hepatocellular carcinoma: a single center experience from China[J]. World Journal of Surgical Oncology, 2014, 12(1): 175. DOI:10.1186/1477-7819-12-175 |



