甲状腺乳头状癌(papillary thyroid carcinoma, PTC)是甲状腺癌中最常见的病理类型,约占全部甲状腺癌的80%,是近年备受关注的肿瘤之一,也是内分泌系统肿瘤研究的热点[1-2]。研究发现PTC的发病率呈现明显性别差异,女性约为男性的3倍,提示雌激素可能在PTC中具有重要作用[2-4]。
雌激素家族中发挥作用的主要分子形式为17β-雌二醇(17β-estradiol, E2)。雌激素与其相应的雌激素受体(estrogen receptor, ER)发生特异性结合而发挥各种生物学功能。ERα36是一种新型雌激素受体亚型,主要定位于细胞膜和细胞质[5]。研究发现ERα36主要介导非基因型效应的膜信号途径,在乳腺癌中与雌激素结合后,可迅速激活生长因子相关的下游信号转导事件[6],如MAPK/ERK和PI3-K/AKT信号通路,从而增强细胞增殖和侵袭转移能力。
PTC是一种雌激素相关肿瘤,根据相关文献,推断ERα36对PTC的发生、发展具有重要作用,但其在癌细胞中的表达情况和具体的分子机制尚缺乏相关研究。本研究采用免疫组化检测ERα36在人PTC组织标本中的表达,随后通过Western blot实验进一步检测PTC细胞中ERα36的表达,并深入探讨ERα36在PTC细胞中的相关信号通路,阐明ERα36介导雌激素促进PTC增殖的分子机制,表明ERα36可能作为PTC临床治疗和预后的一个潜在靶点而发挥重要作用,为PTC的靶向研究提供更多的理论依据。
1 材料与方法 1.1 材料所用PTC细胞株K-1和BCPAP由香港中文大学George G. Chen教授惠赠。收集重庆医科大学附属第二医院普外科经病理诊断为PTC的组织标本34例作为实验组,距肿瘤3 cm处的癌旁组织标本21例作为对照组。
1.2 主要试剂RPMI1640培养基和胎牛血清(fetal calf serum, FBS)购自美国Gibco公司。兔抗人ERα36多克隆抗体购自美国Cell Applications公司。鼠抗人ERK、AKT抗体、羊抗兔二抗、羊抗鼠二抗购自美国Santa Cruz公司。兔抗人β-actin抗体、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒购自碧云天公司。ICI182780、PD98059、LY294002、MTT试剂盒、DMSO、17β雌二醇购自美国Sigma公司。Lipofectamine RNAiMAX购自美国Invitrogen公司。免疫印迹化学发光剂ECL购自美国Millipore公司。预染蛋白Marker购自美国Bio-Rad公司。免疫组化(S-P)法试剂盒、DAB显色试剂盒购自北京中杉金桥公司。
1.3 细胞培养将PTC细胞株K-1和BCPAP贴壁培养于含10%FBS、100 μg/mL链霉素和100 U/mL青霉素的RPMI 1640培养基中,置于37 ℃、5%CO2饱和湿度孵育箱,常规培养,取对数生长期细胞进行实验。
1.4 siRNA转染根据Lipofectamine RNAiMAX使用说明书对BCPAP细胞进行转染,scrambled siRNA为阴性对照。
1.5 Western blot检测根据具体实验要求进行分组,分别处理BCPAP和K-1细胞后, 取总蛋白50 μg进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE)。按“海绵-厚滤纸-条带-PVDF膜-厚滤纸-海绵”的顺序,将蛋白转移到PVDF膜上,5%的脱脂奶粉封闭1 h,PBST洗膜,加入一抗, 4 ℃过夜。PBST洗膜后加二抗, 37 ℃孵育1 h,PBST洗膜,用ECL发光剂显色,Bio-Rad凝胶成像系统采集图像,分析目的条带,重复3次。
1.6 MTT检测细胞增殖取对数生长期的BCPAP细胞,经胰酶消化后,制成单细胞悬液,以每孔5×103个细胞的浓度接种于96孔板中;培养于37 ℃、5%CO2孵育箱中,孵育24 h;细胞贴壁后,用不同浓度的E2(10-6、10-7、10-8、10-9 mol/L)处理BCPAP细胞24 h,每个浓度设5个平行孔;每孔加入20 μL 0.5 mg/mL的MTT,37 ℃孵育4 h;吸去培养液,每孔加150 μL DMSO,振荡10 min,溶解结晶;酶标仪测量波长490 nm处的光密度值[D(490)],计算细胞增殖率。实验重复3次。
1.7 免疫组织化学染色法[7]S-P测定ERα36的表达。标本经10%甲醛固定,石蜡包埋,4 μm连续切片。切片用常规脱蜡,水化,抗原热修复,以3%过氧化氢室温孵育30 min,灭活内源性过氧化物酶; 用山羊血清封闭30 min,滴加一抗(1:100稀释的兔抗人ERα36),4 ℃孵育过夜; 室温复温30 min后,滴加生物素标记的兔抗人IgG,37 ℃孵育30 min; 辣根酶标记链霉卵白素工作液,37 ℃孵育15 min。DAB显色,复染,脱水,透明,封片。用PBS替代一抗,作阴性对照。
1.8 判断指标参照文献[8]方法测定。在400倍光镜下,每张切片选取5个高倍视野,阳性细胞为细胞质、细胞膜染色为黄色或棕褐色的颗粒。染色强度与阳性细胞百分比如下:0为阴性染色,不显色,阳性细胞<5%;1为弱阳染色,显色呈浅黄色,阳性细胞为6%~25%;2为阳性染色即中度染色,显色呈棕黄色,阳性细胞为26%~50%;3为强阳性染色,显色呈深褐色,阳性细胞>51%。采用Remmele半定量评分,阳性细胞百分率和显色深浅的乘积0~1分为(-)、2~4分为(+)、5~8分为(++)、>9分为(+++)。为便于统计,0或+为阴性即低表达组,++或+++为阳性即高表达组。由两位独立的病理科医师在双盲条件下进行免疫染色结果判定。
1.9 统计学分析应用SPSS 18.0统计软件,计量数据以x±s表示,组间均数差异行t检验。组织标本分析行χ2检验。检验水准:α=0.05。
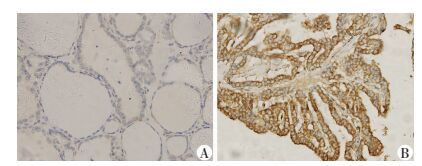
2 结果 2.1 ERα36在甲状腺乳头状癌人体组织标本中的表达ERα36主要表达于细胞质和细胞膜(图 1)。在21例癌旁组织中,ERα36的阳性表达率为0。而在34例PTC组织中,ERα36的阳性表达率为82.4%(28/34),明显高于癌旁组织(P<0.05)。
|
| A:癌旁组织低表达;B:PTC组织高表达 图 1 免疫组化染色观察ERα36在人PTC和癌旁组织中的表达(S-P ×400) |
2.2 ERα36在甲状腺乳头状癌细胞K-1和BCPAP中的表达
Western blot检测显示两株细胞均能检测到ERα36的表达(图 2)。

|
| 图 2 Western blot检测ERα36在K-1和BCPAP细胞中的表达 |
2.3 E2对BCPAP和K-1细胞ERα36表达的影响
选取对数生长期的BCPAP和K-1细胞饥饿培养24 h,梯度浓度E2(0、10-7、10-8、10-9 mol/L)处理24 h,Western blot检测ERα36的表达。结果显示E2能促进BCPAP和K-1细胞ERα36的表达,且在浓度为10-8 mol/L时效果最明显(P<0.05,图 3A、B)。后用10-8 mol/L E2处理细胞0、12、24 h,Western blot检测ERα36的表达。结果显示ERα36的表达随时间延长逐渐增高(P<0.05,图 3C、D)。

|
| A:Western blot检测梯度浓度E2(0、10-7、10-8、10-9 mol/L)处理24 h后K-1和BCPAP细胞中ERα36的表达;B:半定量分析结果a:P<0.05,与0 mol/L比较;C:10-8 mol/L E2处理细胞0、12、24 h后ERα36的表达;D:半定量分析结果a:P<0.05,与0 h比较 图 3 E2促进K-1和BCPAP细胞中ERα36表达 |
2.4 E2对BCPAP和K-1细胞ERK1/2和AKT蛋白磷酸化水平的影响
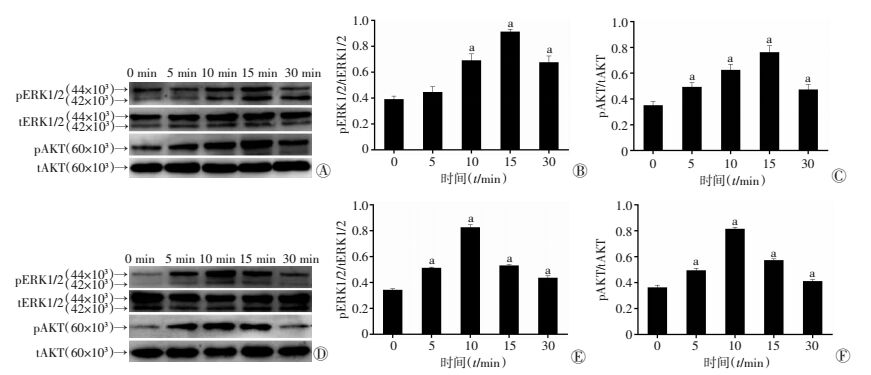
用10-8 mol/L E2分别处理BCPAP和K-1细胞0、5、10、15、30 min后,Western blot检测结果表明E2能促进BCPAP和K-1细胞ERK1/2和AKT蛋白磷酸化水平的升高(P<0.05),且在15 min时BCPAP细胞最明显,在10 min时K-1细胞最明显(图 4)。
|
| A:Western blot检测BCPAP细胞中ERK1/2、AKT磷酸化水平;B、C:分别为BCPAP细胞中ERK1/2、AKT磷酸化水平半定量分析结果a:P<0.05, 与0 min比较;D:Western blot检测K-1细胞中ERK1/2、AKT磷酸化水平;E、F:分别为K-1细胞中ERK1/2、AKT磷酸化水平半定量分析结果a:P<0.05, 与0 min比较 图 4 E2促进BCPAP和K-1细胞ERK1/2和AKT的激活 |
2.5 ERα36-siRNA抑制E2促进的BCPAP细胞ERK1/2和AKT磷酸化水平升高
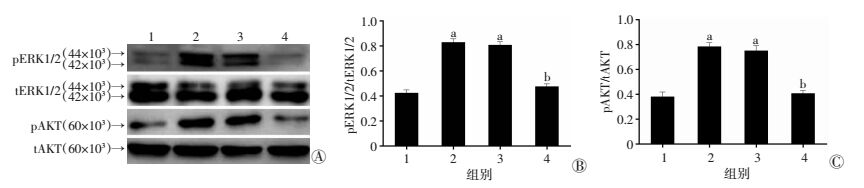
实验前期已构建好ERα36-siRNA干扰质粒,scrambled siRNA作为对照,并成功转染BCPAP细胞。共设4组:对照组、E2组、E2+scrambled siRNA组和E2+ERα36-siRNA组,E2浓度为10-8 mol/L。结果显示:处理BCPAP细胞15 min后,E2+ERα36-siRNA组中,E2诱导的ERK1/2和AKT磷酸化水平升高明显受到抑制(P<0.05,图 5)。
|
|
1:对照组;2:E2组;3:E2+scrambled siRNA组;4:E2+ERα36-siRNA组a:P<0.05, 与对照组比较; b:P<0.05, 与E2组比较 A:Western blot检测;B、C:分别为ERK1/2、AKT磷酸化水平半定量分析 图 5 ERα36-siRNA抑制E2诱导BCPAP细胞激活ERK1/2和AKT |
2.6 E2对BCPAP细胞增殖的影响
用梯度浓度的E2(0、10-7、10-8、10-9 mol/L)处理BCPAP细胞24 h后,采用MTT检测各组细胞增殖率分别为0、(39.0±6.6)%、(59.3±11.0)%、(28.0±7.0)%。结果显示:低浓度E2促进细胞增殖,高浓度E2抑制细胞增殖(P<0.05),最佳处理浓度为10-8 mol/L。用10-8 mol/L处理细胞0、12、24 h后,检测各组细胞增殖率分别为0、(22.3±6.4)%、(67.0±8.0)%,结果表明随处理时间增加,E2对细胞的促增殖作用逐渐增强(P<0.05)。
2.7 ERα36-siRNA抑制E2促进BCPAP细胞增殖实验共设6组:对照组、E2组、E2+ICI182780(雌激素拮抗剂)组、E2+PD98059(ERK抑制剂)组、E2+LY294002(AKT抑制剂)组和E2+ERα36-siRNA组,E2浓度为10-8 mol/L。检测各组细胞增殖率分别为0、(68.6±4.7)%、(14.1±3.0)%、(28.2±2.8)%、(28.6±3.4)%、(15.2±2.7)%,结果显示阻断ERK/AKT通路和干扰ERα36表达后,E2的促增殖作用受到明显抑制(P<0.05)。
3 讨论传统观点认为,E2主要通过与经典的核雌激素受体ERα、ERβ结合直接调控靶基因的表达。然而,现有研究表明,雌激素还能触发多种非基因组调节的膜信号通路,且发现了多种介导快速细胞传导事件的新型雌激素受体。新型雌激素受体ERα36已被证实对子宫内膜癌细胞增殖及他莫昔芬耐药起重要作用[9]。在乳腺癌中,ERα36能介导E2通过膜信号快速激活MAPK/ERK和PI3K/AKT通路,从而促进癌细胞的增殖和侵袭转移能力,使其成为一个新的潜在乳腺癌治疗靶点[6, 10-11]。ERα36在子宫内膜癌、卵巢癌以及胃癌细胞中均有表达,但其在甲状腺乳头癌中的作用尚不清楚。
本研究探索了ERα36介导E2促进PTC细胞增殖的相关通路及其具体的分子机制。在人34例PTC组织标本中,免疫组化结果显示ERα36主要定位于细胞膜和细胞质,且阳性表达率为82.4%,显著高于癌旁组织(P<0.05)。此外,通过Western blot实验在PTC细胞BCPAP和K-1中均检测到ERα36的表达;E2能促进ERα36的表达,且在浓度为10-8 mol/L时最为明显;ERα36的表达随处理时间的增加逐渐增强。随后用10-8 mol/L E2分别处理BCPAP和K-1细胞,结果显示E2能促进BCPAP和K-1细胞ERK1/2、AKT蛋白磷酸化水平的升高。为检测ERα36是否参与E2的相关信号通路,本研究于前期构建了ERα36-siRNA干扰质粒,并以scrambled siRNA为对照,结果显示:ERα36-siRNA明显抑制了E2对ERK1/2、AKT蛋白磷酸化水平的促进,表明ERα36在E2介导的信号通路中发挥了重要作用。为证实ERα36是否介导E2促进PTC增殖,用MTT检测细胞增殖情况,结果显示E2能促进细胞增殖,而在阻断ERK/AKT通路后,E2的促增殖作用受到明显抑制。
综上所述,本研究结果表明,在PTC中,ERα36介导雌激素通过ERK/AKT途径促进PTC细胞增殖,进一步说明了ERα36可能成为PTC治疗和预后的一个潜在靶点。但是ERα36与雌激素结合后可参与细胞中多种非基因型信号通路的调控,并发挥不同的生物学功能。因此,需要进一步研究ERα36介导雌激素对PTC作用的具体信号通路,可为PTC的临床治疗和预后评估提供更多的理论依据。
| [1] | DALAL V, KAUR M, BANSAL A. Papillary carcinoma thyroid with anastomosing channels: An unusual morphology[J]. J Lab Physicians, 2017, 9(2): 140–142. DOI:10.4103/0974-2727.199631 |
| [2] | RAHBARI R, ZHANG L, KEBEBEW E. Thyroid cancer gender disparity[J]. Future Oncol, 2010, 6(11): 1771–1779. DOI:10.2217/fon.10.127 |
| [3] | DERWAHL M, NICULA D. Estrogen and its role in thyroid cancer[J]. Endocr Relat Cancer, 2014, 21(5): T273–283. DOI:10.1530/ERC-14-0053 |
| [4] | PRZYBYLIK-MAZUREK E, HUBALEWSKA-DYDEJCZYK A, FEDOROWICZ A, et al. Factors connected with the female sex seem to play an important role in differentiated thyroid cancer[J]. Gynecol Endocrinol, 2012, 28(2): 150–155. DOI:10.3109/09513590.2011.563909 |
| [5] | WANG Z, ZHANG X, SHEN P, et al. Identification, cloning, and expression of human estrogen receptor-alpha36, a novel variant of human estrogen receptor-alpha66[J]. Biochem Biophys Res Commun, 2005, 336(4): 1023–1027. DOI:10.1016/j.bbrc.2005.08.226 |
| [6] | CHAUDHRI R A, SCHWARTZ N, ELBARADIE K, et al. Role of ERα36 in membrane-associated signaling by estrogen[J]. Steroids, 2014, 81: 74–80. DOI:10.1016/j.steroids.2013.10.020 |
| [7] |
唐萃, 杨磊, 王旎, 等. G蛋白偶联雌激素受体1、表皮生长因子受体和趋化因子受体1在甲状腺乳头状癌中的表达及意义[J].
第三军医大学学报, 2014, 36(12): 1317–1321.
TANG C, YANG L, WANG N, et al. Expression and significance of GPER1, EGFR and CXCR1 in papillary thyroid carcinoma[J]. J Third Mil Med Univ, 2014, 36(12): 1317–1321. |
| [8] |
赵乐, 唐萃, 杨磊, 等. Caveolin-1、GPR30和Vimentin在甲状腺乳头状癌组织中的表达及意义[J].
中国免疫学杂志, 2015, 31(11): 1510–1514.
ZHAO L, TANG C, YANG L, et al. Expression and significance of Caveolin-1, GPR30 and Vimentin in papillary thyroid carcinoma[J]. Chin J Immunol, 2015, 31(11): 1510–1514. DOI:10.3969/j.issn.1000-484X.2015.11.015 |
| [9] | LIN S L, YAN L Y, ZHANG X T, et al. ER-alpha36, a variant of ER-alpha, promotes tamoxifen agonist action in endometrial cancer cells via the MAPK/ERK and PI3K/Akt pathways[J]. PLoS ONE, 2010, 5(2): e9013. DOI:10.1371/journal.pone.0009013 |
| [10] | YIN L, ZHANG X T, BIAN X W, et al. Disruption of the ER-α36-EGFR/HER2 positive regulatory loops restores tamoxifen sensitivity in tamoxifen resistance breast cancer cells[J]. PLoS ONE, 2014, 9(9): e107369. DOI:10.1371/journal.pone.0107369 |
| [11] | CHAUDHRI R A, OLIVARES-NAVARRETE R, CUENCA N, et al. Membrane estrogen signaling enhances tumorigenesis and metastatic potential of breast cancer cells via estrogen receptor-α36 (ERα36)[J]. J Biol Chem, 2012, 287(10): 7169–7181. DOI:10.1074/jbc.M111.292946 |



