2. 400014 重庆,重庆市急救医疗中心:ICU
2. Department of Critical Care Medicine, Chongqing Emergency Medical Center, Chongqing, 400014, China
百草枯(paraquat, PQ)是广泛应用于发展中国家农村的一种除草剂,误食、服毒往往引起严重的药物中毒,大多数中毒患者由消化道吸收。该病具有发病时间早、进展快、致死量低、病死率高的特点,患者常因严重的全身炎症反应以及不可逆的肺纤维化和全身多脏器功能衰竭(mul-tiple organ failure,MOF)而死亡[1]。而炎症反应是PQ中毒最终导致肺纤维化和MOF的多个病理过程的核心中间环节[2],目前在临床中对于救治PQ中毒的药物主要集中于免疫抑制剂,但效果不够理想[3]。近年来胆碱能抗炎通路(cholinergic ant-iinflammtory pathway,CAP)受到研究者关注,胆碱酯酶抑制剂甲硫酸新斯的明可以增加内源性乙酰胆碱从而激活胆碱能抗炎通路,抑制炎性细胞因子的释放,发挥抗炎作用[4]。
在炎症反应的细胞因子变化过程中,细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)可能扮演重要作用,SOCS通过对非受体酪氨酸蛋白激酶信号转导途径中的JAK/信号转导和转录激活因子信号转导途径(Janus kinase/signal transducers and activators of transcription,JAK/STAT)的抑制,限制细胞因子的强度和作用时间[5]。但在胆碱能抗炎通路抑制百草枯中毒动物炎症反应的过程中,SOCS是否参与作用,尚少见相关报道。
我们之前在部分临床病例观察发现应用新斯的明的患者有更轻的炎症反应和更好的预后[6],在此基础上本研究通过动物实验进一步验证并初步探讨其可能机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂及仪器甲硫酸新斯的明(上海信谊金朱药业有限公司;批号:国药准字H31022770;规格:2 mL:1 mg),20%百草枯可溶胶剂(南京红太阳生物化学有限责任公司,农药登记证PD20131912),TRIzol(美国Invitrogen公司),Prime-Script®RT reagent kit with gDNA Eraser及SYBR®Premix Ex TaqTM(美国TaKaRa公司)。实时定量PCR试剂盒购自Bio-Rad公司,实时定量PCR反应管和反应仪器为美国Bio-Rad公司产品,RNA提取应用TRIzol试剂盒及反转录酶试剂盒(SuperscriptⅡ)购自美国Gibco公司,引物由上海生工公司合成。
1.1.2 实验动物成年SD大鼠96只,雌雄不拘。购于重庆医科大学实验动物中心。室温下自由进食普通饲料,正常饮水。
1.2 方法 1.2.1 百草枯中毒模型及分组20%百草枯可溶胶剂按照说明书用生理盐水稀释成百草枯浓度为20 g/L的水溶液。动物按随机数字法分为3组,每组32只。新斯的明组(NES组):腹腔注射PQ水溶液20 mg/kg后2 h腹腔注射新斯的明300 μg/kg;PQ组:腹腔注射PQ水溶液20 mg/kg后2 h腹腔注射生理盐水300 μg/kg;对照组:以等量生理盐水代替PQ溶液腹腔注射。
1.2.2 血清TNF-α、IL-6、IL-10的检测各组大鼠在注射前及注射后6、24、72 h取血,ELISA检测血清中TNF-α、IL-6、IL-10水平,检测步骤严格按照试剂盒说明书进行操作。
1.2.3 大鼠肺组织病理学观察各组大鼠在注射前及注射后6、24、72 h选未死亡大鼠分批处死,取左上肺组织,于10%甲醛溶液浸泡后石蜡包埋,制4 μm厚切片,HE染色后光镜下观察。
1.2.4 局部肺组织中TNF-α、IL-6、IL-10的检测取1.2.3中各时间点处死的大鼠右肺组织300 mg称质量后匀浆,离心后取上清液,ELISA检测肺组织中TNF-α、IL-6、IL-10水平,操作步骤同1.2.2。
1.2.5 大鼠肺湿/干质量测定取1.2.3中各时间点处死的大鼠肺组织,称量湿质量(W)后,再置于70 ℃烤箱中24 h烤至恒重,称其干质量(D),计算肺组织湿干质量比(W/D)。
1.2.6 qPCR检测肺组织SOCS1和SOCS3 mRNA表达取1.2.3中各时间点处死的大鼠肺组织,异硫酸氰胍一步法提取组织总RNA,步骤按试剂盒操作说明书进行,提取的总RNA定量并经电泳鉴定合格后进行实时定量PCR检测。应用Primer premier 5.0软件设计PCR引物,由上海生工合成。SOCS1引物序列:正向5′-TGGTAGCACGTAACCAGGTG-3′,反向5′-CG-CTGGTCCGCGTGATG-3′,产物长度216 bp;SOCS3引物序列:正向5′-CTGCCTGCCCCACTCTG-3′,反向5′-CT-GGACCCATTCGGGAGTTC-3′,产物长度210 bp;GAPDH引物序列:正向5′-TGGTGAAGGTCGGTGTGAAC-3′,反向5′-ACCAGCTTCCCATTCTCAGC-3′,产物长度196 bp。紫外分光光度计测总RNA的纯度及含量。qPCR扩增的条件及参数为95 ℃预变性5 min; 95 ℃变性15 s; 60 ℃退火,20 s; 72 ℃延伸400 s; 共40个循环; 末端延伸45 ℃→95 ℃,每1 s升温0.1 ℃。
1.3 统计学分析计量资料用x±s表示,多组间比较用方差分析,两两比较使用SNK-q检验,检验水准α=0.05。
2 结果 2.1 动物存活情况至注射后24 h各组均无大鼠死亡,注射后72 h,PQ组有1只大鼠死于呼吸衰竭,解剖可见死亡大鼠肺组织呈现严重的急性肺损伤表现,肺间质内出现大量炎性细胞,并开始有成纤维细胞增生,符合百草枯中毒致死特征。
2.2 大鼠血清TNF-α、IL-6、IL-10水平PQ染毒后大鼠血清TNF-α水平迅速升高,显著高于对照组(P < 0.05)。在24 h达到高峰,而到72 h时有所下降。NES组大鼠血清TNF-α水平变化趋势类似,但在6、24、72 h 3个时间点上均低于PQ组,差异有统计学意义(P < 0.05)。PQ染毒后大鼠血清IL-6水平也显著高于对照组(P < 0.05), 至72 h时仍未下降。NES组大鼠PQ染毒后血清IL-6水平也显著高于对照组(P < 0.05),但在24、72 h两个时间点上低于PQ组(P < 0.05)。血清IL-10水平在PQ染毒后升高幅度较小,但仍然高于对照组(P < 0.05), 而NES组的IL-10水平在6、24、72 h时间点上高于PQ组(P < 0.05)。见表 1。
| 组别 | 时间 | TNF-α | IL-6 | IL-10 |
| 对照组 | 0 h | 43.4±2.6 | 76.4±6.3 | 34.2±2.9 |
| 6 h | 44.8±3.1 | 77.1±7.2 | 30.7±3.2 | |
| 24 h | 42.0±5.6 | 76.8±10.8 | 31.4±4.7 | |
| 72 h | 45.2±7.2 | 73.5±8.4 | 33.8±6.9 | |
| PQ组 | 0 h | 45.0±4.2 | 74.8±5.3 | 30.2±3.8 |
| 6 h | 94.3±19.8a | 94.3±9.3a | 37.0±4.1a | |
| 24 h | 187.5±34.3a | 179.5±42.3a | 41.2±5.6a | |
| 72 h | 154.2±28.9a | 378.5±58.2a | 65.8±8.4a | |
| NES组 | 0 h | 46.0±5.3 | 78.0±7.3 | 33.0±4.1 |
| 6 h | 71.8±10.4 ab | 89.2±10.4 | 58.9±6.7ab | |
| 24 h | 118.0±16.8ab | 129.4±15.6ab | 69.1±7.7ab | |
| 72 h | 97.8±34.2ab | 278.5±37.7ab | 89.2±11.4ab | |
| a: P < 0.05, 与对照组比较;b:P < 0.05, 与PQ组比较 | ||||
2.3 大鼠肺组织TNF-α、IL-6、IL-10水平
PQ染毒后,大鼠肺组织TNF-α、IL-6、IL-10水平均较对照组显著升高。但NES组TNF-α、IL-6水平低于PQ组(P < 0.05),而NES组在6、24、72 h 3个时间点上IL-10水平高于PQ组。见表 2。
| 组别 | 时间 | TNF-α | IL-6 | IL-10 |
| 对照组 | 0 h | 2.14±0.14 | 3.23±0.11 | 1.27±0.09 |
| 6 h | 2.09±0.19 | 3.41±0.15 | 1.29±0.08 | |
| 24 h | 2.31±0.28 | 3.37±0.20 | 1.35±0.12 | |
| 72 h | 2.25±0.41 | 3.12±0.32 | 1.25±0.10 | |
| PQ组 | 0 h | 2.20±0.11 | 3.28±0.17 | 1.30±0.04 |
| 6 h | 6.98±0.51a | 3.91±0.11a | 1.75±0.09a | |
| 24 h | 12.11±1.24a | 9.31±1.87a | 2.78±0.15a | |
| 72 h | 9.17±1.80a | 12.3±4.28a | 4.16±0.88a | |
| NES组 | 0 h | 2.30±0.14 | 3.39±0.31 | 1.26±0.12 |
| 6 h | 5.30±0.62ab | 3.78±0.87 | 2.47±0.84ab | |
| 24 h | 8.27±1.22ab | 6.75±0.96ab | 4.22±1.01ab | |
| 72 h | 6.09±1.40ab | 8.22±2.55ab | 5.19±1.55ab | |
| a: P < 0.05, 与对照组比较;b:P < 0.05, 与PQ组比较 | ||||
2.4 各时间点肺组织病理学观察
PQ组和NES组大鼠肺组织在染毒后24 h时开始出现炎症反应,但肺组织形态基本正常,肺泡间隔内可见炎性细胞浸润,肺泡间隔开始出现局部断裂。NES组病理改变似乎略轻于PQ组,但差别不明显。至染毒后72 h,PQ组肺组织明显充血,肺泡腔及肺泡间隔内出现大量的炎性细胞。肺泡间隔断裂,出现肺大泡;NES组肺组织也呈现明显的充血和炎性细胞以及肺泡间隔断裂,但病变程度明显较PQ组轻,见图 1。
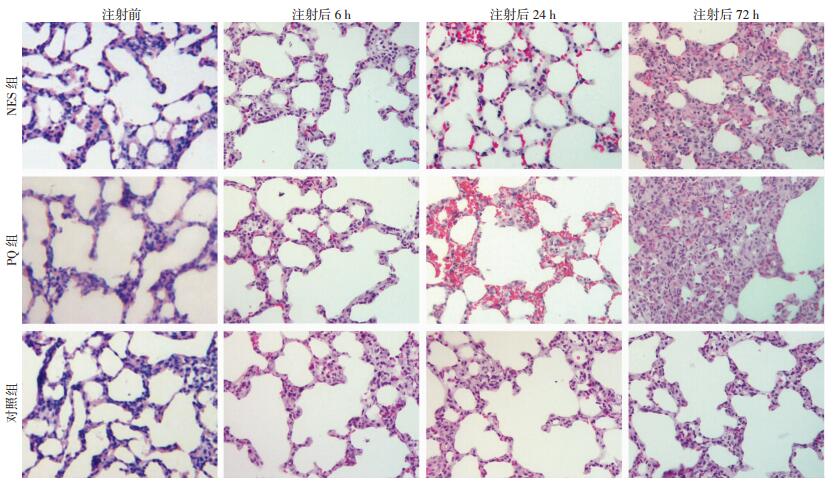
|
| 图 1 3组大鼠不同时间肺组织病理学观察(HE ×400) |
2.5 大鼠肺组织湿干质量比(W/D)变化
染毒后,大鼠肺组织湿干质量比显著高于对照组(P < 0.05), NES组大鼠肺湿干质量比在6 h时与PQ组差异无统计学意义,但在24、72 h时均显著低于PQ组(P < 0.05),见表 3。
| 组别 | 0 h | 6 h | 24 h | 72 h |
| 对照组 | 3.71±0.19 | 3.87±0.23 | 4.10±0.38 | 3.96±0.40 |
| PQ组 | 3.92±0.11 | 4.26±0.31a | 5.51±0.57a | 5.90±0.61a |
| NES组 | 3.80±0.27 | 4.19±0.46a | 4.77±0.49ab | 4.88±0.53ab |
| a: P < 0.05, 与对照组比较;b:P < 0.05, 与PQ组比较 | ||||
2.6 肺组织SOCS1和SOCS3 mRNA表达水平
染毒后,PQ组和NES组大鼠SOCS1、SOCS3 mRNA表达升高,均在染毒后72 h时有所回落,与对照组相比,差异有统计学意义(P < 0.05)。NES组SOCS1 mRNA表达水平与PQ组比较,差异无统计学意义。但是与PQ组比较,NES组SOCS3 mRNA的表达水平更高,差异有统计学意义(P < 0.05)。见图 2。
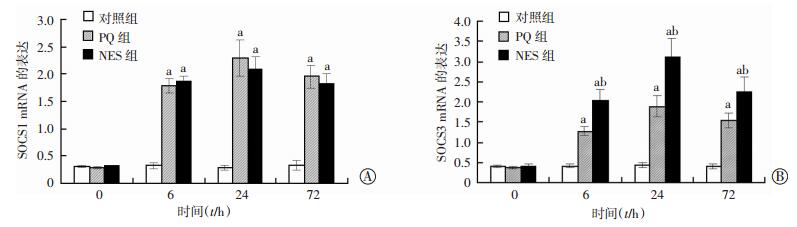
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与PQ组比较 图 2 3组大鼠不同时间点SOCS1(A)和SOCS3 (B)mRNA表达水平的变化(n=32, x±s) |
3 讨论
百草枯是在我国广泛应用的一种除草剂,我国每年均有大量因误食、服毒自杀中毒的患者。百草枯中毒起病急、病死率高、预后差。因为缺乏特效药,目前对百草枯中毒的救治主要围绕抗炎、抗纤维化、免疫抑制、抗氧化等方面进行,效果不尽人意且缺乏足够的试验和临床依据[7]。百草枯口服后除了引起消化道糜烂出血外,最主要的是导致全身多脏器的损害、全身性炎症反应,尤其是造成急性肺损伤以后不可逆的肺纤维化。中毒早期的严重全身性炎症反应和急性肺损伤是其致死的主要原因,而肺纤维化既是PQ引起肺损伤的最终结局,也是后期PQ中毒的主要死因。全身性炎症反应和急性肺损伤既是百草枯中毒直接的致死原因,也是后续发生不可逆肺纤维化的重要因素,其在百草枯中毒的病理生理过程中有着重要作用。肺泡炎是肺纤维化形成的病理基础和前奏,肺部炎症导致了肺泡持续性损伤及细胞外基质(extra-cellular matrix,ECM)的反复破坏、修复、重建和过度沉积[8]。胆碱能抗炎途径已得到众多研究证实。用胆碱酯酶抑制剂提高机体内乙酰胆碱浓度可以激活胆碱能抗炎途径,减轻全身性炎症反应[9]。而且我们在之前的临床研究中也观察到应用了胆碱酯酶抑制剂新斯的明的PQ中毒患者有着更轻的全身炎症反应和更好的预后[6]。本研究在此基础上进一步在动物实验上探讨新斯的明对减轻PQ中毒大鼠全身炎症反应和肺损伤的作用并初步探讨其机制。
SOCS是一系列能抑制细胞因子传导的蛋白质,通过抑制JAK/STAT途径对细胞因子的生成进行负反馈调节,即细胞因子刺激SOCS的产生,而提高了的SOCS又能通过JAK/STAT途径将细胞因子的强度和作用时间限制在一定范围内[10]。已有研究发现,在全身严重感染性疾病中,组织细胞中的SOCS1、SOCS3表达增高[10-13],但是PQ中毒导致的全身性炎症反应是否也存在SOCS1、SOCS3的表达变化,以及胆碱能抗炎途径是否涉及该信号通路尚少见相关报道,因此我们通过观察大鼠PQ中毒以及应用新斯的明之后的部分炎症因子和SOCS1、SOCS3的表达变化,尝试初步探索胆碱能抗炎途径在PQ中毒导致的全身和肺部炎症中的作用和可能相关的信号途径。
本研究结果发现,染毒6 h后大鼠肺组织病理学变化尚不明显。至24 h时,开始出现明显的炎症反应,肺泡毛细血管明显扩张,肺泡间隔内可见炎性细胞浸润,肺泡间隔开始出现局部断裂。染毒72 h后,大鼠肺组织明显充血,有着更加广泛的弥漫性渗出,肺泡腔及肺泡间隔内出现大量的炎性细胞。肺泡间隔断裂,出现肺大泡,并且开始出现间质纤维化样变。病理改变符合PQ急性中毒大鼠的特征[14]。而且其中NES组肺组织炎症损伤病理学变化比PQ组轻,尤其是72 h区别比较明显。染毒后PQ组和NES组大鼠肺湿干质量比显著上升,而NES组24、72 h时的肺湿干质量比低于PQ组,表明NES能有效减少肺组织液体渗出从而降低肺组织含水量。以上结果表明新斯的明能够减轻PQ中毒大鼠的肺组织炎症损伤,对大鼠肺组织具有保护作用。而我们前期临床研究也发现,运用新斯的明的患者肺损伤评分要低于常规组[6],这一结果也能与之互相印证。
胆碱能抗炎途径主要由乙酰胆碱结合巨噬细胞表面的乙酰胆碱受体α7nAChR,从而抑制NF-κB的核转运,并且激活JAK/STAT3通路[15],进而下调TNF-α、IL-1β、IL-6、NO等早期促炎因子的表达,但对IL-4、IL-10等抗炎因子却无抑制作用[15-16]。因此,该炎症反射和抗炎因子可协同抑制炎症的发展。本研究结果显示,染毒后NES组大鼠的血清和肺组织TNF-α、IL-6均显著低于PQ组,而IL-10水平却高于PQ组。显示新斯的明可以减少PQ中毒大鼠TNF-α、IL-6炎性介质的合成,而对抗炎因子IL-10却无影响,符合胆碱能抗炎途径的特点。
正常状态下,动物体内SOCS家族的表达非常微弱,而感染性全身炎症反应时,受细胞因子、内毒素等的刺激,SOCS1、SOCS3 mRNA表达均显著升高[17]。本研究发现PQ中毒大鼠体内的SOCS1、SOCS3 mRNA表达也显著升高,由此可以推测,非感染性的炎症也可以促进其表达,可能细胞因子在其中发挥了主要作用。且本研究结果显示,对PQ中毒大鼠注射新斯的明后SOCS1表达变化差异不显著,而SOCS3表达明显升高。因此推测,可能新斯的明发挥的抗炎作用是抑制胆碱酯酶之后升高的乙酰胆碱浓度与细胞膜上相应受体结合使得SOCS3表达增多,进而通过JAK/STAT信号通路抑制促炎因子的合成与释放。
本研究观察到了新斯的明对PQ中毒大鼠全身炎症反应和肺损伤的抑制作用,并且观察到了SOCS1/SOCS3 mRNA表达的变化,为胆碱能抗炎途径在PQ中毒救治中的应用提供了一定的依据,初步探讨了其可能的机制。但对于其发挥抗炎效应涉及的信号通路具体环节还未涉及,有待进一步研究。
| [1] |
李海军, 赵兴勤, 谷琳琳, 等. 急性百草枯中毒的研究和治疗进展[J].
医学综述, 2012, 18(2): 264–266.
LI H J, ZHAO X Q, GU L L, et al. Progress of the research and treatment in acute paraquat poisoning[J]. Med Recapitul, 2012, 18(2): 264–266. DOI:10.3969/j.issn.1006-2084.2012.02.037 |
| [2] | XIE H, WANG R, TANG X, et al. Paraquat-induced pulmonary fibrosis starts at an early stage of inflammation in rats[J]. Immunotherapy, 2012, 4(12): 1809–1815. DOI:10.2217/imt.12.122 |
| [3] |
菅向东, 刘会敏, 张伟, 等. 百草枯中毒救治"齐鲁方案"[C]. 第十三届全国劳动卫生与职业病学术会议论文集, 2014: 91-91.
JIAN X D, LIU H M, ZHANG W, et al. Qilu Scheme on diagnoses and treatment in acute paraquat poisoning[C]. Proceedings of the 13th National Conference on Labor Hygiene and Occupational Diseases of China, 2014: 91-91. |
| [4] | LIU Z, WANG Y, WANG Y, et al. Dexmedetomidine attenuates inflammatory reaction in the lung tissues of septic mice by activating cholinergic anti-inflammatory pathway[J]. Int Immunopharmacol, 2016, 35: 210–216. DOI:10.1016/j.intimp.2016.04.003 |
| [5] | HANADA T, KINJYO I, INAGAKI-OHARA K, et al. Negative regulation of cytokine signaling by CIS/SOCS family proteins and their roles in inflammatory diseases[J]. Rev Physiol Biochem Pharmacol, 2003, 149(1): 72–86. DOI:10.1007/s10254-003-0015-z |
| [6] |
吴燕燕, 黄健, 罗杰, 等. 甲硫酸新斯的明对百草枯中毒的疗效观察[J].
第三军医大学学报, 2017, 39(15): 1578–1581.
WU Y Y, HUANG J, LUO J, et al. Clinical efficiency of neostigmine methylsulfate for treatment of paraquat poisoning[J]. J Third Mil Med Univ, 2017, 39(15): 1578–1581. DOI:10.16016/j.1000-5404.201611256 |
| [7] |
百草枯中毒诊断与治疗"泰山共识"专家组, 菅向东. 百草枯中毒诊断与治疗"泰山共识"(2014)[J].
中国工业医学杂志, 2014, 27(2): 117–119.
Professional Group of "Taishan" Expert Consensus on diagnoses and Treatment in Acute Paraquat Poisoning, JIAN X D. "Taishan" Expert Consensus on diagnoses and treatment in acute paraquat poisoning[J]. Chin J Industr Med, 2014, 27(2): 117–119. |
| [8] |
田莉, 高路杨, 唐军栋, 等. 基因芯片技术在肺纤维化研究中的应用[J].
工业卫生与职业病, 2013(2): 118–120.
TIAN L, GAO L Y, TANG J D, et al. Application of gene chip technology in pulmonary fibrosis[J]. Industr Health Occup Dis, 2013(2): 118–120. |
| [9] |
石星星, 姚建华, 王成, 等. α7烟碱型乙酰胆碱受体激动剂通过抑制核转录因子-κB活化可减轻脂多糖诱导的巨噬细胞炎症反应[J].
中华危重病急救医学, 2017, 29(4): 300–305.
SHI X X, YAO J H, WANG C, et al. α7 nicotinic acetylcholine receptor agonist attenuated the lipopolysaccharide-induced inflammatory response via inhibiting the activation of nuclear factor-κB[J]. Chin Crit Care Med, 2017, 29(4): 300–305. DOI:10.3760/cma.j.issn.2095-4352.2017.04.003 |
| [10] | GRUTKOSKI P S, CHEN Y, CHUNG C S, et al. Sepsis-induced SOCS-3 expression is immunologically restricted to phagocytes[J]. J Leukoc Biol, 2003, 74(5): 916–922. DOI:10.1189/jlb.0303108 |
| [11] | REICHARD A C, CHEEMARLA N R, BIGLEY NJ. SOCS1/3 expression levels in HSV-1-infected, cytokine-polarized and -unpolarized macrophages[J]. J Interferon Cytokine Res, 2015, 35(1): 32–41. DOI:10.1089/jir.2013.0070 |
| [12] | ALSTON C I, DIX R D. Murine cytomegalovirus infection of mouse macrophages stimulates early expression of suppressor of cytokine signaling (SOCS)1 and SOCS3[J]. PLoS ONE, 2017, 12(2): e0171812. DOI:10.1371/journal.pone.0171812 |
| [13] | ELLIOTT J, JOHNSTON J A. SOCS: role in inflammation, allergy and homeostasis[J]. Trends Immunol, 2004, 25(8): 434–440. DOI:10.1016/j.it.2004.05.012 |
| [14] |
支巧明, 孙海晨, 钱晓明, 等. 百草枯中毒致大鼠肺损伤病理模型的实验研究[J].
医学研究生学报, 2008, 21(2): 134–136.
ZHI Q M, SUN H C, QIAM X M, et al. Experimental study on the pathological rat modelof paraquat-induced acute lung injury and pulmonary fibrosis[J]. J Med Postgrad, 2008, 21(2): 134–136. |
| [15] | DE JONGE W J, VAN DER ZANDEN E P, THE F O, et al. Stimulation of the vagus nerve attenuates macrophage activation by activating the Jak2-STAT3 signaling pathway[J]. Nat Immunol, 2005, 6(8): 844–851. DOI:10.1038/ni1229 |
| [16] | STERNBERG E M. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens[J]. Nat Rev Immunol, 2006, 6(4): 318–328. DOI:10.1038/nri1810 |
| [17] | LIU X, LI J, PENG X, et al. Geraniin Inhibits LPS-Induced THP-1 Macrophages Switching to M1 Phenotype via SOCS1/NF-κB Pathway[J]. Inflammation, 2016, 39(4): 1421–1433. DOI:10.1007/s10753-016-0374-7 |



