骨缺损在临床相当常见,骨骼是仅次于血液用于移植最多的组织[1],同时对于各种原因引起的大段骨缺损的修复与重建,仍然是个难题。当前,采用自体骨是骨组织移植的金标准[2]。但是其缺点也明显,比如疼痛以及供体部位病变感染。同种异体和异种骨移植物也有少量应用,但需要进行脱细胞处理以降低其免疫原性,从而大大降低其成骨诱导特性。组织工程与再生医学的快速发展为临床骨缺损治疗提供了新的策略,其中在种子细胞的选择上,目前主要使用干细胞,如骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)、脂肪干细胞(adipose-derived stem cells,ADSCs),其作用机制主要为膜内成骨。另一种重要的成骨途径即软骨内成骨,是在软骨雏形的基础上逐渐成骨。YANG等[3]研究发现肥大软骨细胞有分化为成骨细胞能力,同时作者在研究过程中也发现软骨细胞在骨缺损部位成骨能力比较强,因此提出假设可以使用软骨细胞作为种子细胞用于骨组织缺损的修复,若此假设成立,则该方法将具有良好的临床应用前景。医师可直接在手术室中完成自体细胞提取并植入受损部位。检索中外文献,有关软骨细胞修复骨缺损的研究较少。本研究以同种异体软骨细胞作为种子细胞,海藻酸盐水凝胶作为支架结构对SD大鼠颅骨缺损模型进行修复重建,初步验证软骨细胞在骨缺损中的修复作用。
1 材料与方法 1.1 实验动物及主要试剂、仪器2月龄健康雄性SD大鼠12只,体质量310~363 g,由第三军医大学动物实验中心提供。实验方案经由第三军医大学西南医院动物实验管理委员会批准。实验中所需制备的细胞:SD大鼠乳鼠膝关节软骨分离培养获得第2代软骨细胞,按文献[4-5]方法制备。试剂:番红O、固绿染色剂(Sigma公司,美国);HE染色剂(北京索莱宝公司);海藻酸钠(Sigma公司,美国);DMEM培养基(GBICO公司,美国);EDTA、CaCl2(上海生工生物工程公司)。仪器:光学显微镜(Olympus公司,日本);图像采集软件及分析处理软件(Bruker公司,比利时);Micro-CT(Bruker公司,比利时)。
1.2 软骨细胞分离和培养取新生3 d龄SD大鼠乳鼠2只,颈椎脱臼法处死后无菌条件取双侧膝关节胫骨平台及股骨内外侧髁软骨组织,PBS漂洗后用手术刀将软骨组织切碎约1 mm× 1 mm×1 mm大小,PBS漂洗3次,放入2.5%胰蛋白酶中消化30 min,置入盛有10 mL含3 mg/mL Ⅱ型胶原酶的DMEM培养基的培养皿中过夜,用70 μm孔径细胞滤器过滤消化液获得软骨细胞团,PBS漂洗后并再次过滤,将细胞团置入DMEM混悬后转至100 mL培养瓶,在37 ℃、5% CO2培养箱培养,每3天换液。当细胞生长至90%~100%融合时,加入0.25%胰蛋白酶2 mL消化,按1:2传代,取第2代细胞备用。
1.3 软骨细胞-海藻酸钠水凝胶制备以PBS为溶剂配制质量分数为0.5%的海藻酸钠溶液,搅拌溶解后静置除去气泡。取培养好的第2代软骨细胞以1×106/mL加入海藻酸钠溶液中,轻柔吹打混合均匀。取混合溶液,用4号针头滴入到2% CaCl2溶液中,静置15 min凝胶微球成形后滤出,PBS漂洗后置入含DMEM的6孔板中备用[6]。单纯海藻酸盐水凝胶微球按上述方法制备,不加入软骨细胞(图 1)。

|
| ▲:示单纯海藻酸钠水凝胶;△:示软骨细胞复合海藻酸钠水凝胶 图 1 海藻酸钠水凝胶微球制备图 |
1.4 颅骨缺损动物模型的建立和分组
取2月龄健康雄性SD大鼠12只,按照随机分组方法分为实验组和对照组(n=6),称质量后用4%水合氯醛按1 mL/100 g剂量行腹腔麻醉,备皮消毒后在颅骨顶做一长约2.5 cm正中纵切口,暴露术区,用直径5 mm圆形孔钻在顶骨矢状缝一侧做一个直径为5 mm全层缺损,钻孔过程中用冷藏生理盐水持续冲洗[7]。实验组与对照组分别于缺损区植入软骨细胞-海藻酸钠水凝胶及单纯海藻酸钠水凝胶微球。充分止血后缝合切口,肌注抗生素,术后第2、4天追加抗生素。
1.5 检测指标 1.5.1 一般情况术后6周内观察动物的饮食、手术切口、运动及精神活力状况,如出现死亡需要记录死亡原因。
1.5.2 大体观察术后6周采用CO2窒息法处死实验大鼠,切开头皮,暴露颅骨实验区域,取下整块头盖骨标本,观察颅骨缺损部位的大体修复情况。
1.5.3 Micro-CT扫描检测取术后6周两组标本进行Micro-CT扫描观察。① 将标本放置于4%多聚甲醛固定12 h,PBS适当冲洗,去掉颅骨周围多余的筋膜组织(如近期不能扫描,将标本储存在70%酒精或是PBS中-20 ℃保存)。② 将标本放于含PBS的10 mL离心管,设置扫描参数,电压50~70 kV,电流115~150 μA,为精确测量骨小梁结构的密度变化,像素值设置为10 μm,层距为10 μm,扫描过程耗时约1 h。③ 利用SkyScan 3D软件将连续扫描后的断层图像进行三维重建。④ 感兴趣区域(ROI)的选择:以颅骨圆形缺损圆心为中点,创建一个直径5 mm、高1 mm的圆柱形ROI,能够包含整个缺损部位。图像分析处理软件自动生成每个标本感兴趣区域的相应数据,包括骨组织体积分数(trabecular bone volume, Bv/Tv)、骨矿物质密度(bone mineral density, BMD)、骨小梁数目(trabecular number, Tb.N.)。
1.5.4 组织学观察取上述标本4%多聚甲醛固定12 h,PBS漂洗后进行EDTA脱钙,针刺测试脱钙完成后常规石蜡包埋切片,厚度为5 μm,行番红O/固绿、HE染色,观察缺损部位新生成骨细胞形态及分布,胶原纤维合成与分布情况。
1.6 统计学方法采用SPSS 17.0统计软件,数据以x± s表示,采用t检验。
2 结果 2.1 一般情况术后6周内没有发生动物死亡、病变情况,大鼠饮食、活动良好,手术切口已完全愈合,无红肿开裂及植入物排出现象。
2.2 大体观察术后6周实验组缺损已基本修复完全,新生组织与周围骨组织界限清楚,表面光滑无塌陷或碎裂,质地较硬接近新生骨组织;对照组缺损明显,周围为不规则骨和纤维结缔组织(图 2)。实验组中有4例标本实现完全修复,2例尚未完全修复,残留有微小孔隙;对照组标本均表现明显缺损,只在缺损边缘出现了少量不规则的新生骨及纤维结缔组织。两组修复效果差异明显。

|
| 图 2 术后6周单纯海藻酸钠凝胶对照组(A)与软骨细胞复合海藻酸钠凝胶实验组(B)标本大体情况 |
2.3 Micro-CT扫描检测
Micro-CT扫描观察可以见到,术后6周实验组缺损区内由大量新生骨小梁填充,与周围宿主骨整合良好,其密度略低于正常骨组织;对照组缺损区内大面积仍然为空洞,仅在缺损边缘出现少量新生骨小梁,形成不规则骨(图 3)。输入图像分析软件后显示,Bv/Tv、BMD、Tb.N.数值实验组(n=6) 分别为(28.34±5.53)、(335.36±53.52)、(2.39±1.12),对照组(n=6) 分别为(7.80±3.61)、(104.95±34.54)、(0.82±0.29),实验组数值均明显高于对照组,差异有统计学意义(P < 0.01)。
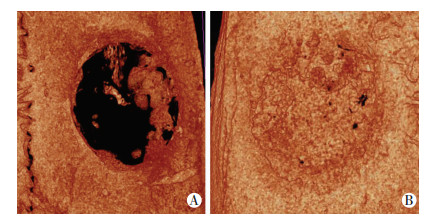
|
| 图 3 术后6周单纯海藻酸钠凝胶对照组(A)与软骨细胞复合海藻酸钠凝胶实验组(B)标本Micro-CT三维重建 |
2.4 组织学观察
术后6周实验组显示出较好的骨缺损修复效果,成骨明显,修复区域完整且连续,其内可见大量成骨细胞和新生骨样组织,与周围宿主骨整合良好,出现毛细血管样结构,部分标本显示修复区域保留了软骨样组织,一定程度说明了成骨来源。对照组显示大块明显缺损,边缘有少量新生骨样组织以及较多纤维结缔组织,有炎性细胞出现(图 4)。

|
| ↑:示修复部位 图 4 凝胶植入术后6周2组大鼠颅骨缺损部位组织学观察结果(LM ×40) |
3 讨论
种子细胞、生物活性因子和支架材料是骨组织工程的三大要素[8]。本实验以同种异体软骨细胞作为种子细胞,选择海藻酸钠作为支架材料进行组织工程骨的构建,探讨其对大鼠颅骨临界尺寸骨缺损的修复效果。
临床上各种因素导致的骨缺损比较常见,而骨缺损的修复重建仍然是个难题。研究发现,大鼠颅骨缺损直径达到5 mm即不能实现自我修复[9]。临床上治疗骨缺损主要是使用修补材料,包括自体骨、同种异体骨、异种骨以及人工替代材料[10],由于材料来源有限、免疫排斥反应、成骨能力受限等原因,并不能有效满足临床需求。近年来,骨组织工程技术快速发展,为骨缺损的修复重建提供了新的方案,其主要方法是将机体细胞(比如BMSCs、ADSCs等)分离后体外培养扩增,接种到支架材料上并加入促进成骨的相关生物活性因子,植入到骨缺损区域。种子细胞在体内逐渐增殖、分化、成骨,支架材料也降解被相应组织替代,从而实现骨缺损修复[11]。目前主流的骨组织工程种子细胞主要是使用BMSCs、ADSCs以及IPSC(诱导多功能干细胞)[12],具有较好的修复效果,但是其局限性也比较明显,比如血管化能力较弱,深部组织缺乏充足的养分输送,从而导致成骨较差,以及临床伦理限制。ZHOU等[13]研究发现,软骨细胞在软骨内成骨途径中不仅出现了软骨细胞的肥大、凋亡,进而被成骨细胞所取代,同时也有软骨细胞逐渐分化为成骨细胞的现象,软骨细胞具有成为骨组织工程种子细胞进行骨缺损修复的潜力。
本研究在一定程度上证实了同种异体软骨细胞对SD大鼠颅骨缺损模型具有较好的修复效果,实验组缺损区域内成骨明显,并有多处毛细血管形成。海藻酸钠水凝胶是经典的软骨组织工程支架材料,具有稳定保持软骨细胞表型的作用[14]。软骨细胞的获取可采用自体鼻软骨、肋软骨以及异体软骨等,需要量较小,可进行体外扩增且不需分化培养,临床使用没有伦理冲突。BMSCs以及ADSCs对于营养和氧气要求比较高,作为种子细胞进行骨修复时,处于深部组织的细胞处于乏氧和低养分的状态,容易发生变性、坏死。相对来说,正常生理状态下,软骨细胞即是处于缺血、缺氧的环境,其对氧气及营养的要求相对较低,因此其在缺损区域内存活、增殖及分化的能力较其他种子细胞更强,同时,血管的形成对于深层部位组织成骨更是起到了重要的作用。软骨细胞修复骨缺损的机制可能类似于生长板的软骨内成骨作用,软骨细胞肥大并表达Sox9、Runx2、IHH(印度豪猪蛋白)、X型胶原以及碱性磷酸酶促进了基质钙化、血管化和成骨[2],同时肥大软骨细胞可直接分化为成骨细胞进行缺损修复[15]。
5 mm直径的大鼠颅骨缺损即不能自我修复,本实验术后修复期仅为6周,即出现了实验组较好的缺损修复,与对照组差异明显,说明以软骨细胞作为种子细胞对颅骨缺损进行修复是很有临床应用前景的。尚需要继续探讨该方法的中长期修复效果,尝试进行低浓度细胞接种以及使用异种软骨细胞进行骨缺损修复的研究。
| [1] | GUPTE M J, MA P X. Nanofibrous scaffolds for dental and craniofacial applications[J]. J Dent Res, 2012, 91(3): 227–234. DOI:10.1177/0022034511417441 |
| [2] | BARDSLEY K, KWARCIAK A, FREEMAN C, et al. Repair of bone defects in vivo using tissue engineered hypertrophic cartilage grafts produced from nasal chondrocytes[J]. Biomaterials, 2017, 112: 313–323. DOI:10.1016/j.biomaterials.2016.10.014 |
| [3] | YANG L, TSANG K Y, TANG H C, et al. Hypertrophic chondrocytes can become osteoblasts and osteocytes in endochondral bone formation[J]. Proc Natl Acad Sci USA, 2014, 111(33): 12097–12102. DOI:10.1073/pnas.1302703111 |
| [4] | CRAWFORD A, DICKINSON S C. Chondrocyte isolation, expansion, and culture on polymer scaffolds[J]. Methods Mol Biol, 2004, 238: 147–158. DOI:10.1385/1-59259-428-x:147 |
| [5] | MAN Z, HU X, LIU Z, et al. Transplantation of allogenic chondrocytes with chitosan hydrogel-demineralized bone matrix hybrid scaffold to repair rabbit cartilage injury[J]. Biomaterials, 2016, 108: 157–167. DOI:10.1016/j.biomaterials.2016.09.002 |
| [6] | OLDER Y M O, XIE M, ANDREASSEN J P, et al. Viscoelastic properties of mineralized alginate hydrogel beads[J]. J Mater Sci Mater Med, 2012, 23(7): 1619–1627. DOI:10.1007/s10856-012-4655-x |
| [7] | KUNERT-KEIL C, SCHOLZ F, GEDRANGE T, et al. Comparative study of biphasic calcium phosphate with beta-tricalcium phosphate in rat cranial defects--A molecular-biological and histological study[J]. Anatomischer Anzeiger : official organ of the Anatomische Gesellschaft, 2015, 199: 79–84. DOI:10.1016/j.aanat.2013.12.001 |
| [8] |
杨柳. 加强软骨与骨组织工程中关键技术的应用[J].
中华实验外科杂志, 2005, 22(3): 263–265.
YANG L. Strengthening the application of key techniques in cartilage and bone tissue engineering[J]. Chin J Exp Surg, 2005, 22(3): 263–265. DOI:10.3760/j.issn:1001-9030.2005.03.002 |
| [9] | ISSA J P, GONZAGA M, KOTAKE B G, et al. Bone repair of critical size defects treated with autogenic, allogenic, or xenogenic bone grafts alone or in combination with rhBMP-2[J]. Clin Oral Implants Res, 2016, 27(5): 558–566. DOI:10.1111/clr.12622 |
| [10] | DIMITRIOU R, JONES E, MCGONAGLE D, et al. Bone regeneration: current concepts and future directions[J]. BMC Medicine, 2011, 9: 66. DOI:10.1186/1741-7015-9-66 |
| [11] | DIMITRIOU R, JONES E, MCGONAGLE D, et al. Bone regeneration: current concepts and future directions[J]. BMC Medicine, 2011, 9: 66. DOI:10.1186/1741-7015-9-66 |
| [12] | PAGNI G, KAIGLER D, RASPERINI G, et al. Bone repair cells for craniofacial regeneration[J]. Adv Drug Deliv Rev, 2012, 64(12): 1310–1319. DOI:10.1016/j.addr.2012.03.005 |
| [13] | ZHOU X, VON DER MARK K, HENRY S, et al. Chondrocytes transdifferentiate into osteoblasts in endochondral bone during development, postnatal growth and fracture healing in mice[J]. PLoS Genet, 2014, 10(12): e1004820. DOI:10.1371/journal.pgen.1004820 |
| [14] | LEMOINE D, WAUTERS F, BOUCHEND'HOMME S, et al. Preparation and characterization of alginate microspheres containing a model antigen[J]. International Journal of Pharmaceutics, 1998, 176(1): 9–19. DOI:10.1016/S0378-5173(98)00303-2 |
| [15] | YANG G, ZHU L, HOU N, et al. Osteogenic fate of hypertrophic chondrocytes[J]. Cell Res, 2014, 24(10): 1266–1269. DOI:10.1038/cr.2014.111 |



