细菌感染是人类长期面临的重大威胁。特别是近年来细菌耐药性的增加以及多重耐药细菌的不断出现,以抗生素为代表的抗菌药物的研发和应用已陷入困境[1]。在此情况下,从提高机体自身免疫防御的角度出发,积极寻找新型抗菌药物,对于拓宽细菌感染的解决措施具有重要意义。自噬(autophagy)是指主要存在于细胞内一种“自我吞噬(self-eating)”的效应[2]。既往认为,细胞自噬主要参与对衰老或变性的胞质成分和细胞器的降解,以维持细胞稳态[3]。近来研究表明,自噬还与细胞免疫防御功能密切相关。业已证实,吞噬细胞可通过自噬作用包裹和清除进入胞内的细菌、真菌等病原体,这一效应也被称作抗菌性自噬(antibacterial autophagy)[4-5]。围绕细胞抗菌性自噬效应探索新型的抗菌机制,有可能成为抗菌药物研发的新方向。
青蒿琥酯(artesunate, AS)是具有倍半萜结构的抗疟药青蒿素的衍生物,为现有临床上市药物[6-7]。近年来,有关青蒿素及其衍生物新型药理机制或新适应证的研究日益受到关注。我们课题组前期发现,AS具有良好的体内外抗炎活性,同时能够与抗生素协同,显著增强抗生素对细菌的杀伤活性[8-9]。然而AS自身是否能够直接作用于宿主免疫细胞,通过调节自噬作用而提高细胞的抗菌活性,目前尚不清楚。本研究以小鼠骨髓巨噬细胞为研究对象,观察AS对细胞自噬及杀菌功能的调控作用,为探索AS基于抗菌性自噬效应的药物新适应证开发究奠定实验基础。
1 材料与方法 1.1 实验材料 1.1.1 试剂耗材大肠埃希菌(E.coli, EC)标准株(35218) 购自美国ATCC。AS购自桂林南药,胰蛋白胨、酵母提取物、巨噬细胞集落刺激因子(M-CSF)、钙离子螯合剂乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、还原型谷胱甘肽(GSH)、N-乙酰半胱氨酸(NAC)、细胞裂解剂皂苷(saponin)、3-MA、Ly294002以及LC3B抗体等购自美国Sigma公司。胎牛血清、DMEM高糖培养基和胰酶等细胞培养相关试剂购自GIBCO公司。逆转录试剂盒和SYBR Green荧光定量PCR试剂盒购自日本TOYOBO公司。Atg5抗体购自美国CST公司,F4/80抗体购自美国Abcam公司。CELLROX Deep Green试剂购自美国Molecular probe公司。RIPA细胞裂解液(中)、BCA蛋白浓度测定试剂盒、SDS-PAGE电泳凝胶配制试剂盒、辣根过氧化物酶标记山羊抗兔和山羊抗大鼠IgG(H+L)、GAPDH抗体、蛋白上样缓冲液(5×)以及DAPI(细胞核染液)等购自上海碧云天生物科技有限公司。PBS、10%多聚甲醛溶液购自武汉博士德生物科技有限公司。总RNA提取试剂盒购自北京天根生物科技有限公司。注射用生理盐水购自重庆西南药业股份有限公司。营养琼脂平板购自重庆庞通医疗器械有限公司。细胞培养瓶/孔板、共聚焦培养皿等细胞培养先关耗材购自无锡耐思生物科技有限公司。无酶PCR管、无酶移液器头等购自Axygen公司。
1.1.2 实验动物由北京华阜康生物科技股份有限公司提供无特殊病原体(SPF)级雄性BALB/c小鼠50只[生产许可证号:SCXK(京)2014-0004],6~8周龄,体质量18~20 g,在我中心小动物层流实验室中分笼饲养,自由饮水及进食[使用许可证号:SYXK(渝)2012-0012]。实验经第三军医大学实验动物福利伦理审查委员会批准实施。
1.1.3 主要仪器设备小鼠独立送风隔离笼具(independent ventilation cage, IVC)笼具、超净工作台、CO2孵箱、倒置显微镜、核酸蛋白仪、荧光定量PCR仪、垂直电泳仪、高灵敏度化学发光成像系统、多功能读数仪、细菌菌落计数仪、恒温摇床、激光共聚焦显微镜等。
1.2 实验方法 1.2.1 小鼠骨髓巨噬细胞(bone marrow derived macrophage, BMDM)的分离及体外培养参考前期研究方法进行[11]。主要操作步骤如下:BALB/c小鼠采用颈椎脱臼法处死,置于75%酒精浸泡消毒后取仰卧位置于方盘中,剥离小鼠后肢皮毛,换无菌器械切除后肢并置于生理盐水中,剔除肌肉,在关节处离断股骨,以生理盐水反复冲洗骨髓腔5次,洗涤液收集于50 mL离心管中,4 ℃,1 000 r/min离心5 min。弃上清,换用含10%血清的DMEM培养基重悬细胞,转至T25细胞培养瓶中。用含50 ng/mL M-CSF和10%血清的DMEM细胞培养基在CO2培养箱中培养2 d,去除未贴壁细胞,更换新鲜含50 ng/mL M-CSF和10%血清的DMEM细胞培养基继续培养3 d,待细胞分化为巨噬细胞后进行后续实验。
1.2.2 小鼠BMDM细胞的形态和标志物检测取体外培养的小鼠BMDM细胞,接种于激光共聚焦培养皿中,贴壁培养12 h,10%多聚甲醛固定10 min,5% BSA封闭1 h,加入F4/80的一抗(1:400稀释),4 ℃过夜孵育,PBS洗涤后加入Cy3标记羊抗兔IgG二抗,37 ℃孵育2 h用DAPI染核,激光共聚焦显微镜观察细胞形态和F4/80阳性细胞比例。
1.2.3 大肠埃希菌的体外培养及处理BMDM细胞挑取接种于营养琼脂平板上的大肠埃希菌35218单个菌落,转移至含5 mL LB液体培养基的小三角烧瓶中,37 ℃,250 r/min增菌培养至D(600) 检测值达到0.5~0.8(换算菌液浓度为5×108 CFU/mL)终止增菌,PBS洗涤3次,按照与细胞比例为10:1加入分化后的BMDM细胞中,孵育1h后PBS洗涤细胞3次,同时加入舒氨西林(200 μg/mL)去除剩余的胞外细菌。而后加入AS以及自噬抑制剂,继续培养2 h后洗涤细胞3次,加入0.3% saponin裂解细胞,稀释后取100 μL涂布于营养琼脂平板,过夜孵育后行平板菌落计数。
1.2.4 荧光定量PCR检测自噬基因mRNA表达将经处理后的小鼠BMDM细胞加入1 mL TRIzol裂解液,离心取上清,参照试剂盒说明书提取总RNA。行反转录及Real-time PCR反应,通过2-ΔΔCt的方法计算LC3B和Beclin1基因相对于内参基因β-actin的相对定量比值。PCR引物由上海生工生物有限公司合成,序列如表 1。
| 名称 | 序列 | 长度(bp) |
| β-actin | 上游:5′-GGGAAATCGTGCGTGACATCAAAG-3′ | 180 |
| 下游:5′-CATACCCAAGAAGGAAGGCTGGAA-3′ | ||
| LC3B | 上游: 5′-CGTCCTGGACAAGACCAAGT-3′ | 160 |
| 下游: 5′-ACACTTCGGAGATGGGAGTG-3′ | ||
| Atg5 | 上游: 5′-TTGAGTCAGGACAACGAGGC-3′ | |
| 下游: 5′-GTCCTGTGTGTCTCAGCGAA-3′ | 161 |
1.2.5 Western blot检测自噬相关蛋白的表达
将小鼠BMDM细胞以PBS洗涤2次后,加入1 mL RIPA裂解液,冰上裂解5 min,离心取上清胞浆蛋白样品,采用BCA法行蛋白定量后煮沸处理。将变性后的蛋白经SDS-PAGE电泳分离后转至PVDF膜,5% BSA封闭1 h,加入LC3B、Atg5和内参一抗(1:1 000),4 ℃过夜孵育,洗涤后加入HRP标记的二抗(1:2 000),37 ℃孵育1 h后加入反应液,化学发光曝光处理。
1.2.6 细胞ROS检测小鼠BMDM细胞加入CELLROX Deep Green探针预孵育30 min,PBS洗涤后加入AS或其他活性氧(reactive oxy gen species, ROS)调节剂处理30 min,多功能读数仪检测活细胞胞内ROS水平。
1.3 统计学处理采用SPSS 13.0软件进行统计分析处理。数据以x±s表示。两组组间比较采用独立样本t检验,多组比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 小鼠骨髓巨噬细胞细胞的形态及标志物染色激光共聚焦显微镜检测结果显示,小鼠骨髓细胞经M-CSF刺激培养后,定向增殖分化为BMDM细胞。在第2次换液培养72 h后可观察到大多数细胞均呈梭型,提示贴壁状态良好。同时大部分细胞均为F4/80(巨噬细胞标志物)阳性着色,提示骨髓细胞已分化为巨噬细胞,适宜进行进一步研究(图 1)。
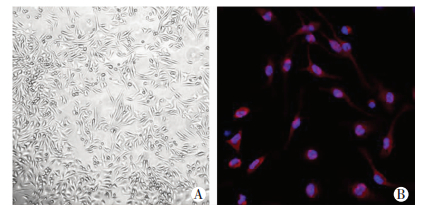
|
| 图 1 小鼠骨髓巨噬细胞形态(A)和标志物F4/80免疫荧光染色(B)变化 |
2.2 青蒿琥酯对骨髓巨噬细胞胞内杀菌活性的影响
为研究AS在体外对BMDM细胞杀菌活性的调节作用,我们将大肠埃希菌标准菌株(ATCC35218) 与BMDM细胞预孵育1 h,而后加入AS处理细胞,观察比较有无AS处理下BMDM细胞的胞内细菌水平是否存在差异。结果显示,不同浓度(1、3和10×104 CFU/mL)的大肠埃希菌感染细胞后,AS均可显著降低BMDM细胞胞内的细菌水平,差异具有统计学意义(P < 0.01)。当感染细菌的浓度固定为10×104 CFU/mL时,BMDM细胞胞内细菌水平随AS药物浓度的升高(5、10和20 μg/mL)和作用时间的延长(2 h)而逐渐降低,差异具有统计学意义(P < 0.01)。上述结果提示AS能够增加BMDM细胞的杀菌活性,进而促进对胞内细菌的清除,且呈现明显的剂量依赖和时间依赖的特点(图 2)。
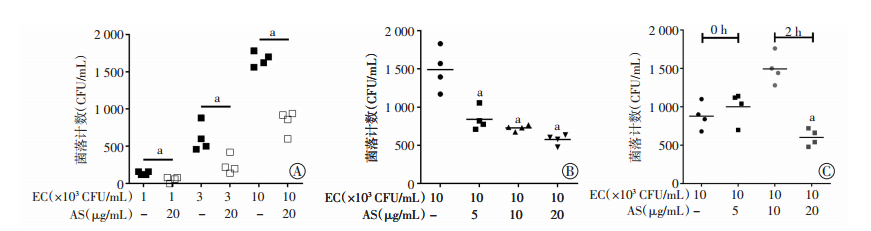
|
| A:不同大肠埃希菌浓度感染后胞内细菌计数变化a: P < 0.01, 与各浓度EC组比较;B:不同AS浓度处理后胞内细菌计数变化a: P < 0.01, 与EC组比较;C:AS处理0 h和2 h后胞内细菌计数变化a: P < 0.01,与EC组2 h比较 图 2 青蒿琥酯对小鼠骨髓巨噬细胞胞内杀菌活性的影响 |
2.3 青蒿琥酯对骨髓巨噬细胞自噬基因/蛋白表达的影响
为明确AS是否可直接影响细胞自噬水平,我们利用RT-PCR和Western blot法对小鼠BMDM细胞自噬基因/蛋白表达进行了检测。结果显示,AS组(2.5、5、10和20 μg/mL)作用于小鼠BMDM细胞后,能够以剂量依赖的方式上调自噬相关蛋白LC3B和Atg5的mRNA表达,当AS浓度超过10 μg/mL后,较medium组差异具有统计学意义(P < 0.01)。Western blot检测结果显示,AS组也可上调LC3Ⅱ/Ⅰ比值,增加Atg5的蛋白表达,且该作用也具有确切的时效(0.5、1和2 h)和量效(5、10和20 μg/mL)关系。上述结果表明,AS能够上调BMDM细胞的自噬水平(图 3、4)。
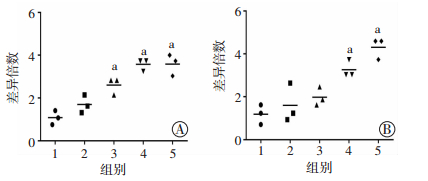
|
| 1:medium组;2:AS 2.5 μg/mL组;3:AS 5 μg/mL组;4:AS 10 μg/mL组;5:AS 20 μg/mL组;a: P < 0.01,与medium组比较;A: AS对LC3B表达的影响;B: AS对Atg5表达的影响 图 3 青蒿琥酯对小鼠骨髓巨噬细胞自噬相关基因表达水平的影响 |
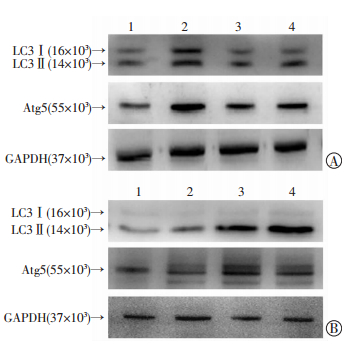
|
| A:AS上调LCⅡ/Ⅰ和Atg5表达的量效关系1:medium组;2:AS 20 μg/mL组;3:AS 10 μg/mL组;4:AS 5 μg/mL组;B:AS上调LCⅡ/Ⅰ和Atg5表达的时效关系1:medium组;2:AS 0.5 h组;3:AS 1 h组;4:AS 2 h组 图 4 青蒿琥酯对骨髓巨噬细胞自噬相关蛋白表达水平的上调作用 |
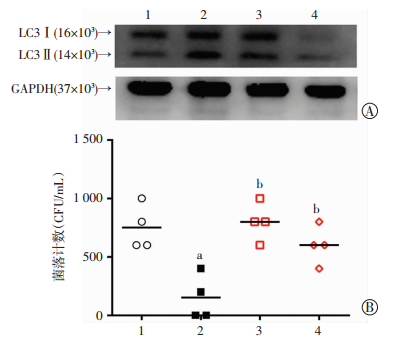
2.4 自噬抑制剂对青蒿琥酯介导大肠埃希菌在骨髓巨噬细胞胞内降解的影响
为明确AS介导细胞自噬水平上调是否与其增强BMDM细胞杀菌活性的效应有关,我们采用自噬抑制剂3-MA(1 mmol/L)和Ly294002(10 μmol/L)与AS共同作用BMDM细胞。结果显示,AS+3-MA和AS+Ly294002组LC3Ⅱ/LC3Ⅰ比值较AS组明显降低,提示自噬水平下降。菌落计数结果也显示,EC+AS组胞内细菌水平较EC组显著降低(P < 0.01),EC+AS+3-MA组和EC+AS+Ly294002组较EC+AS组显著升高(P < 0.01)。上述结果提示,AS介导BMDM细胞杀菌活性的效应可能与其上调细胞自噬水平的作用有关(图 5)。
|
| A:自噬抑制剂对AS上调LCⅡ/Ⅰ表达的影响1:medium组;2:AS组;3:AS+3-MA组;4:AS+Ly294002组;B:自噬抑制剂对AS介导细胞杀菌活性的影响1:EC组;2:EC+AS组;3:EC+AS+3-MA组;4:EC+AS+Ly294002组a: P < 0.01,与EC组比较;b:P < 0.01,与EC+AS组比较 图 5 自噬抑制剂对AS介导BMDM的自噬水平及杀菌活性的影响 |
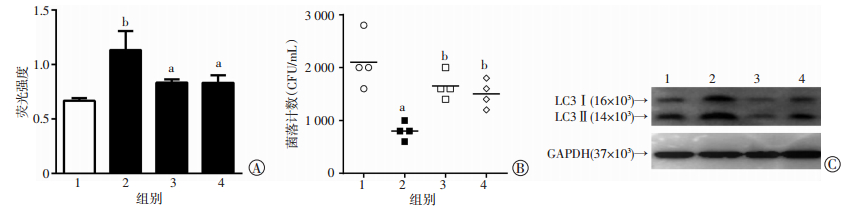
2.5 青蒿琥酯对骨髓巨噬细胞胞内活性氧的上调效应及其在介导抗菌性自噬作用的作用
为进一步探讨AS上调自噬进而介导细胞杀菌作用的可能机制,我们利用ROS的荧光探针检测了细胞ROS水平,结果显示,AS组BMDM细胞的胞内ROS水平较medium组显著升高(P < 0.01)。AS+GSH组或AS+NAC组ROS水平较AS组显著下降(P < 0.05)。细菌菌落检测结果显示,EC+AS组胞内细菌水平较EC组显著降低(P < 0.01),EC+AS+GSH组和EC+AS+NAC组较EC+AS组显著升高(P < 0.01)。上述结果提示AS可能通过上调BMDM细胞的胞内ROS水平,介导抗菌性自噬效应(图 6)。
|
| A:ROS清除剂对细胞ROS水平的影响1:medium组;2:AS组;3:AS+GSH组;4:AS+NAC组;a:P < 0.05,与AS组比较,b:P < 0.01,与medium组比较;B:ROS清除剂对AS诱导细胞自噬水平的影响1:medium组;2:AS组;3:AS+GSH组;4:AS+NAC组;C:RPS清除剂对AS介导细胞杀菌活性的影响1:EC组;2:EC+AS组;3:EC+AS+GSH组;4:EC+AS+NAC组a:P < 0.01,与EC组比较;b:P < 0.01,与EC+AS组比较 图 6 青蒿琥酯对小鼠骨髓巨噬细胞活性氧水平的上调作用以及活性氧清除剂对其介导杀菌活性的影响 |
3 讨论
AS是一种传统的抗疟药物。近年来有关其在调节炎症和免疫反应中的作用日益受到关注[11-12],但AS是否参与对机体抗菌作用的调节,有待进一步研究确认。我们在前期研究中发现AS能够促进小鼠巨噬细胞摄取LPS[13]。在本研究中,我们对其调节巨噬细胞杀菌效应的药理活性进行了探讨。在体外培养的小鼠原代巨噬细胞中,我们观察到AS可显著促进胞内大肠埃希菌的降解,且该作用呈现确切的药理活性特点(时效和量效)。上述结果提示提示AS可能存在一种新型的药理活性,即通过增加单核巨噬细胞的杀菌活性以实现对胞内细菌的清除。
巨噬细胞是机体应对细菌感染的第一道防线。既往认为,巨噬细胞主要通过内体-溶酶体途径发挥抗菌效应。近来研究表明,上调吞噬细胞的自噬水平,可增强其对分枝杆菌和沙门氏菌等胞内细菌的清除作用[14]。由此可见,自噬可能也是介导巨噬细胞杀灭胞内细菌的重要机制,值得进行研究探讨,以助于发现新的抗菌调节分子[15-16]。大肠埃希菌是临床局部和全身性感染最为常见的致病菌之一。近来研究表明,大肠埃希菌除释放毒素造成机体损伤外,还可侵入上皮细胞和单核巨噬细胞等,影响细胞免疫功能或直接造成细胞损伤。因此研究机体针对大肠埃希菌的胞内杀菌机制,有可能为寻找介导大肠埃希菌胞内杀菌的新型药物提供新思路。文献[17]报道,免疫抑制患者注射免疫球蛋白可上调外周血中心粒细胞的自噬水平,进而增加对多重耐药大肠埃希菌的杀灭活性。该结果提示增加细胞的自噬活性可能对细胞杀菌作用有益。AS是否也可上调免疫细胞的自噬水平,目前尚少见研究报道。本研究发现,AS能够直接上调自噬相关蛋白LC3B和Atg5的mRNA表达(P < 0.01),促进自噬体标志物LC3Ⅱ分子的转化。将自噬抑制剂(3-MA和Ly294002) 与AS共同作用于感染大肠埃希菌的BMDM细胞,则细胞自噬水平降低,同时胞内细菌数量恢复到未加AS的水平,表明AS的药理活性受到抑制。该结果提示自噬水平的上调,可能是AS提高巨噬细胞杀菌活性的重要机制。AS含有特殊的过氧桥结构,可在亚铁离子的作用下产生氧自由基[6]。已有研究表明,AS可通过上述作用造成肿瘤细胞的氧化应激,诱导其凋亡或坏死[6]。业已证实,ROS也是调节细胞自噬水平的重要分子机制之一[18]。在本研究中,我们利用荧光探针对胞内ROS水平进行检测,发现AS能够直接上调BMDM细胞的胞内ROS水平(P < 0.01),采用还原性物质GSH和NAC与AS共同作用后,胞内ROS水平较单独AS组显著降低(P < 0.01),同时AS对自噬的上调作用受到抑制,且胞内细菌水平与也恢复到未加AS的水平。以上结果表明AS可能通过上调细胞ROS水平,进而活化细胞的自噬作用并增加其杀菌活性。
综上,本研究对引发细胞抗菌性自噬的调控机制进行了初步研究,发现了AS对小鼠巨噬细胞抗菌作用的上调效应,并证实该作用与其激活ROS,进而上调自噬相关分子的表达和活化有关,上述研究发现AS可能在调节细胞自噬水平以及抗菌免疫反应方面发挥重要作用,因此值得作为有前景的新型抗菌药物进行深入研究。
| [1] | BROWN E D, WRIGHT G D. Antibacterial drug discovery in the resistance era[J]. Nature, 2016, 529(7586): 336–343. DOI:10.1038/nature17042 |
| [2] | RUBINSZTEIN D C, BENTO C F, DERETIC V. Therapeutic targeting of autophagy in neurodegenerative and infectious diseases[J]. J Exp Med, 2015, 212(7): 979–990. DOI:10.1084/jem.20150956 |
| [3] | RYTER S W, CLOONAN S M, CHOI A M. Autophagy: a critical regulator of cellular metabolism and homeostasis[J]. Mol Cells, 2013, 36(1): 7–16. DOI:10.1007/s10059-013-0140-8 |
| [4] | HUANG J, CANADIEN V, LAM G Y, et al. Activation of antibacterial autophagy by NADPH oxidases[J]. Proc Natl Acad Sci USA, 2009, 106(15): 6226–6231. DOI:10.1073/pnas.0811045106 |
| [5] | CADWELL K. Crosstalk between autophagy and inflammatory signalling pathways: balancing defence and homeostasis[J]. Nat Rev Immunol, 2016, 16(11): 661–675. DOI:10.1038/nri.2016.100 |
| [6] | CHOI W H. Novel pharmacological activity of artesunate and artemisinin: their potential as anti-tubercular agents[J]. J Clin Med, 2017, 6(3): pii:E30. DOI:10.3390/jcm6030030 |
| [7] |
娄小娥, 周慧君. 青蒿琥酯的药理和毒理学研究进展[J].
中国医院药学杂志, 2002, 22(3): 47–49.
LOU X E, ZHOU H J. Progression in the pharmacological and toxicological study of aeresunate[J]. Chin Hosp Pharm J, 2002, 22(3): 47–49. DOI:10.3321/j.issn:1001-5213.2002.03.024 |
| [8] | JIANG W, CEN Y, SONG Y, et al. Artesunate attenuated progression of atherosclerosis lesion formation alone or combined with rosuvastatin through inhibition of pro-inflammatory cytokines and pro-inflammatory chemokines[J]. Phytomedicine, 2016, 23(11): 1259–1266. DOI:10.1016/j.phymed.2016.06.004 |
| [9] | LI B, YAO Q, PAN X C, et al. Artesunate enhances the antibacterial effect of {beta}-lactam antibiotics against escherichia coli by increasing antibiotic accumulation via inhibition of the multidrug efflux pump system acrAB-tolC[J]. J Antimicrob Chemother, 2011, 66(4): 769–777. DOI:10.1093/jac/dkr017 |
| [10] |
范仕郡, 祝元锋, 杨永军, 等. AMPK信号通路在调节小鼠骨髓巨噬细胞抗菌性自噬效应中的作用[J].
局解手术学杂志, 2015, 24(6): 591–594.
FAN S J, ZHU Y F, YANG Y J, et al. Role of ampk signaling pathway in regulating antibacterial autophagy in murine bone marrow derived macro-phages[J]. J Region Anat Opera Surg, 2015, 24(6): 591–594. DOI:10.11659/jjssx.09E015136 |
| [11] | WEI C M, LIU Q, SONG F M, et al. Artesunate inhibits RANKL-induced osteoclastogenesis and bone resorption in vitro and prevents LPS-induced bone loss in vivo[J]. J Cell Physiol, 2017. DOI: 10.1002/jcp.25907.[Epubaheadofprint] |
| [12] | ILAMATHI M, SIVARAMAKRISHNAN V. Artesunate acts as fuel to fire in sensitizing HepG2 cells towards TRAIL mediated apoptosis via STAT3 inhibition and DR4 augmentation[J]. Biomedecine & pharmacotherapie, 2017, 88: 515–520. DOI:10.1016/j.biopha.2017.01.086 |
| [13] | LI B, YU M, PAN X, et al. Artesunate reduces serum lipopolysaccharide in cecal ligation/puncture mice via enhanced LPS internalization by macrophages through increased mRNA expression of scavenger receptors[J]. Int J Mol Sci, 2014, 15(1): 1143–1161. DOI:10.3390/ijms15011143 |
| [14] | WILD P, FARHAN H, MCEWAN D G, et al. Phosphorylation of the autophagy receptor optineurin restricts salmonella growth[J]. Science, 2011, 333(6039): 228–233. DOI:10.1126/science.1205405 |
| [15] | LASSEN K G, KUBALLA P, CONWAY K L, et al. Atg16L1 T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense[J]. Proc Natl Acad Sci USA, 2014, 111(21): 7741–7746. DOI:10.1073/pnas.1407001111 |
| [16] | DERETIC V, SAITOH T, AKIRA S. Autophagy in infection, inflammation and immunity[J]. Nat Rev Immunol, 2013, 13(10): 722–737. DOI:10.1038/nri3532 |
| [17] | MATSUO H, TOH H, KITAMURA N, et al. Intravenous immunoglobulin enhances the killing activity and autophagy of neutrophils isolated from immunocompromised patients against multidrug-resistant bacteria[J]. Biochem Biophys Res Commun, 2015, 464(1): 94–99. DOI:10.1016/j.bbrc.2015.06.004 |
| [18] | XU J, WU Y, LU G, et al. Importance of ROS-mediated autophagy in determining apoptotic cell death induced by physapubescin B[J]. Redox Biol, 2017, 12: 198–207. DOI:10.1016/j.redox.2017.02.017 |



