2. 400038 重庆,第三军医大学军事预防医学院军队流行病学教研室;
3. 400037 重庆,第三军医大学新桥医院:胸外科;
4. 400037 重庆,第三军医大学新桥医院:全军呼吸内科研究所,全军呼吸病研究重点实验室
2. Department of Epidemiology, College of Military Preventive Medicine, Third Military Medical University, Chongqing, 400038;
3. Department of Thoracic Surgery, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China;
4. Institute of Respiratory Diseases, Key Laboratory of Respiratory Diseases, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
肺癌作为全球最为普遍的恶性肿瘤之一,其死亡率居所有恶性肿瘤的首位[1]。长链非编码RNA (long non-coding RNAs,lncRNAs)是一类转录本长度大于200nt的功能性RNA分子[2]。近年来的研究表明,lncRNAs在基因的表达调控中扮演重要角色,参与X染色体沉默、基因组印记、染色质修饰、转录激活、转录干扰和核内运输等多种重要的调控过程[3]。目前的研究表明lncRNAs在肺癌的发生、发展中也起到了重要的作用[4]。本研究前期通过lncRNA表达谱芯片和生物信息学分析,筛选到可能对肺腺癌和正常肺组织基因表达差异起重要作用的关键lncRNA MUC5B-AS1(Ensembl数据库中ID为ENSG00000255177)。此外,我们前期在临床组织样本中对MUC5B-AS1的表达进行qPCR检测,发现MUC5B-AS1在肺癌组织中的表达显著高于癌旁组织。MUC5B-AS1在肺癌细胞中的生物学功能有待于进一步研究。因此,本研究通过构建lncRNAs MUC5B-AS1过表达的细胞模型,探究其对肺腺癌细胞增殖、迁移以及侵袭的影响,为lncRNA MUC5B-AS1在肺癌中的作用及其分子机制的研究奠定基础。
1 材料与方法 1.1 材料与试剂 1.1.1 细胞株人肺腺癌细胞系H1299、A549、SPCA1、H1975以及人正常肺上皮细胞系HBE均购自中科院上海细胞生物学研究所细胞库。
1.1.2 试剂胎牛血清(FBS)购自杭州四季青生物有限技术公司,0.25%胰酶、1640培养基购自HyClone公司,F-12K培养基购自Gibco公司,转染试剂LipofectamineTM2000购自Invitrogen公司,总RNA提取试剂盒RNAios puls、反转录试剂盒、qPCR试剂盒均购自TaKaRa公司,CCK-8检测试剂盒购自DOJINDO公司,Transwell小室购自Corning公司,Matrigel基质胶购自BD公司。
1.2 方法 1.2.1 LncRNA MUC5B-AS1过表达载体的构建在Ensembl数据库(http://asia.ensembl.org/index.html)中找到长链非编码MUC5B-AS1的全长序列,合成MUC5B-AS1基因序列(上海生工公司合成),并将该序列构建到pcDNA3.1中,得到pcDNA3.1-MUC5B-AS1过表达载体。转化E.coli DH5α感受态细胞,提取质粒,测序鉴定载体构建是否成功;将构建好的质粒过表达载体转染肺腺癌细胞系;提取转染后细胞总RNA,qRT-PCR方法检测MUC5B-AS1的表达量,鉴定过表达效果。
1.2.2 细胞培养及转染细胞株HBE、H1299、H1975、SPCA1和A549分别接种在含10%的胎牛血清的RPMI1640培养基与F-12K培养基中,在37 ℃、5%CO2饱和湿度培养箱中孵育培养。取对数生长期的肺腺癌细胞株,用0.25%胰蛋白酶消化,调整细胞至一定密度,接种于6孔板中。脂质体2000转染pcDNA3.1空质粒(对照组)和pcDNA3.1-MUC5B-AS1过表达质粒(实验组)均按照转染试剂说明书进行。细胞转染处理48 h后,进行qRT-PCR验证转染及过表达效果。
1.2.3 总RNA提取运用RNAios puls试剂盒,6孔板每孔加入700 μL细胞裂解液裂解细胞提取总RNA,提取完毕后采用分光光度仪进行定量及检测纯度,并取出2 μL总RNA进行琼脂糖凝胶电泳,检查总RNA是否存在降解。
1.2.4 qRT-PCR检测基因表达量按TaKaRa公司的反转录试剂盒说明书进行反转录反应得到cDNA,-20 ℃保存。以cDNA为模板进行qPCR扩增。lncRNA MUC5B-AS1基因上游引物序列为5′-CT-CTGTGAGGATCCAGTGGACG-3′,下游引物序列为5′-TGTGCTTTGCTGTGACGACT-3′; 内参基因β-actin上游引物序列为5′-CCACGAAACT ACCTTCAACTCC-3′,下游引物序列为5′-GTGATCTCCTTCTGCATCCTGT-3′。反应体系25 μL,包括cDNA模板1 μL,上下游引物各1 μL,PCR mixture 12.5 μL,DEPC水9.5 μL,PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。采用2-△△Ct分析法,按照公式分别计算实验组、对照组的ΔCt,以对照组的ΔCt为参照,计算2-ΔΔCt,即为lncRNA MUC5B-AS1相对表达量。ΔCt =Ct实验组-Ct对照组,ΔΔCt =ΔCt靶基因-ΔCt内参基因。
1.2.5 CCK-8法检测细胞增殖具体方法参考文献[5],简要如下:将1×105个细胞铺板至6孔板,待细胞汇合度达到70%~80%时,利用脂质体2000分别将pcDNA3.1-MUC5B-AS1过表达载体和pcDNA3.1空载体转染至细胞中,48 h后,将细胞消化离心,再次铺板至96孔板,每孔1 500个细胞,每组设置3个复孔。分别在24、48、72 h,4、5 d时加入CCK-8试剂染色,2 h后在酶联免疫检测仪下测定450 nm的光密度值D(450)。实验重复3次。
1.2.6 细胞迁移将1×105个细胞铺板至6孔板,待细胞汇合度达到70%~80%时,利用脂质体2000分别将pcDNA3.1-MUC5B-AS1过表达载体和pcDNA3.1空载体转染至细胞中,48 h后用无血清的培养液收集两组细胞,以1×104/孔接种于Transwell小室,下室内加入500 μL含10%胎牛血清的1640培养基,12 h后取出Transwell小室,棉拭子刮出膜上层细胞,100%甲醇固定30 min,PBS洗3次,0.1%结晶紫染色15 min。倒置显微镜下随机选取5个视野观察照相。相同条件下实验重复3次。
1.2.7 细胞侵袭实验分组与转染同细胞迁移实验。用预冷的无血清细胞培养基稀释Matrigel基质胶至1 mg/μL。取60 μL稀释后的基质胶加入Transwell上室,放置于37 ℃培养箱中孵育30 min。无血清的培养液收集两组细胞后,以1×104/孔接种于Transwell小室,下室内加入500 μL含10%胎牛血清的1640培养基,24 h后取出Transwell小室,棉拭子刮出膜上层细胞,100%甲醇固定30 min,PBS洗3次,0.1%结晶紫染色15 min。倒置显微镜下随机选取5个视野观察照相。相同条件下实验重复3次。
1.3 统计学分析应用SPSS 22.0统计软件进行数据分析,计量资料采用x±s表示,两组间比较采用独立样本t检验,检验水准α=0.05。
2 结果 2.1 肺腺癌细胞系中的lncRNA MUC5B-AS1的表达采用RT-PCR检测lncRNA MUC5B-AS1在4株肺癌细胞系H1299、A549、SPCA1、H1975和人支气管上皮细胞系HBE中的相对表达情况,结果表明,和HBE细胞相比,lncRNA MUC5B-AS1在SPCA1和A549细胞系中相对高表达,而在H1299细胞系中相对低表达(图 1)。此外,针对该5株细胞系进行qRT-PCR检测分析,lncRNA MUC5B-AS1在HBE、SPCA1、A549、H1975、H1299中表达量分别为1、2.46、47.45、0.03、0.017,在H1299与A549细胞系中分别表达最低与最高,与HBE细胞系比较差异有统计学意义(P < 0.05)。基于以上结果,我们选择H1299、A549细胞系为研究对象,继而研究lncRNA MUC5B-AS1对肺癌细胞株生物功能的影响。
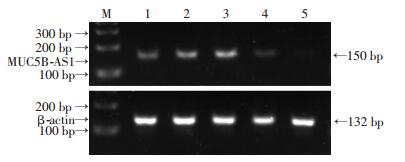
|
| M:标准;1:HBE;2:SPCA1;3:A549;4:H1975;5:H1299 图 1 RT-PCR检测MUC5B-AS1在肺腺癌细胞系中的表达 |
2.2 MUC5B-AS1过表达载体的构建及过表达效果鉴定
化学合成lncRNA MUC5B-AS1目的序列,并将该序列构建至pcDNA3.1载体中得到MUC5B-AS1过表达载体pcDNA3.1-MUC5B-AS1。在转染前,通过酶切质粒的方法将获取重组后的载体进行酶切,酶切产物进行凝胶电泳,目的条带的大小符合所需目的基因片段大小(图 2)。此外,经过测序比对,目的序列即为lncRNA MUC5B-AS1序列。将pcDNA3.1-MUC5B-AS1转染至H1299细胞系中,利用qRT-PCR对转染后细胞系中的MUC5B-AS1表达量进行检测并分析。结果表明:H1299、A549细胞转染pcDNA3.1-MUC5B-AS1后MUC5B-AS1的表达量与空质粒对照组相比显著增高,分别过表达3 925倍(P < 0.05)与7.8倍(P < 0.05), 证明MUC5B-AS1过表达细胞系构建成功,且转染后MUC5B-AS1的表达显著提高。
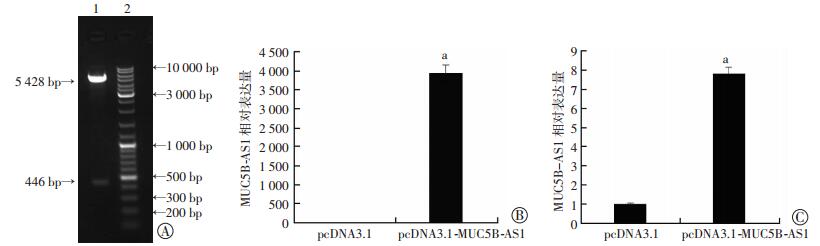
|
| A:HindⅢ和XhoⅠ双酶切产物电泳结果1:酶切产物,2:DNA标准;B:将pcDNA3.1-MUC5B-AS1质粒转至H1299细胞中,48 h后qPCR检测MUC5B-AS1表达(n=3,x±s);C:将pcDNA3.1-MUC5B-AS1质粒转至A549细胞中,48 h后qPCR检测MUC5B-AS1表达(n=3,x±s) a:P<0.05,与pcDNA3.1比较 图 2 MUC5B-AS1过表达载体的构建及过表达效果鉴定 |
2.3 MUC5B-AS1对肺腺癌细胞增殖的影响
利用CCK-8法检测MUC5B-AS1过表达细胞系增殖情况,并绘制生长曲线。结果显示,过表达MUC5B-AS1与空载体对照组相比,在转染后的第1、2、3、4、5天差异均无统计学意义(P>0.05,图 3)。说明lncRNA MUC5B-AS1对肺腺癌细胞的增殖无影响。
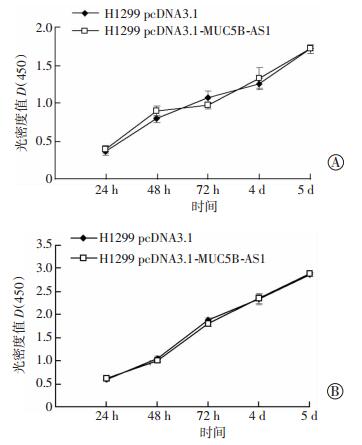
|
| A:H1299细胞,B:A549细胞 图 3 CCK-8检测MUC5B-AS1过表达对肺癌细胞系H1299及A549生长的影响(n=3,x±s) |
2.4 MUC5B-AS1对肺腺癌细胞迁移的影响
利用Transwell实验检测MUC5B-AS1过表达对H1299、A549细胞迁移能力的影响,在无基质胶的条件下,观察MUC5B-AS1过表达实验组与空载体对照组穿过小室细胞的数量。结果表明,过表达MUC5B-AS1后H1299与A549细胞的迁移能力比空质粒对照组显著增强(P < 0.05,图 4,表 1),提示MUC5B-AS1可以促进肺腺癌细胞的迁移能力。
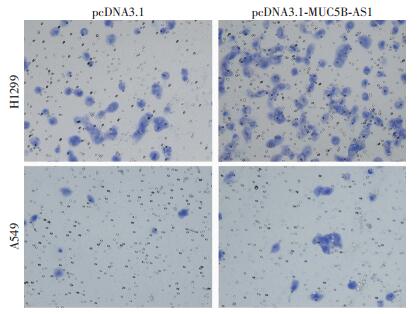
|
| 图 4 MUC5B-AS1过表达对肺癌细胞系H1299迁移的影响(结晶紫×200) |
| 细胞系 | 迁移细胞数 | 侵袭细胞数 | P值 |
| H1299 pcDNA3.1 | 44.27±3.25 | 19.33±1.53 | 0.004 |
| H1299 pcDNA3.1-MUC5B-AS1 | 69.27±6.31 | 41.00±5.29 | 0.002 |
| A549 pcDNA3.1 | 4.67±1.01 | 12.47±0.50 | 0.001 |
| A549 pcDNA3.1-MUC5B-AS1 | 13.20±1.05 | 39.33±1.89 | < 0.001 |
2.5 MUC5B-AS1对肺腺癌细胞侵袭的影响
利用Transwell实验检测MUC5B-AS1过表达对H1299、A549细胞侵袭能力的影响,在有基质胶的条件下,观察MUC5B-AS1过表达实验组与空载体对照组穿过小室细胞的数量。结果表明,过表达MUC5B-AS1后H1299与A549细胞的侵袭能力比空质粒对照组显著增强(P < 0.05),提示MUC5B-AS1可以促进肺腺癌细胞的侵袭能力(图 5,表 1)。
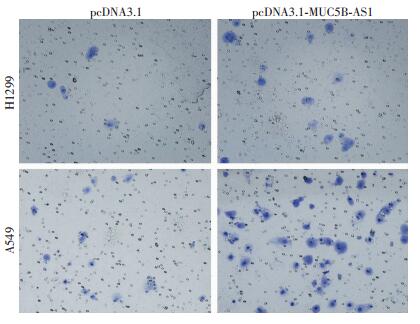
|
| 图 5 MUC5B-AS1过表达对肺癌细胞系H1299侵袭的影响(结晶紫×200) |
3 讨论
lncRNAs为至少包含200个核苷酸的功能性RNA,由OKAZAKI等[6]首次在小鼠的DNA转录产物中发现。越来越多的证据表明lncRNA引发了癌症的启动与发生、发展[7]。当前,已经发现了很多与肺癌相关的lncRNAs,如H19[8]、HOTAIR[9]、MALAT1[10]、ANRIL[11]、GAS5[12]。但是更多的其他肺癌相关lncRNA还有待进一步的发掘。我们通过基因芯片筛查到lncRNA MUC5B-AS1,目前少见lncRNA MUC5B-AS1在任何肿瘤中的作用相关报道,主要是针对lncRNA MUC5B-AS1的靶基因MUC5B对肺功能影响[13]及肿瘤发生、发展的作用研究[14-15],然而lncRNA MUC5B-AS1在肺腺癌中的表达及功能不清楚,因此有必要对lncRNA MUC5B-AS1基因在肺腺癌中的作用进行探索验证。本研究主要从lncRNA MUC5B-AS1对H1299及A549细胞增殖及迁移、侵袭的功能影响进行了探讨。结果显示,lncRNA MUC5B-AS1在肺腺癌细胞系对增殖的影响并不明显;但对肺癌细胞侵袭迁移有明显的促进作用,因此可能在肺腺癌的发生、发展中起到促进肿瘤转移的作用。
近年来,大量证据显示lncRNAs作为一种新的调控因子参与癌症的生物过程,尤其是在肿瘤增殖过程中发挥重要的作用。例如,lncRNA HNF1A-AS1通过调控细胞周期蛋白D1(CCND1)促进肺腺癌细胞的增殖[16];lncRNA IRAIN也是一种反义非编码RNA,其在类胰岛素生长因子1受体(IGF1R)的染色体增强子或启动子环形成过程中发挥了重要作用,从而通过IGF1R调控非小细胞肺癌细胞的增殖[17]。基于相关研究表明lncRNAs在肺癌细胞的增殖中发挥重要作用,本研究首先探究了MUC5B-AS1对肺腺癌细胞增殖的作用。然而,本研究结果初步表明,过表达MUC5B-AS1并不影响肺腺癌细胞株的增殖。
研究表明迁移、侵袭与转移是造成非小细胞肺癌治疗失败的关键原因。与此同时,lncRNAs与非小细胞肺癌的形成和转移之间有着密切的联系。如MIAO等[18]发现lncRNA FOXF1-AS1一方面通过对E钙黏蛋白与波形蛋白调控从而诱导肺癌细胞的EMT;另一方面作用于EZH2调控其靶基因FOXF1参与肺癌细胞的转移。JIA等[19]研究发现lncRNA-HIT通过提高ZEB1在CHD1启动子区域的结合,调节ZEB1的表达,调控细胞的转移。我们研究发现,肺腺癌细胞H1299过表达MUC5B-AS1后,尽管增殖能力没有发生变化,但其迁移和侵袭的能力得到显著的提升。这一结果提示,MUC5B-AS1可能在肺腺癌的转移过程中起到了一定的促进作用。
目前,lncRNAs发挥生物学功能的机制有多种,lncRNAs可能与DNA、RNA或者蛋白相互作用发挥其生物学功能。生物信息学分析发现MUC5B-AS1全长434 bp,有两个外显子,位于11p15.5染色体区域,与黏蛋白5B(Mucin 5B,MUC5B)基因相重叠,位于MUC5B的外显子中,转录方向与MUC5B相反,属于反义lncRNAs。MUC5B属于黏蛋白家族的成员,黏蛋白的表达异常与肿瘤细胞的增殖、分化、侵袭转移等生物学行为密切相关[20]。越来越多研究表明MUC5B已经被看作很多癌症的生物标志物。例如,有研究表明,DUSP28基因参与MUC5B在胰腺癌细胞AsPC-1的迁移与生存的调控作用,而在增殖方面并无影响;该研究还发现MUC5B对胰腺癌细胞迁移、生存能力的影响大于增殖的影响[21]。因此,我们推测,MUC5B-AS1作为MUC5B基因的反义RNA,很可能通过调节MUC5B基因的表达进而促进肺腺癌细胞的迁移和侵袭,相关的机制还需进一步研究。
本研究还存在一定的局限性,首先,本研究只针对lncRNA MUC5B-AS1进行了细胞功能研究,并未对lncRNA MUC5B-AS1如何发挥促癌作用的具体机制进行深入研究;其次,本研究的结果仅限于细胞水平,并未进行裸鼠体内实验验证。综上所述,本研究发现,lncRNA MUC5B-AS1在肺腺癌细胞系的迁移侵袭中发挥了一定的促进作用,可能在肺腺癌的发生、发展中起到促进肿瘤转移的作用。因此,我们接下来将深入研究lncRNA MUC5B-AS1发挥促癌作用的具体机制,以期为肺腺癌的防治提供新的思路和方法。
| [1] | SIEGEL R L, MILLER K D, FEDEWA S A, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3): 177–193. DOI:10.3322/caac.21395 |
| [2] | PONTING C P, OLIVER P L, REIK W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4): 629–641. DOI:10.1016/j.cell.2009.02.006 |
| [3] | FATICA A, BOZZONI I. Long non-coding RNAs: new players in cell differentiation and development[J]. Nat Rev Genet, 2014, 15(1): 7–21. DOI:10.1038/nrg3606 |
| [4] | XIE W, YUAN S, SUN Z, et al. Long noncoding and circular RNAs in lung cancer: advances and perspectives[J]. Epigenomics, 2016, 8(9): 1275–1287. DOI:10.2217/epi-2016-0036 |
| [5] |
傅莉媛, 熊刚, 李娟, 等. MTF-1对食管鳞癌EC109细胞株生长和迁移的影响[J].
第三军医大学学报, 2014, 36(8): 750–754.
FU L Y, XIONG G, LI J, et al. Effects of MTF-1 on cell prolife-ration and migration in human esophageal carcinoma EC109 cells[J]. J Third Mil Med Univ, 2014, 36(8): 750–754. DOI:10.16016/j.1000-5404.2014.08.027 |
| [6] | OKAZAKI Y, FURUNO M, KASUKAWA T, et al. Analysis of the mouse transcriptome based on functional annotation of 60, 770 full-length cDNAs[J]. Nature, 2002, 420(6915): 563–573. DOI:10.1038/nature01266 |
| [7] | FATICA A, BOZZONI I. Long non-coding RNAs: new players in cell differentiation and development[J]. Nat Rev Genet, 2014, 15(1): 7–21. DOI:10.1038/nrg3606 |
| [8] | MATOUK I J, HALLE D, GILON M, et al. The non-coding RNAs of the H19-IGF2 imprinted loci: a focus on biological roles and therapeutic potential in Lung Cancer[J]. J Transl Med, 2015, 13: 113. DOI:10.1186/s12967-015-0467-3 |
| [9] | ONO H, MOTOI N, NAGANO H, et al. Long noncoding RNA HOTAIR is relevant to cellular proliferation, invasiveness, and clinical relapse in small-cell lung cancer[J]. Cancer Med, 2014, 3(3): 632–642. DOI:10.1002/cam4.220 |
| [10] | GUTSCHNER T, HAMMERLE M, EISSMANN M, et al. The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J]. Cancer Res, 2013, 73(3): 1180–1189. DOI:10.1158/0008-5472.CAN-12-2850 |
| [11] | LIN L, GU Z T, CHEN W H, et al. Increased expression of the long non-coding RNA ANRIL promotes lung cancer cell metastasis and correlates with poor prognosis[J]. Diagn Pathol, 2015, 10(1): 14. DOI:10.1186/s13000-015-0247-7 |
| [12] | DONG S, QU X, LI W, et al. The long non-coding RNA, GAS5, enhances gefitinib-induced cell death in innate EGFR tyrosine kinase inhibitor-resistant lung adenocarcinoma cells with wide-type EGFR via downregulation of the IGF-1R expression[J]. J Hematol Oncol, 2015, 8: 43. DOI:10.1186/s13045-015-0140-6 |
| [13] | LIVRAGHI-BUTRICO A, GRUBB B R, WILKINSON K J, et al. Contribution of mucus concentration and secreted mucins Muc5ac and Muc5b to the pathogenesis of muco-obstructive lung disease[J]. Mucosal Immunology, 2016, 10(2): 395–407. DOI:10.1038/mi.2016.63 |
| [14] | VALQUE H, GOUYER V, GOTTRAND F, et al. MUC5B leads to aggressive behavior of breast cancer MCF7 cells[J]. PLoS ONE, 2012, 7(10): e46699. DOI:10.1371/journal.pone.0046699 |
| [15] | WAKATA K, TSUCHIYA T, TOMOSHIGE K, et al. A favourable prognostic marker for EGFR mutant non-small cell lung cancer: immunohistochemical analysis of MUC5B[J]. BMJ Open, 2015, 5(7): e008366. DOI:10.1136/bmjopen-2015-008366 |
| [16] | WU Y, LIU H, SHI X, et al. The long non-coding RNA HNF1A-AS1 regulates proliferation and metastasis in lung adenocarcinoma[J]. Oncotarget, 2015, 6(11): 9160–9172. DOI:10.18632/oncotarget.3247 |
| [17] | FENG J, SUN Y, ZHANG E B, et al. A novel long noncoding RNA IRAIN regulates cell proliferation in non small cell lung cancer[J]. Int J Clin Exp Pathol, 2015, 8(10): 12268–12275. |
| [18] | MIAO L, HUANG Z, ZENGLI Z, et al. Loss of long noncoding RNA FOXF1-AS1 regulates epithelial-mesenchymal transition, stemness and metastasis of non-small cell lung cancer cells[J]. Oncotarget, 2016, 7(42): 68339–68349. DOI:10.18632/oncotarget.11630 |
| [19] | JIA X, WANG Z, QIU L, et al. Upregulation of LncRNA-HIT promotes migration and invasion of non-small cell lung cancer cells by association with ZEB1[J]. Cancer Med, 2016, 5(12): 3555–3563. DOI:10.1002/cam4.948 |
| [20] | BAFNA S, KAUR S, BATRA S K. Membrane-bound mucins: the mechanistic basis for alterations in the growth and survival of cancer cells[J]. Oncogene, 2010, 29(20): 2893–2904. DOI:10.1038/onc.2010.87 |
| [21] | LEE J, LEE J, YUN J H, et al. DUSP28 links regulation of Mucin 5B and Mucin 16 to migration and survival of AsPC-1 human pancreatic cancer cells[J]. Tumour Biol, 2016, 37(9): 12193–12202. DOI:10.1007/s13277-016-5079-x |



