随着计算机断层扫描(computed tomography,CT)的广泛应用,高危人群疾病筛查中周围性肺部病变(peripheral pulmonary lesions,PPLs)的检出率日益增加。明确诊断是有效治疗的前提,传统的经支气管镜肺活检(transbronchial biopsy,TBB)技术对肺外周病变的诊断能力不佳,CT引导下经皮肺穿刺(CT-guided transthoracic needle aspiration,CT-TTNA)在PPLs的诊断中应用普遍,但气胸和肿瘤种植等并发症不容忽视[1-2],因此如何既安全又准确地诊断PPLs是医师面临的挑战。气道内径向超声(radial endobronchial ultrasound,R-EBUS)的成功研发已有十余年历史,小超声探头可通过支气管镜的活检工作通道进入远端气道进行360°成像扫描,显著提高了PPLs的诊断率[3-4],但目前在国内尚未推广应用。
本研究回顾性分析2015年1月至2017年3月在我院呼吸内镜室行R-EBUS引导下支气管镜检查的PPLs患者的临床资料及检查结果,以探讨其在PPLs诊断中的应用价值。
1 对象与方法 1.1 对象回顾性分析2015年1月1日至2017年3月31日在蚌埠医学院第一附属医院呼吸内镜中心接受R-EBUS引导下支气管镜检查的住院或门诊患者共140例,筛选后最终入组本研究的病例符合:(1) 胸部CT证实为周围性肺部病变;(2) 常规支气管镜下未见新生物;(3) 均有后续随访结果。所有入选患者接受R-EBUS引导下经支气管肺活检(R-EBUS-TBB)和(或)刷检,未能明确者接受经皮肺穿刺、外科胸腔镜或开胸手术、抗感染治疗后随访;同一患者细胞病理诊断不一致时,以外科手术的组织病理结果为金标准。本研究2012年4月经蚌埠医学院第一附属医院伦理委员会批准,所有患者检查前均签署知情同意书。
1.2 主要设备日本Olympus公司:BF-1T260、BF-260和BF-P260F (活检通道2.0 mm)可弯曲支气管镜;UM-S20-17S (1.4 mm外径)或UM-S20-20R(1.7 mm外径)超声小探头;EU-MEl超声主机;MAJ-935小探头驱动器;引导鞘套装(K-201,1.95 mm外径)。
1.3 检查方法常规术前禁食禁水、测血压,2%利多卡因分别行咽喉部、鼻腔局部麻醉,术中持续鼻导管吸氧。麻醉满意后患者取平卧位经鼻腔进镜,术中心电、血氧饱和度监测,依次进入健侧及患侧的支气管及其分支常规观察,结合影像学提示的病变部位,经气管镜的活检工作通道引入超声探头定位目标病灶,获取特征性超声图像后根据是否使用导向鞘(guide sheath,GS)选择进行以下操作:(1) 未使用GS者,助手固定气管镜,超声探头平支气管镜活检通道入口处作标记,撤出超声探头,测量探头与标记处的长度,按此距离原路径依次插入活检钳、细胞刷,反复钳取5~6次和刷检3次送组织病理和细胞学[5];(2) 使用GS者,确定靶病灶步骤同前,助手将GS固定于气管镜工作通道入口处,从GS内撤去探头,保留GS,按照刷检-活检-再刷检的顺序获取标本[6]。
1.4 统计学处理数据采用SPSS 19.0统计软件进行统计学分析。计量资料用x±s表示,计数资料用率表示,率的比较采用χ2检验或Fisher确切概率法;检验水准:α=0.05。
2 结果 2.1 一般资料及诊断结果140例患者因腔内存在可视病灶、失访等原因剔除,最终83例患者符合入组标准。其中男性55例,女性28例,年龄(59.81±11.85) 岁,最后诊断:肺癌52例(其中腺癌26例,鳞癌6例,非小细胞癌14例,差分化癌4例,小细胞肺癌1例,转移癌1例),肺炎22例(其中慢性炎5例,间质性肺炎1例),肺结核4例,结核球2例,炎性假瘤1例,小B细胞淋巴瘤1例,结节病1例。83例R-EBUS引导下经支气管镜检查患者确诊49例,肺癌26例(其中腺癌16例,鳞癌3例,非小细胞癌3例,差分化癌3例,小细胞肺癌1例)、肺炎18例(其中慢性炎6例)、结核3例、小B细胞淋巴瘤1例、结节病1例;未确诊者经开胸手术或胸腔镜(18例)、经皮肺穿刺(13例)、淋巴结/肝/髂骨穿刺各1例确诊。
2.2 R-EBUS引导下经支气管镜检查结果83例患者接受检查,其中74处PPLs经EBUS准确识别和定位(89.16%,74/83),9例超声下未发现目标病变。总诊断成功率59.04%(49/83),其中肺恶性病变诊断率50.94%(27/53),非恶性病变诊断率73.33%(22/30)(χ2=3.97,P=0.046);R-EBUS TBB诊断率(56.92%,37/65) 高于刷检(30.12%,25/83)(χ2=10.76,P=0.001),二者联合使用诊断率可提高至59.04%,差异有统计学意义(χ2=16.75,P=0.000 2);支气管镜下超声引导联合测量技术(EBUS-D)诊断率为60.00%(45/75),经导向鞘引导的超声支气管镜(EBUS-GS)诊断率为50.00%(4/8),二者相比差异无统计学意义(χ2=0.03,P=0.87)。
2.3 病变大小、部位与结果病灶直径10.0~52.4 mm,其中直径≤20 mm者19例,确诊7例(36.84%),诊断率低于直径>20 mm者42例(65.62%,42/64)(χ2=5.02,P=0.03)。各叶段病灶诊断率分别为右上叶46.15%(12/26),右中叶100.00%(8/8),右下叶53.85%(7/13),左上叶固有段37.50%(3/8),左上叶舌段63.64%(7/11),左下叶70.59%(12/17),差异无统计学意义(χ2=10.05,P=0.07);而上叶(22/45,48.89%)与中/下叶(27/38,71.05%)相比,诊断率有明显不同(χ2=4.18,P=0.04),见图 1、2。

|
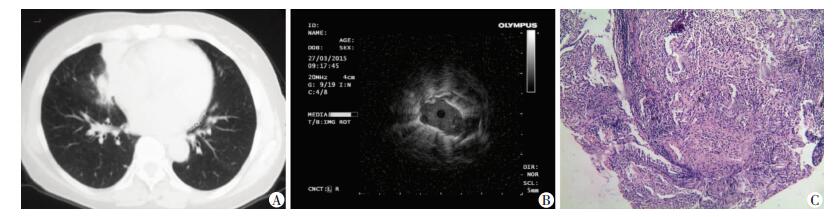
| A:胸部CT表现;B: EBUS-GS表现;C:细胞学刷检液基细胞学检测结果(HE×400) 图 1 肺腺癌患者CT、EBUS-GS表现与细胞学检查结果 |
|
| A:胸部CT表现;B: EBUS-D表现;C:组织学病理变化(HE×40) 图 2 肺炎患者CT、EBUS-D表现与病理学变化 |
2.4 径向超声与靶病变
恶性PPLs超声图像多表现为低回声病灶与含气肺组织间规则、清晰的边界,而良性病变大多边界不清,此外目标病变超声图像与探头所在的位置也有关,探头位于病灶内时边界更清晰,典型者可呈“同心圆”状,反之呈“偏心”样改变;超声探头位于病变区域内者诊断率为81.58%(31/38),与超声下病变偏离探头者50.00%(18/36) 的诊断率相比,差异具有统计学意义(χ2=8.24,P=0.004)。
典型病例:病例1,患者,女性,57岁,于2015年3月因“咳嗽1个月”就诊我院,胸部CT平扫示左下叶病灶,经EBUS-GS探及位于探头旁的LB10病灶,行刷检液基细胞学确诊腺癌(图 1A~C)。病例2,患者,女性,68岁,于2015年3月因“咯血10余天”来院就诊,胸部CT平扫示右中叶病灶,行EBUS-D探及RB4b病灶, 探头位于靶病灶内,组织学活检病理证实为肺炎(图 2 A~C)。
2.5 并发症操作中患者耐受性较好,仅为经气管镜取材部位少量出血,无大出血、气胸等的发生。
3 讨论周围性肺部病变是临床诊治的难点,寻找准确、安全、创伤性小的诊断方法是提高疗效的关键。R-EBUS技术为实现精准活检提供了一个有力的手段,国外更多研究使用引导鞘(EBUS-GS),但引导鞘较为昂贵,且经引导鞘活检往往获取标本偏小,限制了在国内的推广应用,而支气管镜下超声引导联合测量技术(EBUS-D)方便易行,但目前研究较少。
本研究表明:R-EBUS引导下支气管镜检查的PPLs患者总诊断率为59.04 %,与国外研究结果相似[7-8]。但良性病变的诊断率高于恶性病变,这与既往的研究有所不同[9-10],考虑与纳入本研究的非恶性病变直径偏大有关,超声探头更容易准确定位目标病灶,联合组织病理学、细胞学、微生物学多个检查方法获取标本对良、恶性肺周围性病变的诊断是有益的。R-EBUS-TBB诊断率高于刷检,二者联合使用总诊断率提高至59.04 %,因此应根据患者和病灶的具体情况选择使用或联合应用活检、刷检、冲洗液、灌洗液和刮匙等多种方式获取标本有助于提高阳性率[11]。
EBUS-GS在PPLs诊断中应用有较多研究,在肯定其优点的同时,注意到EBUS-GS仍存在以下不足:首先GS是一次性耗材,成本较高,增加了患者的经济负担,其次引导鞘套装配套的活检钳直径较小,与正常支气管壁相比,病变管壁增厚,小活检钳难以触及靶支气管壁外病变组织,故钳取组织少,对于弯曲角度较大的上叶远端病灶GS难以进入靶支气管,为了保证取材满意,更多研究需要透视引导确认活检钳位置和开闭状态[11-15]。EBUS-D最大的技术优势在于EBUS引导定位后,利用支气管镜的可弯曲性和柔韧性,较易进入因角度原因等不能进入的靶支气管,并可使用较大的活检钳取得满意标本;另外一个优势在于超声小探头的可重复使用性。本组资料使用了EBUS-D、EBUS-GS两种方法诊断PPLs,其中90%以上的患者使用了EBUS-D技术。结果显示:EBUS-D、EBUS-GS诊断率分别为60.00%、50.00%,二者相比差异无统计学意义,说明EBUS-D同样可安全用于PPLs的诊断,且与EBUS-GS相比具有节约成本、减少资源浪费的优点。但本研究中EBUS-D的诊断率(60.00%)高于FUSO等[5]报道治疗支气管镜下联合EBUS-D的总诊断率(50%),主要与气管镜的选择有关,本次入组患者中酌情使用了超细支气管镜,可达更远端的靶病灶细支气管,探查到常规气管镜无法发现的病变,提高了获取标本的准确性,结果的相关性和一致性较好。我们的体会是EBUS-D操作中只要活检钳准确到达靶病灶,较易取得组织,为了提高诊断阳性率,要对获取的标本进行取材满意度评估,必要时超声探头再次确认位置。
结节的大小显著影响R-EBUS诊断率[16-17],但国外的一些研究也有不同的报道[18]。本研究发现:病灶直径≤20 mm者诊断率(36.84%)低于直径>20 mm者(65.62%);各叶段病灶间诊断率差异无统计学意义,而上叶与中/下叶相比,诊断率差异有统计学意义。该研究提示病变的位置、大小对诊断结果有不同影响:大的病灶容易被EBUS所探及,较易获取到更多的组织,相对位置较高的上叶PPLs,对于不能灵活弯曲、转向的超声小探头、GS来说确实存在挑战,阳性率偏低,而且在上叶病变时操作者要特别小心对超声小探头的损害,位置较高的PPLs经皮肺穿刺可能是更好的选择。而外周小结节是R-EBUS操作的挑战,国外一些作者建议联合导航技术,包括虚拟导航和电磁导航,诊断率为63.3%~88.0%[6, 19-20],GODBOUT等[21]还进行了联合直视可视化操作系统的研究。我们的经验是通过准确阅读胸部CT,完全可以实现病灶的叶段精确定位,再结合超细支气管镜+超声小探头的使用,可以获得较高阳性率。本研究虽然没有纳入磨玻璃影(ground-glass opacity,GGO)病灶,但是随着GGO在低剂量螺旋CT筛查中被越来越多地发现,R-EBUS在GGO中的应用值得关注。国外有研究显示: R-EBUS-TBB对GGO的总诊断率为65%,≥20 mm病灶阳性率高达68.4%,其中包括了混合磨玻璃影[22-23],但纳入的病例数过少、单中心研究为主等局限性可能导致结果的偏差,R-EBUS在GGO中的诊断价值有待更多前瞻性多中心研究。
PPLs超声图像由于超声探头辐射范围的限制、声波衰减、异质回声等因素的存在会影响结果的判断,而探头所在与病灶的位置关系形成的超声影像相对易辨认。探头位于病变区域内者诊断率与病变偏离探头者的诊断率相比,差异具有统计学意义,这与国外研究结论一致[24-25]。再次证实超声探头与病变的相对位置对诊断率有显著的影响,当探头直接指向病变时,其活检成功率将明显增加;考虑主要是因为当超声探头位于病变区域内时,其所探及病灶完全包绕目标支气管管腔,活检工具成功获取标本的概率大增。
所有患者操作中耐受性较好,未使用镇痛镇静药物,仅经气管镜取材部位少量出血,局部使用止血药,无需特殊处理,因为是在腔内进行活检,所以大出血、气胸等并发症发生率显著低于经皮肺穿刺,同时避免了患者X线片下辐射暴露的风险,理论上也避免了肿瘤的针道种植,因此R-EBUS对PPLs诊断是较为安全的方法之一[6, 12, 26]。
未来需要扩大样本量、开展前瞻性研究;其次操作细节如超声图像判别、精细操控R-EBUS的能力均会影响诊断结果,而且本研究EBUS-GS组的病例数较少,也对结果产生一定影响;未来还需结合快速细胞学检测进一步提高诊断阳性率。
综上所述,EBUS可准确定位肺部周围性病变,不管病变的大小、部位、径向超声探头与靶病变的位置关系等影响因素如何,R-EBUS引导下经支气管镜获取组织病理学或细胞学可提高PPLs的诊断率,是安全可实施的,EBUS-D作为PPLs的诊断技术同样有效,同时避免医疗资源的浪费。
| [1] | DHOORIA S, SEHGAL I S, GUPTA N, et al. Role of radial endobronchial ultrasound-guided transbronchial needle aspiration in the diagnosis of pulmonary nodules: case report and literature review[J]. Lung India: official organ of Indian Chest Society, 2017, 34(1): 61. DOI:10.4103/0970-2113.197094 |
| [2] | WANG C, LI X, ZHOU Z, et al. Endobronchial ultrasonography with guide sheath versus computed tomography guided transthoracic needle biopsy for peripheral pulmonary lesions: a propensity score matched analysis[J]. J Thorac Dis, 2016, 8(10): 2758–2764. DOI:10.21037/jtd.2016.09.52 |
| [3] | ZARIC B, STOJSIC V, CARAPIC V, et al. Radial endobronchial ultrasound (EBUS) guided suction catheter-biopsy in histological diagnosis of peripheral pulmonary lesions[J]. J Cancer, 2016, 7(1): 7–13. DOI:10.7150/jca.13081 |
| [4] | KUO C H, LIN S M, LEE K Y, et al. Endobronchial ultrasound-guided transbronchial biopsy and brushing: a comparative evaluation for the diagnosis of peripheral pulmonary lesions[J]. Eur J Cardiothorac Surg, 2014, 45(5): 894–898. DOI:10.1093/ejcts/ezt472 |
| [5] | FUSO L, VARONE F, MAGNINI D, et al. Role of ultrasound-guided transbronchial biopsy in the diagnosis of peripheral pulmonary lesions[J]. Lung Cancer, 2013, 81(1): 60–64. DOI:10.1016/j.lungcan.2013.04.004 |
| [6] | HAYAMA M, OKAMOTO N, SUZUKI H, et al. Radial endobronchial ultrasound with a guide sheath for diagnosis of peripheral cavitary lung lesions: a retrospective study[J]. BMC Pulm Med, 2016, 16(1): 76. DOI:10.1186/s12890-016-0244-y |
| [7] | CHAVEZ C, SASADA S, IZUMO T, et al. Endobronchial ultrasound with a guide sheath for small malignant pulmonary nodules: a retrospective comparison between central and peripheral locations[J]. J Thorac Dis, 2015, 7(4): 596–602. DOI:10.3978/j.issn.2072-1439.2015.03.04 |
| [8] | HIBARE K R, GOYAL R, NEMANI C, et al. Radial endobronchial ultrasound for the diagnosis of bronchoscopically invisible lesions: First case series from India[J]. Lung India, 2017, 34(1): 43–46. DOI:10.4103/0970-2113.197100 |
| [9] | TAY J H, IRVING L, ANTIPPA P, et al. Radial probe endobronchial ultrasound: factors influencing visualization yield of peripheral pulmonary lesions[J]. Respirology, 2013, 18(1): 185–190. DOI:10.1111/j.1440-1843.2012.02276.x |
| [10] | YOSHIKAWA M, SUKOH N, YAMAZAKI K, et al. Diagnostic value of endobronchial ultrasonography with a guide sheath for peripheral pulmonary lesions without X-ray fluoroscopy[J]. Chest, 2007, 131(6): 1788–1793. DOI:10.1378/chest.06-2506 |
| [11] | IZUMO T, SASADA S, CHAVEZ C, et al. The diagnostic value of histology and cytology samples during endobronchial ultrasound with a guide sheath[J]. Jpn J Clin Oncol, 2015, 45(4): 362–366. DOI:10.1093/jjco/hyv004 |
| [12] | HAYAMA M, IZUMO T, MATSUMOTO Y, et al. Complications with endobronchial ultrasound with a guide sheath for the diagnosis of peripheral pulmonary lesions[J]. Respiration, 2015, 90(2): 129–135. DOI:10.1159/000431383 |
| [13] | CHAN A, DEVANAND A, LOW S Y, et al. Radial endobronchial ultrasound in diagnosing peripheral lung lesions in a high tuberculosis setting[J]. BMC Pulm Med, 2015, 15(1). DOI:10.1186/s12890-015-0089-9 |
| [14] |
潘文森, 于婧, 刘欣, 等. 气管内超声结合引导鞘管对于肺部周边病变诊断的研究[J].
中华超声影像学杂志, 2015, 24(6): 543–545.
PAN W S, YU J, LIU X, et al. Diagnosis of pulmonary peripheral lesions by intrauterine ultrasound combined with guided sheath[J]. Chin J Ultrasonogr, 2015, 24(6): 543–545. DOI:10.3760/cma.j.issn.1004-4477.2015.06.026 |
| [15] | CASUTT A, PRELLA M, BEIGELMAN-AUBRY C, et al. Fluoroscopic-guided radial endobronchial ultrasound without guide sheath for peripheral pulmonary lesions: a safe and efficient combination[J]. Arch Bronconeumol, 2015, 51(7): 338–343. DOI:10.1016/j.arbres.2014.09.017 |
| [16] | SCHUHMANN M, BOSTANCI K, BUGALHO A, et al. Endobronchial ultrasound-guided cryobiopsies in peripheral pulmonary lesions: a feasibility study[J]. Eur Respir J, 2014, 43(1): 233–239. DOI:10.1183/09031936.00011313 |
| [17] |
李明, 彭爱梅, 张国良, 等. 支气管超声下经引导鞘肺活检术诊断肺周围性病变的价值[J].
中华结核和呼吸杂志, 2014, 37(1): 36–40.
LI M, PENG A M, ZHANG G L, et al. Endobronchial ultrasound transbronchial lung biopsy with guide-sheath for the diagnosis of peripheral pulmonary lesions[J]. Chin J Tuber Respir Dis, 2014, 37(1): 36–40. DOI:10.3760/cma.j.issn.1001-0939.2014.01.010 |
| [18] | EBERHARDT R, ANANTHAM D, ERNST A, et al. Multimodality bronchoscopic diagnosis of peripheral lung lesions: a randomized controlled trial[J]. Am J Respir Crit Care Med, 2007, 176(1): 36–41. DOI:10.1164/rccm.200612-1866OC |
| [19] | GEX G, PRALONG J A, COMBESCURE C, et al. Diagnostic yield and safety of electromagnetic navigation bronchoscopy for lung nodules: a systematic review and meta-analysis[J]. Respiration, 2014, 87(2): 165–176. DOI:10.1159/000355710 |
| [20] | SEIJO L M. Electromagnetic navigation bronchoscopy: clinical utility in the diagnosis of lung cancer[J]. Lung Cancer (Auckl), 2016, 7: 111–118. DOI:10.2147/LCTT.S98643 |
| [21] | GODBOUT K, MARTEL S, SIMON M, et al. Evaluation of pulmonary nodules using the spyglass direct visualization system combined with radial endobronchial ultrasound: a clinical feasibility study[J]. Open Respir Med J, 2016, 10(1): 79–85. DOI:10.2174/1874306401610010079 |
| [22] | IZUMO T, SASADA S, CHAVEZ C, et al. The diagnostic utility of endobronchial ultrasonography with a guide sheath and tomosynthesis images for ground glass opacity pulmonary lesions[J]. J Thorac Dis, 2013, 5(6): 745–750. DOI:10.3978/j.issn.2072-1439.2013.11.30 |
| [23] | IKEZAWA Y, SHINAGAWA N, SUKOH N, et al. Usefulness of endobronchial ultrasonography with a guide sheath and virtual bronchoscopic navigation for ground-glass opacity lesions[J]. Ann Thorac Surg, 2017, 103(2): 470–475. DOI:10.1016/j.athoracsur.2016.09.001 |
| [24] | ALI M S, TRICK W, MBA B I, et al. Radial endobronchial ultrasound for the diagnosis of peripheral pulmonary lesions: a systematic review and meta-analysis[J]. Respirology, 2017, 22(3): 443–453. DOI:10.1111/resp.12980 |
| [25] | SHEPHERD R W. Bronchoscopic pursuit of the peripheral pulmonary lesion: navigational bronchoscopy, radial endobronchial ultrasound, and ultrathin bronchoscopy[J]. Curr Opin Pulm Med, 2016, 22(3): 257–264. DOI:10.1097/MCP.0000000000000273 |
| [26] | KATSURADA M, IZUMO T, NAGAI Y, et al. The dose and risk factors for radiation exposure to medical staff during endobronchial ultrasonography with a guide sheath for peripheral pulmonary lesions under X-ray fluoroscopy[J]. Japanese Journal of Clinical Oncology, 2014, 44(3): 257–262. DOI:10.1093/jjco/hyt224 |



