Cajal间质细胞(interstitial cells of Cajal, ICCs)是胃肠道起搏细胞,产生并传递慢波。2005年后,在胃肠道组织以外的组织和器官,如胰腺[1]、前列腺间质[2]、食管[3]、主动脉[4]、脾脏[5]、颞颌关节[6]等发现一种特殊类型的间质细胞,在超微结构、免疫组化特征、基因和蛋白组成与Cajal间质细胞相似[7-8],研究者将其命名为Cajal样间质细胞(interstitial cajal-like cells, ICLCs)。2010年,POPESCU等[9]为了避免ICLCs与ICCs混淆,建议将ICLCs重命名为特络细胞(telocytes,TCs),突起命名为telopodes(Tps)。
目前对TCs的免疫表型和超微结构已有了深入的了解,TCs免疫表型有c-kit/CD117、CD34、vimentin、S-100等[1, 10],TCs免疫标志物在不同器官和组织中表达不同[11]。尚未发现TCs特异性的免疫标记;目前精确识别TCs主要依据其透射电镜下的特殊超微结构进行鉴别[1, 12]。
CD117是原癌基因c-kit编码的Ⅲ型酪氨酸激酶kit受体。ICCs持续表达由c-kit原癌基因编码的Ⅲ型酪氨酸激酶kit受体,能够与由平滑肌细胞Sl基因编码的配体干细胞生长因子(stem cell factor, SCF)结合,激活胞内信号通路调控ICCs的增殖、发育。甲磺酸伊马替尼为酪氨酸激酶特异性抑制剂,在临床用于治疗胃肠道间质瘤。在体和离体研究表明,甲磺酸伊马替尼能够通过抑制kit受体的磷酸化,从而有效抑制kit受体的激活[13-14]。
本研究拟在前人研究基础上,以健康豚鼠胰腺为研究对象,确定豚鼠胰腺内TCs的位置、形态及免疫表型,利用甲磺酸伊马替尼对TCs进行干预,为在体研究TCs提供可行手段,为进一步研究TCs的功能提供研究基础。
1 材料与方法 1.1 材料健康豚鼠54只,9周龄,雌雄不限,体质量340~440 g,购自重庆大学实验动物中心,适应性喂养1周。甲磺酸伊马替尼(100 mg/片,江苏豪森药业),一抗为大鼠抗小鼠c-kit单克隆抗体(美国NOVUS公司)、兔抗小鼠CD117多克隆抗体(美国Proteintech公司)、兔抗小鼠vimentin多克隆抗体(美国GeneTex),二抗为山羊抗大鼠(北京中杉金桥)、山羊抗兔Ig/HRP(北京中杉金桥公司),β-actin(上海生工)、免疫组化检测试剂盒(北京中杉金桥公司),DAB显色剂(北京中杉金桥公司),透射电子显微镜(H-7650,日本日立公司),电泳仪(BG-Power600k,北京百晶),正置荧光显微镜(ci-e-ds-r11,日本尼康公司);冰冻切片机(MEV,德国赛利公司)。
1.2 免疫组织化学染色观察TCs内CD117/vimentin表达1%戊巴比妥钠腹腔注射深度麻醉,暴露腹腔,取豚鼠新鲜的胰腺组织,制作冰冻切片(5~10 μm),贴于防脱处理的载玻片上;100%丙酮固定15 min,3%双氧水-甲醇去除内源性过氧化酶,10%山羊血清封闭30 min,一抗大鼠抗小鼠CD117(1:300),4 ℃孵育过夜;次日复温后,山羊抗大鼠(1:2 000),37 ℃,孵育30 min,DAB显色,透明封片;一抗兔抗小鼠vimentin(1:500),4 ℃孵育过夜;次日复温后,二抗为山羊抗兔,37 ℃,孵育30 min,DAB显色,透明封片,正置荧光显微镜下观察拍照。
1.3 透射电子显微镜观察TCs超微结构新鲜离体胰腺修块后,放入预冷的3%戊二醛固定液内,放入4 ℃冰箱2 h,0.1 mol/L磷酸漂洗液漂洗3次,每次15 min,1%锇酸固定液固定,0.1 mol/L磷酸漂洗液漂洗后进行脱水、包埋、固化,超薄切片并3%醋酸铀-枸橼酸铅双染色后,透射电镜下观察并拍片。
1.4 动物分组与处理健康豚鼠54只,简单随机抽样方法分正常对照组,用药组(7、14、21、28 d),停药组(W7、W14、W21、W28 d)共9组,每组6只。参考MEI等[13]研究方法。甲磺酸伊马替尼[浓度为32.5 mg/mL,30 mg/(kg·d)]灌胃,每日上午称体质量,计算每只豚鼠所需药物的质量、体积,正常对照组用等体质量所需药物等体积的生理盐水灌胃。造模结束后,1%戊巴比妥钠腹腔注射深度麻醉后,取新鲜胰腺组织分别进行免疫组化、透射电镜及蛋白印迹检测。
1.5 Western blot检测胰腺内CD117/vimentin蛋白表达根据碧云天RIPA及PMSF说明书进行蛋白提取,BCA蛋白浓度测定试剂盒进行浓度测定,SDS-PAGE电泳,转移至PVDF膜,5%脱脂奶粉封闭,一抗兔抗小鼠CD117(1:500),4 ℃孵育过夜,二抗山羊抗兔(1:5 000),室温,1.5 h,TBST洗膜,化学发光;一抗兔抗vimentin(1:2 000),4 ℃孵育过夜,二抗山羊抗兔(1:5 000),室温,1.5 h,TBST洗膜,化学发光。采用Image-pro plus 6.0图像分析系统检测蛋白免疫印迹结果中的目的蛋白灰度值。
1.6 统计学分析采用SPSS 19.0统计软件,先进行正态性检验及方差齐性检验,若符合正态分布,方差齐用Dunnet检验,方差不齐用Games-Howell检验,数据以x± s表示。进一步组间两两比较,若方差齐,用LSD检验;若方差不齐,采用Games-Howell检验。检验水准α=0.05。
2 结果 2.1 胰腺内CD117/vimentin表达及TCs超微结构表现 2.1.1 免疫组织化学染色CD117免疫组化结果显示,CD117呈阳性的细胞胞体呈三角形或梭形,胞体较小,胞质较少,位于相邻两个腺泡之间的结缔组织内,与腺泡细胞的位置很近(图 1A);胞体发出2~3支突起Tps,细而长,突起与相邻细胞的突起相互连接,形成网络结构,围绕着腺泡,部分网络结构清晰可见(图 1A)。阳性细胞主要位于胰腺的外分泌部,内分泌部未见CD117的阳性细胞(图 1B)。vimentin免疫组化结果显示,胰腺组织中存在vimentin阳性细胞所形成的网络结构,细胞胞体呈梭形,胞体比较小,胞质比较少,多为细长而弯曲的突起,与TCs形态一致(图 1C)。
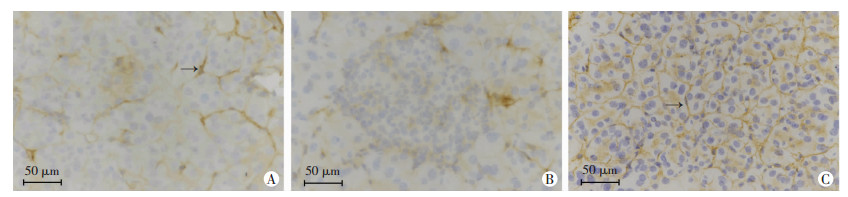
|
| A:CD117;B:胰腺组织内胰岛;C:vimentin;↑:示TCs 图 1 免疫组化观察豚鼠胰腺组织CD117、vimentin表达(S-P) |
2.1.2 透射电子显微镜
电镜下超微结构显示,TCs胞体为椭圆形,细胞核较大,细胞质较少,胞质内可见线粒体、滑面内质网、分泌性小囊泡,Tps与腺泡细胞之间形成缝隙连接(图 2A);2~4个细而长的突起Tps,呈管腔样结构,有粗段和细段相间分布的念珠状特殊结构,突起内细胞器比较少,突起相互连接形成网络结构,围绕着腺泡(图 2B、C);TCs位于胰腺结缔组织内,紧邻腺泡细胞,位于腺泡与腺泡之间(图 2A);胞质胞膜与突起胞膜有分泌囊泡(图 2A)。
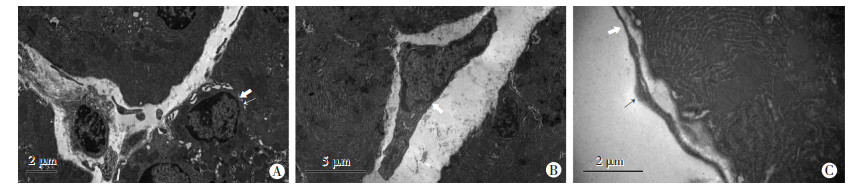
|
| A: Tps与腺泡细胞之间的缝隙连接(⇧示)及分泌性囊泡(↑示); B:成纤维细胞(⇧示); C: Tps念珠状管腔样结构;⇧:示突起细段;↑:示突起粗段 图 2 透射电子显微镜观察豚鼠胰腺内TCs超微结构 |
与胰腺间质内TCs相区别的胰腺结缔组织内的成纤维细胞细胞质较多,含有较丰富粗面内质网,突起有2个至多个,但较粗,较短(图 2B)。
2.2 甲磺酸伊马替尼干预对TCs形态、免疫表型及蛋白表达的影响 2.2.1 免疫组化观察各组豚鼠胰腺组织TCs形态及CD117、vimentin的蛋白表达CD117免疫组织化学染色结果显示(图 3),用药7 d组TCs形态和正常对照组相比细胞形态无明显差异;随着用药时间的延长,用药14、21、28 d组与正常对照组相比,Tps逐渐变短,网络结构逐渐变少,胞体和突起围绕着腺泡的结构变少。停药后,逐渐恢复。
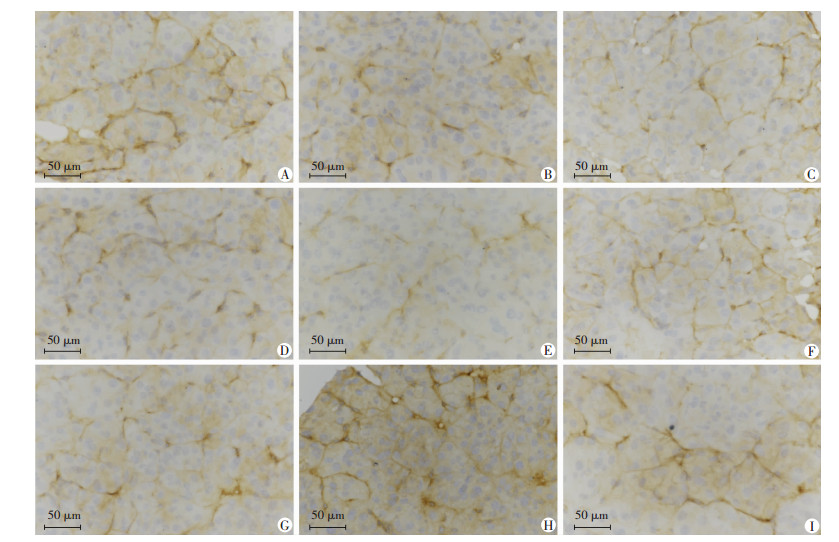
|
| A:正常对照组;B:用药7 d组;C:用药14 d组;D:用药21 d组;E:用药28 d组;F:停药7 d组;G:停药14 d组;H:停药21 d组;I:停药28 d组 图 3 免疫组化(S-P)观察各组豚鼠胰腺组织CD117的表达 |
vimentin免疫组织化学染色结果显示(图 4),视野中阳性细胞细长突起的TCs和周围间质细胞形成清晰的网络结构,胰腺组织内包含星形细胞、成纤维细胞等间质细胞,随着用药时间的延长,仍有清晰的网络结构,根据TCs细长突起的特殊结构,视野中突起变短的趋势,停药后逐渐恢复。
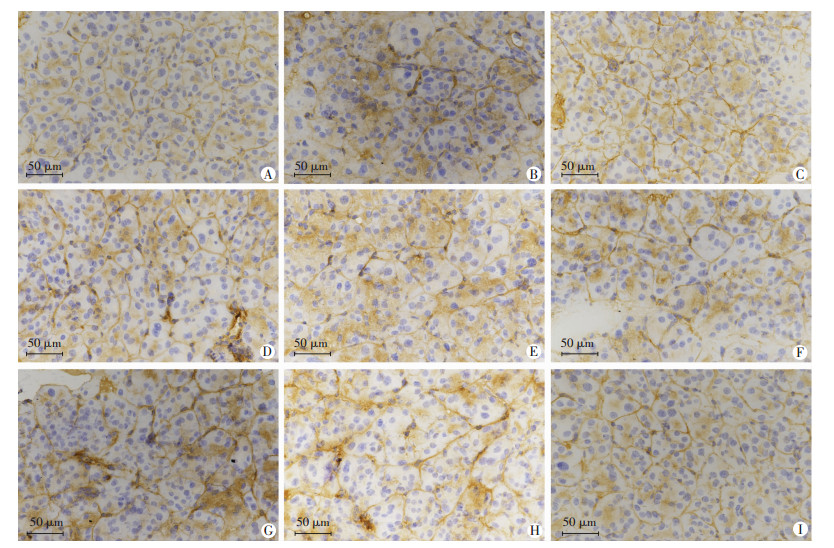
|
| A:正常对照组;B:用药7 d组;C:用药14 d组;D:用药21 d组;E:用药28 d组;F:停药7 d组;G:停药14 d组;H:停药21 d组;I:停药28 d组 图 4 免疫组化(S-P)观察各组豚鼠胰腺组织vimentin的表达 |
2.2.2 Western blot检测各组豚鼠胰腺组织CD117、vimentin的表达 2.2.2.1 CD117蛋白表达
药物作用后,CD117蛋白表达随着用药时间的延长呈递减趋势,14、21、28 d用药组与正常对照组比较差异有统计学意义(P < 0.05, 图 5A、B)。停止药物作用后,蛋白表达随着停药时间的延长呈递增趋势,W7、W14 d组与正常对照组比较差异有统计学意义(P < 0.05),W21、W28 d组和正常对照组比较差异无统计学意义;W14、W21、W28 d组与用药28 d组比较差异有统计学意义(P < 0.05,图 5D、E)。
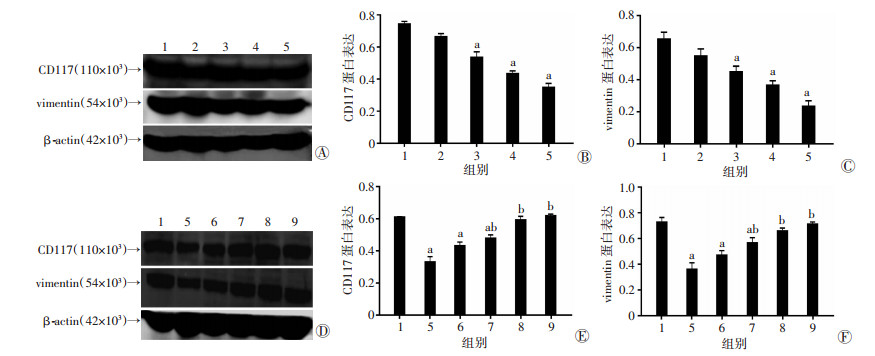
|
| A:Western blot检测用药组CD117/vimentin蛋白表达;B:用药组CD117半定量分析结果;C:用药组vimentin半定量分析结果;D:Western blot检测停药组CD117/vimentin蛋白表达;E:停药组CD117半定量分析结果; F:停药组vimentin半定量分析结果1:正常对照组;2:用药7 d组;3:用药14 d组;4:用药21 d组;5:用药28 d组;6:停药7 d组;7:停药14 d组;8:停药21 d组;9:停药28 d组;n=6, x± s, a: P < 0.05,与正常对照组比较;b: P < 0.05,与用药28 d组比较 图 5 Western blot检测甲磺酸伊马替尼对胰腺组织内CD117/vimentin表达的抑制作用 |
2.2.2.2 vimentin蛋白表达
药物作用后,vimentin蛋白表达随着用药时间的延长呈递减趋势,用药14、21 d和28 d组与正常对照组比较差异有统计学意义(P < 0.05,图 5A、C)。停止药物作用后,蛋白表达随着停药时间的延长呈递增趋势,W7和W14 d组与正常对照组比较差异具有统计学意义(P < 0.05),W21、W28 d组与正常对照组比较差异无统计学意义,W14、W21、W28 d组与用药28 d组比较差异具有统计学意义(P < 0.05,图 5D、F)。
3 讨论近年来研究发现,TCs分布于多个器官和组织,与周围的间质细胞形成复杂的网络结构,参与组织和器官的生理和病理过程[15]。本研究通过免疫组化染色发现豚鼠胰腺组织中存在一种长梭形间质细胞,其形态与POPESCU等[1]报道的TCs的分布与形态特征十分相似,透射电子显微镜显示的超微结构进一步证实胰腺内存在telocytes。有文献指出,组织内的TCs可能通过邻分泌或旁分泌的方式向周围的细胞传递信息[16],其分泌囊泡的内容物还可参与病理状态下细胞间的信息交流和信号传递[17]。在心脏中,TCs通过囊泡分泌miRNA-21营养心肌干细胞并引导干细胞增殖、分化、成熟和迁移,在疾病状态下可以参与调控心肌细胞的再生,调节细胞死亡与细胞更新之间的平衡,防止发生因收缩功能障碍而导致的心脏衰竭[18];在肝脏内TCs通过细胞间的缝隙连接或外泌体参与肝脏的再生[19];TCs分泌囊泡中的miRNA-126、miR-130、let-7e、miRNA-100等参与血管的形成和组织修复[15, 20-21]。TCs在胰腺内功能的研究尚不清楚。现有的研究基础为研究胰腺内TCs潜在功能提供了新的思路及方向,胰腺内与相邻细胞形成网络结构的TCs是否也能通过细胞间的缝隙连接或通过分泌性囊泡参与胰腺组织的再生和修复及其可能的作用机制值得进一步探讨。
甲磺酸伊马替尼为苯胺嘧啶衍生物,是一特异性强、高效的酪氨酸激酶特异性抑制剂,通过竞争性结合酪氨酸激酶三磷酸腺苷(ATP)结合位点,抑制酪氨酸激酶的磷酸化,降低其活性,抑制信号转换,影响细胞的增殖和细胞凋亡[22-23]。同时,甲磺酸伊马替尼可强有力地抑制c-kit受体的活性,从而影响细胞的正常形态、数量和功能[23]。有研究者通过在体给予小鼠甲磺酸伊马替尼溶液灌胃阻断kit信号通路用于探讨kit信号通路对新生小鼠胃肠道ICCs的发育和增殖,指出甲磺酸伊马替尼可作为一种可靠的体外研究kit信号通路作用于ICCs的方法和手段[13, 24]。本研究应用甲磺酸伊马替尼进行药物干预后,CD117/vimentin免疫组化结果显示TCs细胞数量减少,突起变短,网络结构减少,胞体和突起围绕着腺泡的结构变少,胰腺内CD117/vimentin蛋白表达量也随着用药时间的延长呈减少趋势,停止药物干预后,TCs网络结构逐渐恢复,蛋白表达量也逐渐恢复,这与MEI等[13]对肠道Cajal细胞的研究结果一致,说明甲磺酸伊马替尼能够影响胰腺内TCs的形态及TCs内相关免疫标记,胰腺内的TCs与肠道内的Cajal间质细胞一样,受甲磺酸伊马替尼药物的影响,其影响的机制是否为甲磺酸伊马替尼阻断胰腺内TCs的kit信号通路或其他机制还需后续离体实验对胰腺TCs进行离体培养后进一步证实。同时,本课题组后续实验将进一步探讨胰腺内的TCs是否对胰腺内分泌功能造成影响及其可能的作用机制,探讨TCs作为临床治疗胰腺相关疾病靶细胞的可能性,为临床治疗胰腺相关疾病建立新的治疗策略。
综上所述,本研究证实豚鼠胰腺内存在TCs,甲磺酸伊马替尼可作为一种在体研究kit信号通路作用于TCs的方法和手段。
| [1] | POPESCU L M, HINESCU M E, IONESCU N, et al. Interstitial cells of Cajal in pancreas[J]. J Cell Mol Med, 2005, 9(1): 169–190. DOI:10.1111/j.1582-4934.2005.tb00347.x |
| [2] | CORRADI L S, JESUS M M, FOCHI R A, et al. Structural and ultrastructural evidence for telocytes in prostate stroma[J]. J Cell Mol Med, 2013, 17(3): 398–406. DOI:10.1111/jcmm.12021 |
| [3] | CHEN X, ZHENG Y, MANOLE C G, et al. Telocytes in human oesophagus[J]. J Cell Mol Med, 2013, 17(11): 1506–1512. DOI:10.1111/jcmm.12149 |
| [4] | ZHANG H Q, LU S S, XU T, et al. Morphological evidence of telocytes in mice aorta[J]. Chin Med J, 2015, 128(3): 348–352. DOI:10.4103/0366-6999.150102 |
| [5] | CHANG Y, LI C, GAN L, et al. Telocytes in the Spleen[J]. PLoS ONE, 2015, 10(9): e0138851. DOI:10.1371/journal.pone.0138851 |
| [6] | RUSU M C, LORETO C, MǍNOIU V S. Network of telocytes in the temporomandibular joint disc of rats[J]. Acta Histochem, 2014, 116(4): 663–668. DOI:10.1016/j.acthis.2013.12.005 |
| [7] | VANNUCCHI M G, TRAINI C. Interstitial cells of Cajal and telocytes in the gut: twins, related or simply neighbor cells[J]. Biomol Concepts, 2016, 7(2): 93–102. DOI:10.1515/bmc-2015-0034 |
| [8] | KOSTIN S, POPESCU L M. A distinct type of cell in myocardium interstitial cajal-like cells (ICLCs)[J]. J Cell Mol Med, 2009, 13(2): 295–308. DOI:10.1111/j.1582-4934.2008.00668.x |
| [9] | POPESCU L M, FAUSSONE-PELLEGRINI M S. TELOCYTES-a case of serendipity: the winding way from Interstitial Cells of Cajal (ICC), via Interstitial Cajal-Like Cells (ICLC) to TELOCYTES[J]. J Cell Mol Med, 2010, 14(4): 729–740. DOI:10.1111/j.1582-4934.2010.01059.x |
| [10] | ZHENG Y, BAI C, WANG X. Telocyte morphologies and potential roles in diseases[J]. J Cell Physiol, 2012, 227(6): 2311–2317. DOI:10.1002/jcp.23022 |
| [11] | VANNUCCHI M G, FAUSSONE-PELLEGRINI M S. The Telocyte Subtypes[J]. Adv Exp Med Biol, 2016, 913: 115–126. DOI:10.1007/978-981-10-1061-3_7 |
| [12] | NICOLESCU M I, POPESCU L M. Telocytes in the interstitium of human exocrine pancreas: ultrastructural evidence[J]. Pancreas, 2012, 41(6): 949–956. DOI:10.1097/MPA.0b013e31823fbded |
| [13] | MEI F, HAN J, HUANG Y, et al. Plasticity of interstitial cells of cajal: a study in the small intestine of adult Guinea pigs[J]. Anat Rec (Hoboken), 2009, 292(7): 985–993. DOI:10.1002/ar.20928 |
| [14] | LORINCZ A, REDELMAN D, HORVÁTH V J, et al. Progenitors of interstitial cells of cajal in the postnatal murine stomach[J]. Gastroenterology, 2008, 134(4): 1083–1093. DOI:10.1053/j.gastro.2008.01.036 |
| [15] | DÍAZ-FLORES L, GUTIÉRREZ R, DÍAZ-FLORES L Jr, et al. Behaviour of telocytes during physiopathological activation[J]. Semin Cell Dev Biol, 2016, 55: 50–61. DOI:10.1016/j.semcdb.2016.01.035 |
| [16] | CISMASIU V B, POPESCU L M. Telocytes transfer extracellular vesicles loaded with microRNAs to stem cells[J]. J Cell Mol Med, 2015, 19(2): 351–358. DOI:10.1111/jcmm.12529 |
| [17] | WANG J, JIN M, MA W H, et al. The history of telocyte discovery and understanding[J]. Adv Exp Med Biol, 2016, 913: 1–21. DOI:10.1007/978-981-10-1061-3_1 |
| [18] | KOSTIN S. Cardiac telocytes in normal and diseased hearts[J]. Semin Cell Dev Biol, 2016, 55: 22–30. DOI:10.1016/j.semcdb.2016.02.023 |
| [19] | LIU J, CAO Y, SONG Y, et al. Telocytes in liver[J]. Curr Stem Cell Res Ther, 2016, 11(5): 415–419. DOI:10.2174/1574888x10666150630112035 |
| [20] | CRETOIU S M, POPESCU L M. Telocytes revisited[J]. Biomol Concepts, 2014, 5(5): 353–369. DOI:10.1515/bmc-2014-0029 |
| [21] | RATAJCZAK M Z, RATAJCZAK D, PEDZIWIATR D. Extracellular microvesicles (ExMVs) in cell to cell communication: A role of telocytes[J]. Advances in Experimental Medicine and Biology, 2016, 913: 41–49. DOI:10.1007/978-981-10-1061-3_3 |
| [22] | SHIMOJIMA N, NAKAKI T, MORIKAWA Y, et al. Imatinib blocks spontaneous mechanical activities in the adult mouse small intestine: Possible inhibition of c-Kit signaling[J]. Pharmacology, 2005, 74(2): 95–99. DOI:10.1159/000084021 |
| [23] | DRUKER B. Imatinib (Gleevec) as a paradigm of targeted cancer therapies[J]. Keio J Med, 2010, 59(1): 1–3. DOI:10.2302/kjm.59.1 |
| [24] | ORDÖG T. Interstitial cells of Cajal in diabetic gastroenteropathy[J]. Neurogastroenterol Motil, 2008, 20(1): 8–18. DOI:10.1111/j.1365-2982.2007.01056.x |



