宫颈癌是女性常见的恶性肿瘤之一,估计每年全球新发病例为52.8万例[1]。而高级别宫颈上皮内瘤变(cervical intraepithelial neoplasia, CINⅡ~Ⅲ)作为宫颈癌的癌前病变,高危型人乳头瘤病毒持续性感染(high risk-human papilloma virus, hrHPV)是其高危诱因之一,多发生于25~35岁的年轻女性,约1/3未经治疗的高度病变可在10~20年内发展成癌[2]。目前宫颈锥切术是诊断和治疗宫颈上皮内瘤变的普遍方法,其中冷刀锥切术(cold knife conization, CKC)和超频电刀锥切术(loop electrosurgical excision procedure, LEEP)是最常见的两种手术方式,有效的锥切治疗可阻断宫颈病变进展,减少其复发,并同时保留患者的生育功能。虽然宫颈锥切术被认为非常有效,但仍有5%~25%的患者出现术后疾病复发或持续[3]。本文针对锥切术后复发的患者进行研究,探索其复发高危因素,为合理制定手术及术后随访方案提供依据。
1 资料与方法 1.1 研究对象 1.1.1 纳入标准2013年8月至2016年6月于重庆医科大学附属第一医院妇科就诊,经我院阴道镜下宫颈多点活检或外院活检、我院病理复核证实为高级别宫颈上皮内瘤变(CIN Ⅱ~Ⅲ级),并接受CKC或LEEP治疗,术后诊断为高级别宫颈上皮内瘤变, 术后遵医嘱随访(随访时间2~39个月,中位随访时间19个月)患者。患者均选择继续观察并签署了书面知情同意书。
1.1.2 排除标准合并阴道上皮瘤变;接受全子宫切除手术治疗;锥切标本不符合要求(病理报告中大体标本未注明长、宽、厚度);术后诊断为宫颈浸润癌或切缘阳性并行子宫切除术。
1.2 资料收集回顾历史病例,收集患者的年龄、月经状态、阴道分娩次数、鳞状细胞癌相关抗原(squamous cell carcinoma antigen, SCC-Ag)、治疗前HPV感染分型、宫颈活检病理分级、手术时间及记录、术后病理结果(术后病理分级,锥切标本长、宽、厚度、切缘状态)等资料。
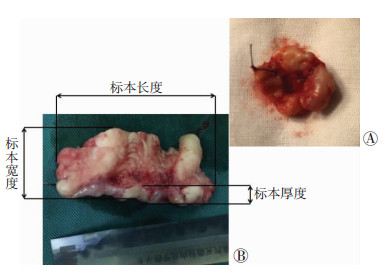
1.3 手术方式 1.3.1 CKC在全麻下行宫颈锥切术,结合患者病灶累及范围及有无生育要求确定切除范围。术后于锥体底端12点处做缝合标记后送病检(图 1A)。
|
| A: CKC宫颈大体标本;B:宫颈矢状位剖面图 图 1 宫颈锥切术标本剖面图 |
1.3.2 LEEP
利用超频电刀在局麻下行宫颈锥切术, 切除前均用卢戈氏液碘染宫颈, 并结合阴道镜图像确定宫颈阴道部病灶部位及范围, 切除宽度超病灶0.3~0.5 cm, 切除组织标记后送病检。
1.4 病理评估宫颈锥切标本均置于10%福尔马林中固定24~48 h后, 将宫颈从矢状面剖开,并测量其长、宽、厚度(cm,图 1B),分别代表锥切底边周长、深度及宽度。并由2名病理科医师审核病理标本,复核最终病变分级及切缘状态。
1.5 宫颈标本大小(锥切范围)计算方法BOONSTRA等[4]研究发现, 宫颈新鲜组织在制片过程中经过甲醛固定、脱水和石蜡包埋后,组织会缩水, 其缩水百分比为新鲜组织的15.3%,因此,本研究也考虑到制片时组织缩水因素, 即将测量结果除以0.847再乘以2, 则为相应锥切范围(锥切宽度=标本厚度/0.847×2;锥切深度=标本宽度/0.847×2;锥切底边周长=标本长度/0.847×2)。
1.6 术后随访术后每隔3~6个月进行宫颈细胞学和/或HPV检测,连续3次正常后,每年1次细胞学和/或HPV检测,随访时任一项阳性均建议行阴道镜检查,必要时行阴道镜下宫颈多点活检和/或宫颈管搔刮术。
1.7 复发诊断标准经阴道镜下宫颈多点活检和/或宫颈管搔刮病理证实的任何程度的CIN或宫颈癌。
1.8 统计学分析连续变量用x± s或M(范围)表示,分类变量用频数(百分数)表示。计数资料采用χ2检验或连续校正χ2检验或Fisher确切概率分析,计量资料采用t检验或Mann-Whitney检验。复发危险因素采用COX比例风险回归模型进行分析。Kaplan-Meier方法用以估计复发时间,log-rank检验用于比较组间的差异。绘制ROC曲线以评估高危因素预测复发的诊断价值。两者间相关性采用Spearman非参数相关分析。采用SPSS 19.0统计软件,检验水准:α=0.05。
2 结果 2.1 患者临床病理学特征2013年8月至2016年6月共有265名患者因高级别宫颈上皮内瘤变入院治疗,其中120例选择行全子宫切除术,145例行锥切术,其中有32例病理标本与本研究不符(病理报告中大体标本未注明长、宽、厚度),故最终有113例纳入研究,患者的临床病理资料见表 1。患者平均年龄41岁,未绝经者占93.8%,绝经者占6.2%;83.2%患者选择行冷刀锥切术,16.8%行LEEP锥切术;有82.3%的患者术前存在高危型HPV感染,11.1%患者术后持续高危型HPV感染;锥切标本厚度、宽度及长度中位数分别为1.0、2.5、3.0 cm;有7例(6.2%)患者存在切缘阳性,其中2例低级别病变,2例高级别病变,3例未分级,并最终选择随访;中位随访时间为19(2~39) 个月。
| 变量 | 数据 |
| 年龄(岁, x± s) | 40.88±6.21 |
| 月经状况[例(%)] | |
| 绝经 | 7(6.2) |
| 未绝经 | 106(93.8) |
| 阴道分娩数[次, M(范围)] | 1 (0~9) |
| 锥切方式[例(%)] | |
| CKC | 94 (83.2) |
| LEEP | 19 (16.8) |
| 锥切标本厚度[cm, M(范围)] | 1 (0.3~3.5) |
| 锥切标本宽度[cm, M(范围)] | 2.5 (1~4) |
| 锥切标本长度[cm, M(范围)] | 3(1.7~6.5) |
| 切缘状态[例(%)] | |
| 阳性 | 7 (6.2) |
| 阴性 | 106 (93.8) |
| SCCa[ng/mL, M(范围)] | 0.8 (0.2~4.8) |
| 治疗前高危HPV感染状态[例(%)] | |
| 阳性 | 93 (82.3) |
| 阴性 | 5 (4.4) |
| 不详 | 15 (13.3) |
| 术后持续高危HPV感染状态[例(%)] | |
| 阳性 | 12(11.1) |
| 阴性 | 71(65.8) |
| 不详 | 25(23.1) |
| 随访时间[月, M(范围)] | 19 (2~39) |
| a:鳞状细胞癌相关抗原 | |
2.2 锥切术后复发高危因素分析:锥切范围(尤其标本厚度)与复发密切相关 2.2.1 复发组与未复发组间临床病理特征差异
经过随访,113例患者中最终有9例疾病复发/持续, 中位疾病复发/持续时间4(2~22) 个月,5例(4.4%)失访。将复发组与未复发组患者组织病理学特征进行比较, 两组间年龄、月经状况、阴道分娩次数、手术方式、锥切标本厚度、切缘状态、治疗前后高危HPV感染状态差异均具有统计学意义(P < 0.05,表 2)。
| 组别 | n | 年龄(x± s) | 月经状况[例(%)] | 阴道分娩[M(范围)] | 锥切方式[例(%)] | 切缘状态[例(%)] | SCC[ng/mL, M(范围)] | 锥切标本厚度[cm, M(范围)] | 锥切标本宽度[cm, M(范围)] | 锥切标本长度[cm, M(范围)] | 治疗前高危HPV感染状态f[例(%)] | 治疗后高危HPV感染状态g [例(%)] | |||||||
| 绝经 | 未绝经 | CKC | LEEP | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||||||||||
| 复发组 | 9 | 45.67±7.78 | 2(22.2) | 7(77.8) | 2(0~4) | 5(55.6) | 4(44.4) | 3(33.3) | 6(66.7) | 0.85(0.6~2.5) | 0.6(0.5~1.8) | 2.0(1.0~3.0) | 3(2.0~5.0) | 5(71.4) | 2(28.6) | 5(83.3) | 1(16.7) | ||
| 未复发组 | 99 | 40.48±5.63 | 4(4.0) | 95(96.0) | 1(0~9) | 86(86.9) | 13(13.1) | 4(4) | 95(96) | 0.7(0.2~4.8) | 1.0(0.3~3.5) | 2.5(1.0~4.0) | 3(1.7~6.5) | 84(96.6) | 3(3.4) | 7(9.1) | 70(90.9) | ||
| 检验值 | 2.559 | 5.198 | 258.500 | 3.967 | 11.679 | 258.500 | 169.000 | 277.000 | 352.000 | 8.033 | 24.509 | ||||||||
| P | 0.012a | 0.023b | 0.03c | 0.046d | 0.001b | 0.673c | 0.002c | 0.056c | 0.289c | 0.043e | <0.001e | ||||||||
| a:t检验;b:χ2检验;c: Mann-Whitney检验;d:χ2连续校正检验;e:fisher确切概率检验;f:治疗前hrHPV感染状态有14例缺失数据未纳入分析;g:治疗后hrHPV感染状态有25例因缺失数据未纳入分析 | |||||||||||||||||||
2.2.2 复发高危因素多因素分析
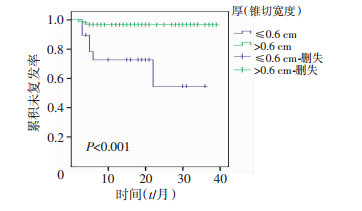
将上表中有统计学差异项纳入多因素分析(因术后持续hrHPV缺失数据较多故未纳入),发现标本厚度、阴道分娩次数、治疗前高危HPV感染与复发密切相关。锥切标本厚度≤0.6 cm将导致复发风险增高(P < 0.05, HR:7.094, 95%CI:1.350~37.279, 表 3);且标本厚度≤0.6 cm组其无疾病复发时间显著短于对照组(P < 0.001, 图 2);此外阴道分娩次数大于2次(HR:10.708, 95%CI:1.543~74.322)、手术前感染高危HPV病毒(HR:8.674, 95%CI:1.047~71.862) 均可致复发风险增高(P=0.016、0.045)。
| 变量 | Wald | HR(95%CI) | Pa |
| 年龄(≥45岁) | 0.426 | 1.948(0.263~14.414) | 0.514 |
| 绝经状态 | 0.02 | 0.847(0.083~8.683) | 0.889 |
| 阴道分娩(≥2次) | 5.753 | 10.708(1.543~74.322) | 0.016 |
| LEEP锥切 | 0.019 | 0.855(0.094~7.740) | 0.889 |
| 切缘(+) | 0.492 | 0.464(0.054~3.968) | 0.483 |
| 标本厚度(≤0.6 cm) | 5.356 | 7.094(1.350~37.279) | 0.021 |
| 治疗前高危HPV感染 | 4.010 | 8.674(1.047~71.862) | 0.045 |
| a:COX风险比例回归模型 | |||
|
| 图 2 高级别宫颈上皮内瘤变标本厚度与复发的关系 |
2.3 锥切范围对复发的预测价值
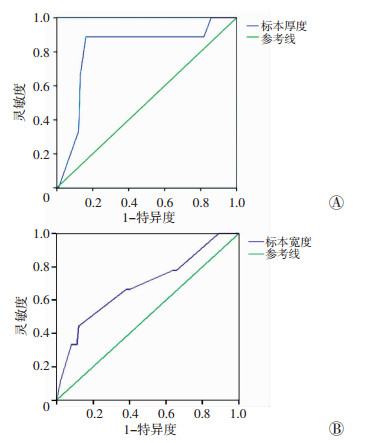
利用所有患者锥切标本厚度绘制ROC曲线(图 3),发现厚度界值取0.75 cm时,其曲线下面积(AUC)为0.81(95%CI:0.650~0.971),预测术后复发的诊断价值最佳,灵敏度为88.9%,特异度为83.8%, 约登指数为0.727;且锥切标本厚度>0.6 cm者,其累计未复发率明显高于厚度≤0.6 cm者(P < 0.001,图 2,表 4)。结合病理标本处理方法可知,标本厚度与锥切宽度相关,因此按照缩水比例计算后可知,手术中锥切宽度大于1.77 cm可能降低其术后复发率。
|
| A:标本厚度预测复发ROC曲线;B:标本宽度预测复发ROC曲线 图 3 高级别宫颈上皮内瘤变锥切范围用于预测术后复发的ROC曲线 |
| 变量 | AUC(95%CI) | 灵敏度(%) | 特异度(%) | P |
| 标本厚度0.75 cm | 0.810(0.650~0.971) | 88.9 | 83.8 | 0.002 |
| 标本宽度1.9 cm | 0.689(0.492~0.886) | 44.4 | 87.9 | 0.061 |
| 阴道分娩≥2次 | 0.591(0.375~0.807) | 22.2 | 96.0 | 0.368 |
| 术前hrHPV感染 | 0.626(0.378~0.873) | 28.6 | 96.6 | 0.271 |
将标本宽度(可知与锥切深度有关)、锥切分娩次数及术前hrHPV感染作为预测复发因子绘制ROC曲线,曲线下面积(AUC)分别为0.689、0.591、0.626(P>0.05,表 4),预测复发诊断效能较低。
2.4 锥切范围与术后持续hrHPV感染的相关性Spearman非参数相关分析提示锥切宽度与锥切深度之间相关性较低(r=0.218,P=0.02),故有理由认为术者可根据具体情况分别选择合理的锥切宽度及深度。
上述结果提示锥切宽度为复发预测因素,而锥切宽度与深度间有弱相关性,同时,复发组术后持续hrHPV感染率较未复发组高(P < 0.001,表 2)。因此,本研究分析了术后持续hrHPV感染状态分别与锥切宽度、深度的相关性,r分别为-0.291、-0.313,P=0.008、0.004,提示锥切越宽、越深,hrHPV持续感染率越小。
3 讨论众所周知,积极有效地治疗宫颈高级别上皮内瘤变是控制宫颈癌发生、发展的关键措施,而宫颈锥切术目前是治疗高级别宫颈上皮内瘤变的标准治疗方案,尤其发病有年轻化趋势,对于希望保留生育功能或保留子宫的女性,这是一种保守性的治疗措施。但值得注意的是,锥切术后仍有疾病持续存在或复发的风险,可能与手术范围不足、未能按要求完成随访有关,这不仅影响治疗效果,还可能导致继发宫颈癌风险增加[5]。因此,迫切需要探索CIN复发/持续的危险因素,从而针对高危人群决定恰当的手术范围及制定术后周密的随访计划。
传统标准的锥切手术应至少切除病变最易累及的鳞柱交接区(squamocolumnar junction, SCJ),横向切口外缘应距宫颈管口5~10 mm,或距碘染不着色区边缘外2~3 mm,切口深度应达宫颈间质,深度应达2~2.5 cm,即包括颈管全长。但在临床工作中,实际手术范围却因患者宫颈本身大小、年龄、生育要求、病变程度或治疗医院及主刀医师经验等不同存在较大差异。既往亦有学者研究手术范围对治疗结局的影响,但却未得出一致的结论。COSTA等[6]的一项纳入699名患者的回顾性研究提示,LEEP锥切深度、宽度及切缘状态均未提示与CIN病变持续有何相关性,其分析的危险因素亦与本研究不尽相同,并未包含高危HPV病毒状态等,这亦可能导致结论出现差异;另一学者回顾性研究了130名行LEEP治疗的患者,发现锥切深度对治疗结局存在影响,锥深1.0~1.5 cm疗效最佳,并发症最低[7]。本研究通过多因素分析发现,锥切宽度密切影响患者术后病情进展,当锥切宽度 < 1.77 cm时,预测患者术后复发或病变持续的敏感度为88.9%,特异度为83.8%,AUC=0.81。同时,虽复发组与未复发组间锥切深度无统计学差异,却仍有相关趋势(复发2.0 cm,未复发2.5 cm,P=0.056), 且锥切深度与宽度存在相关性,当宽度 < 2.24 cm时,预测复发灵敏度为44.4%,特异度为87.9%,AUC=0.689,P=0.061,因此,需扩大样本量进一步证实。此外,杨烨等[8]测量中重度宫颈上皮内瘤变病灶长度及累及腺体深度后建议,CIN累腺患者行锥切术的范围应是帽状的,宫颈阴道部切除范围根据阴道镜检查或碘染色标记决定, 宫颈管周围切除范围纵向深度24~30 mm, 水平深度6~12 mm, 可切除99%宫颈腺体及受累腺体。贺豪杰等[9]研究锥切术后妊娠结局发现,13例分娩患者中,宫颈锥切高度平均为2.0(1.0~3.0) cm, 锥切宽度平均为2.5(1.5~3.0) cm,其认为锥切宽度对术后再次妊娠无明显影响。综合以上结果,建议术者应根据手术可行性及患者需求灵活控制锥切宽度及深度,对于有生育要求的年轻患者,建议锥切宽而不深,既可减少因过度切除宫颈组织而致宫颈变形、狭窄, 及导致再次妊娠时宫颈机能不全至流产、早产、胎膜早破的发生率,又可在一定程度上降低CIN复发率;而对于无生育要求而又希望保留子宫者,则应该行宽而深的大锥切术,尽量切除颈管组织,从而降低复发率。
众所周知,高危型HPV持续感染是导致CIN的根本病因,本研究结果显示术前高危型HPV感染可能导致术后复发风险增加(HR=8.674,P=0.045),此结论与吴瑾[10]、GÖK等[11]研究结果一致;同时,根据多因素分析得知,阴道分娩次数≥2次亦为复发高危因素。因此,对这部分复发高危群体,推荐行大锥切手术,若锥切范围足够则可清除HPV感染的宫颈组织,术后复发风险较低,与此同时,术后监测hrHPV亦可反映手术彻底性。
因本研究为回顾性分析,术后hrHPV感染状态信息缺失较多,故未纳入该项进行多因素分析,较为遗憾,但通过比较复发与未复发组间hrHPV持续感染率,提示术后持续hrHPV感染与复发相关(P < 0.001),关于这点已有学者研究报道,术后HPV持续感染,尤其基因型与术前一致,是CIN复发高危因素[12-13]。此外,本研究发现锥切宽度(r=-0.291,P=0.008) 及锥切深度(r=-0.313,P=0.004) 均与术后持续hrHPV感染相关,其原因可能是足够的手术范围通过改变或者破坏HPV生长环境,从而导致感染难以持续,但需进一步证实。
此外,通过比较复发与未复发组临床病理特征,考虑高龄、绝经、LEEP锥切、切缘阳性可能与术后复发相关(P < 0.05)。此结果与国内外学者的研究结论[14-16]相似。但本研究中切缘阳性在多因素分析中未表现出相关性(HR=0.464,P=0.483),可能与部分患者术后因切缘阳性而选择行全子宫切除而未纳入研究,或立即行二次锥切去除危险因素有关。
本研究仅为单个医疗机构的回顾性研究,研究性质局限性导致某些临床数据搜集不全,如术后hrHPV感染状态在电话随访过程中因患者记忆偏倚或缺失致无法获得完整资料,故需开展前瞻性、大样本的研究进一步获得更加完善的资料,从而对本研究结论进行验证;此外,因本次纳入对象均为住院患者,较门诊患者年龄有高龄化趋势,因其生育需求率较低,无法针对锥切手术范围对下次妊娠的影响进行分析,较为可惜,在后续的研究中,可与宫颈门诊协作,加入有生育要求患者进一步分析;已有大量的研究提示宫颈癌患者肿瘤组织中P16、Ki67的高表达与肿瘤侵袭性及较差的预后相关[17-20],而宫颈高级别上皮内瘤变作为其癌前病变,有理由怀疑是否存在相同/相似的肿瘤标志物与预后相关,但因入院行CKC治疗者多无生育要求,从而手术范围相应较大,故至随访截止日期整体复发率较低,无法建立理想的对照模型进行分析,后期可扩大样本量并延长随访周期后进行相关的研究。
综上所述,锥切手术范围直接影响CIN的治疗结局,锥切范围不够将增加术后复发或病变持续存在的概率,因此建议尽可能行宽而深的锥切,可能为降低术后复发风险的根本方法。此外,针对复发高危患者或手术范围不够者,术后应采用宫颈细胞学检测、HPV基因分型,必要时联合阴道镜检查可早期发现病变,尽早治疗,避免其进一步进展甚至恶变。
| [1] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [2] | WRIGHT T C JR, COX J T, MASSAD L S, et al. 2001 consensus guidelines for the management of women with cervical intraepithelial neoplasia[J]. Am J Obstet Gynecol, 2003, 189(1): 295–304. DOI:10.1067/mob.2003.633 |
| [3] | ZHANG H, ZHANG T, YOU Z, et al. Positive surgical margin, HPV persistence, and expression of both TPX2 and PD-L1 are associated with persistence/recurrence of cervical intraepithelial neoplasia after cervical conization[J]. PLoS One, 2015, 10(12): e0142868. DOI:10.1371/journal.pone.0142868.eCollection2015 |
| [4] | BOONSTRA H, OOSTERHUIS J W, OOSTERHUIS A M, et al. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting[J]. Virchows Arch A Pathol Anat Histopathol, 1983, 402(2): 195–201. DOI:10.1007/bf00695061 |
| [5] | SOUTTER W P, SASIENI P, PANOSKALTSIS T. Long-term risk of invasive cervical cancer after treatment of squamous cervical intraepithelial neoplasia[J]. Int J Cancer, 2006, 118(8): 2048–2055. DOI:10.1002/ijc.21604 |
| [6] | COSTA S, DE NUZZO M, INFANTE F E, et al. Disease persistence in patients with cervical intraepithelial neoplasia undergoing electrosurgical conization[J]. Gynecol Oncol, 2002, 85(1): 119–124. DOI:10.1006/gyno.2001.6579 |
| [7] |
阮海波, 生启芳. 不同锥切深度对LEEP治疗CIN疗效影响的临床研究[J].
中国现代医生, 2015, 53(15): 27–30.
RUAN H B, SHENG Q F. Clinical studies of different depths of leep cone biopsy affect the efficacy of the treatment of cin[J]. China Modern Dr, 2015, 53(15): 27–30. |
| [8] |
杨烨, 祝亚平. 宫颈上皮内瘤变累腺深度与锥切范围的研究[J].
现代妇产科进展, 2009, 18(4): 293–296.
YANG Y, ZHU Y P. A study of depth of cervical intraepitheliai neoplasia glandular involvement and the extent of cervical conization[J]. Prog Obstetr Gynecol, 2009, 18(4): 293–296. |
| [9] |
贺豪杰, 潘凌亚, 黄惠芳, 等. 宫颈锥切术对宫颈上皮内瘤变患者妊娠及其结局的影响[J].
中华妇产科杂志, 2007, 42(8): 515–517.
HE H J, PAN L Y, HUANG H F, et al. Clinical analysis of the effect of cervical conization on fertility and pregnancy outcome[J]. Chin J Obstetr Gynecol, 2007, 42(8): 515–517. DOI:10.3760/j.issn:0529-567x.2007.08.003 |
| [10] |
吴瑾, 贾英, 唐良萏. LEEP术后宫颈上皮内瘤变复发病因分析[J].
激光杂志, 2012, 33(2): 75–76.
WU J, JIA Y, TANG L D. Retrospective analysis the reason of recurrences in cervical intraepithelial neoplasia after loop electrosurgical excision procedure[J]. Laser J, 2012, 33(2): 75–76. DOI:10.3969/j.issn.0253-2743.2012.02.033 |
| [11] | GÖK M, COUP V M, BERKHOF J, et al. HPV16 and increased risk of recurrence after treatment for CIN[J]. Gynecol Oncol, 2007, 104(2): 273–275. DOI:10.1016/j.ygyno.2006.10.011 |
| [12] |
彭永排, 周晖, 卞丽娟, 等. 高度宫颈上皮内瘤变电环切术后复发的预测因素[J].
中山大学学报(医学科学版), 2012, 33(5): 619–624.
PENG Y P, ZHOU H, BIAN L J, et al. Predictors for recurrence of high-grade cervical intraepithelial neoplasia (cin) after loop electrosurgical excision procedure (leep)[J]. J Sun Yat-sen Univ (Med Sci), 2012, 33(5): 619–624. |
| [13] | KANG W D, KIM S M. Human papillomavirus genotyping as a reliable prognostic marker of recurrence after loop electrosurgical excision procedure for high-grade cervical intraepithelial neoplasia (CIN2-3) especially in postmenopausal women[J]. Menopause, 2016, 23(1): 81–86. DOI:10.1097/GME.0000000000000488 |
| [14] | SERATI M, SIESTO G, CAROLLO S, et al. Risk factors for cervical intraepithelial neoplasia recurrence after conization: a 10-year study[J]. Eur J Obstet Gynecol Reprod Biol, 2012, 165(1): 86–90. DOI:10.1016/j.ejogrb.2012.06.026 |
| [15] | PERISIC Z, PERISIC M, KARAPANDZIC V P, et al. Cervical conization-treatment for cervical intraepithelial neoplasia and carcinoma in situ[J]. Eur J Gynaecol Oncol, 2011, 32(5): 534–537. |
| [16] |
孙华盛. LEEP治疗宫颈上皮内瘤变256例疗效及其术后复发的影响因素分析[J].
海南医学, 2013, 24(23): 3473–3475.
SUN H S. Clinical effects of leep in the treatment of patients with cin and the influence factors of relapse[J]. Hainan Med J, 2013, 24(23): 3473–3475. DOI:10.3969/j.issn.1003-6350.2013.23.1444 |
| [17] | LIANG S N, HUANG Y J, LIU L L, et al. Study on the correlation between the expression of Ki67 and FasL and prognosis of cervical carcinoma[J]. Genet Mol Res, 2015, 14(3): 8634–8639. DOI:10.4238/2015.july.31.11.DOI:10.4238/2015 |
| [18] | OMRAN O M, ALSHEEHA M. Human papilloma virus early proteins E6 (HPV16/18-E6) and the cell cycle marker P16 (INK4a) are useful prognostic markers in uterine cervical carcinomas in Qassim Region-Saudi Arabia[J]. Pathol Oncol Res, 2015, 21(1): 157–166. DOI:10.1007/s12253-014-9801-y |
| [19] | ANSCHAU F, SCHMITT V M, LAMBERT A P, et al. Transition of cervical carcinoma in situ to invasive cancer: role of p16 INK4a expression in progression and in recurrence[J]. Exp Mol Pathol, 2009, 86(1): 46–50. DOI:10.1016/j.yexmp.2008.11.006 |
| [20] | YAMAZAKI T, TOMITA S, ICHIKAWA K, et al. P16-immunostaining pattern as a predictive marker of lymph node metastasis and recurrence in early uterine cervical cancer[J]. Pathobiology, 2006, 73(4): 176–182. DOI:10.1159/000096018 |



